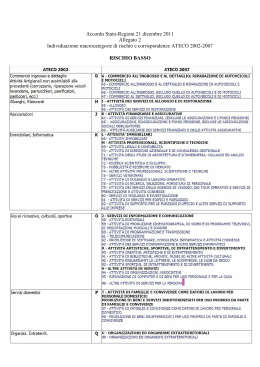
Allegato “a” da compilare a cura del Responsabile della sperimentazione Al Direttore della Struttura sede dello studio OGGETTO: Richiesta di autorizzazione ad effettuare: sperimentazione clinico-farmacologica studio osservazionale dispositivo medico Il sottoscritto___________________________________________ qualità di _____________________ _________________________________, in servizio presso la S._____di ________________________ del P.O. _________________________ Tel. ____________ Fax. ___________-mail _________________ chiede l’autorizzazione ad effettuare lo studio dal titolo:_________________________________________ ____________________________________________________________________________________ ________________________________________________________ Protocollo: __________________ Premesso che il sottoscritto ed i suoi collaboratori medici (indicati nell’allegato n. “A1”) che parteciperanno allo studio sopra citato sono dipendenti: dell’Azienda Sanitaria Napoli 2 Nord altro (specificare) _______________________________________________ A tale scopo dichiara: 1. che si avvarrà, per lo svolgimento dello studio: profit noprofit , della collaborazione dei dipendenti indicati nello schema Allegato “a1”. 2. che sono previsti gli esami descritti nell’Allegato “a2”; 3. che la sperimentazione non potrà avere inizio finché il sottoscritto non avrà ricevuto la prescritta autorizzazione da parte dell’Azienda; 4. che si impegna a riferire, in forma scritta, all’Amministrazione, o alla Società committente, su richiesta, quanto necessario durante tutta la sperimentazione 5. che si impegna a comunicare per iscritto, entro 48 ore dalla conoscenza qualsiasi evento grave o inatteso; 6. che si impegna ad inviare relazioni periodiche al Comitato Etico (ogni 6 mesi per studi di durata annuale o superiore) sullo stato di avanzamento della ricerca; 7. che si impegna inoltre a presentare, al termine della sperimentazione, relazione finale, sottoscritta, completa del prospetto riepilogativo di tutte le prestazioni diagnostiche e strumentali effettuate durante la sperimentazione (Allegato “a”e “a1”); Allegata dichiarazione pubblica sul conflitto di interessi prevista al D.M. del 21.12.2007. ________(luogo), __________________(data) In fede, Il Responsabile dello studio ________________________________________ Firma per autorizzazione Il Direttore della Struttura _____________________________ DICHIARAZIONE DA SOTTOSCRIVERE PER STUDI OSSERVAZIONALI FARMACOLOGICI Il/i farmaco/i è/sono prescritto/i nelle condizioni indicate nell’A.I.C. in Italia; La prescrizione è parte della normale pratica clinica; La decisione di prescrivere il farmaco al singolo paziente è del tutto indipendente da quella di includere il paziente stesso nello studio; Le procedure diagnostiche e valutative corrispondono alla pratica clinica corrente. ________(luogo), __________________(data) Il Responsabile dello studio N.B.: Si ricorda che per poter essere considerato uno studio di tipo osservazionale devono essere rispettate congiuntamente tutte e quattro le condizioni sopra riportate. Allegato “a1” (da compilare e allegare alla domanda di adesione sperimentatore, allegato “a”) ELENCO DEI MEDICI PARTECIPANTI ALLO STUDIO PROT. _______________________ COGNOME NOME QUALIFICA FIRMA Se trattasi di studi profit: I collaboratori medici sono a conoscenza che “la sperimentazione clinica deve essere condotta da dirigenti sanitari con le modalità della libera professione intramoenia secondo quanto previsto per l’attività libero-professionale)” Se trattasi di studi no-profit: I collaboratori medici potranno svolgere lo studio in attività di servizio, secondo quanto previsto dal D.M. 17.12.2004 ________(luogo), __________________(data) Firma del Responsabile dello Studio ___________________________________ Nota: indicare anche informazioni sul personale infermieristico, tecnico del comparto (se previsto) Allegato “a2” (da compilare e allegare alla domanda di adesione sperimentatore, allegato “a”) PROSPETTO RIEPILOGATIVO DEI COSTI ASSISTENZIALI PREVISTI PER PAZIENTE INERENTI LA SPERIMENTAZIONE PROPOSTA ED ECCEDENTI LA ROUTINE PRESTAZIONI DIAGNOSTICHE STRUMENTALI E DI LABORATORIO NUMERO INDAGINE/PRESTAZIONE SERVIZIO EROGANTE COSTO ________(luogo), __________________(data) Il Responsabile della Sperimentazione ________________________________ Allegato “a3” (da compilare e allegare alla domanda di adesione sperimentatore, allegato “a”) DICHIARAZIONE SUL CONFLITTO DI INTERESSI DI CUI ALL’APPENDICE 15 DEL D.M. 21/12/ In merito alla dichiarazione pubblica sul conflitto di interessi dello sperimentatore, dichiaro inoltre quanto segue: Impiego nell’industria farmaceutica nel corso degli ultimi cinque anni(1): Elencare ogni eventuale interesse nell’industria farmaceutica (se necessario utilizzare più moduli) ________________________________________________________________ ________________________________________________________________ ________________________________________________________________ ________________________________________________________________ Interessi finanziari nel capitale di un’industria farmaceutica: o Nome dell’industria:___________________________________________ o Tipo di azioni: o Numero di azioni ____________________________________________ ___________________________________________ Altri rapporti con l’industria farmaceutica(2) ________________________________________________________________ ________________________________________________________________ ________________________________________________________________ ________________________________________________________________ Altri interessi o fatti che si ritiene debbano essere portati a conoscenza, ivi compresi elementi relativi ai componenti del proprio nucleo familiare (i componenti del nucleo familiare sono: il coniuge, il/la compagno/a ed i figli a carico che vivono sotto lo stesso tetto dell’interessati): (non è necessario menzionare il nome di tali persone) ________________________________________________________________ ________________________________________________________________ Il/la sottoscritto/a dichiara di non detenere, a sua conoscenza, altri interessi diretti o indiretti nell’industria farmaceutica oltre a quelli summenzionati. Dichiara inoltre che si impegna a presentare una nuova dichiarazione pubblica di interessi qualora dovessero risultare nuovi o ulteriori interessi, tali dal dover essere portati a conoscenza. ________(luogo), __________________(data) Firma del Responsabile dello Studio ____________________________________
Scaricare