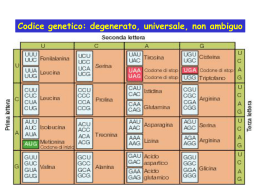
Le molecole di RNA hanno strutture che non corrispondono a dei minimi di energia potenziale La formazione della loro struttura tridimensionale è guidata Anche la loro degradazione è guidata Nell’exosoma hanno un ruolo fondamentale gli enzimi : • Polinucleotide fosforilasi (PNP), che hanno attività di RNAsi • RNA elicasi, che sono compatti macchinari proteici in grado di sfruttare l'energia liberata dall’idrolisi dell’ATP per rimodellare in modo dinamico le strutture tridimensionali di RNA /e di complessi RNA/proteina Il complesso PM/Scl (spesso chiamato semplicemente exosoma) è un complesso multiproteico in grado di degradare diversi tipi di RNA che è presente negli archea e negli eucarioti, mentre nei batteri svolge funzioni analoghe un complesso più semplice chiamato degradosoma. Il core dell’exosoma è costituito da una struttura ad anello a sei membri a cui sono attaccate altre proteine. Nelle cellule eucarioti, gli exosomi si trovano nel citoplasma, nel nucleo e soprattutto nel nucleolo. La loro attività è controllata da varie proteine presenti in quei compartimenti cellulari. L’exosoma degli eucarioti non degrada soltanto a partire dall’estremità 3’, ma anche in siti all'interno della molecola di RNA. La sua struttura ricorda il complesso proteico che degrada le proteine, il proteasoma. J Biomed Sci. 2007 Jul;14(4):523-532. Lin-Chao et al. - The PNPase, exosome and RNA helicases as the building components of evolutionarily-conserved RNA degradation machines Nature 511, 435–439 (24 July 2014) doi:10.1038/nature13406. Wasmuth et al. - Structure of an Rrp6–RNA exosome complex bound to poly(A) RNA Le proteine componenti dell’exosoma sono il bersaglio di : • autoanticorpi nei pazienti con specifiche malattie autoimmuni specifiche (specialmente la PM/Scl overlap syndrome) • alcuni chemioterapici antitumorali funzionano bloccando l'attività degli exosomi • inoltre, mutazioni nella proteina 3 dell’exosoma causa l’ipoplasia ponto-cerebellare e la spinal motor neuron disease Exosoma archea (a sinistra) ed eucariotico (a destra). La numerazione delle proteine mostra che l’exosoma archea contiene solo quattro proteine diverse, mentre l’exosoma eucariotico ha la stessa struttura tridimensionale ma contiene nove proteine diverse. Le RNA elicasi, componenti fondamentali di complessi macromolecolari (come gli exosomi), partecipano praticamente a tutti i processi associati con l'espressione dell'informazione genetica in quanto controllano : • la struttura tridimensionale degli RNA • la maturazione e la qualità degli RNA • la degradazione degli RNA • la formazione di complessi RNA/proteine RNA Biol. 2013 Jan;10(1):56-70. doi: 10.4161/rna.22270. Hardwick & Luisi - Rarely at rest: RNA helicases and their busy contributions to RNA degradation, regulation and quality control La miriade di processi biologici della vita non sono mai fermi Ad esempio il controllo dell'espressione genica è dinamico: il pool dei trascritti è in continuo mutamento e risponde in modo sensibile alle variazioni del bilanciamento tra sintesi e degradazione. In tutti i regni della vita la regolazione della degradazione dei trascritti è un meccanismo fondamentale dello sviluppo e della risposta alle diverse condizioni ambientali. Le RNA elicasi manipolano la struttura dell'RNA, rimodellano i complessi ribonucleoproteici, e collaborano con una varietà di ribonucleasi (RNasi). Le RNA elicasi A condividono il motivo “DExD/H box" che è presente, oltre che in archea ed eucarioti, anche nei batteri. Il mantenimento nel corso dell’evoluzione di complessi proteici mette in evidenza il ruolo fondamentale della loro attività per soddisfare le esigenze cellulari di controllo dinamico del metabolismo dell'RNA. RNA Biol. 2013 Jan;10(1):56-70. doi: 10.4161/rna.22270. Hardwick & Luisi - Rarely at rest: RNA helicases and their busy contributions to RNA degradation, regulation and quality control Schema di interazione tra RNA elicasi e RNAasi nel degradosoma. (in alto) particolare di un degradosoma a riposo (al centro) cattura di un RNA strutturato e legame di ATP (in basso) svolgimento dell’RNA che viene processato dalla RNAsi e/o idrolizzato dalla PNPasi. L’Angiogenina (ANG), nota anche come ribonucleasi 5 (RNAsi 5), è un membro di una superfamiglia di RNAsi secrete, specifica per i vertebrati. ANG era stata originariamente identificata come un fattore angiogenico dei tumori, ma la sua attività biologica è stata estesa ad indurre l’angiogenesi per stimolare la proliferazione cellulare e, più recentemente, per promuovere la sopravvivenza delle cellule. In condizioni di crescita, ANG viene traslocata nel nucleo dove si accumula nel nucleolo e stimola la trascrizione dell'RNA ribosomiale (rRNA), facilitando così la crescita e la proliferazione cellulare. J Cell Physiol. 2012 Jul;227(7):2822-6. doi: 10.1002/jcp.23051. Li & Hu - Emerging role of angiogenin in stress response and cell survival under adverse conditions In condizioni di stress, ANG si accumula nei compartimenti citoplasmatici e modula la produzione di tiRNA, una nuova classe di piccoli RNA che è derivata dai tRNA ed è indotta dallo stress. I tiRNA sopprimono globalmente la traduzione delle proteine inibendo sia la traduzione cap-dipendente che capindipendente, compresa quella mediata da IRES deboli. Non viene invece interessata la traduzione mediata da forti IRES, un meccanismo spesso utilizzato dai geni anti-apoptotici che inducono la sopravvivenza. Così, la riprogrammazione della sintesi da parte dei tiRNA mediata da ANG, consente di risparmiare energia per l’anabolismo e promuovere la sopravvivenza delle cellule. Questa funzione di ANG recentemente scoperta presenta un nuovo meccanismo d'azione nella regolazione della crescita e della sopravvivenza cellulare. J Cell Physiol. 2012 Jul;227(7):2822-6. doi: 10.1002/jcp.23051. Li & Hu - Emerging role of angiogenin in stress response and cell survival under adverse conditions Meccanismo d'azione di ANG. I segnali di crescita stimolano la traslocazione nucleare di ANG, mentre i segnali di stress dirigono ANG ai granuli di stress. Entrambi i percorsi sono mediati da un recettore di membrana che ancora non è stato identificato. Nel nucleo ANG stimola la trascrizione degli rRNA, consentendo la biogenesi dei ribosomi e quindi la crescita e la pproliferazione cellulare. In condizioni di stress, ANG non viene traslocato nel nucleo, ma è piuttosto accumulato in compartimenti citoplasmatici quali i granuli di stress, in cui si media la produzione di tiRNA, reprogramming la sintesi proteica e promuovendo la sopravvivenza. Il Citosol è quella componente liquida colloidale che si trova all’interno della cellula e che circonda gli organuli subcellulari (nucleo, reticolo endoplasmatico, apparato di Golgi, lisosomi, mitocondri, ecc.). Il Citosol è la parte della cellula dove si trovano i meccanismi molecolari per la regolazione del ciclo cellulare, per la regolazione della trascrizione e per l’assemblaggio dell’apoptosoma che avvierà la cellula all’autodistruzione Nel Citosol si realizza la glicolisi, il ciclo dei pentosi fosfati, la sintesi dei desossiribonucleotidi, la formazione degli amminoacil-tRNA, la sintesi proteica, la trasduzione del segnale nel corso della comunicazione tra cellule, ecc. H glicina alanina prolina C C C N C H2 cisteina istidina C N C H2 triptofano La corretta sintesi della proteina dipende dal fatto che ogni tRNA leghi l’amminoacido corrispondente alla tripletta che lo codifica Le Amminoacil-tRNA sintetasi sono veri e propri fossili molecolari, enzimi antichi miliardi di anni In ogni cellula è presente almeno una diversa Amminoacil-tRNA sintetasi, una per ogni amminoacido Ogni Amminoacil-tRNA sintetasi riconosce in modo specifico sia l’amminoacido che il suo corrispondente tRNA La maggior parte degli elementi di riconoscimento del tRNA sono nella regione delle estremità 5’ e 3’ (che contiene la sequenza CCA) e nel lobo inferiore che contiene la sequenza detta anticodone 2 | H | CH3 | CH CH3 GLICINA ALANINA CH3 VALINA | CH CH3 CH2 | CH3 ISOLEUCINA La cellula eucariote ha ben oltre 20 differenti amminoacil-tRNA sintetasi La reazione catalizzata è legare, con un legame ad alta energia, il giusto amminoacido al giusto tRNA con l’anticodone usando l’energia della molecola di ATP Durante la sintesi proteica, l’idrolisi del legame ad alta energia tra amminoacido e tRNA è sufficiente per formare il legame peptidico AMMINOACIL-tRNA-SINTETASI AMMINOACIDO + ATP + tRNA AMMINOACIL-tRNA + AMP + PiPi STADIO VELOCE : amminoacido + ATP STADIO LENTO: amminoacil-AMP + tRNA oppure stato di transizione amminoacil-AMP + PiPi amminoacil-tRNA + AMP oppure amminoacido + tRNA + AMP • Lo stato di transizione rappresenta quel momento della reazione in cui i nuovi legami chimici si stanno formando ed i vecchi legami chimici si stanno rompendo • Se tutto è perfetto, la reazione va verso destra con la formazione dei prodotti; bastano però differenze infinitesime e la reazione torna indietro verso sinistra Esistono due classi di Amminoacil-tRNA sintetasi: • gli enzimi della classe I, generalmente monomerici, legano alcuni amminoacidi (Arg, Cys, Gln, Glu, Ile, Leu, Met, Trp, Tyr, Val) ai corrispondenti tRNA in posizione 2’ • gli enzimi della classe II, dimerici, legano gli altri amminoacidi (Ala, Asn, Asp, Gly, His, Lys, Phe, Ser, Pro, Thr) ai corrispondenti tRNA in posizione 3’ • gli enzimi della classe I e della classe II si legano in modo diverso ai loro corrispondenti tRNA Ribosoma Nota: - le dimensioni dei ribosomi degli Archea sono simili a quelle degli Eubatteri; - sembra che sia funzionante il ribosoma chimerico Archea/Eucariote, ma non il ribosoma chimerico Eubattere/Eucariote - i ribosomi dei mitocondri e dei cloroplasti sono simili a quelli dei procarioti ma più piccoli; L’assemblaggio del ribosoma eucariotico è uno spettacolare esempio di processo altamente dinamico e regolato. Le subunità ribosomali minore (40S) e maggiore (60S) sono il risultato dell’assemblaggio di circa 80 proteine ribosomali e quattro diversi rRNA. La costruzione e la localizzazione intracellulare delle particelle pre-ribosomali coinvolgono una moltitudine di fattori transitoriamente associati ed enzimi che consumano energia in oltre 50 step, fattori di trasporto (come Bud20) che viaggiano con le particelle ribosomali pre-60S per raggiungere il citoplasma dove vengono rilasciati prima dell’ inizio della traduzione. Targeted proteomics reveals compositional dynamics of 60S pre-ribosomes after nuclear export- Mol Syst Biol. 2012;8:628. doi: 10.1038/msb.2012.63 - Altvater et al. Oltre 200 fattori non-ribosomali coinvolti in assemblaggio, maturazione e trasporto intracellulare delle particelle pre-40S e pre-60S mentre viaggiano dal nucleolo al citoplasma I pre-rRNA prodotti dalla Pol I subiscono modificazioni co-trascrizionali nel nucleolo dove avviene l’assemblaggio con le proteine ribosomali. Le particelle pre-60S incontrano ~ 100 fattori mentre viaggiano verso il complesso del poro nucleare (NPC) seguitando a subire variazioni della composizione; al contrario, le particelle pre-40S subiscono un minor numero di modificazioni mentre viaggiano verso gli NPC Targeted proteomics reveals compositional dynamics of 60S pre-ribosomes after nuclear export- Mol Syst Biol. 2012;8:628. doi: 10.1038/msb.2012.63 - Altvater et al. La maturazione finale delle particelle pre-40S e pre60S avviene nel citoplasma dove arrivano trasportate separatamente agli NPC da varie esportine NegIi step finali di maturazione si ha rilascio dei fattori di trasporto e non, assemblaggio delle proteine ribosomali mancanti ed il completamento della maturazione dei pre-rRNA Questi passaggi sono fondamentali perché un mancato rilascio e riciclo dei fattori porta alla loro deplezione nel nucleolo con conseguente compromissione dell’assemblaggio e produzione di ulteriori subunità ribosomali Targeted proteomics reveals compositional dynamics of 60S pre-ribosomes after nuclear export- Mol Syst Biol. 2012;8:628. doi: 10.1038/msb.2012.63 - Altvater et al. • Il ribosoma dei batteri è costituito da una subunità maggiore 50S ed una subunità minore 30S • Nel ribosoma sono legati (i) una molecola di mRNA tra le due subunità, (ii) una molecola di tRNA con legato l’amminoacido nel sito A, (iii) una molecola di tRNA con la proteina in formazione nel sito P, il tRNA senza amminoacido nel sito E S = unità Svedberg Ribosoma eucariotico La subunità minore possiede una cavità per ospitare l’mRNA che interagisce con il suo rRNA Le molecole di tRNA sono ospitate in una cavità che si forma tra le subunità minore e maggiore immagine della subunità minore di un ribosoma di Archea: rRNA in grigio, proteine colorate Nella subunità maggiore le molecole di tRNA sono ospitate in una cavità che si forma con la subunità minore Nella regione dove avviene la formazione del legame peptidico non ci sono proteine La proteina in sintesi esce da un tunnel formato da rRNA e da proteine ribosomali Le proteine sono disposte sulla superficie con qualche motivo che entra all’interno Per iniziare la sintesi proteica nei batteri: • i fattori di inizio (IF1) legano la subunità minore • il tRNA contenente la formil-metionina (fMet) si lega al sito P • altre proteine (IF2 e IF3) assemblano la subunità maggiore utilizzando l’energia liberata dall’idrolisi del GTP • i ribosomi si legano in qualsiasi punto dell’mRNA • l’AUG di inizio di ogni sequenza da tradurre è preceduto dalle sequenze di Shine e Dalgarno che attivano la subunità minore che si fermerà al primo AUG che successivamente incontrerà Negli eucarioti, l’inizio della traduzione è più complesso perché numerosi fattori guidano il reclutamento della subunità minore e la scansione di un mRNA, la selezione di un tRNAmet iniziatore, l’assemblaggio della subunità maggiore per formare il ribosoma 80S Il tRNAmet iniziatore è legato da eIF2-GTP (eukaryotic Initiation Factors) che lo posiziona nella subunità ribosomiale 40S. A questo punto intervengono eIF1, eIF1A, eIF3 ed eIF5 per formare il complesso di pre-inizio 43S che si lega al cap al 5’ di un mRNA guidato da eIF4F ed eIF3 per iniziare la scansione di un mRNA fino a trovare il primo AUG Raggiunto il primo AUG, la scansione si ferma e l’energia liberata dall’idrolisi del GTP da parte di eIF1 consente di fissare il tRNAmet iniziatore all’AUG ed innesca la dissociazione di eIF1 e di eIF2-GDP Il successivo assemblaggio della subunità maggiore 60S è facilitato da eIF5B che idrolizza GTP e si dissocia dalla subunità minore 40S insieme ad eIF1A, lasciando il ribosoma posizionato e pronto per la fase di elongazione The initiation of mammalian protein synthesis and mRNA scanning mechanism - Nature. 2013 Aug 15;500(7462):307-11. doi: 10.1038/nature12355 - Lomakin IB, Steitz TA. Nelle cellule di lievito in crescita esponenziale, un forte controllo è esercitato dai fattori di allungamento (eEF1A, eEF2, eEF3). Altri due forti punti di controllo sono il reclutamento di mRNA e dei tRNA per la subunità ribosomale 40S (eIF4F, eIF2) e per la terminazione (ErF1, Dbp5) Ci sono molti fattori che promuovono l'efficienza della scansione di mRNA nella regione 5‘-untranslated (eIF1, eIF1A, Ded1, eIF2B, eIF3 e eIF5) per permettere alla cellula di operare una rapida scansione di 5’UTR particolarmente lunghi La sintesi proteica è il processo cellulare che consuma più energia E’ stato stimato che in una singola cellula di Saccharomyces cerevisiae sono sintetizzate con grande precisione fino a 13.000 proteine al secondo Il controllo preciso della traduzione è alla base della crescita e della competitività dei viventi, quindi le proprietà quantitative del macchinario di traduzione e l'evoluzione delle sue componenti molecolari sono strettamente accoppiati An in vivo control map for the eukaryotic mRNA translation machinery - Mol Syst Biol. 2013;9:635. doi: 10.1038/msb.2012.73 - Firczuk et al. mRNA maturo (dopo splicing ed eventuale editing) che può essere esportato nel citoplasma per essere tradotto in proteina La coda di poli-A all'estremità 3' dell’mRNA forma un anello chiuso con il cap al 5’ a cui si lega il PIC (pre-initiation complex) all’inizio della traduzione. L'integrità di questo anello di mRNA circolarizzato è un bersaglio per il controllo della traduzione Negli eucarioti, l’inizio è la fase più regolata della traduzione: - formazione del PIC, con la subunità ribosomiale 40S e vari fattori di inizio associati per legare l’mRNA - una volta legato l’mRNA, il PIC scansiona l'mRNA per individuare il codone di inizio AUG, il cui riconoscimento innesca una serie di eventi che portano ad assemblare la subunità maggiore ed alla formazione del complesso d'inizio 80S. La complessità del percorso di inizio della traduzione offre molte opportunità di regolazione Translational control decrypted - Nature Structural & Molecular Biology, Focus on Translational Control, Editorial, vol. 19, 559, 2012 - (http://www.nature.com/nsmb/focus/translation/index.html) - (http://www.nature.com/nsmb/focus/translation/library/index.html) Un controllo traduzionale mRNA-specifico è determinato da elementi regolatori cis-acting, presenti essenzialmente nella regione 3' non tradotta (3'UTR) dell’mRNA. Questi elementi regolatori assemblano una miriade di fattori regolatori che modulano la lunghezza della coda di poli-A che, a sua volta, definisce la quantità di traduzione dell'mRNA. Questo meccanismo è importante per modulare l'espressione genica in processi fisiologicamente importanti, come l'infiammazione, l'apprendimento e l'acquisizione della memoria, e lo sviluppo embrionale Translational control decrypted - Nature Structural & Molecular Biology, Focus on Translational Control, Editorial, vol. 19, 559, 2012 - (http://www.nature.com/nsmb/focus/translation/index.html) - (http://www.nature.com/nsmb/focus/translation/library/index.html) In arancione un membro di una superfamiglia di GTPasi che regolano un gran numero di funzioni nella cellula eucariotica. Gli enzimi di questa superfamiglia condividono lo stesso meccanismo: 1) passano da una conformazione all’altra scambiando GDP con GTP quando interagiscono con un target predeterminato, in questo caso tRNA-aa 2) idrolizzano il GTP (liberando solo il fosfato e trattenendo nel sito attivo il prodotto GDP) quando interagiscono con un target predeterminato, in questo caso il ribosoma Nella cellula esistono particolari GTPasi che appartengono ad una grande superfamiglia genica, due classi e numerose famiglie che presentano forti omologie nonostante che le sequenze possano essere abbastanza differenti. Questi enzimi condividono lo stesso mecccanismo tipico ed inusuale: • idrolizzano il substrato GTP solo quando interagiscono con un opportuno bersaglio, diverso per i vari membri di ogni sottofamiglia • solo il fosfato prodotto dalla reazione di idrolisi viene liberato, il GDP viene invece mantenuto nel sito attivo • solo a seguito di una interazione molecolare con un bersaglio diverso per i vari membri della famiglia, l’enzima è in grado di liberare il prodotto GDP ed assumere la forma giusta per legare una nuova molecola del substrato GTP • possono esistere in almeno due conformazioni differenti G protein-GTP (active) GDP GDP Exchange Factor (GEF) GEF GTP GAP GTPase Activating Protein (GAP) Pi G protein-GDP (inactive) due conformazioni differenti = due differenti interazioni si comportano come una specie di interruttore ON/OFF Famiglie di piccole GTPasi e loro ruoli: • Proteine G (eterotrimeri a, b, g): signalling • IF-2, EF-Tu, EF-G, RF-3: Initiation Factors, Elongation Factors, Releasing Factors • Ras: signalling dei fattori di crescita • Rab: indirizzamento e corretta fusione di vescicole • ARF: gemmazione di vescicole rivestite da proteine • Ran: trasporto di proteine dentro e fuori dal nucleo • Rho: Regolazione assemblaggio del citoscheletro
Scaricare