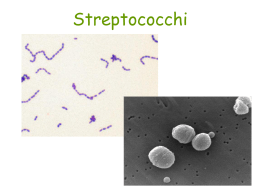
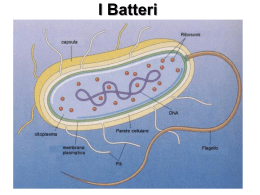
Gli streptococchi e gli stafilococchi orali Microbiologia della cavità orale Genere Streptococcus Tassonomia: Genere appartenente alla famiglia delle Streptococcaceae Caratteristiche: Cocchi Gram-positivi, asporigeni, aerobi facoltativi (alcune volte anaerobi obbligati), immobili. Disposizione caratteristica è la formazione di diplococchi che, in terreni liquidi, può progredire in catene più o meno lunghe. Gruppi di Lancefield: Nel 1933 R. C. Lancefield li divise in diversi gruppi (dalla A alla W, escludendo le lettere I e J) in base ad un antigene specifico presente nella loro parete cellulare (polisaccaridico o “sostanza C”, acidi teicoici o non tipizzabile) I gruppi sierologici sono correlati all’epidemiologia delle infezioni sostenute dagli streptococchi: • gruppo A – Streptococcus pyogenes ○ gruppo G – S. canis • gruppo B – Streptococcus agalactiae ○ gruppo L – rar. isolati dall’uomo (endocardite) • gruppo C – S. dysgalactiae, S. equi, S. equisimilis ○ gruppo M – endocardite subacuta, ascessi • gruppo D → Genere Enterococcus ○ gruppo N – streptococchi lattici (Lactococcus) • gruppo F – S. anginosus, S. constellatus, S. milleri ○ NON tipizzabili (alfa-emolitici o non-emolitici) Streptococcus spp Genere: Streptococcus Caratteristiche generali • Cocchi Gram-positivi (diametro: 0.6-1μm) con caratteristica disposizione a catenella • Aerobi-anaerobi facoltativi • Asporigeni • Immobili • Ossidasi negativi • Catalasi negativi Streptococcus spp Suddivisione in base • Attività emolitica su agar sangue – α emolisi (Streptococchi viridanti) – β emolisi (Streptococcus pyogenes) (Streptococcus agalactiae) g emolisi • Antigene C antigene polisaccaridico contenuto nella parete cellulare – Classificazione di Lancefield A, B, C, D e G. Streptococcus spp in chains Streptococcus pneumoniae (diplococcus). Fluorescent stain Non-groupable • S. pneumoniae – pneumonia • viridans streptococci – e.g. S. mutans * dental caries hemolysis reaction - sheep blood agar • alpha – partial hemolysis • green color • beta – complete clearing – A and B • gamma – no lysis Hemolysis • Groups A an B – beta • Group D – alpha • S. pneumoniae and viridans – alpha S. pneumoniae S. pneumoniae • Diplococchi lanceolati • Alfa emolitico • pneumolisina – Degrada i globuli rossi in condizioni di anaerobiosi • cresce su agar sangue • non possiede antigene di gruppo (Lancefield) Capsula • Importante fattore di patogenicità – Ceppi virulenti • Proprietà anti-fagocitarie • Proprità antigeniche (carboidrati) – Variabili nei vari stipiti – almeno 83 sierotipi diversi Capsula • immunità – Sierotipo specifica • vaccino contiene diversi sierotipi Patogenesi • Acido Teicoico – Attivazione del complemento – Richiamo di un elevato numero di cellule infiammatorie al sito d’infezione DISEASES CAUSED BY STREPTOCOCCUS PNEUMONIAE PNEUMOCOCCAL INFECTION Non-invasive disease • Sinusitis (sinuses) • Otitis media (middle ear) • Pneumonia (lungs) Musher, in Principles and Practice of Infectious Diseases, 1995 Invasive disease • Bacteraemia (blood) • • • • Meningitis (CNS) Endocarditis (heart) Peritonitis (body cavity) Septic arthritis (bones and joints) • Others (appendicitis, salpingitis, soft-tissue infections) Diagnosi di laboratorio • Microscopia e colorazione di Gram diretta • Esame colturale • Colonie alpha emolitiche • “Ombellicate” • Identificazione • Sensibilità all’optochina • Solubilità al bile • Reazione di “Quellung” • Antibiogramma Identificazione Sensibile all’optochina Group A streptococcus (S. pyogenes) Streptococcus pyogenes β emolitico di Gruppo A (responsabile di circa il 90% delle infezioni streptococciche umane) Ulteriormente suddivisibile in base alle caratteristiche antigeniche di alcune proteine di parete • Proteina M • Proteina T • Proteina R Streptococcus pyogenes Fattori di virulenza • Cellulari – Capsula (non immunogena) • Potere antifagocitario – Proteina M (ca 80 tipi - principale fattore di virulenza) • Potere antifagocitario • Potere immunogeno – Principale target dell’immunità naturale – Variabilità antigenica nell’ambito della specie – Possibili reinfezioni con tipi antigenici diversi • Patogenesi sequele post-infettive • Super antigene – Proteina F1 • responsabile per l’internalizzazione del microrganismo Streptococcus pyogenes Fattori di virulenza • Extracellulari – Esoenzimi • • • • • Ialuronidasi Streptochinasi NADasi DNAsi C5a peptidasi – Tossine • Eritrogenica (scarlattina) – Ceppi lisogeni portatori di un fago che codifica per la tossina – 4 varietà antigeniche (A, B, C e D) • Citotossine/emolisine – Streptolisina O – Streptolisina S Streptococcus pyogenes Habitat • Presenti nell’uomo – Tratto respiratorio – Cute – Tratto intestinale • Portatori sani 4-25% (le % più alte nei bambini) Trasmissione • Interumana (principalmente secrezioni alte vie respiratorie) Soggetti colpiti • Particolarmente comune in età pediatrica (5-15 anni) Streptococcus pyogenes Manifestazioni Acute/Suppurative • Angina streptococcica ± Scarlattina (Complicanze suppurative) • • • • • Ascesso peritonsillare Otite media Mastoidite Polmonite Meningite • Infezioni cutanee e sottocutanee – Impetigine – Erisipela – Cellulite • Sindrome da shock tossico/fascite necrotizzante • (Febbre puerperale) Streptococcus pyogenes Diagnosi di laboratorio Test rapido Tampone colturale: Esame colturale – Semina su agar sangue: • Colonie 1-2 mm di diametro (aspetto ± mucoso) circondate da β emolisi Identificazione – Cocchi Gram + – Catalasi-negativi – Sensibili alla bacitracina – Gruppo A con test al lattice (agglutinazione antigene-anticorpo) Streptococcus pyogenes Terapia • Penicillina (farmaco di prima scelta) • Macrolidi (farmaci di seconda scelta) Microbiologia della cavità orale La cavità orale costituisce un ecosistema formato da habitat molto diversi tra loro. E’ caratterizzata da una elevata dinamicità dovuta alla continua eliminazione ed introduzione di batteri ed alimenti. Pertanto, anche se esiste una popolazione batterica residente, occasionalmente non deve sorprendere il fatto di ritrovare nella cavità orale microrganismi che di solito colonizzano altri siti dell’ospite. Microbiologia della cavità orale Tra i fattori che influenzano l’ecosistema orale, i più importanti sono: la presenza di placca; l’igiene orale; i trattamenti odontostomatologici; le condizioni fisiche personali (aumento della quantità di fibronectina, glicoproteina posta sull’epitelio); dieta alimentare Microbiologia della cavità orale L’ambiente è formato dalle labbra, guance, palato, denti e solco gengivale I denti presentano una superficie dura che contrariamente a molte altre superfici corporee non subisce il fenomeno dello sfaldamento. Il dente presenta: • facce prossimali in condizioni di anaerobiosi; • facce vestibolari; • facce linguali; • margine gengivale. Microbiologia della cavità orale L’ambiente orale è colonizzato da: Protozoi; Miceti; Virus; Batteri. Oltre 350 specie batteriche differenti risiedono in modo permanente nel cavo orale. Tra le tante il genere Streptococcus rappresenta una grossa componente eziologica. Microbiologia della cavità orale Genere Streptococcus Gruppi di Sherman (1937) – Jones (1978): suddivisione in base a caratteristiche fisiologiche o patogenetiche o di habitat Streptococchi piogenici – S. agalactiae, S. canis, S. dysgalactiae, S. equi, S. equisimilis, S. iniae, S. porcinus, S. pyogenes, S. suis, S. urinalis. Beta-emolitici correlati a patologie piogeniche Pneumococchi – S. pneumoniae Streptococchi orali – S. anginosus, S. australis, S. constellatus, S. cricetus, S. cristatus, S. gordonii, S. infantis, S. intermedius, S. milleri, S. mitior, S. mitis, S. mutans, S. oralis, S. parasanguinis, S. peroris, S. ratti, S. salivarius, S. sanguinis, S. sobrinus, S. vestibularis. Streptococchi viridanti poiché alfa-emolitici. Alcuni di essi sono patogeni opportunisti (isolati da altre sedi in condizioni normali o patologiche). Eziologia batterica principale nelle endocarditi (50-70%). Causa primaria di carie (S. mutans, S. sanguinis). Streptococchi fecali – S. avium, S. faecalis, S. faecium, S. gallinarum (passati al genere Enterococcus), S. bovis, S. equinus, S. gallolyticus, S. infantarius. Streptococchi lattici – trasferiti nel genere Lactococcus Streptococchi anaerobi – (in realtà aerotolleranti e passati ad altri generi) Recente classificazione (1995) è quella di Kawamura et al. Basata su omologie di sequenze delle subunità ribosomiali 16S. Microbiologia della cavità orale Genere Streptococcus Specie sanguinis Caratteristiche: Cocco Gram-positivo, asporigeno, aerobio facoltativo, immobile. Raggruppamento: non classificabile secondo Lancefield o appartente al gruppo H. Alfa-emolitico o più raramente beta-emolitico o non-emolitico inserito, secondo Sherman-Jones, negli streptococchi orali. Streptococcus sanguinis si ritrova in quantità consistente nella placca dentaria; infatti è la prima specie batterica ad aderire alla superficie dei denti e viene quindi considerato il primo agente della carie. Successivamente, dopo la formazione della placca, viene sostituito da S. mutans. Può essere agente eziologico di setticemie ed endocarditi subacute e viene quindi isolato dal sangue, da cui il nome. Forme L (cioè prive di parete cellulare) di questa specie sono state messe in relazione con casi di stomatite aftosa. Microbiologia della cavità orale Genere Streptococcus Gruppo mutans Caratteristiche: Cocco Gram-positivo, asporigeno, aerobio facoltativo, immobile, isolato per la prima volta nel 1924 da Clark. Raggruppamento: non classificabile secondo Lancefield o qualche ceppo appartente al gruppo E. Alfa-emolitico o non-emolitico inserito secondo ShermanJones negli streptococchi orali. Distinto in otto sierotipi (a-h), da luogo a cinque specie differenti: S. mutans (sierotipi c,e ed f), S. rattus (sierotipo b), S. cricetus (sierotipo a), S. sobrinus (sierotipi d e g), S. ferus Isolato dalla carie dentaria: sembra sia il principale responsabile nel mantenere il processo cariogeno iniziato da S. sanguinis e la colonizzazione è favorita da una dieta ricca di zuccheri. Può essere agente eziologico di endocarditi subacute. Microbiologia della cavità orale Fattori di patogenicità degli Streptococchi orali Streptococcus mutans produce un composto polisaccaridico insolubile extracellulare derivante dal metabolismo del saccarosio. Altri microrganismi orali, di contro, non ne sono capaci; a questa rete polisaccaridica questi ultimi aderiscono, contribuendo alla formazione della placca batterica. S. mutans presenta inoltre una spiccata adesività per lo smalto. Viene mantenuto un pH di 5 o inferiore per diverse ore dalla placca (smette di funzionare il tampone della saliva capace di rimuovere tale microrganismo). S. mitior, S. salivarius, S. sanguinis non producono acidi dal saccarosio. Gli acidi che S. mutans, S. sanguinis e S. salivarius producono sono l’acido lattico e l’acido acetico, capaci di attaccare lo smalto e di limitare la crescita degli altri microrganismi. L’acido paraminobenzoico (PABA) prodotto da S. mutans è un fattore di crescita per S. sanguinis. Microbiologia della cavità orale Nuove frontiere nel combattere gli effetti negativi di alcuni Streptococchi orali Il corredo genomico completo di S. mutans è stato sequenziato da Joseph Ferretti et al. (Science Center of the University of Oklahoma) e pubblicato su “Proceedings of the National Academy of Sciences”. Oltre 2 milioni di coppie di basi, individuando 1963 frammenti del codice genetico, al 63% dei quali è stata attribuita una funzione. Almeno un centinaio di questi geni sono esclusivi del microrganismo. • In Florida (Jeffrey Hilmann) si sta ingegnerizzando un ceppo di S. mutans incapace di produrre acido lattico, anche dal glucosio; inoltre è stata inserita una sequenza, mutacina 1140, capace di aggredire il batterio “normale” ed altri nocivi; attualmente il mutante è controllato e limitato da una fonte di D-alanina per sicurezza (risultati presentati al Congresso Nazionale dell’Accademia Italiana di Conservativa, Riva del Garda, 21 Aprile 2004) • In Inghilterra si è in sperimentazione umana per la commercializzazione in dentifrici o colluttori di un vaccino basato su anticorpi in grado di bloccare i siti normalmente attaccati da S. mutans; Biofilm di S. mutans Coaggregazione batterica Coaggregazione batterica nella formazione della placca dentale STAPHYLOCOCCUS spp Famiglia: Micrococcaceae Genere: Staphylococcus Cocchi Gram-positivi (0.5um-1um) Aggregazione a “grappolo d’uva” Immobili Aerobi o Anaerobi Facoltativi Catalasi positivi Alofili (crescono in presenza di cloruro di sodio 10%) Principali componenti della normale flora batterica cute naso Staphylococcus • Si riconoscono 20 specie di cui 12 sono state riscontrate nell’uomo • Coagulasi-positivi – Staphylococcus aureus (pigmenti carotenoidi) • Coagulasi-negativi – – – – Staphylococcus epidermidis Staphylococcus saprophyticus Staphylococcus capitis Staphylococcus haemolyticus, ecc.. • Coagulasi - lega il fibrinogeno e lo converte in fibrina insolubile Staphylococcus aureus Fattori di virulenza di Staphylococcus aureus • Componenti strutturali – Capsula – Proteina A • Tossine – – – – Citotossine Enterotossine (A-E, G-I) 30-50% di ceppi di S. aureus Tossine esfoliative (ETA e ETB) 5-10% di ceppi di S. aureus TSST (Toxic Shock Syndrome Toxin-1) • Enzimi – – – – – – – Coagulasi Catalasi Ialuronidasi Fibrinolisina Lipasi Nucleasi Penicillinasi Diffusione • Enzimi che degradano i tessuti – lipasi – ialuronidasi → acido ialuronico del tessuto connetivo Causa importante di infezioni opportunistiche sia in ambito ospedaliero che comunitario: • ascessi/infezioni cutanee • polmoniti • osteomieliti • artriti settiche • batteremie • endocarditi • sindrome dello shock tossico/pelle ustionata/ tossinfezioni alimentari S. aureus • bambini – Sindrome della pelle ustionata * esfoliatina Sindrome dello shock tossico • • • • • febbre eritema desquamazione vomito diarrea Staphylococcus epidermidis • principale componente della normale flora batterica della cute • infezioni: batteriemie, endocarditi, ferite chirurgiche, vie urinarie • infezioni opportunistiche/nosocomiali (cateteri, shunt, protesi e dialisati peritoneali) Staphylococcus saprophyticus • infezioni delle vie urinarie/opportunistiche • coagulasi-negativi – non facilmente differenziabili da S. epidermidis Diagnosi di laboratorio • Esame Microscopico • Esame colturale – Terreno selettivo:MSA • Test sierologici • Identificazione – Coagulasi – Fermentazione del mannitolo – Nucleasi termostabile • Antibiogramma Identificazione S. aureus • beta emolitici – agar sangue • Fermentano il mannitolo • Pigmentazione giallo-oro (aureus) • coagulasi-positivi Identificazione Stafilococchi coagulasi - negativi • Non-emolitico – su agar sangue • Non fermenta il Mannitolo • Non-pigmentato • Coagulasi-negativo Terapia, Profilassi e Controllo • Beta-lattamici: 30-50% di S. aureus e la maggior parte degli stafilococchi coagulasi negativi sono resistenti alle penicilline – Beta-lattamasi – mecA codifica per PBP2a in MRSA • Glicopeptidi • Controllo della diffusione di MRSA in ambito nosocomiale • Chemioprofilassi per i portatori sani con vancomicina e rifampicina Antibiotico terapia • Resistenza alla penicillina – penicillinasi • Antibiotici beta lattamici (inclusa la meticillina) – spesso inefficaci – Modificazioni nelle PBP (PBP 2a) – Resistenza alla penicillina • Vancomicina • Farmaco di prima scelta • Resistenza è già stata osservata Summary Figure (Identification Scheme) Note: Strep. viridans are alpha hemolytic and negative for all the tests below GRAM POSITIVE COCCI Catalase Streptococcus (pairs & chains) + Staphylococcus (Clusters) Coagulase + S. aureus &hemolytic mannitol yellow - Hemolysis • S. epidermidis nonhem olytic (usua lly) mannitol (2) white • BETA: Bacitracin S .pyogenes (group A) + CAMP/Hippurate + S. agalactiae (group B) ALPHA: Optochin/Bile Solubility GAMMA: Bile Es culin + S. pneumoniae + 6.5% NaCl + Group D* Enterococcus Bile Esc ulin NaCl Group D* + 6.5% Non-Enterococcus (*can also be beta or alpha hemolytic)
Scaricare