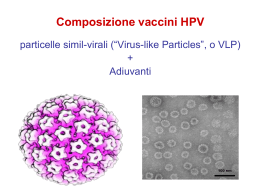
La vaccinazione contro l’HPV Bologna 16 marzo 2007 Seminario di studio Alba Carola Finarelli Servizio Sanità Pubblica Direzione Sanità e politiche sociali Contenuti dell’incontro: • Epidemiologia delle infezioni da HPV • Epidemiologia del carcinoma della cervice uterina e copertura dello screening • I vaccini contro l’HPV nell’uomo • Efficacia e sicurezza del vaccino quadrivalente • Riflessioni sulle strategie vaccinali Epidemiologia delle infezioni da HPV I PAPILLOMAVIRUS • Sono virus a DNA a doppia elica contenuti in un capside icosaedrico di 55 nm di diametro. • Ne esistono oltre 200 tipi di cui 100 ben caratterizzati. • Sono strettamente specie specifici e più di 80 tipi infettano l’uomo. • Oltre 30 tipi infettano le mucose genitali e di essi circa 15 sono definiti a rischio oncogeno. Il genoma di HPV si suddivide in 3 regioni: - Una regione precoce “Early” (E18) costituita da geni responsabili della trascrizione, della replicazione e della trasformazione tra cui gli oncogeni E6 e E7. - Una regione tardiva “Late” che codifica per le proteine del capside (L1-L2). - Una regione di controllo (LCR) che contiene elementi regolatori per la trascrizione e la replicazione. HPV che infettano la cervice uterina Sono stati suddivisi in HPV: “a basso rischio” (6, 11, 42, 43, 44 ecc.) quasi mai associati a carcinomi invasivi della cervice •“a medio rischio” (35, 39, 51, 56, 59 ecc.) associati, ma non di frequente, con il carcinoma della cervice •“ad alto rischio” (16, 18, 31, 33, 45, 52, 58 ecc.) frequentemente associati ai carcinomi della cervice L’infezione da HPV E’ la più comune delle infezioni a trasmissione sessuale e la trasmissione può avvenire anche tramite semplice contatto nell’area genitale. Il profilattico riduce il rischio, ma non protegge completamente dall’infezione. Il 50-80% dei soggetti sessualmente attivi si infetta nel corso della vita con un virus HPV e fino al 50% si infetta con un tipo oncogeno. L’80-90% delle infezioni sono transitorie, asintomatiche e guariscono spontaneamente. L’infezione persistente con HPV oncogeni è la condizione necessaria per l’evoluzione a carcinoma. Il DNA dell’HPV è presente nel 99.7% dei carcinomi cervicali. Baseman JG et al. J Clin Virol 2005; 32 Suppl 1; S1624; Brown DR et al. J Infect Dis 2005; 191: 182–92; Bosch FX et al. J Natl Cancer Inst Monogr 2003; 313; Possibili esiti di una infezione da HPV Infezione da HPV a basso rischio ad alto rischio 6, 11, altri 16, 18, altri Condilomi genitali Infezione cervice Terapia CIN I/II CIN II/III Regressione Carcinoma cervice Regressione IL CARCINOMA E’ UN ESITO RARO DI UNA INFEZIONE COMUNE Per ogni milione di donne infettate con un qualunque tipo di HPV: • 100.000 svilupperanno un’anomalia citologica cervicale • 8.000 svilupperanno un CIN III (ca in situ) • 1.600 svilupperanno un carcinoma della cervice I tipi 16 e 18 di HPV sono identificati più frequentemente nei tumori cervicali 16 18 17,2 45 6,7 31 2,9 33 2,6 52 Genotipo 53.5% 70.7% 77.4% 80.3% 82.9% 85.2% 87.4% 88.8% 53,5 2,3 58 2,2 35 1,4 59 1,3 56 1,2 51 1,0 39 0,7 68 0,6 73 0,5 82 0,3 altri 1,2 4,4 X 0 10 20 30 40 50 60 70 80 90 100 Casi di carcinoma della cervice attribuiti ai genotipi di HPV (%) Munoz N et al. Int J Cancer 2004; 111: 278–85. Prevalenza dei diversi tipi di HPV per regione OMS Per ogni milione di donne infettate con un qualunque tipo di HPV: Progressione della malattia Epitelio normale Anni Mesi Tempo Infezione da HPV coilocitosi Screening Trattamento CIN I Lesioni squamose intraepiteliali di basso grado (LSIL) CIN II Decenni CIN III Lesioni di alto grado (HSIL) Carcinoma Prevalenza HPV in Italia popolazione generale (2002): Torino screening 25-70 anni Brescia ambulatorio 18-63 anni prevalenza 8,8% prevalenza 6,6% donne con citologia anormale (1995-01): Vicenza 15-60 anni Catania prevalenza 35,3% prevalenza 53,9% donne con CIN2+ (2000-01): Firenze prevalenza 97,5% HPV oncogeni (%) 15 16 14 12 10 10 8 6 5 4 2 0 0 20-24 25-29 30-34 35-39 40-44 45-49 50-54 55-59 60-64 Tasso di incidenza del carcinoma della cervice standardizzato per 100,000 Incidenza età-specifica di CC e prevalenza di infezione HPV per età in Italia Età (anni) Fonti: AIRT 2006 e Ronco 2005 Il carcinoma della cervice uterina e copertura dello screening Epidemiologia del carcinoma della cervice uterina in Italia Fonti di dati: – registri tumori (25% della popolazione italiana) – Cause di morte ISTAT Epidemiologia del carcinoma della cervice uterina in Italia Periodo 1999-2002 – media annuale: – 3.500 casi incidenti (10/100.000 donne tutte le età) 370 decessi ca cervice 1800 morti per ca utero in sede non specificata – Circa 1.000 decessi stimati per ca utero – Tasso di mortalità corretto per misclassificazione: 3/100.000 donne. AIRT Working Group. Italian Cancer Figures - Report 2006. Incidence, mortality and estimates. Epidemiologia & Prevenzione. January-February 2006 (2). Tassi di incidenza e mortalità da carcinoma della cervice uterina per classi di età Fonte: AIRT Working Group. Italian Cancer Figures - Report 2006. Incidence, mortality and estimates. Epidemiologia & Prevenzione. JanuaryFebruary 2006 (2). Andamento dei tassi di incidenza e mortalità anni 1988-2002 tasso standardizzato standardized rate (x 100.000) 12 10 8 6 4 2 0 1988-1992 1993-1997 incidenza-incidence 1998-2002 mortalità-mortality Fonte: AIRT Working Group. Italian Cancer Figures - Report 2006. Incidence, mortality and estimates. Epidemiologia & Prevenzione. January-February 2006 (2). Lo screening in Italia La popolazione obiettivo di tutti i programmi di screening include circa il 66,7% della popolazione femminile tra i 25-64 anni di età. L’adesione ai programmi varia considerevolmente tra regione e regione. Media compliance all’invito: 37% In totale attualmente circa il 25% della popolazione obiettivo viene invitata ogni anno attraverso i programmi regionali/locali (standard 33%) Quinto rapporto dell’Osservatorio Nazionale Prevenzione dei Tumori Femminili (available at www.osservatoriotumori.it ) L’abitudine alla diagnosi precoce in Italia e in Emilia-Romagna Lo screening “opportunistico” gioca un ruolo determinante • Dallo studio Passi 2005 risulta che il 78% delle donne Italiane hanno eseguito almeno un Pap test a scopo preventivo, di cui circa il 70 % negli ultimi 3 anni. • In Emilia-Romagna 90% e 83%, rispettivamente. I vaccini contro l’hpv nell’uomo Gli studi sui vaccini preventivi contro l’HPV Studi di fase I: test iniziale del vaccino in piccoli numeri di soggetti adulti sani, hanno valutato principalmente la sicurezza. Studi di fase II: studi più ampi, hanno valutato l’efficacia (di solito attraverso l’immunigenicità) e la sicurezza nella popolazione target. Studi di fase III: studi pilota su cui si basa l’autorizzazione all’uso in termini di efficacia e sicurezza. Studi di fase IV o post-marketing: valutano sicurezza ed efficacia su grandi numeri investigando: • L’uso ottimale del vaccino (es. età, co-somministrazione) • L’efficacia in gruppi a rischio (anziani, immunodepressi) • Il mantenimento dell’efficacia e il monitoraggio della sicurezza a lungo termine Endpoint per valutare l’efficacia teorica e pratica dei vaccini contro l’HPV Endpoint clinici: • CIN1 • CIN 2-3 HPV+ • carcinoma della cervice Endpoint virologici: • infezione incidente • Infezione persistente • rilevazione di genotipi specifici Endpoint immunologici • tassi di sieroconversione • medie geometriche dei titoli anticorpali Vaccini preventivi contro l’HPV commercializzati o di prossima commercializzazione in Italia Gardasil (Merck- Sanofi Pasteur MSD) • Vaccino quadrivalente (tipi 16/18/6/11) • Somministrato in 3 dosi IM (0, 2 e 6 mesi) • Adiuvante: alluminio • Richiesta di marketing all’EMEA fine 2005, licenza ottenuta • Decreto autorizzazione al commercio AIFA 3 marzo 2007 (classe HRR) Cervarix (GlaxoSmithKline) • Vaccino bivalente (tipi 16/18) • Somministrato in 3 dosi IM (0, 1 e 6 mesi) • Adiuvante: AS04 (Al(OH)3 + + MPL®) • Richiesta di marketing all’EMEA marzo 2006 Costo del vaccino quadrivalente Gardasil 360 $ al pubblico (USA) 564.45 Euro al pubblico (Italia: da aprile 2007) per ciclo vaccinale (3 dosi) 376.20 Euro (342+34,2 IVA) per SSR Efficacia e sicurezza del vaccino anti-hpv DENOMINAZIONE DEL MEDICINALE GARDASIL sospensione iniettabile in siringa preriempita Vaccino del Papillomavirus Umano [Tipi 6, 11, 16, 18] (Ricombinante, adsorbito) Struttura delle VLP costituite da pentameri di L1 INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Gardasil è un vaccino per la prevenzione: 1. della displasia di alto grado del collo dell’utero (CIN 2/3) e del carcinoma del collo dell’utero HPV 6, 11, 16 e 18 correlati. 2. delle lesioni displastiche di alto grado della vulva (VIN 2/3) HPV 6, 11, 16 e 18 correlati. 3. delle lesioni genitali esterne (condilomi acuminati) HPV 6, 11, 16 e 18 correlati. 4.1 Indicazioni • L’indicazione è basata sulla dimostrazione di efficacia di Gardasil in donne adulte di età compresa tra 16 e 26 anni e sulla dimostrazione dell’immunogenicità di Gardasil in bambini ed adolescenti di età compresa tra 9 e 15 anni. • L’efficacia protettiva non è stata valutata nei maschi 5.1 Proprietà farmacodinamiche Meccanismo d’azione • Non esistono modelli animali per lo studio dell’infezione da papillomavirus umano. • I modelli animali su papillomavirus specie specifici hanno messo le basi e sono stati utilizzati come modelli per lo sviluppo dei vaccini umani. • Il ruolo esatto dei vari meccanismi immuni nell’efficacia protettiva dei vaccini HPV L1 VLP non è ancora stato determinato, ma sembra che l’efficacia sia mediata dallo sviluppo di una risposta immune di tipo umorale. STUDI CLINICI DEL PRODOTTO (12 studi clinici su 21.514 soggetti ) Sulla base dell’età dei soggetti coinvolti negli studi il programma di valutazione del vaccino quadrivalente è stato diviso in: • Studi di efficacia su soggetti di sesso femminile di età 16-26 anni. • Studi di bridging di immunogenicità in soggetti di sesso femminile e maschile di 9-15 anni confrontati con soggetti di sesso femminile di età 16-26 anni. 1 - STUDI DI EFFICACIA CLINICA (totale di 20,887 soggetti) 4 studi clinici di Fase II e III, randomizzati, in doppio cieco, controllati con placebo che includevano oltre 20,000 donne di età 16-26 anni. Gli studi sono stati condotti in Nord e Sud America, Europa, Asia dal 1998 al 2005 con un follow-up massimo di 4 anni. ENDPOINTS DI EFFICACIA PRIMARIA • CIN 2/3 e AIS HPV16/18+ come marker clinico surrogato del cervico-carcinoma • CIN di qualsiasi grado HPV 6,11,16,18+ • Lesioni della vulva e della vagina (condilomi genitali, VIN e VaIN) HPV 6,11,16,18+ • VIN 2/3 e VaIN 2/3 HPV 16/18 + come markers clinici surrogati di carcinoma vulvare e vaginale. METODI I soggetti sono stati randomizzati al vaccino/placebo all’arruolamento senza effettuare uno screening preliminare per la presenza di una infezione da HPV. All’arruolamento tutti i soggetti sono stati sottoposti a: • Test sierologico anti HPV • Pap test • Prelievo cervico-vaginale per tipizzazione HPV • Colposcopia in caso di Pap test anomalo Ogni 6 o 12 mesi tutti i soggetti hanno ripetuto: • Pap-test • Prelievo cervico-vaginale per tipizzazione HPV POPOLAZIONI UTILIZZATE PER LE ANALISI DEGLI STUDI DI EFFICACIA Popolazione Per Protocollo (PPE Per Protocol Efficacy) (tutti gli studi): • Somministrazione di 3 dosi entro 1 anno dall’arruolamento • naive (negativi alla PCR e sieronegativi) a HPV 6,11,16,18 all’arruolamento e fino ad 1 mese dopo la terza dose (7°mese) • assenza di violazioni maggiori dal protocollo • Efficacia misurata a partire dalla visita al 7° mese La PPE comprende solo il 64 -84% di tutti i soggetti arruolati BASELINE DATA DELLA PPE • Il profilo demografico della Popolazione per Protocollo è compatibile con quello della popolazione generale. • Le caratterisitiche demografiche relative all’età, sesso, razza, regione geografica, abitudine al fumo, consumo di alcoool e storia di MST all’arruolamento sono analoghe tra soggetti vaccinati e soggetti che hanno ricevuto il placebo. • Le abitudini sessuali differiscono per area geografica. L’età al 1° rapporto è in media 16,7 anni. Tra gli anticoncezionali la contraccezione orale è la più utilizzata (59%) specie in Europa (68%). POPOLAZIONE MITT-3 (Intention to treat) Rappresenta la popolazione femminile più simile a quella generale: • Somministrazione di almeno 1 dose di vaccino • Soggetti HPV positivi o negativi al momento dell’arruolamento • Efficacia misurata a partire da 1 mese dopo la 1° dose EFFICACIA (%) DEL VACCINO HPV QUADRIVALENTE (analisi combinata su 4 studi N = >20.000) 100 95% 100% 100% 99% 93% 70% 54% 47% 50 42% 36% 0 PPE population CIN/AIS CIN 1 MITT-3 population CIN 2 CIN3/AIS EGL 2 - STUDI DI IMMUNOGENICITÀ (su un totale di 12,345 soggetti) END POINT IMMUNOLOGICI PRIMARI • Media geometrica di titoli anti HPV 6, 11, 16, 18 un mese dopo la terza dose (7° mese). • Proporzione di soggetti che hanno sieroconvertito a ciascuno dei 4 antigeni un mese dopo la terza dose (7° mese). Per i vaccini HPV non è stato identificato un livello minimo anticorpale associato alla protezione. POPOLAZIONE NEGLI STUDI DI IMMUNOGENICITÀ Per Protocol Immunogenicity (PPI) Population: • soggetti sieronegativi e PCR negativi all’HPV 6,11,16,18 all’arruolamento • PCR negativi al 7° mese • vaccinati con 3 dosi nei tempi stabiliti • senza deviazioni dal protocollo dello studio. Percentuale di sieroconversione all’HPV 6, 11, 16, 18 al terzo e al settimo mese dall’arruolamento 100 99,5 99 98,5 98 97,5 97 96,5 96 95,5 95 HPV6 HPV11 HPV16 HPV18 HPV6 MESE 3 Femmine 16-23 anni HPV11 HPV16 HPV18 MESE 7 Maschi 10-15 anni Femmine 10-15 anni STUDI DI BRIDGING DI IMMUNOGENICITÀ Maschi 9 – 15 anni (Protocolli 016 e 018) Femmine 9 – 15 anni (Protocolli 016 e 018) Femmine 16 – 26 anni (Protocolli 013 e 015) n GMT (95% IC) n GMT (95% IC) n GMT (95% IC) HPV 6 901 1038 (975- 1105) 927 931 (877- 989) 2827 542 (527- 559) HPV 11 901 1392 (1304- 1485) 927 1306 (1226- 1390) 2827 766 (741- 793) HPV 16 900 6091 (5640- 6579) 929 4945 (4584- 5335) 2707 2314 (2206- 2427) HPV 18 905 1359 (1256- 1470) 932 1046 (971- 1127) 3040 461 (444- 478) GMT- medie geometriche del titolo in mMU/ml (mMU= unità milli-Merck) Medie geometriche dei titoli anticorpali all’arruolamento, al terzo e al settimo mese 10000 1000 100 10 1 HPV6 HPV11 HPV16 HPV18 HPV6 HPV11 HPV16 HPV18 HPV6 HPV11 HPV16 HPV18 MESE 1 MESE 3 MESE 7 Femmine 16-23 anni Maschi 10-15 anni Femmine 10-15 anni I maschi? Non sono stati inclusi negli studi iniziali di efficacia per cui non esistono dati che permettano studi di bridging tra maschi adulti e adolescenti. E’ stata dimostrata l’immunogenicità del Gardasil in maschi 9-15 anni di età e i titoli anticorpali sono risultati non inferiori a quelli delle donne 16-26 anni. Sono in corso studi clinici di efficacia sui maschi. La sezione 4.1 e 5.1 della RCP (Riassunto Caratteristiche Prodotto) riporta che negli adolescenti maschi sono state dimostrate immunogenicità e sicurezza del Gardasil, ma che non esistono dati sull’efficacia protettiva. 3 – STUDI SUL PROFILO DI SICUREZZA (11,813 soggetti che hanno ricevuto Gardasil e 9,701 placebo) Nel corso di 5 studi clinici (di cui 4 controllati con placebo) la sicurezza è stata valutata sulla base della sorveglianza effettuata tramite la scheda di vaccinazione nei 14 giorni successivi ad ogni iniezione di Gardasil o placebo su 6,160 soggetti vaccinati e 4,064 che avevano ricevuto il placebo e attraverso la segnalazione di ogni nuova situazione clinica per il periodo di follow-up fino a 4 anni. EVENTI AVVERSI La percentuale di soggetti che ha riportato un evento avverso è risultata simile tra il gruppo dei vaccinati (59%) e quello placebo (60%). Pochi soggetti hanno riportato eventi avversi gravi e le proporzioni sono risultate analoghe tra vaccinati e placebo. L’insorgenza di malattie autoimmuni sistemiche non ha evidenziato differenze nel gruppo dei vaccinati rispetto ai placebo. I decessi avvenuti non sono risultati correlabili al vaccino. Reazioni avverse correlate all’uso del vaccino con un frequenza pari almeno all’1,0% Disordini generali e alterazioni del sito di somministrazione: Molto comune: piressia; eritema, dolore e gonfiore al sito di iniezione Comune: sanguinamento, prurito al sito di iniezione Alterazioni dell’app. respiratorio, del torace e del mediastino: Molto raro: broncospasmo Alterazioni della cute e del tessuto sottocutaneo: Rari: orticaria 4.4 AVVERTENZE SPECIALI E PRECAUZIONI D’IMPIEGO • Gardasil non ha mostrato di avere effetto terapeutico. • La vaccinazione non sostituisce l’abituale screening del collo dell’utero. • Non vi sono dati circa l’impiego di Gardasil in soggetti con una risposta immunitaria ridotta. • La durata della protezione conferita non è attualmente nota, è stata osservata un’efficacia protettiva prolungata per 4,5 anni dopo il completamento del ciclo delle 3 dosi. 4.5 INTERAZIONE CON ALTRI MEDICINALI E ALTRE FORME DI INTERAZIONE • La somministrazione concomitante con il vaccino dell’epatite B non interferisce con la risposta immunitaria ai tipi di HPV. La risposta al vaccino dell’epatite B è stata ridotta con analoghi tassi di sieroprotezione ma ridotte medie geometriche dei titoli anticorpali. • L’uso di contraccettivi ormonali (il 57% delle donne vaccinate ne faceva uso) non sembra influenzare la risposta immunitaria a Gardasil 4.6 GRAVIDANZA E ALLATTAMENTO • Non sono stati effettuati studi specifici sul vaccino in donne in gravidanza. • Nelle gravidanze insorte durante gli studi clinici (2,266 donne di cui 1,115 vaccinate e 1,151 del gruppo placebo) non è stato rilevato alcun impatto negativo sulla fertilità in termini di incidenza di aborti spontanei, morti intra-uterine e anomalie congenite. • Nonostante i dati non abbiano fornito alcuna segnalazione circa la sicurezza di impiego in gravidanza essi non sono sufficienti per raccomandarne l’uso. • Gardasil può essere somministrato a donne in allattamento sulla base di quanto osservato in 995 madri che hanno allattato nel corso degli studi clinici senza comparsa di reazioni avverse né alterazioni di immunogenicità del vaccino. Conclusioni sulle evidenze disponibili ad oggi Sicurezza: buon profilo di sicurezza a 4,5 anni su oltre 10.000 soggetti vaccinati Immunogenicità: elevata immunogenicità con tassi di siero-conversione >98% per tutti i tipi di HPV target Efficacia: elevata efficacia nel prevenire le infezioni dei genitali esterni, le VIN2-3 e le CIN 2-3 HPV 16 e 18 correlate Scheda tecnica del vaccino Gardasil: http://www.emea.eu.int/humandocs/PDFs/EPAR/gardasi l/H-703-PI-it.pdf Gap conoscitivi bisognosi di ricerca post-marketing • profilo di sicurezza a lungo termine • durata dell’efficacia • comprensione dei meccanismi immunologici d’azione • pressione selettiva • cross-protezione • co-somministrazione • vaccini di 2° generazione Gli studi finanziati dal Ministero della salute: gli obiettivi (1) •descrivere l’incidenza per carcinoma della cervice in Italia, per area geografica ed età •descrivere la mortalità per carcinoma della cervice in Italia, aggiustata per misclassificazione, per area geografica ed età •stimare la prevalenza delle infezioni da HPV ad alto rischio nelle donne tra 18 e 26 anni, residenti nel nord, centro e sud Italia •stimare la prevalenza delle infezioni da HPV ad alto rischio nelle donne tra 25 e 60 anni residenti nel nord, centro e sud Italia Gli studi finanziati dal Ministero della salute: gli obiettivi (2) •effettuare una indagine di conoscenza, attitudine e pratica (CAP) sul tumore della cervice uterina e le sue possibilità di prevenzione primaria e secondaria, in un campione di donne italiane di 18-26 anni •stimare l’adesione all’offerta attiva della vaccinazione contro l’HPV rivolta a donne italiane tra 18 e 26 anni •valutare la fattibilità di uno studio sull’interazione tra vaccinazione anti-HPV e screening del carcinoma della cervice •stimare attraverso modelli matematici il possibile impatto di diverse strategie di prevenzione del carcinoma della cervice (programmi di screening/vaccinazione) Riflessioni sulle strategie vaccinali dove è il virus • Frequenza HPV molto diversa nelle varie aree del mondo • Quindi impatto del vaccino molto diverso (vedi diapositive su prevalenza HPV nelle diverse Regioni OMS) cosa si sa sul vaccino registrato Dopo 4,5 anni dalla somministrazione: • efficacia protettiva nei confronti degli HPV 16 e 18 vicina al 100% sulle lesioni precancerose nelle donne 16-24 anni • immunogenicità elevata (fino al 98%) verso gli HPV contenuti nel vaccino nelle ragazze 9-15 anni • rimane scoperto dalla protezione il 30% degli HPV ad alto rischio (screening) cosa non si sa • Durata della protezione • Pressione selettiva verso altri HPV ad alto rischio • Efficacia nelle donne con infezione presente o pregressa • Efficacia nei maschi • Efficacia e sicurezza in popolazioni specifiche (gravide, immunodepressi) “confusione” su tema rischio vaccinazione in gravidanza (CSS) i punti chiave Strategia nazionale • Coordinamento delle azioni - informazione/formazione operatori - informazione cittadini - esecuzione (impatto organizzativo) - registro delle vaccinate - sorveglianza effetti avversi - sorveglianza risultati pubblico/privato (l’obiettivo più difficile) Una parentesi……gli eventi avversi (1) Cosa • Segnalare qualsiasi sintomo che desti preoccupazione, osservato dopo la somministrazione del vaccino come (2) • Scheda segnalazione regionale (ministeriale modificata) reperibile presso Servizio Farmacovigilanza aziendale e Servizi vaccinali • Informazioni essenziali: - dati anagrafici di chi viene vaccinato - data e ora somministrazione vaccino - data e ora insorgenza sintomi - descrizione sintomi: tipo, durata, esito (allegare eventuali accertamenti o lettera dimissione se ricovero) - tipo e nome commerciale vaccino - n. Lotto e scadenza vaccino SCHEDA UNICA DI SEGNALAZIONE DI SOSPETTA REAZIONE AVVERSA(ADR) (da compilarsi a cura dei medici o degli operatori sanitari e da inviare al Responsabile di farmacovigilanza della struttura sanitaria di appartenenza) 1. INIZIALI DEL 2. DATA DI NASCITA 3. SESSO 4. DATA INSORGENZA REAZIONE 5. ORIGINE ETNICA CODICE SEGNALAZIONE PAZIENTE __ __ ____/_____/________ []M []F ____/_____/________ ora _______ _________________ *se il segnalatore è un medico 6. DESCRIZIONE DELLA REAZIONE ED EVENTUALE DIAGNOSI* 7. GRAVITA' DELLA REAZIONE: ◊ GRAVE [] DECESSO []OSPEDALIZZAZIONE O PROLUNGAMENTO OSP. []INVALIDITA' GRAVE O PERMANENTE []HA MESSO IN PERICOLO DI VITA []ANOMALIE CONGENITE/DEFICIT DEL NEONATO ◊ NON GRAVE 8. EVENTUALI ESAMI DI LABORATORIO RILEVANTI PER ADR : riportare risultati e date in cui gli accertamenti sono stati eseguiti 9. ESITO ◊ RISOLUZIONE COMPLETA ADR IL ____/____/______ ◊ RISOLUZIONE CON POSTUMI ◊ MIGLIORAMENTO ◊ REAZIONE INVARIATA O PEGGIORATA ◊ DECESSO IL ___/___/_____ 10. AZIONI INTRAPRESE: specificare []dovuto alla reazione avversa []il farmaco può avere contribuito []non dovuto al farmaco []causa sconosciuta ◊ NON DISPONIBILE in caso di sospensione compilare i campi da 16 a 19 INFORMAZIONI SUL FARMACO 11. FARMACO SOSPETTO : (nome specialità medicinale) A) _______________________________________ 14. VIA DI SOMMINISTRAZIONE __________________ B) _______________________________________ 14. VIA DI SOMMINISTRAZIONE __________________ C) _______________________________________ 14. VIA DI SOMMINISTRAZIONE __________________ IN CASO DI VACCINI INDICARE ANCHE: SCADENZA, ORA E SITO DI SOMMINISTRAZIONE 12. LOTTO _________________________ SCAD. ___/___/______13. DOSAGGIO/DIE _____________ 15. DURATA DELL'USO: DAL ____/____/_______ AL ____/____/______ ORA ________ SITO__________ 12. LOTTO _________________________ SCAD. ___/___/______13. DOSAGGIO/DIE _____________ 15. DURATA DELL'USO: DAL ____/____/_______ AL ____/____/______ORA ________ SITO___________ 12. LOTTO _________________________ SCAD. ___/___/______13. DOSAGGIO/DIE _____________ 15. DURATA DELL'USO: DAL ____/____/_______ AL ____/____/______ ORA ________ SITO__________ 16. IL FARMACO E' STATO SOSPESO? A): SI [ ] NO [ ] B): SI [ ] NO [ ] C): SI [ ] NO [ ] 17. LA REAZIONE E' MIGLIORATA DOPO LA SOSPENSIONE? A): SI [ ] NO [ ] B): SI [ ] NO [ ] C): SI [ ] NO [ ] 18. Il FARMACO E' STATO RIPRESO? A): SI [ ] NO [ ] B): SI [ ] NO [ ] C): SI [ ] NO [ ] 19. SONO RICOMPARSI I SINTOMI DOPO LA RISOMMINISTRAZIONE? NE? A): SI [ ] NO [ ] B): SI [ ] NO [ ] C): SI [ ] NO [ ] 20.INDICAZIONI O ALTRO MOTIVO PER CUI IL FARMACO E' STATO USATO: 20 bis.LUOGO DI SOMMINISTRAZIONE DEL VACCINO in caso di vaccini specificare anche l'ordine numerico della dose o del richiamo [ ] ASL A: [ ] dose________ [ ] richiamo________ [ ] AOSP B: [ ] dose________ [ ] richiamo________ [ ] AMBULATORIO PRIVATO C: [ ] dose________ [ ] richiamo________ [ ] ALTRO specificare________________________________ 21. FARMACO/I CONCOMITANTE/I, DOSAGGIO, VIA DI SOMMINISTRAZIONE, DURATA DEL TRATTAMENTO 22.USO CONCOMITANTE DI ALTRI PRODOTTI A BASE DI PIANTE OFFICINALI, OMEOPATICI,INTEGRATORI ALIMENTARI, ecc. (specificare): 23:CONDIZIONI CONCOMITANTI PREDISPONENTI (se il farmaco sospetto è un vaccino riportare l'anamnesi ed eventuali vaccini somministrati nelle 4 settimane precedenti alla somministrazione) INFORMAZIONI SULLA SEGNALAZIONE 24. QUALIFICA DEL SEGNALATORE 25. DATI DEL SEGNALATORE [ ] MMG NOME COGNOME [ ] PEDIATRA DI LIBERA SCELTA [ ] MEDICO SERVIZI VACCINALI [ ] MEDICO OSPEDALIERO INDIRIZZO [ ] FARMACISTA [ ] SPECIALISTA TEL. FAX E-MAIL [ ] ALTRO spec.________________________________________ 27. FIRMA DEL SEGNALATORE 26. DATA DI COMPILAZIONE ____/____/_____ 29. FIRMA RESPONSABILE FARMACOVIGILANZA 28.CODICE ASL dove (3) • Al Referente Farmacovigilanza aziendale che - immette i dati riportato nella scheda, nel dataset ministeriale informatizzato - spedisce la scheda cartacea al Servizio Farmacovigilanza regionale per le vaccinazioni la sorveglianza regionale è affidata al Servizio Sanità Pubblica Cosa si sta facendo in Italia • documento condiviso con Regioni, Ministero, ISS • Strategia nazionale • Protocollo aggiornamento operatori • Predisposizione materiale formazione • Predisposizione materiale per informazione cittadini i rischi da evitare • False attese sugli effetti del vaccino • Falsa sicurezza verso altre infezioni sessualmente trasmesse • Minore adesione allo screening un vaccino molto diverso dagli altri • l’obiettivo • il target • estrema complessità di coordinamento delle azioni e dei risultati - molti soggetti coinvolti - sorveglianza duplice (infezione, malattia) tanti attori sulla scena • • • • • • • • • • • Sanità pubblica Servizi per la famiglia Servizi per la salute della donna – centri screening Servizi per i giovani Operatori sanitari di svariati ambiti: clinica, prevenzione, epidemiologia Diversi target: infanzia, adolescenza, adulti Mezzi di comunicazione Associazioni cittadini Associazioni di malati Politici Industria La coerenza da garantire!!!!! Grazie per l’attenzione e l’ascolto Un ringraziamento particolare alle dottoresse Serena Donati (ISS) e Luisella Grandori (RER)
Scarica