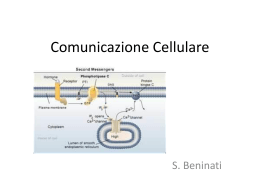
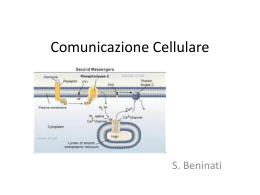
Concetti basilari per lo studio del binding recettoriale I recettori sono presenti in concentrazioni molto piccole nei tessuti. Incubando il tessuto contenente i recettori R ed il ligando radiomarcato D in opportune condizioni sperimentali si formerà il complesso RD secondo l’equazione R+D RD Quando il sistema raggiunge l’equilibrio in ogni provetta avremo: Radioligando Tessuto Tampone di incubazione Incubazione Ligando radiomarcato D Equilibrio Recettore RD Recettore libero R Il recettore libero R non potrà essere misurata ma possiamo misurare la quantità di complesso ligando-recettore RD. Per poter calcolare la quantità del complesso RD è necessaria un’operazione di separazione del legato (Bound) dalla quantità di ligando radiomarcato D libero in soluzione non legato al tessuto (Free). Equilibrio Separazione Metodi di separazione del RD dal mezzo di reazione Filtrazione Il metodo più semplice e classico è quello della filtrazione su membrane in fibra di vetro Whatman GF/A, GF/B, GF/C dove varia la porosità 0.7 mm-2.7 mm Il tessuto contenente il recettore legato al radioligando aderisce al filtro mentre il radioligando libero passa attraverso la membrana. Limiti e precauzioni della filtrazione Le proteine ostruiscono il filtro Il ligando radiomarcato tende a legarsi alle fibre del filtro. Elevata velocità di filtrazione (deve essere completata in 4-5 secondi per evitare che il ligando radiomarcato si stacchi dal recettore. In genere si perde il 5% di RD) Centrifugazione Limiti e precauzioni della centrifugazione Una certa quantità di ligando radiomarcato (Free) potrebbe restare intrappolato nel pellet. Numero limitato degli alloggi nel rotore Dialisi Viene impiegata quando il recettore ha bassa affinità per il ligando radiomarcato (micromolare). Una piccola membrana simile alla cellulosa da dialisi separa due camere L L R R L R L L L L La membrana è scelta in modo tale che il ligando possa passare mentre il recettore viene trattenuto. Il ligando diffonde fino a raggiungere l’equilibrio. Nella camera azzurra [L] sarà Ligando libero Nella camera gialla [L]= ligando libero +ligando legato La differenza fra questi valori è la concentrazione di ligando legato. Quella che viene misurata è la deplezione di ligando libero Cromatografia per esclusione Viene impiegata quando il recettore ha elevata affinità per il ligando radiomarcato (picomolare). Studi di binding Analisi di saturazione • Analisi di Scatchard • Analisi di Hill Analisi cinetica • Cinetica di associazione • Cinetica di dissociazione Analisi di competizione Analisi di saturazione Kon Recettore-Ligando Recettore + Ligando Koff Il binding avviene quando ligando e recettore collidono mediante diffusione e quando la collisione ha un corretto orientamento e sufficiente energia. La velocità di associazione è data dal numero di eventi di binding per unità di tempo Von = [Ligando] × [Recettore] × kon Una volta avvenuto il binding, ligando e recettore restano legati per un certo periodo di tempo. La velocità di dissociazione del complesso è data dal numero di eventi per unità di tempo Voff = [ligando-recettore] × koff Dopo la dissociazione il ligando e il recettore non devono aver subito modifiche. All’equilibrio avremo: Von = Voff [Ligando] × [Recettore] × kon = [Ligando-Recettore] × koff Riarrangiando l’equazione avremo: [Ligando] [Recettore] Koff = = Kon [Ligando-Recettore] Kd Per meglio comprendere il significato della Kd poniamo [Ligando] = Kd L’equazione pertanto diviene: [Recettore] [Ligando-Recettore] da cui si evince che: = 1 [Recettore] = [Ligando- Recettore] Quando [Ligando] = Kd la quantità di recettore libero è esattamente uguale alla quantità di recettore occupato. I recettori totali sono la somma di quelli liberi più quelli legati al ligando, e quando [Ligando] = Kd avremo che metà della popolazione recettoriale sarà occupata all’equilibrio. Se il ligando ha elevata affinità per il recettore, la Kd sarà piccola perché basterà una piccola concentrazione di ligando per legare la metà dei recettori. Non bisogna confondere la Kd (costante di dissociazione all’equilibrio) con Koff (costante di dissociazione). Non sono la stessa cosa ed hanno dimensioni differenti. Kon = costante di associazione (molare-1 min-1) Koff = costante di dissociazione (min-1) Kd = costante di dissociazione all’equilibrio (molare) La legge di azione di massa permette di definire la frazione di recettore occupata all’equilibrio in funzione della concentrazione di ligando. Frazione recettoriale occupata [RL] [Rtot] = [RL] [R] + [RL] Questa equazione non è utile perché non conosciamo la concentrazione di recettore libero. Poiché [R] = [Rtot] - [RL] e sapendo che: [R] [L] Kd = [RL] [R] [L] ([Rtot] - [RL]) [L] [RL] = = Kd Kd [RL] Kd = [Rtot] [L] - [RL] [L] [RL] Kd + [RL] [L] = [Rtot] [L] [RL] (Kd + [L] ) = [Rtot] [L] [RL] = [Rtot] [L] Kd + [L] da cui la frazione recettoriale occupata [RL]/ [Rtot] sarà: [Ligando] [RL] [Rtot] [Ligando] = Ligando + Kd Frazione recettoriale occupata 0 0% 1Kd 50% 4Kd 80% 9Kd 90% 99Kd 99% La legge di azione di massa è un modello semplice che può essere usato per spiegare alcuni dati sperimentali e non è utile in tutte le situazioni. Il modello assume che: Tutti i recettori sono ugualmente accessibili al ligando I recettori sono liberi o legati con il ligando. Non devono esserci differenti stati di affinità recettoriale o di binding parziale Il binding non deve alterare il ligando o il recettore Il binding deve essere reversibile Informazioni provenienti dall’analisi di saturazione KD Indica la concentrazione di radioligando che all’equilibrio occupa il 50% dei recettori presenti nel preparato biologico Bmax Indica la densità recettoriale nel tessuto studiato. Si esprime in moli/mg di proteina. Approccio sperimentale all’analisi di saturazione L’esperimento di saturazione viene effettuato determinando il Binding Totale e il Binding Non-Specifico a differenti concentrazioni di ligando radiomarcato. Binding Totale Viene definito aggiungendo al tessuto concentrazioni crescenti di radioligando Binding Non-Specifico Viene definito in presenza di ligando non marcato ad elevata concentrazione alla quale tutto il radioattivo viene spiazzato dai siti specifici di legame Esempio: Vogliamo determinare il binding specifico all’equilibrio per un determinato radioligando alla concentrazione di 0.5 nM Provetta 1 (Binding totale) Tessuto + Rx (0.5 nM) Lettura radioattività =2500 cpm Provetta 2 (Binding non specifico) Tessuto + Rx (0.5 nM) + Ligando non marcato (10 mM) Lettura radioattività= 500 cpm Alla concentrazione 0.5 nM di RX il complesso RD (Binding Specifico, Bound) sarà : 2500-500= 2000 cpm. Il valore 500 cpm rappresenta la quantità di RX che si è legato a siti non specifici di legame. Infatti l’impiego del ligando non marcato ad levata concentrazione spiazza RX solo da tutti i siti specifici ma non da quelli non specifici. Realizzando differenti concentrazioni di RX e definendo per ciascuna il Binding Totale e il binding Non-Specifico si calcola il Binding Specifico. Bound (pmol/mg protein) 0.15 Binding totale Binding non specifico Binding specifico 0.10 Le tre curve corrispondenti sono riportate in figura 0.05 0.00 0.1 0.2 0.3 0.4 0.5 0.6 [3H]spiroperidolo, (nM) Visualizzando solo la curva del binding specifico possiamo individuare la Kd e la Bmax Bound (pmol/mg protein) 0.100 0.075 Bmax 0.050 0.025 0.000 0.00 Kd 0.25 0.50 0.75 [3H]spiroperidolo, (nM) 1.00 Come trasformare i cpm in concentrazione Esempio:Un campione dal volume totale di un 1 mL fornisce 5000 cpm per un Rx di attività specifica 27 Ci/mmole cpm = efficienza (%) dpm Conoscendo l’efficienza strumentale (es 55%) 5000 cpm corrispondono a 9090 dpm Sapendo che 2.22 x 106 dpm corrispondono a 1 mCi Avremo che 9090 dpm corrispondono a 4.1 x 10-3 mCi Dall’attività specifica del radioligando sappiamo che 27 Ci corrispondono ad 1 mmole. Cioè 27 x 106 mCi ad 1 mmole Avremo che 4.1 x 10-3 mCi corrispondono a 1.52 x10-10 mmoli Il campione in esame ha un volume totale di 1 mL La concentrazione sarà: 1.52x10-10 M (0.152 nM). Analisi di Scatchard Partendo dall’equazione: [Rtot] [L] [RL] = Kd + [L] [RL] ([L] + Kd ) = [L] [Rtot] [RL] [L] + [RL] Kd = [L] [Rtot] dividendo tutto per [L] Kd avremo: [RL] [L] [L] Kd + [Rtot] [L] [RL]Kd [L] Kd = [L] Kd quindi: [RL] [L] [Rtot] = Kd - [RL] Kd Se indichiamo con B la concentrazione di ligando legato [RL]; con Bmax la quantità massima di ligando legato [Rtot]; con F la quantità di ligando libero [L] avremo: B _ B + Bmax = F Kd Kd Riportando in grafico il rapporto tra la quantità di ligando legato e ligando libero (B/F) rispetto alla quantità di ligando legato (B) avremo: 1.00 B/F 0.75 0.50 Bmax 0.25 0.00 0.000 0.025 0.050 0.075 0.100 0.125 0.150 Bound Si ottiene una retta con Slope = - 1 Kd L’intercetta sull’asse delle ascisse (B/F = 0) permette di ricavare Bmax che rappresenta la densità recettoriale. Se è presente un solo tipo di recettore lo Scatchard sarà lineare. Se sono presenti invece due tipi di recettore in uguale concentrazione ma con differenze in Kd per il radioligando avremo: B Binding specifico A 1.00 0.75 B/F 0.50 0.25 0.00 0.000 0.025 [radioligando] 0.050 0.075 0.100 0.125 0.150 Bound Le curve dei singoli recettori sono riportate in rosso e azzurro mentre in nero la curva somma del binding totale. Nel grafico di Scatchard (B) la linea nera del binding totale (inteso come somma del binding specifico delle popolazioni recettoriali esistenti) evidenzia una curvatura e le due linee tratteggiate rappresentano il binding specifico di ciascun recettore. Dall’analisi di Scatchard si può determinare l’omogeneità di una popolazione recettoriale (sempre che vi siano differenze evidenti tra i valori di Kd del radioligando per ciascun recettore). In caso contrario avremo un’informazione apparente (di un’unica popolazione recettoriale). La soluzione del problema è realizzata ovviamente da radioligandi selettivi per ciascun tipo di recettore presente. Analisi di Hill Considerando l’equazione: [Rtot] [L] [RL] = Kd + [L] che può essere scritta: [RL] [L] + [RL] Kd = [Rtot] [L] [RL] Kd = [Rtot] [L] - [RL] [L] [RL] = [L] ([Rtot] - [RL]) Kd da cui: [RL] = [Rtot] - [RL] [L] Kd se il ligando L interagisce con n siti secondo l’equazione nL + R avremo: [RL] RLn = [Rtot] - [RL] B Bmax - B [L]n Kd = [L]n Kd passando ai logaritmi: B log = n log [L] - log Kd Bmax - B dove n è il coefficiente di Hill (nH) Se esiste un solo sito di interazione per recettore (n =1) si ha una retta con pendenza = 1 B log Bmax - B Per calcolare la Kd bisogna porre log B =0 Bmax - B 0 pendenza = nH log [L] Analisi cinetica Binding di associazione L’esperimento cinetico di associazione viene effettuato per determinare la costante di velocità di associazione Kon e lo stato stazionario. La quantità di binding aumenta nel tempo fino ad un valore massimo (Ymax). Questo non corrisponde alla Bmax. Infatti Ymax è la quantità di binding specifico all’equilibrio per una certa quantità di ligando usato nell’esperimento di associazione. Bmax è la quantità massima di binding estrapolata a concentrazioni molto alte di ligando. Ymax 5000 cpm La concentrazione di recettore libero ad ogni tempo di misurazione corrisponde alla Ymax meno il binding specifico misurato allo stesso tempo. 7500 2500 0 0 10 20 30 tempo (ore) La velocità con la quale incrementa il binding è dato da tre fattori (oltre alle condizioni sperimentali come pH, temperatura): La costante di velocità di associazione Kon (min-1 M-1). La concentrazione del radioligando. La costante di velocità di dissociazione Koff (min-1). Effetto della concentrazione di Rx sul raggiungimento dello stato stazionario Binding specifico Binding di dissociazione Binding non specifico tempo Si porta sistema recettore-radioligando all’equilibrio e poi si aggiunge il ligando freddo misurando il binding a diversi intervalli di tempo. Analisi di competizione Il binding di competizione viene effettuato per determinare l’affinità di un ligando per un dato recettore. Viene utilizzata una concentrazione fissa di RX e di proteine recettoriali. Il sistema viene portato all’equilibrio in presenza di concentrazioni differenti di ligando e quindi viene separato il legato (Bound) da tutto il resto. Binding totale Il binding totale viene determinato in presenza del radioligando (in questo caso [3H]-8-OH-DPAT) e del solo tessuto. Binding non specifico Viene determinato in presenza di 8-OH-DPAT ad elevate concentrazioni (10 mM) in modo che esso spiazzi dai siti recettoriali specifici tutto [3H]-8-OH-DPAT. La radioattività residua è data dal legame non specifico del radioligando con proteine non recettoriali. Binding specifico Viene ottenuto per differenza tra il binding totale e quello non specifico Calcolo del valore di IC50 Concentrazione [3H]-8-OH-DPAT 0.81 nM Binding totale Binding non specifico Binding specifico 9200 cpm 920 cpm 8280 cpm Curva di spiazzamento del composto 8-OH-DPAT [ ] 8-OH-DPAT RX spiazzato Binding specifico Spiazzamento cpm percentuale 1 x 10-10 8700 9200-8700 500/8280 6% 1 x 10-9 7500 9200-7500 1700/8280 21 % 1 x 10-8 2500 9200-2500 6700/8280 81 % 1 x 10-7 1800 9200-1800 7400/8280 89 % 1 x10-6 920 9200-920 8280/8280 100 % Alla concentrazione 1x 10-6 viene definito il binding non specifico (920 cpm) che sottratto al binding totale (9200 cpm) fornisce il binding specifico (8280 cpm). A questa concentrazione tutto il radioligando è stato spiazzato dai siti recettoriali specifici (100 %). Curva di spiazzamento del composto 1 [ ] Composto 1 RX spiazzato Binding specifico Spiazzamento cpm percentuale 1 x 10-10 9000 9200-9000 200/8280 2% 1 x 10-9 8100 9200-8100 1100/8280 13 % 1 x 10-8 6500 9200-6500 2700/8280 33 % 1 x 10-7 2800 9200-2800 6400/8280 77 % 1 x10-6 1720 9200-1720 7480/8280 90 % Le curve di spiazzamento da cui ricavare il valore di IC50, si ottengono riportando in grafico le percentuali di spiazzamento in funzione del log della dose % spiazzamento 8-OH-DPAT Composto 1 IC50 = 3.02 nM IC50 = 20.6 nM 0 50 100 10 -11 10 -10 10 -9 10 -8 10 -7 10 -6 10 -5 Log dose Il valore di IC50 indica la concentrazione di ligando in grado di spiazzare il 50 % di radioligando dai siti recettoriali all’equilibrio E’ preferibile esprimere il valore di affinità come Ki in quanto si eliminano le variabili - concentrazione del radioligando utilizzato nel saggio di binding - natura del radioligando impiegato Equazione di Cheng-Prusoff IC50 Ki = [RX] 1+ Kd
Scaricare