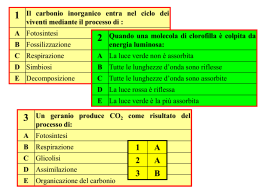
CO2 LA CO2 È UN GAS, CHIAMATO ANIDRIDE CARBONICA. L’ANIDRIDE CARBONICA, DETTA ANCHE DIOSSIDO DI CARBONIO, A PRESSIONE ATMOSFERICA E A TEMPERATURA AMBIENTE È UN GAS INCOLORE, DI ODORE PUNGENTE E SAPORE DEBOLMENTE ACIDULO, È PIÙ PESANTE DELL’ARIA (CIRCA 1,5 VOLTE) E TENDE A STRATIFICARSI AL SUOLO LA MOLECOLA DI CO2 È TRIATOMICA. Come dice la formula è fatta da Carbonio e Ossigeno. Il Carbonio ha configurazione elettronica 1𝑠 2 2𝑠 2 2𝑝2 Mentre L’Ossigeno ha configurazione 1𝑠 2 2𝑠 2 2𝑝4 . Questo significa che il Carbonio ha 4 elettroni spaiati e quindi può formare 4 legami mentre l’ossigeno ha 2 elettroni spaiati e ne può formare quattro. I due Atomi si legano formando legami covalenti polari perché la differenza di elettronegatività è uguale a 1. Il Carbonio forma 2 doppi legami con ciascun Ossigeno. LE CARATTERISTICHE DELLA CO2 L’ANIDRIDE CARBONICA HA UN VASTO CAMPO DI APPLICAZIONI GRAZIE ALLE SUE PROPRIETA’: L'ANIDRIDE CARBONICA È PRINCIPALMENTE REPERIBILE IN FORMA GASSOSA, PUÒ ESSERE SOLIDA SOLO QUANDO SI TROVA A TEMPERATURA INFERIORE A -78 GRADI C. L'ANIDRIDE CARBONICA LIQUIDA ESISTE PRINCIPALMENTE QUANDO L'ANIDRIDE CARBONICA È DISSOLTA IN ACQUA. L'ANIDRIDE CARBONICA È SOLUBILE IN ACQUA SOLO QUANDO LA PRESSIONE È MANTENUTA. A SEGUITO DI PERDITE DI PRESSIONE TENDE A FUORIUSCIRE NELL'ARIA, LASCIANDO UNA MASSA DI BOLLE D'ARIA NELL'ACQUA. GEOMETRIA DELLA MOLECOLA LA FORMA DI MOLTE MOLECOLE PUÒ ESSERE SPIEGATA DA UNA TEORIA INDICATA CON LA SIGLA VSEPR TALE TEORIA SI BASA SUL PRINCIPIO CHE GLI ELETTRONI CHE FANNO PARTE DELL’ULTIMO STRATO - SIA LE COPPIE DI ELETTRONI DEI LEGAMI COVALENTI, SIA EVENTUALMENTE QUELLE DI ELETTRONI NON CONDIVISI - TENDONO A RESPINGERSI E SI POSIZIONANO ALLA MASSIMA DISTANZA POSSIBILE FRA LORO, FORMANDO ANGOLI DI LEGAME I PIÙ AMPI POSSIBILE. NELL’ANIDRIDE CARBONICA (𝐶𝑂2 ) C'È UN ANGOLO DI 180° TRA I DUE ATOMI DI OSSIGENO LEGATI AL CARBONIO . ANCHE IN QUESTO CASO LA TEORIA VSEPR SPIEGA LA GEOMETRIA DELLA MOLECOLA CHE È INFATTI LINEARE. Il carbonio forma due doppi legami covalenti con due atomi di ossigeno e gli elettroni di questi legami staranno alla massima distanza possibile fra loro, formando appunto un angolo di legame di 180°. Questa molecola quindi pur avendo legami Covalenti polari a causa della sua geometria lineare risulterà apolare in quanto i due dipoli si annullano. LA RESPIRAZIONE La 𝐶𝑂2 viene emessa dalla respirazione e dalla combustione. La combustione è un processo fortemente esotermico tra una sostanza combustibile e una sostanza comburente, di solito l’ossigeno dell’aria. COMBUSTIBILE I COMBUSTIBILI SONO SOSTANZE CAPACI DI BRUCIARE, CIOÈ IN GRADO DI DAR LUOGO A UNA REAZIONE CHIMICA CON L’OSSIGENO. Possono essere: Solidi: ad esempio legno, carbone, tessuto, gomma, plastica etc. Liquidi: ad esempio petrolio, olio combustibile, benzina, alcool etc. Gassosi: ad esempio metano, propano, GPL, acetilene, idrogeno etc. COMBURENTE Un comburente è una sostanza che agisce come agente ossidante di un combustibile in una reazione di combustione. Senza di esso, la combustione non ha luogo. Comburente e combustibile devono trovarsi allo stato gassoso perché la combustione abbia luogo. L'innesco è la condizione energetica necessaria perché la reazione di combustione abbia luogo. combustibile + comburente → energia + prodotti MONOSSIDO DI CARBONIO UN PRODOTTO PERICOLOSISSIMO DELLA COMBUSTIONE CHE È PRESENTE NELLA NOSTRA CASA È IL MONOSSIDO DI CARBONIO (CO). QUESTO GAS, SE NON È REGOLARMENTE DISPERSO O ESPULSO DAGLI APPOSITI SISTEMI DI ESTRAZIONE (CAPPE E CAMINI), INVADE GLI AMBIENTI DELLA NOSTRA CASA SENZA CHE CE NE ACCORGIAMO PROVOCANDOCI DANNI LETALI. L’INTOSSICAZIONE DA MONOSSIDO DI CARBONIO L'INTOSSICAZIONE DA MONOSSIDO DI CARBONIO (CO) È LA FORMA PIÙ COMUNE DI AVVELENAMENTO E TRA LE PRIME CAUSE DI MORTE NEI PAESI INDUSTRIALIZZATI. SI VERIFICA TIPICAMENTE IN AMBIENTE DOMESTICO PER IL MALFUNZIONAMENTO DEI SISTEMI DI RISCALDAMENTO. IN CASO DI INTOSSICAZIONE DI MONOSSIDO DI CARBONIO OCCORRE: • APRIRE LE FINESTRE PER UN RICAMBIO DELL’ARIA • USCIRE ALL’APERTO CALCOLO DELL’ANIDRIDE CARBONICA DELLA NOSTRA AULA CALCOLO IL VOLUME DI 𝐶𝑂2 PRODOTTA DA 15 ALLIEVI CHE RIMANGONO NELLA NOSTRA AULA PER 6 ORE A PORTE CHIUSE, SAPENDO CHE IL IN 1H L’ESSERE UMANO EMETTE 20L DI 𝐶𝑂2 CALCOLIAMO: VAULA= 6M • 4M • 2,75M = 66 𝑚3 VOLUME 𝐶𝑂2 PRODOTTO= 6H • 0,020𝑚3 /H • 15P =1,8 𝑚3 PERCENTUALE DEL VOLUME DI 𝐶𝑂2 RISPETTO AL VOLUME DELL’AULA: 1,8 𝑚3 /60 • 100 =3% FOTOSINTESI CLOROFILLIANA LE PIANTE PRODUCONO IL LORO NUTRIMENTO CATTURANDO L'ENERGIA EMANATA DAL SOLE MEDIANTE LE PROPRIE FOGLIE. IL MECCANISMO DI ASSORBIMENTO SI REALIZZA POICHÉ, SULLE FOGLIE, ESISTE UNA SOSTANZA CAPACE DI ASSORBIRE LE RADIAZIONI SOLARI UN PIGMENTO VERDE CHE PRENDE IL NOME DI CLOROFILLA.
Scarica