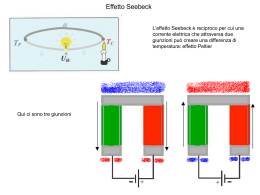
Lezione 13 - I solidi e le loro celle elementari La cella elementare ! L’unità ripetitiva strutturale di tutti i solidi cristallini Lo stato solido •Cristallino •Amorfo (vetroso) SOLIDI CRISTALLINI •Metallici •Ionici •Covalenti •Molecolari r = a0 / 2 r V(sfera) = 4/3π·r3 V(atomo) = 4/3π·(a0/2)3 a0 V(cella) = a03 Cella elementare cubica a corpo centrato r = 3 a0 / 4 V(atomo) = 4/3π·( 3 a0/4)3 Reticolo cubico a corpo centrato I reticoli COMPATTI 74% di spazio occupato Record max per un tipo di atomo supposto sferico Cella elementare cubica a facce centrate (CFC) r = 2 a0 / 4 V(atomo) = 4/3π·( 2a0/4)3 % S.Occ. = 4*4/3π·( 2a0/4)3 a0 3 = 1,414·π 6 = 0,74 =74% Il reticolo CFC è in realtà cubico COMPATTO (74% s.o.) Formazione del legame ionico Consideriamo allora il legame ionico dal punto di vista energetico, analizzando ancora una volta la reazione di sintesi del Cloruro di Sodio. 1 cal = 4,1867999409 Joule 2Na(s) + Cl2(g) → 2 NaCl(s) + 196,6 kcal Trasformandosi in ioni entrambi gli atomi hanno raggiunto una configurazione più stabile ed hanno diminuito il loro contenuto energetico. Tuttavia se confrontiamo semplicemente le variazioni di energia associate alla formazione degli ioni, il processo non sembra energeticamente favorito. Na(g) + 118,5 kcal/mol → Na+(g) + eCl(g) + e- → Cl-(g) + 83,4 kcal/mol Na(g) + Cl(g) + 35,1 kcal → Na+(g) + Cl-(g) Energia reticolare Quando idealmente gli ioni di carica opposta si avvicinano, l’energia reticolare diminuisce fino ad arrivare ad un valore minimo per una distanza tra gli ioni pari alla somma dei loro raggi ionici. Nel caso del Cloruro di Sodio, ad esempio, l’energia reticolare è pari a 188 kcal/mol in corrispondenza ad una distanza interionica di 276 pm (picometri) = 181 pm (raggio ionico Cl-) + 95 pm (raggio ionico Na+).
Scaricare