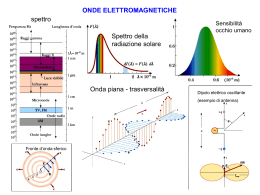
Che cos’è la costante di Planck? La costante di Planck fu introdotta nel 1900 dal fisico omonimo, e può essere definita coma la costante di proporzionalità che lega l’energia di una radiazione e la sua frequenza secondo la legge E = hn Ne consegue che ad ogni frequenza è associata una ben determinata energia. Fisica classica o meccanica quantistica? h = 6.626x10-34joule s (cost. di Planck) J = momento angolare = [ joule s ] J >> h J h fenomeno classico fenomeno quantistico The light blue glow given off by mercury street lamps has a wavelength of λ = 436nm. What is its frequency? La frequenza, n , è il numero di oscillazioni che un'onda compie nell'unità di tempo ed è quindi uguale la velocità divisa per la lunghezza d’onda: 𝜈 = 𝑉𝑒𝑙𝑜𝑐𝑖𝑡à 𝜆 l'unità di misura è chiamata hertz (Hz), dal fisico tedesco Heinrich Rudolf Hertz, dove 1 Hz caratterizza una oscillazione che occorre una volta in un secondo. Nel caso di una radiazione elettromagnetica la velocità sarà c = 3 x 108 m/sec The light blue glow given off by mercury street lamps has a wavelength of λ = 436nm. What is its frequency? The unit s-1 is so common when talking about waves that it was given the name Hertz. That is, 1 s-1 = 1 Hz. Thus, we would say that light with a wavelength of 436 nm corresponds to a frequency of 6.88 × 1014 Hertz. Il numero d'onda, , è il numero di oscillazioni che un'onda compie nell'unità di spazio ed è quindi l'inverso della lunghezza d'onda: La sua unità di misura nel Sistema Internazionale è il metro alla meno uno, m-1, viene però più spesso impiegato il suo multiplo cm-1. Quindi, nel caso di una radiazione elettromagnetica, per passare da numero d’onda a frequenza basta moltiplicare il numero d’onda per c n= c Una delle prime osservazioni interessanti avvenne nel 1884 quando Johann Balmer, insegnante svizzero, osservò che alcune righe dello spettro di emissione dell'idrogeno potevano essere calcolate utilizzando la formula: Balmer suppose che tale formula fosse, in realtà, un caso particolare di una legge più generale, che venne trovata da Johannes Rydberg e Walter Ritz e nota come legge di RydbergRitz: con n1>n2 ed R la costante di Rydberg. •As n increases (holding Z constant), then the energy increases (becomes less negative). In the limit that n goes to infinity then the energy goes to zero. •As Z increases (holding n constant), then the energy decreases (becomes more negative). This makes sense, since a higher Z means a more positively charged nucleus, which holds the electron tighter. For the hydrogen atom Z=1 so En= - RH/n2 Ef= -R 1 𝑛𝑓 2 Ei= -R Ef-Ei= -R 1 𝑛𝑓 2 - (-R ΔE= -R ( 1 𝑛𝑓 2 1 𝑛𝑖 2 ΔE= -hc RH ( - 1 𝑛𝑓 2 - 1 𝑛𝑖 2 1 𝑛𝑖 2 ) 1 𝑛𝑖 2 ) E= h n E=h c n ν = RH ( 1 𝑛𝑓 2 - 1 𝑛𝑖 2 ) ) Formula di Rydberg Calcolare la lunghezza d’onda in nanometri della transizione n= 4 → 2 nell’atomo di idrogeno. RH = 109677 cm–1 (costante di Rydberg) RH = 109677.76 cm–1 (costante di Rydberg). ni → nf Wavelength 3 → 2 λ=657 (red) 4 → 2 λ=487 (green) 5 → 2 λ=435 (blue) ∞ → 2 λ=365 (purple) photoelectric effect 2 parametri per radiazione incidente: 1) INTENSITÀ LUMINOSA (proporzionale all’ampiezza dell’onda) 2) FREQUENZA della radiazione 2 parametri per gli elettroni emessi: 1) NUMERO di elettroni emessi 2) ENERGIA CINETICA di ogni elettrone emesso (1/2 mv2) o velocità di emissione. 1) Aumentando l’intensità luminosa aumenta il numero elettroni emessi, ma solo se la radiazione ha n> n0 (frequenza critica). 2) Aumentando l’intensità luminosa non aumenta l’energia cinetica degli elettroni emessi 3) Aumentando la frequenza della radiazione (con valori superiori a n0) aumenta l’energia cinetica degli elettroni emessi Ephoton = h n h = 6.63 × 10-34 J · s ← Planck's Constant Natura corpuscolare e ondulatoria dell’elettrone secondo De Broglie Un’onda stazionaria è un’onda che non si propaga, ma rimane sempre nella stessa zona di spazio. Orbita dell’elettrone come onda stazionaria circolare l= 2π𝑟 𝑛 2pr=nl 2pr = ℎ n 𝑚𝑣 mvr = n ℎ 2p
Scaricare