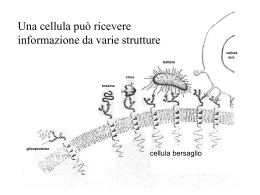
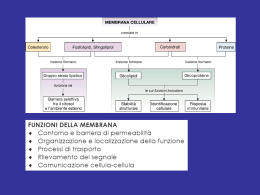
Membrana Plasmatica Rafts di membrana Falchetto, Dottorato 2013 Struttura degli Sfingolipidi La sfingomielina è un fosfolipide I gangliosidi sono glicolipidi STRUTTURA GENERALE DEGLI SFINGOLIPIDI Struttura chimica generale degli sfingolipidi. Diversi sostituenti (R) danno: H: ceramide Fosfocolina: sfingomielina Zuchero/i: glicosfingolipidi CERAMIDI I ceramidi sono una famiglia di molecole lipidiche. Un ceramide è composto da sfingosina e di un acido grasso Si trovano in elevata concentrazione nella membrana plasmatica come uno dei componenti della sfingomielina, che è uno dei principali lipidi del doppio strato lipidico. Per anni si è presunto che i ceramidi e altri sfingolipidi fossero soltanto elementi strutturali ma oggi si sa che sono molto di più. Forse uno degli aspetti più affascinanti del ceramide è che esso può agire da molecola di segnalamento. Le funzioni più note dei ceramidi come segnalatori cellulari includono la regolazione del differenziamento, proliferazione e morte cellulare programmata (apoptosi). Sono anche coinvolti nella formazione di exosomi. Strutture di due tipi di fosfolipidi e di un glicolipide Sfingolipidi Senza residuo di zucchero, fosfolipide I principali glicolipidi sono: -cerebrosidi:(singolo zucchero) -globosidis (oligosaccaridi -sulfatidi (singolo zucchero acido) -gangliosidi (diversi zuccheri acidi) GLICOSFINGOLIPIDI Nella classe dei glicolipidi la testa polare é legata alla sfingosina mediante legame glicosidico di una molecola di zucchero, invece che mediante un legame fosfoesterico, come nel caso dei fosfolipidi. (A) Il galattocerebroside è chiamato un glicolipide neutro perchè lo zucchero che forma la sua testa non è carico. (B) Un ganglioside contiene sempre uno o più residui di acido sialico (noti anche come acido Nacetilneuraminico,NANA) carichi la cui strutturà è illustrata in (C). Gal = galattosio; Glc = glucosio, GalNAc = Nacetilgalattosamina (questi 3 zuccheri non sono carichi) Principali classi di glicosfingolipidi (1) CEREBROSIDI: hanno un unico zucchero (di solito il galattosio) legato al ceramide. I cerebrosidi aumentano nella malattia di Krabbe a causa della mancanza dell’enzima lisosomiale galattosidasi. SULFATIDI: sono esteri solforici dei galattocerebrosidi. Costituiscono fino al 15% della ‘materia bianca’ del cervello. I solfatidi si accumulano nel cervello nel corso della leucodistrofia metacromatica a causa di mancanza dell’enzima degradativo solfatasi. Principali classi di glicosfingolipidi (2) GLOBOSIDI: sono ceramide oligosaccaridi neutri, in cui gli zuccheri sono di solito galattosio, glucosio o N-acetilgalattosamina. Un globoside importante é il ceramide triesosido che si accumula nel rene di pazienti con la malattia di Fabry a causa di mancanza dell’enzima lisosomiale galattosidasi A. GANGLIOSIDI: sono glicosfingolipidi acidi e contengono acido Nacetilneuramico (NANA; noto anche come acido sialico). Sono concentrati nelle estremità nervose e costituiscono fino a 5-10% della massa lipidica totale delle cellule nervose. I gangliosidi più comuni sono GM1, GD1a, GD1b, GT1b. Il GM1 è un componente delle cellule della mucosa intestinale e si può legare alla subunità ß della tossina del colera, provocando un aumento dell cAMP, del trasporto degli ioni cloro, e una grave diarrea. Il GM2 aumenta nella malattia di Tay Sachs a causa di una carenza della ß-hexosaminidase A. RUOLI DEGLI SFINGOLIPIDI RUOLO PROTTETIVO, come ad es. nella superficie apicale delle cellule epiteliali per proteggerle dal basso pH o dalla digestione enzimatica. RUOLO NELLA TRASMISSIONE ELETTRICA in particolare i gangliosidi carichi dopo un campo elettrico nelle cellule nervose. RUOLO COME ISOLATORI ELETTRICI RUOLO NEL RICONOSCIMENTO CELLULA-CELLULA. Ad esempio i recettori per i glicosfingolipidi sui neutrofili si legano alla P-selettina sulle cellule endoteliali: Sintesi della sfingomielina e dei glicolipidi Il ceramide, che è sintetizzato nel ER, viene convertito sia in sfingomielina (un fosfolipide) o in glicolipidi nell’apparato di Golgi. Nella prima reazione, un gruppo fosforilcolina viene trasferito dalla fosfatidilserina al ceramide. In alternativa, diversi glicolipidi differenti possono essere sintetizzati mediante aggiunta di uno o più residui di zuccheri (ad es. glucosio). RAFTS LIPIDICI Esempi di proteine ancorate alla membrana plasmatica mediante lipidi e glicolipidi. Alcune proteine (ad es., la proteina dei linfociti Thy-1) sono ancorate al foglietto esterno della membrana plasmatica mediante ancore a glicosil fosfatidil inositolo (GPI) che vengono legate covalentemente al loro Cterminale nel reticolo endoplasmatico. Queste proteine sono glicosilate ed esposte sulla superficie cellulare. Altre proteine sono ancorate al foglietto interno della membrana plasmatica in seguito alla loro traduzione su ribosomi liberi nel citosol. La proteina Ras illustrata è ancorate mediante un gruppo prenilico legato covalentemente alla catena laterale di una cisteina del C-terminale e da un gruppo palmitoilo legato ad una cisteina localizzata 5 aminoacidi più a monte. La protein Src è ancorata mediante un gruppo miristoil legato al suo N-terminale. Anche una regione carica positivamente della Src gioca un ruolo nell’associazione alla membrana, forse mediante l’interazione con le teste cariche negativamente della fosfatidilserina. Modello ipotetico dell’organizzazione lipidica nei microdomini “raft”. Gli sfingolipidi (figure in rosso con due gambe) e il colesterolo intercalato (figure più piccole arancione) formano un microdominio altamente impacchettato in un ambiente ricco di fosfatidilcolina (PC; figure blu, due gambe). Le regioni ricche di PC sono impacchettate meno strettamente e più fluide dei domini ricchi in sfingolipidi e colesterolo. Thomas Harder and Kai Simons: Caveolae, DIGS, and the dynamics of sphingolipid-cholesterol microdomains. Current Opinion in Cell Biology 1997, 9:534-542 Kai Simons I rafts lipidici sono microdomini ricchi in sfingolipidi e colesterolo che si trovano nel foglietto esterno della membrana plasmatica. Pierce SK. Lipid rafts and B-cell activation. Nat Rev Immunol. 2002 Feb;2(2):96-105. Un “raft” (zattera) lipidico. I “rafts” lipidici sono piccole zone specializzate delle membrane dove alcuni lipidi (soprattutto sfingolipidi e colesterolo) e proteine (verde scuro) si concentrano. Dato che il bilayer lipidico è un può più spesso nei “rafts”, alcune proteine di membrana vi si accumulano. http://www.ncbi.nlm.nih.gov/books/NBK26871/figure/A1881/ “LIPID RAFTS” (zattere lipidiche) Un sempre maggiore numero di prove sperimentali suggerisce che la membrana plasmatica contenga “rafts lipidici” arricchiti in sfingolipidi, colesterolo ed alcune proteine di membrana Rafts lipidici (2) La maggior parte delle molecole lipidiche nelle membrane cellulari sono disposte in modo casuale nel monostrato lipidico in cui risiedono. Le forze di van der Waals di attrazione fra le code di acidi grassi vicini non sono sufficientemente selettive da tenere insieme gruppi di molecole di questo tipo. Tuttavia, per alcune molecole lipidiche, come gli sfingolipidi, che tendono ad avere catene di acidi grassi lunghe e sature, le forze di attrazione possono essere sufficientemente forti da trattenere transitoriamente molecole adiacenti vicine formando piccoli microdomini. Tali microdomini - “rafts” lipidici - possono essere considerati come fasi di separazione transitorie nel doppio strato lipidico in cui si concentrano gli sfingolipidi. Rafts lipidici (3) Si pensa che la membrana plasmatica delle cellule animali contenga molti di questi “rafts” lipidici (~70 nm di diametro), che sono ricchi sia di sfingolipidi che di colesterolo. Dato che le catene di idrocarburi dei lipidi ivi concentrati sono più lunghe e più dritte delle catene di acidi grassi della maggior parte dei lipidi di membrana, i “rafts” sono più spessi delle altre zone del “bilayer” e sono meglio in grado di accomodare alcune proteine di membrana, che tendono quindi ad accumularsi in quelle regioni. In questo modo, si pensa che i “rafts” lipidici organizzino tali proteine – sia concentrandole per il trasporto in piccole vescicole, sia permettendo alle proteine di funzionare in modo integrato - come fanno quando convertono segnali extracellulari in segnali intracellulari. Rafts lipidici (4) Per la maggior parte, le molecole lipidiche in un monostrato si muovono in torno indipendentemente da quelle dell’altro monostrato. Tuttavia, nei “rafts” lipidici, le lunghe catene idrocarburiche degli sfingolipidi di un monostrato interagiscono con quelle dell’altro monostrato. Perciò, i due monostrati di un “raft” lipidico interagiscono mediante le loro code lipidiche. Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31-9. Review. Erratum in: Nat Rev Mol Cell Biol 2001 Mar;2(3):216. Rafts lipidici (5) I rafts lipidici pottrebbero mediare lo smistamento (“sorting”) di glicosfingolipidi e proteine ancorate mediante GPI alla membrana plasmatica apicale (Alberts et al.: Molecular Biology of the Cell. Garland Pub; 4th edition (March 2002), pp. 589-590 pp. 763-764) La membrana plasmatica apicale di molte cellule è enormemente arricchita di glicosfingolipidi che aiutano a proteggere questa superficie esposta dal danno ad esempio provocato dagli enzimi digestivi e pH acido in siti come lo stomaco o il lume dell’intestino. Anche proteine della membrana plasmatica che sono legate al bilayer lipidico da un ancora di glicosilfosfatidilinositolo (GPI), si trovano esclusivamente nella membrana plasmatica apicale. Se sui usano tecniche di DNA ricombinante per legare un’àncora di GPI ad una proteina che normalmente sarebbe consegnata alla superficie basolaterale, la proteine viene invece consegnata alla membrana apicale. Rafts lipidici (6) Si ritiene che le proteine con àncora di GPI vengano dirette alla membrana apicale perché sono associate ai glicosfingolipidi nei “rafts” lipidici che si formano nella membrana della rete trans del Golgi. Anche le proteine di membrana con domini trans-membrana insolitamente lunghi si accumulano nei “rafts”. Inoltre, i “rafts” preferenzialmente contengono proteine GPI-ancorate e alcune proteine che legano carboidrati (lectine) che possono aiutare a stabilizzare le membrane. Una volta che hanno selezionato il loro carico caratteristico di molecole, i rafts gemmano dalla rete trans del Golgi in vescicole di trasporto destinate alla membrana plasmatica apicale. Una cellula polarizzata Modello di “rafts” lipidici nella rete trans del Golgi. Si pensa che gli glicosfingolipidi e il colesterolo formino “rafts” nel “bilayer lipidico”. Proteine di membrana con segmenti trans-membrana sufficientemente lunghi si distribuiscono preferenzialmente nei “rafts” lipidi e quindi vengono smistate in vescicole di trasporto. Questi “rafts” vengono in seguito inglobati in vescicole di trasporto che li trasportano al dominio apicale della membrana plasmatica. Proteine che legano i carboidrati (lectine) nel lume della rete trans- del Golgi possono aiutare a stabilizzare i “rafts”, come illustrato. Trasporto dall’ apparato di Golgi. Le proteine sono smistate nella rete trans Golgi e trasportate in vescicole alle loro destinazioni finali. In assenza di segnali di indirizzamento specifici, le proteine sono trasportate alla membrana plasmatica mediante secrezione costitutiva. In alternativa, le proteine possono essere spostate dalla via di secrezione costitutiva e marcate per essere indirizzate ad altre destinazioni, come ai lisosomi oppure alla secrezione regolata dalle cellule. Trasporto alla membrana plasmatica della cellule polarizzate. Le membrane plasmatiche delle cellule epiteliali polarizzate sono divise in domini apicali e basolaterali. In questo esempio (epitelio intestinale), la superficie apicale della cellula si affaccia sul lume dell’intestino, le superficie laterali sono in contatto con le cellule vicine, e la superficie basale poggia su uno strato di matrice extracellulare (la lamina basale). La membrana apicale è caratterizzate dalla presenza di microvilli, che facilitano l’assorbimento dei nutrienti aumentando l’area superficiale di scambio. Proteine specifiche vengono indirizzate sia alle membrane apicale che basolaterali nella rete trans Golgi. Le giunzioni occludenti (“Tight junctions”) fra cellule vicine mantengono l’identità delle membrane apicale e basolaterali impedendo la diffusione di proteine fra questi domini. Rafts GLICOLIPIDI E TRASDUZIONE DEL SEGNALE Processi di trasduzione di segnale che coinvolgono i rafts Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31-9. Taïeb N, Yahi N, Fantini J. Rafts and related glycosphingolipid-enriched microdomains in the intestinal epithelium: bacterial targets linked to nutrient absorption. Adv Drug Deliv Rev. 2004 Apr 19;56(6):779-94. Rafts lipidici e trasduzione dei segnali (a) La specificità e fedeltà della trasduzione dei segnali sono essenziali per che le cellule rispondano efficacemente a modificazioni nel loro microambiente. Ciò si ottiene in parte mediante localizzazione differenziale delle proteine che partecipano alle vie di segnalazione. Nella membrana plasmatica, una delle possibili modalità di compartimentazione utilizza i rafts lipidici. http://en.wikipedia.org/wiki/Lipid_raft Rafts lipidici e trasduzione dei segnali (b) I piccolo rafts lipidici possono formare piattaforme di concentrazione dopo l’attivazione dei singoli recettori mediante legame con i ligandi. Se l’attivazione dei recettori si svolge in un raft lipidico il complesso di segnalamento è protetto da enzimi non presenti nei rafts come le fosfatasi di membrana. Complessivamente, il legame nei rafts recluta proteine ad un nuovo microambiente in modo che lo stato fosforilativo possa essere modificato da chinasi e fosfatasi locali per originare un segnalamento a valle. Rafts lipidici e trasduzione dei segnali (c) Segnalamento associato a rafts lipidici: da immunoglobuline E da B cell antigen receptor da “T cell antigen receptor” da EGF receptor da insulin receptor ecc. GLICOLIPIDI E TRASDUZIONE DI SEGNALE Kohji Kasahara (Tokyo Metropolitan Institute of Medical Science) Hakomori et al. hanno dimostrato che i glicosfingolipidi (GSLs) sono modulatori della trasduzione di segnale. L’aggregazione dinamica di GSLs e colesterolo sembra dare origine a microdomini nell’ambito del bilayer lipidico e l’associazione di una gran varietà di molecole di segnalamento con questo dominio. I GSLs sono relativamente ricchi di acidi grassi con catene aciliche sature, che permettono uno stretto impachettamento e conferiscono temperature di fusione alte. Viceversa, i fosfolipidi derivati dal glicerolo sono relativamente ricchi di acidi grassi con catene aciliche cis-insature (stutture a gomito), che impediscono l’impachetamento stretto, e conferiscono temeprature di fusione basse. Proteine ancorate tramite GPI, proteine acilate (con coda di acido grasso) come la famiglia src delle tirosina chinasi e le proteine trimerica G, sono asssociate ai microdomini di GSLs. Le proteine ancorate a GPI hanno di solito catene aciliche sature che probabilmente si inseriscono preferenzialmente nei microdomini GSLs. La famiglia Src delle proteina chinasi vengono modificate da lipidi a catena satura (palmitoilazione e miristilazione) che probabilmente si inseriscono preferenzialmente nei microdomini ricchi in GSLs. Il cross-linking mediato da anticorpi (o ligandi) delle proteine GPIancorate induce l’attivazione della famiglia delle src-chinasi e un transiente aumento della fosforilazione a livello della tirosina di diversi substrati (Fig. 2a). Anche il cross-linking degli GSLs mediato da anticorpi induce l’attivazione della famiglia src delle proteina chinasi e un transitorio aumento di fosforilazione della tirosina (Fig.2b). Ciò dimostra che il cross-linking dei GSLs mediato da anticorpi può simulare il segnalamento mediato da proteine GPI-ancorate. Anticorpi contro le proteine GPI-ancorate fanno immunoprecipitare la famiglia delle src-chinasi, e anticorpi contro i GSL co-immunoprecipitano le srcchinasi e le proteine GPI-ancorate. Inoltre, la rimozione enzimatica della frazione di carboidrati dei GSLs della superficie cellulare ostacola l’attivazione della famiglia delle src-chinasi mediante anticorpo-mediato cross-linking delle proteine GPI-ancorate. Queste osservazioni suggeriscono che i GSLs sono coinvolti nel signalamento mediato da proteine GPI-ancorate. Nonostante non ci sia ancora accordo sul fatto che le proteine GPIancorate si associno stazionariamente ai microdomini GSLs, si pensa che il cross-linking mediato da anticorpi delle proteine GPI-ancorate induca la traslocazione verso i microdomini GSL o stabilizzino la loro associazione con i microdomini GSL. I microdomini GSL (“rafts”) sono coinvolti nel segnalamento mediato da immunorecettori e recettori dei fattori di crescita. Un’attivazione efficiente delle cellule T richiede un segnale da un “T-cell antigen receptor” e un secondo segnale da una molecola co-stimolatoria. La co-stimolazione porta al reclutamento di microdomini GSL verso il sito di contatto cellula-cellula fra la cellula T e la cellula che presenta l’antigene. La concentrazione di chinasi della famiglia src e di molecole “downstream”, e l’esclusione della tirosina fosfatasi CD45, permette una forte e prolungata fosforilazione di diversi substrati. Inoltre, i recettore per l’”Epidermal Growth Factor, EGF” e Ras sono presenti nei microdomini GSL e il trattamento con EGF induce la traslocazione di Raf-1 e MAPKK chinasi dal citosol ai microdomini GSL. Ciò suggerisce che i microdomini GSL possono essere siti di inizio per la cascata delle MAP chinasi. Attivazione delle ERK MAP kinasi. La stimolazione dei recettori dei fattori di crescita porta all’attivazione della piccola proteina che lega il GTP, Ras, che interagisce con la proteina chinasi Raf. A sua volta Raf fosforila e attiva MEK, una proteina chinasi a dopplice specificità che attiva ERK mediante fosforilazione di residui sia di treonina che di tirosina (Thr-183 and Tyr185). La ERK quindi fosforila una gran varietà di proteine bersaglio nucleari e citoplasmatiche. ACILAZIONE DELLE PROTEINE G Nelle cellule di Mammifero la palmitoilazione, la miristilazione e la prenilazione mediano l’associazione delle subunità della proteina G alla membrana. La mancanza di queste modificazioni porta alla solubilizzazione delle proteine (Wedegaertner at al., 1995). http://lipidlibrary.aocs.org/lipids/protlip/index.htm Covini, Dott 2013 In particolare… La palmitoilazione ha un ruolo nell’indirizzare le proteine G-alfa alla membrana, ed in particolare, a specifici sub-domini (rafts). (Huang et al.,1997) Infatti la mancanza di palmitato causa una errata localizzazione delle proteine G-alfa nelle membrane intracellulari. (Huang at al., 1999; Morales et al.,1999) Covini, Dott 2013 Proteine «scaffold» (impalcatura) (1) Sono proteine che avvicinano diverse altre proteine in una via di segnalamento e permettono la loro interazione. Reclutano effettori a valle in una via ed aumentano la specificità del segnale. http://www.ncbi.nlm.nih.gov/books/NBK26813/figure/A2 769/?report=objectonly Proteine «scaffold» (impalcatura) (3) Funzioni delle proteine scaffold nel segnalamento cellulare. (A) In assenza di una proteina scaffold, la diffusione libera permette alle chinasi e ai loro substrati di interagire, portando ad una attivazione casuale e non-specifica dei substrati e scarsa efficienza di segnalazione. (B): Il legame di una chinasi e dei substrati ad una proteina scaffold (verde) facilita l’attivazione dei substrati e permette l’incanallamento del segnale verso una cascata specifica. (C) La proteina scaffold potrebbe orientare o attivare allostericamente le sue chinasi associate, aumentando così l’efficacia di segnalazione. (D): L’interazione della proteina scaffold con un adattatore locale (grigio scuro) restringe l’attivazione della via di segnalazione a regioni subcellulari specifiche (grigio chiaro). Dard N, Peter M. Scaffold proteins in MAP kinase signaling: more than simple passive activating platforms. Bioessays. 28:146-156, 2006. Tipi di rafts CAVEOLAE CAVEOLAE (1) Le caveolae sono rafts lipidici specializzati che svolgono diverse funzioni di segnalamento. Sono state identificate per prima mediante esame con microscopia elettronica a metà degli anni 50 da due ricercatori (Palade, 1953; Yamada, 1955), come invaginazioni a forma di fiaschette di 50-100 nm della membrana plasmatica: Alberts, 3rd ed: Figura 13.48. Caveolae sulla membrana plasmatica di un fibroblasto umano. (A) ME a trasmissione di un fibroblasto in sezione trasversale che mostra caveolae come profonde invaginazioni della membrana plasmatica. (B) ME a scansione di una replica “deep-etch”, che mostra numerose caveolae sul versante citoplasmatico della membrana plasmatica. Il loro rivestimento sembra essere fatto da filamenti disposti concentricamente che contengono la proteina transmembrana caveolina. Notare che le caveolae differiscono sia in dimensioni che in struttura dai pozzetti rivestiti da clatrina, uno dei quali è visibile in altro a destra di (B). CAVEOLAE (2) Le caveolae sono state osservate in una gran diversità di tipi cellulari, in particolare nelle cellule endoteliali, ma non nei tessuti neuronali. Nelle caveolae sono particolarmente concentrate molte proteine e lipidi (Tabella 1); tuttavia, la marcatura delle cellule con un marcatore del dominio “Pleckstrin Homology, PH” specifico per il PIP2 indica che questo lipide non è concentrato nelle caveolae. Il principale marcatore delle caveolae è la proteina caveolina. CAVEOLAE (3) Caveolae. I glicosfingolipidi, e altri lipidi con catene aciliche lunghe e dritte sono indicati in arancione, i lipidi normali in giallo-verde. Le proteine transmembrana caveoline sono in blu. "I rubini rossi" rappresentano enzimi e recettori ancorati a GPI. Le sfere verdi sono ”Src-like kinases” palmitolate, e i recettori transmembranosi grigio e arancione rappresentano recettori di segnalamento associati alle caveolae. http://www.bms.ed.ac.uk/research/others/smaciver/Cyto-Topics/caveolae.htm http://www.glycoforum.gr.jp/science/word/glycolipid/GLA01E.html CAVEOLE Al microscopio elettronico : Fiasche (50-100 nm) profondamente invaginate CAVEOLINE: • • • PM= 23 Kda Struttura a forcina con : N- e C-terminale citoplasmatico Dominio di oligomerizzazione Domino transmembrana Interagiscono con il colesterolo Funzioni: • • • POTOCITOSI (endocitosi mediata da recettori per piccole molecole) Modulano l’attività delle proteine G trimeriche Coinvolti nelle vie di trasduzione del Ca++ e dell’insulina Robert G et al Current Opinion in Cell Biology, 1996 Le caveole giocano un ruolo nell’endocitosi? Dal momento della loro scoperta, si imaginava che le caveolae fossero siti di endocitosi, forse a causa della loro somiglianza con i pozzetti rivestiti di clatrina nei momenti in cui esse si distaccano dalla membrana plasmatica. Tuttavia, è stata recentemente fornita evidenza che le caveolae sono domini statici fissi e NON sono coinvolti nell’endocitosi (Thomsen et al., 2002). Però è stato anche dimostrato in modo convincente che il virus SV40 viene internalizzato a livello delle caveolae e che queste strutture possono essere attivate dallo stato statico descritto da (Thomsen et al, 2002) da segnali provenienti dal virus (Pelkmans et al, 2002). Caveolae e Oncogenesi L’espressione della caveolina è stata correlata sia alla trasformazione oncogenica che alla sua regressione: La sotto-regolazione della caveolina ha provocato trasformazione maligna che poteva essere rovesciata da caveolina anti-senso (Galbiati et al, 1998) La sovra-espressione della caveolina-1 ha abrogato la crescita indipendente da ancoraggio (N.B. una caratteristica della malignità) (Engelman et al, 1997). L’espressione della caveolina ha inibito la crescita di cellule mammarie maligne umane (Lee et al, 1998). Le caveolae sono coinvolte nell’infezione batterica? Molti batteri che infettano i vertebrati hanno adottato una strategia per illudere i sistemi immunitari dell’ospite invadendo le cellule. L’adesione e captazione dei batteri sono processi molto complessi che coinvolgono diverse proteine batteriche e un gran numero di proteine dell’ospite (di segnalamento e del citoscheletro) fuorviate dai batteri. La nucleolina è stata identificata come recettore per EHEC E. coli (enterohemorrhagic E. coli ) (Sinclair & O'Brien, 2002), ma non è chiaro se la nucleolina sia associata alle caveolae. I batteri potrebbero essere internalizzati mediante un meccanismo simile a quello descritto per il virus SV40 (Pelkmans et al, 2002). Caveolae neuronali Mentre le cellule neuronali esprimono caveolina-1 e caveolina-2, esse non formano caveolae morfologicamente distinguibili. Invece, hanno microdomini ricchi di caveoline associate alla striatina e ad altre proteine associate. Le striatine sono concentrate nelle spine dendritiche (Bartoli et al, 1998), d’accordo con l’opinione comune che le spine siano regioni in cui si concentra l’attività di segnalamento. Ierarchia dell’eterogeneità delle membrane cellulari basate sui rafts. Lingwood D, Simons K. Lipid rafts as a membrane-organizing principle. Science. 2010 Jan 1;327(5961):46-50. Lingwood D, Simons K. Lipid rafts as a membrane-organizing principle. Science. 2010 Jan 1;327(5961):46-50.
Scaricare