Il Trapianto Allogenico di cellule staminali emopoietiche Dipartimento Ematologia Oncologia U.O. Trapianto Di Cellule Staminali Emopoietiche Istituto G. Gaslini - Genova Versione 2 Aprile 2011 Ai genitori dei bambini che debbono eseguire Trapianto Allogenico di Cellule Staminali Emopoietiche (Allo-TCSE) Gentili Genitori, vostro figlio sarà sottoposto a Trapianto Allogenico di Cellule Staminali Emopoietiche (Allo-TCSE) presso il nostro Centro trapianti. Questo libretto ha lo scopo di spiegare le tappe principali del trapianto per fornirvi informazioni generali su questa procedura medica, sulle terapie di supporto e sulle complicanze che potranno presentarsi. Non è scopo del presente libretto fornire le più aggiornate scoperte mediche o fornire informazioni su tutti i possibili scenari che possono presentarsi durante la procedura di trapianto. Non si farà riferimento a specifiche malattie né a considerazioni statistiche riguardo i risultati a lungo termine del trapianto. Informazioni personalizzate riguardo le singole patologie e i singoli pazienti così come aggiornamenti sulla ricerca medica, che può comportare modifiche dei trattamenti erogati, verranno fornite caso per caso nei colloqui medici pre-trapianto. Questo libretto non deve sostituirsi ai colloqui con i medici bensì deve essere usato come vostro punto di riferimento per tali colloqui che durante il ricovero saranno giornalieri. A tale scopo nella parte strutturata come calendario-agenda come pure in fondo al libretto vi sono spazi bianchi nei quali potete annotare domande o richieste di spiegazioni. Oltre al presente libretto vi verrà consegnato un altro opuscolo redatto dal personale infermieristico del Centro Trapianti allo scopo di fornire informazioni sul reparto di degenza, sui servizi di supporto all’assistenza e sui comportamenti da adottate durante il ricovero, in particolare su quelli che hanno implicazioni di natura igienica ed alimentare. I Medici dell'Unità di Trapianto INDICE IL TRAPIANTO ALLOGENICO DI CELLULE STAMINALI EMOPOIETICHE (CSE) Cosa è il trapianto allogenico di CSE (generalità sul trapianto allogenico) 03 Chi può essere donatore di CSE ( tipi di trapianto allogenico) 05 Perché fare il trapianto di CSE (le indicazioni al trapianto) 07 TAPPE FONDAMENTALI DEL TRAPIANTO ALLOGENICO DI CSE Valutazione pre-trapianto Erogazione del regime di condizionamento Infusione delle CSE (o Trapianto) Periodo pre-attecchimento e le sue problematiche Periodo dell’attecchimento e le sue problematiche Dimissione dall’unità di trapianto Primo periodo post-dimissione A casa dopo il trapianto 09 10 11 11 13 14 15 17 CALENDARIO- AGENDA Settimana -3 e –2 Settimana –1 Giorno 0 Settimana +1 Settimana +2 Settimana +3 Settimana +4 (primo mese) Settimana +5 Secondo e terzo mese Dal 4° mese a 1-2 anni Dopo 1-2 anni 22 24 26 27 29 31 33 35 37 45 46 DOMANDE COMUNI E RISPOSTE Quanto dura un trapianto? Che cos’è il rigetto? Cos’è la GvHD? Cos’è il trapianto autologo di CSE? Ci possono essere conseguenze a distanza dovute al trapianto? Quanto costa effettuare il trapianto? 48 48 49 49 50 50 NOTE 51 VOCABOLARIO 53 IL TRAPIANTO ALLOGENICO DI CELLULE STAMINALI EMOPOIETICHE (CSE) 1) COSA E’ IL TRAPIANTO ALLOGENICO DI CSE (GENERALITA’ SUL TRAPIANTO ALLOGENICO) Il Trapianto di midollo osseo, attualmente meglio definibile trapianto di cellule staminali emopoietiche (TCSE), è una strategia terapeutica che ha assunto nel corso degli ultimi decenni un ruolo di primaria importanza nel trattamento di molti tumori del sangue, tumori solidi, nelle aplasie midollari, nelle immunodeficienze congenite nonché in numerose malattie metaboliche e congenite dell’infanzia. Il trapianto di cellule staminali emopoietiche prevede: 1) la eradicazione dell’emopoiesi e della risposta immune del ricevente mediante la somministrazione di radioterapia e/o chemioterapia a dosi elevate (regime di condizionamento) 2) il successivo ripristino delle normali funzioni midollari e dell’immunocompetenza grazie all’infusione di cellule staminali prelevate da un donatore idoneo. La fonte delle cellule staminali utilizzata a scopo di trapianto è stata, originariamente, il sangue midollare, ottenuto tramite prelievo di midollo osseo mediante aspirazioni multiple dalle ossa del bacino (HPC-BM); in anni più recenti 3 è divenuto possibile utilizzare cellule staminali raccolte da sangue periferico (HPCApheresis) Per questo motivo la vecchia terminologia di “trapianto di midollo osseo” è stata oggi sostituita dalla più attuale di “trapianto di cellule staminali emopoietiche”. Tecnicamente il trapianto si riduce ad una semplice infusione di cellule staminali midollari o periferiche tuttavia, definire questa operazione “trapianto” è ampiamente giustificato se si pensa che dalle cellule staminali emopoietiche presenti nel materiale infuso avranno origine sia un nuovo sistema emopoietico (produzione midollare di globuli bianchi polimorfonucleati, globuli rossi e piastrine) sia un nuovo sistema immunitario (linfociti), uguali a quelli del donatore e che dovranno essere in grado di convivere e interagire con con il ricevente. Dunque il trapianto allogenico di cellule staminali emopoietiche non deve essere visto come una difficile operazione chirurgica ma piuttosto come una delicata e complessa trasfusione di cellule staminali che deve tener conto delle complesse regole del sistema di istocompatibilità (HLA). La base della compatibilità tra soggetto ricevente e soggetto donatore è infatti rappresentata da un sistema di riconoscimento, disposto sulla superficie di tutte cellule (antigeni d'istocompatibilità del sistema HLA) che vengono riconosciute dal sistema immunitario. La compatibilità viene verificata attraverso accurati e ripetuti tests di laboratorio 4 Il successo di un trapianto dipenderà, in gran parte, dal grado di compatibilità tra i due soggetti e in particolare dal comportamento dei due sistemi immunitari che vengono a contatto. Infatti tale convivenza non sempre è facile e pacifica, potendone derivare da un lato il rigetto del trapianto, se hanno il sopravvento le difese immunitarie del ricevente non adeguatamente condizionate, e dall’altro la malattia del trapianto contro l’ospite (Graft-versus-Host-Disease: GvHD) se si manifesta in maniera evidente l’aggressione del sistema immunitario trapiantato verso i tessuti del ricevente 2) CHI PUÒ ESSERE IL DONATORE DI CSE (TIPI DI ALLO-TRAPIANTO e FONTI DI CELLULE STAMINALI) Nel trapianto allogenico il donatore può essere un familiare oppure un donatore non familiare volontario, reclutato presso i registri mondiali dei donatori; tra i trapianti allogenici va annoverato anche quello effettuato con cellule staminali placentari prelevate dal cordone ombelicale (HPC-CB), che a sua volta può appartenere a un familiare oppure provenire da una banca dei cordoni. 5 A grandi linee si distinguono i seguenti tipi di trapianto allogenico: Trapianto allogenico da familiare HLA identico: il donatore è solitamente un fratello/sorella, non gemello, che ha casualmente ereditato dai due genitori gli stessi componenti del sistema HLA (N.B. la possibilità che due fratelli siano HLA identici è del 25%). Trapianto allogenico da familiare HLA parzialmente compatibile: tra ricevente e il familiare donatore possono esservi un certo numero di differenze HLA che tuttavia vengono ritenute accettabili ai fini del trapianto. Trapianto da donatore non consanguineo: il donatore è un soggetto totalmente estraneo al gruppo familiare, iscritto ad un registro donatori, che casualmente ha caratteristiche HLA uguali o molto simili a quelle del ricevente. E’ indispensabile che il donatore identificato confermi la disponibilità ad effettuare la donazione delle sue CSE midollari o periferiche. La donazione è un atto che avviene in maniera volontaria, gratuita e anonima. L’attuale legislatura prevede che l’anonimato venga mantenuto indefinitivamente pertanto non consente che vi siano rapporti diretti tra donatore e ricevente mentre sono possibili rapporti epistolari mediati dai Registri Donatori. 6 Trapianto aploidentico: Si tratta di un particolare tipo di trapianto in cui il donatore è rappresentato da un familiare (solitamente un genitore, ma può trattarsi di altro congiunto) che presenta una compatibilità con il ricevente del 50%. Affinché possa essere eseguito è necessaria una manipolazione in vitro o in vivo del prodotto da infondere. Fonti di CSE Midollo osseo (HPC-BM): il donatore viene sottoposto ad espianto. Sangue periferico (HPC-Apheresis): il donatore viene trattato con un fattore di crescita (GCSF) che provoca la mobilizzazione delle CSE dal midollo al sangue periferico. Successivamente tali CSE vengono raccolte tramite una procedura di aferesi extracorporea. Sangue cordonale (HPC-CB): sono utilizzate le CSE raccolte dal cordone ombelicale al momento della nascita che poi,fino al momento del loro utilizzo, vengono conservate, congelate, in apposite banche. 3) PERCHÈ FARE IL TRAPIANTO ALLOGENICO DI CSE (LE INDICAZIONI AL TRAPIANTO) Le indicazioni al trapianto allogenico di CSE sono molteplici e correlate a molti e diversi fattori legati al paziente e alla sua malattia per cui ogni caso deve essere visto singolarmente e come tale discusso con i medici curanti e i medici che eseguiranno il trapianto. Molto brevemente, senza entrare nello specifico, ricordiamo che il trapianto allogenico di CSE può essere indicato in una malattia neoplastica, soprattutto ematologica, come consolidamento dei risultati ottenuti con la terapia tradizionale (leucemie acute ad alto rischio, leucemie croniche); nel caso di malattia parzialmente resistente alla terapia (leucemia acuta o linfomi recidivati, alcuni tumori solidi). In tali casi il trapianto consente non solo di somministrare una terapia antitumorale a dosi elevate, non limitata dai fenomeni di tossicità midollare, che hanno come effetto la distruzione delle cellule neoplastiche ma anche, in un secondo tempo, lo sviluppo di un nuovo sistema immunitario ad origine dal donatore che potrebbe essere utile a combattere microscopici residui neoplastici ed effettuare un controllo immunologico del tumore (effetto GvL = Graft Versus Leucemia e effetto GVT = Graft Versus Tumor). 7 Inoltre il trapianto di CSE può trovare indicazione nei casi in cui il paziente sia affetto da un’aplasia del midollo osseo o da un difetto cronico di una delle cellule del sangue come nel caso della talassemia o di alcune immunodeficienze, o alcune malattie metaboliche. In queste ultime situazioni lo scopo del trapianto sarà quello di fornire un elemento congenitamente deficitario (aplasie congenite, immunodeficienze, malattie metaboliche congenite) o sostituire un elemento non correttamente funzionante (talassemia, alcune immunodeficienze). Infine il trapianto può trovare indicazione in alcune rare malattie congenite come l'osteopetrosi o in alcuni casi di malattie autoimmuni non responsive ai trattamenti classici. L’elenco delle indicazioni al trapianto di CSE ha subito nel corso degli anni un continuo aggiornamento, con progressivo aggiungersi di patologie che possono beneficiare di tale trattamento. L’elenco delle indicazioni al trapianto allogenico viene aggiornato annualmente in armonia con gli standard nazionali ed internazionali. I casi clinici non contemplati nella tabella delle indicazioni consolidate devono essere discussi nell’ambito dell’ AIEOP (associazione italiana ematologia oncologia pediatrica), del GITMO (gruppo italiano trapianto di midollo osseo) e commissione MUD (donatore non correlato). 8 TAPPE FONDAMENTALI DEL TRAPIANTO ALLOGENICO DI CSE 1) VALUTAZIONE PRETRAPIANTO La valutazione pretrapianto del ricevente è finalizzata a confermare l’idoneità al trapianto. Ciò vale soprattutto per le malattie neoplastiche nelle quali risulta importante: A. Verificare lo stato di remissione della malattia tramite esami ematologici oltre che strumentali (puntato midollare, puntura lombare, TC, RMN, scintigrafie e quanto altro necessario). B. Valutare le condizioni fisiche generali del paziente con studio approfondito della funzionalità dei vari organi ed apparati come cuore, fegato, polmoni, sistema nervoso centrale, etc. Tali valutazioni richiedono in genere una decina di giorni e per lo più vengono svolte in regime ambulatoriale o di D.H. La valutazione pre-trapianto è una tappa fondamentale del percorso trapiantologico. E’ il momento in cui va definitivamente confermata l’ indicazione al trapianto ma soprattutto viene confermata la fattibilità del trapianto facendo un bilancio tra i rischi che comporta la malattia di base rispetto al rischio insito nella stessa procedura di trapianto, anche in relazioni alle attuali condizioni cliniche del paziente. Da tale verifica scaturiranno le decisioni definitive riguardo l’ idoneità al trapianto e potrebbero in tale momento essere apportate modifiche ai precedenti programmi in termini per esempio di spostamento della data del trapianto o di modifiche del tipo di condizionamento. Poco prima dell’ingresso nel reparto di degenza del trapianto al paziente verrà posizionato un catetere venoso centrale (CVC) bilume utilizzando come punto di ingresso le vene giugulari, se integre dal punto di vista anatomico. Nel caso il paziente sia già portatore di un precedente CVC monolume, questo viene rimosso e sostituito con il bilume. 9 In questa fase vi viene richiesto il consenso informato a procedere con il programma di trapianto. Inoltre potrebbe anche essere richiesto il vostro consenso informato ad inserire il paziente in studi clinici che solitamente hanno lo scopo di verificare l’efficacia profilattica o terapeutica di particolari farmaci. 2) EROGAZIONE DEL REGIME DI CONDIZIONAMENTO Solitamente la somministrazione del regime di condizionamento inizia il giorno successivo all’ingresso nel reparto di degenza e prosegue per un periodo di tempo variabile da 5 a 10 giorni. La terapia di condizionamento consiste nella somministrazione di dosi elevate di farmaci antiblastici, eventualmente associati ad una radioterapia su tutto il corpo (Irradiazione Corporea Totale = TBI). Gli scopi sono molteplici: 1) Distruggere completamente le cellule neoplastiche come nel caso di leucemie, linfomi o tumori solidi; 2) Rimuovere il midollo emopoietico del ricevente per fare spazio alla nuova emopoiesi che originerà dalle CS del donatore; 3) abolire la sorveglianza immunitaria del ricevente così da consentire alle CSE del donatore di non essere aggredite dal sistema immunitario del ricevente; in tal modo possono raggiungere la loro nuova sede e iniziare a produrre le cellule del sangue. Nel caso di trapianto da donatore non consanguineo nel corso del condizionamento, verranno somministrati particolari farmaci (quale il siero anti-linfocitario) indispensabili per ridurre il rischio di rigetto e di GVHD. Durante la somministrazione del condizionamento possono presentarsi i comuni disturbi della terapia antiblastica (nausea e vomito). Nel caso di somministrazione del Siero Anti-Linfocitario o farmaci simili sono possibili brusche reazioni febbrili o altre manifestazioni, anche molto gravi, a patogenesi immuno-allergica. La radioterapia e i farmaci chemioterapici utilizzati a dosi elevate comportano l’insorgenza di danni non solo al midollo osseo ma anche ad altri organi, in particolare all'apparato gastroenterico e al fegato. I danni prevedibili saranno più o meno gravi a seconda del tipo di condizionamento che viene somministrato. Eccezionalmente si potranno presentare problemi più rari, solo in parte prevedibili, quali convulsioni, disturbi renali o cardiaci, che possono anche essere fatali. 10 Alcuni regimi chemio/radioterapici inoltre possono indurre dei danni che potranno manifestarsi anche ad alcuni anni di distanza (cosiddetti “effetti tardivi del trapianto”) quali la sterilità e la cataratta. Desideriamo tuttavia sottolineare che negli ultimi anni è divenuto sempre più diffuso l’utilizzo di regimi di condizionamento detti “a bassa intensità o non mieloablativi” che risultano meno tossici sia a breve che a lungo termine. Al momento, non tutte le patologie possono beneficiare di tali regimi di condizionamento. 3) INFUSIONE DELLE CSE (O TRAPIANTO) In pratica è una semplice infusione di sangue midollare o di un concentrato di cellule raccolte dal sangue periferico del donatore. L’infusione viene fatta attraverso il catetere venoso centrale in un tempo variabile a seconda del tipo di prodotto da infondere. Tale giornata viene indicata come giorno -0- da cui cominciare a contare i giorni post-trapianto. Gli effetti collaterali dell’infusione sono gli stessi che possono aversi, generalmente su base immunoallergica, con la trasfusione di un emocomponente (concentrato di GR o piastrine). In caso di incompatibilità di gruppo sanguigno ABO tra donatore e ricevente, verranno attuate una serie di misure per prevenire l’insorgenza di incidenti trasfusionali. Malgrado tali misure sono comunque possibili complicazioni a breve (emolisi immediata) , medio (emolisi ritardata), o lungo termine (aplasia pura della serie rossa). 4) PERIODO PRE-ATTECCHIMENTO E LE SUE PROBLEMATICHE Comprende il periodo di aplasia post-trapianto che è contemporaneo al periodo di tossicità acuta del regime di condizionamento. E’ il periodo più rischioso per le possibili complicanze, anche molto gravi, di natura tossica, infettiva, emorragica. La mancanza di globuli bianchi predispone allo sviluppo di infezioni e pertanto un periodo prolungato di febbre durante questa fase rappresenta la norma. Va detto che, anche se raramente, le infezioni possono essere tanto gravi da risultare letali malgrado venga instaurata prontamente una adeguata terapia anti-infettiva. Tale eventualità è più spesso legata allo sviluppo di germi multiresistenti agli antibiotici oppure allo sviluppo di infezioni fungine diffuse o con grave danno d’organo oppure , infine, nel caso di evento infettivo virale. 11 L’assenza di piastrine predispone al rischio di emorragie, che possono essere prevenute con la trasfusione regolare di concentrati piastrinici da aferesi. Va tuttavia segnalato che in rari casi il paziente poli-trasfuso può sviluppare anticorpi anti-piastrine con conseguente refrattarietà alla trasfusione. In tal caso, se possibile, si cercherà un donatore di piastrine compatibile (che potrebbe essere anche uno o tutti e due i genitori) senza avere tuttavia la certezza che ciò possa risolvere il problema. In una situazione del genere il rischio emorragico diviene elevatissimo e può essere letale. La terapia di condizionamento che utilizza l’irradiazione corporea totale e/o chemioterapici ad effetto mieloablativo produce prevalentemente una tossicità a carico del tubo digerente (bocca, stomaco, intestino). Possono svilupparsi lesioni al cavo orale estese e dolorose che provocano impossibilità ad alimentarsi. Lo stesso tipo di lesioni visibili al cavo orale possono estendersi a tutto l’intestino manifestandosi con dolori addominali e diarrea profusa. A causa della tossicità sulle mucose dell’apparato gastroenterico dopo un condizionamento mieloablativo viene regolarmente iniziata una nutrizione parenterale totale (NPT) la cui durata si protrarrà fino alla risoluzione della tossicità sulle mucose con ripresa dell’appetito. Va inoltre segnalata la seppur rara possibilità di gravi complicazioni d’organo, in genere legate a particolari tipi di condizionamenti. A tale proposito si segnala la malattia veno-occlusiva (VOD) che generalmente si manifesta con un grave danno epatico in grado di evolvere rapidamente in una insufficienza fulminante. Il polmone, esposto in ogni fase del trapianto a complicazioni più o meno gravi, in questo periodo può manifestare una delle più temibili complicanze detta “emorragia polmonare diffusa”. Legata alla somministrazione di alte dosi di Ciclofosfamide è la cosiddetta cistite emorragica nella cui patogenesi probabilmente intervengono anche fattori infettivi virali. Per quanto riguarda queste ultime complicanze si segnala che vengono regolarmente poste in atto tutte le precauzioni ad oggi note per prevenirle o diagnosticare precocemente la loro insorgenza. 12 5) PERIODO DELL’ATTECCHIMENTO E LE SUE PROBLEMATICHE Le CSE infuse raggiungono gli spazi midollari all'interno delle ossa del ricevente, dove si moltiplicano e cominciano a produrre globuli bianchi, globuli rossi e piastrine. Il momento dell’attecchimento è variabile in base a tipo di trapianto, fonte delle CSE, tipo di profilassi GVHD. Indicativamente può variare tra il 10° e il 20° giorno con possibilità di arrivare vicini al 30° giorno nel caso di trapianto con cellule staminali cordonali. Diretta conseguenza dell’attecchimento è l’evidenza che i globuli bianchi polimorfonucleati (neutrofili) del sangue superano il numero assoluto di 500 mm/q, per poi arrivare a valori normali. Nello stesso periodo le problematiche infettivologiche come pure le tossicità d’organo tendono a migliorare e risolversi. In un momento successivo si ridurrà per poi cessare la trasfusione-dipendenza di Globuli Rossi e Piastrine. In questa fase, a causa dell’attecchimento del sistema immunitario del donatore nel ricevente, inizia il periodo a rischio per l’insorgenza di GvHD acuta. La GvHD acuta può teoricamente colpire tutti i tessuti del ricevente tuttavia i principali organi bersaglio sono la cute, l’intestino e il fegato. Tali organi possono essere colpiti in varia associazione e con gravità variabile che viene descritta con una gradazione da 1 a 4. Le forme di grado globale 3-4 rappresentano una grave complicanza che, se scarsamente rispondenti alle terapie, possono essere letali. Il trattamento della GvHD prevede l’utilizzo di farmaci (principalmente il cortisone e altri immunosoppressori, anticorpi monoclonali, siero antilinfocitario) o di procedure particolari (linfocitoaferesi) che verranno decisi di volta in volta sulla base della gravità clinica della GvHD, facendo riferimento a volte a dei protocolli consolidati e, altre volte, specie nelle forme più gravi o non rispondenti alle terapie di prima linea, applicando protocolli di trattamento sperimentali. In questa fase, allo scopo di meglio inquadrare l’interessamento d’organo della GvHD potrebbe essere necessario ricorrere a indagini invasive quali la biopsia cutanea, la biopsia epatica, l’endoscopia dell’apparato digerente con esecuzione di biopsie intestinali. 13 Lo studio dell’attecchimento tramite indagini di laboratorio specifiche (cariotipo, polimorfismi del DNA, etc) viene generalmente effettuato su sangue periferico nel momento in cui si ha evidenza dell’attecchimento. In alcune patologie (es. leucemie) è necessario eseguire gli stessi esami su puntato midollare, solitamente 30-40 giorni dopo il trapianto. 6) DIMISSIONE DALL' UNITÀ DI TRAPIANTO La dimissione dal reparto di degenza può avvenire dopo aver verificato le seguenti condizioni: 1) attecchimento stabile in assenza di GvHD. 2) pronta risposta alla terapia nel caso di insorgenza di una GvHD acuta di grado 1-2 . 3) svezzamento dall’ alimentazione parenterale con buona ripresa dell’alimentazione spontanea. 4) assenza di problemi nella assunzione orale dei farmaci. 5) assenza di problematiche infettive Se sono soddisfatte tutte le precedenti condizioni il bambino può essere direttamente dimesso dall'Unità di Trapianto. Se invece le precedenti condizioni sono soddisfatte solo parzialmente, il bambino, non necessitando più di degenza nel reparto TCSE, potrebbe essere trasferito presso un altro reparto del dipartimento di Emato-Oncologia per continuare la preparazione alla definitiva dimissione. Mediamente la durata globale del ricovero, in assenza di complicanze maggiori, è di circa 45 giorni, pertanto la dimissione avviene approssimativamente in giornata +35, +40 posttrapianto. I pazienti che presentano una GvHD di grado 3-4, della cui gravità si è già detto in precedenza, sono quelli che vanno incontro più frequentemente a lungo-degenze che possono protrarsi anche per diversi mesi. In quest’ultima situazione, solo nel caso di una risposta positiva, anche parziale, ai trattamenti instaurati può essere programmato un trasferimento presso altro reparto. 14 7) PRIMO PERIODO POST-DIMISSIONE Dopo la dimissione, per un periodo medio di circa 2 mesi, è necessario che il bambino resti nelle vicinanze del Centro di Trapianto poiché deve essere controllato mediamente due volte alla settimana presso il D.H. della Unità Operativa Emato-Oncologia oppure presso la residenza protetta assegnatagli, tramite il Servizio di Assistenza Domiciliare. Durante questo periodo sono necessari frequenti visite mediche, prelievi di sangue per esami di laboratorio e avverranno periodiche modifiche delle terapie. Lo scopo dei controlli in questa fase è sostanzialmente mirato a monitorare le seguenti situazioni: 1) che all’attecchimento primario faccia seguito un valido e persistente attecchimento di tutte le serie midollari (GR, GB, Piastrine). In questo periodo è comunque probabile che il bambino abbia ancora necessità di saltuarie trasfusioni di globuli rossi e piastrine; 2) che la “coabitazione” donatore-ricevente sia libera da eventi dannosi. Si tratta di cogliere precocemente segni e/o sintomi di insorgenza ex novo o di ripresa di GVHD acuta. Per altri paziente può essere necessario verificare che la precedente GvHD acuta sia in costante miglioramento con la conseguente possibilità di continuare a ridurre la terapia immunosoppressiva in atto. Alcuni pazienti eseguiranno, con un preciso calendario, procedure terapeutiche più complesse quale la linfofoto-aferesi. Più avanti andrà valutata una possibile evoluzione della GvHD acuta verso la cronicità oppure l’insorgenza ex novo di una GvHD cronica; 3) diagnosticare precocemente riattivazioni endogene di patologie infettive di natura virale (CMV, EBV) per poter instaurare un precoce trattamento; 4) seguire nel tempo il regolare ricostituirsi del sistema immunitario nelle sue varie componenti (Linfociti T, B, NK; produzione immunoglobuline). Durante questo periodo è probabile che il bambino necessiti di infusioni periodiche di immunoglobuline. Sempre durante questo periodo può rendersi necessario un nuovo ricovero, che solo raramente significa ritornare presso il reparto di degenza di Trapianto. 15 Nel caso di problematiche infettive certe (per esempio documentate riattivazione virali che necessitano di trattamento specifico) o solo sospette (per esempio episodi febbrili di n.d.d.) il reparto di destinazione è rappresentato dal settore di Malattie Infettive. Nel caso in cui le problematiche presentate indirizzino verso la diagnosi GvHD acuta o cronica, microangiopatia, complicanze immuno-ematologiche o, infine, sospetta ripresa di malattia, il reparto di destinazione per competenza è rappresentato dai settori di Ematologia o Oncologia. Solo in assenza di disponibilità di posti letto presso il reparto di competenza, il ricovero può avvenire momentaneamente presso altro settore per poi eseguire un successivo trasferimento presso il reparto definitivo. In tutti i casi il medico trapiantologo sarà direttamente coinvolto nella gestione del paziente trapiantato, in collaborazione con i colleghi del reparto ospitante. Durante questo primo periodo post-trapianto (più spesso in vicinanza del giorno + 100) è probabile che il bambino esegua un puntato midollare per una seconda valutazione dell’attecchimento midollare. OSPEDALE CASA Istituto G. Gaslini Assistenza. Assistenza Domiciliare domiciliare Istituto G. Gaslini Assistenza. Assistenza Domiciliare domiciliare 16 8) A CASA DOPO IL TRAPIANTO Mediamente, dopo i primi due mesi trascorsi nelle immediate vicinanze del casa Centro trapianti, al bambino viene permesso il ritorno a casa. A domicilio il bambino richiederà ancora numerose attenzioni. Saranno ancora necessari controlli clinici e laboratoristici che mediamente verranno eseguiti inizialmente una volta alla settimana, poi ogni 15 giorni e infine una volta al mese presso un reparto ospedaliero competente in Emato-Oncologia Pediatrica vicino alla sede di residenza Mediamente ogni tre mesi per il primo anno è previsto un controllo presso il Centro Trapianti. Durante tali controlli la permanenza presso il Centro Trapianti, in assenza di problemi maggiori, si limita ad 1-2 giorni. In uno o più di questi controlli è possibile che venga eseguito un puntato midollare così come è possibile che venga decisa la rimozione del CVC. Quando il bambino ritorna a casa (approssimativamente giornata +90/+120 dopo il trapianto) e comunque per il primo anno dopo il trapianto, il paziente soffrirà di un periodo più o meno lungo di immunodeficienza, ovvero di carenti difese contro le infezioni. Tale stato sarà tanto più grave e prolungato se è presente GvHD e se viene effettuata terapia immunosoppressiva utilizzando più di un farmaco. Pertanto le seguenti raccomandazioni sono prevalentemente centrate sulle problematiche di natura infettiva che possono presentarsi in tale periodo. Infezioni possibili di questo periodo: 1) Infezioni virali: herpes zoster (compare con bruciore o dolore in zona facciale e/o sul torace, più raramente sulle gambe o braccia, seguito da comparsa di macchie rosse che diventano rapidamente bolle per lasciare il posto a croste). Provvedimento: contattare il medico curante e poi il Centro Trapianti. 2) Infezioni CVC correlate: (contaminazione del lume da non corretto lavaggio, contaminazione del tunnel sottocutaneo o del foro di uscita da germi opportunistici). 17 Nelle infezioni del decorso sottocutaneo o dell’emergenza del CVC la sintomatologia è rappresentata principalmente da manifestazioni infiammatorie locali con associata o meno febbre. Nel caso di colonizzazione del lume del CVC la sintomatologia può variare ampiamente di gravità: nessun sintomo; rialzo termico con brivido dopo lavaggio/manipolazione del CVC; quadro clinico di sepsi; shock settico. Provvedimento: contattare il Centro Trapianti 3) Infezioni Bronco-polmonari: (insorgono con tosse, difficoltà di respiro, aumento delle frequenza respiratoria, con o senza febbre). Provvedimento: contattare il medico curante e poi il Centro Trapianti 4) Infezioni del cavo orale: (la più frequente è il mughetto o candida orale, con lingua bianca e depositi biancastri sul palato e nella gola). Provvedimento: lavaggi del cavo orale con anti-fungini, maggiore cura dell’igiene della bocca, contattare il Centro Trapianti. Prevenzione delle infezioni I pazienti alla dimissione dovranno continuare terapia preventiva con cotrimoxazolo (Bactrim) 3 giorni alla settimana: tale terapia previene una eventuale infezione da Pneumocistis carini (un agente responsabile di alcuni casi di polmonite post-trapianto). Qualsiasi contatto, certo o anche solo sospetto, con soggetti affetti da malattie infettive contagiose deve essere immediatamente comunicato ai medici del Centro Trapianto. I fratelli e gli altri famigliari devono proseguire normalmente le loro attività (per esempio se un fratello frequenta la scuola o l'asilo può continuare a frequentarlo) tuttavia è necessario essere informati tempestivamente in caso di presenza di malattie infettive nella comunità scolastica o lavorativa frequentata dal congiunto. Sarà importante curare l’igiene del cavo orale, dei genitali e della cute. Se il paziente viene inviato a domicilio con il catetere venoso centrale, si dovrà provvedere regolarmente una volta alla settimana alla medicazione dell’emergenza cutanea; solitamente a giorni alterni o settimanalmente andrà effettuato il lavaggio dello stesso con le apposite soluzioni come indicato durante l’addestramento alla manutenzione del CVC. 18 E' importante che la casa venga ben pulita ed areata prima del ritorno del bambino, con particolare attenzione alla camera da letto e al bagno. Il bambino deve avere asciugamani personali cambiati almeno settimanalmente. E' opportuno che per almeno alcuni mesi non vengano tenuti in casa animali domestici. A casa con i familiari o durante le passeggiate all'aria aperta non è necessario portare la mascherina oronasale; essa deve essere indossata invece in luoghi chiusi o durante i controlli in ambiente ospedaliero fino a nuove indicazioni da parte dei medici. Nel primo mese a casa è meglio che il bambino non abbia molte visite e solo dai parenti più prossimi. Poi potrà iniziare a giocare con qualche amico ed infine, dopo almeno 6 mesi dal trapianto, su permesso del medico, tornare a frequentare la comunità scolastica. Bisogna evitare luoghi affollati (cinema, supermercati, treni, autobus) ed evitare la frequentazione di soggetti con malattie esantematiche sospette o in atto (varicella, morbillo, rosolia) o altre malattie virali (parotite, influenza) o anche solo episodi febbrili da causa sconosciuta. In linea generale la dieta di questo periodo dovrebbe essere libera. In caso contrario verranno fornite a parte indicazioni dietetiche cui attenersi. Anche a domicilio l'igiene personale del bambino è molto importante: sarà opportuno eseguire la doccia (o il bagno) almeno a giorni alterni con le necessarie precauzioni riguardo l’emergenza del CVC. La cute dovrà essere poi asciugata accuratamente ed 19 eventualmente massaggiata con creme protettive e idratanti specie nei casi in cui sia presente secchezza della cute quale esito di una pregressa GvHD. Se il bambino ha eseguito irradiazione corporea totale e/o assume ciclosporina sarà opportuno evitare l'esposizione diretta ai raggi solari per tutto il periodo di assunzione del farmaco. Almeno due volte al giorno il bambino dovrà lavarsi i denti con uno spazzolino morbido e pasta dentifricia. Lo spazzolino deve essere, conservato separato da quelli del resto della famiglia e cambiato frequentemente. Dopo la sospensione definitiva della terapia immunosoppressiva i medici del Centro Trapianti vi forniranno informazioni riguardo la necessità di programmare un calendario di vaccinazioni da eseguire. 20 CALENDARIO-AGENDA Abbiamo qui schematizzato cronologicamente le varie fasi del lungo percorso terapeutico che è definito “trapianto di cellule staminali emopoietiche”. Vengono elencati i momenti più salienti delle varie fasi con qualche nota di commento. Questo capitolo è strutturato sotto forma di agenda in modo da consentirvi di fissare appunti, domande, terapie come in una sorta di diario personale oppure da utilizzare come promemoria per le richieste di spiegazioni alle infermiere e ai medici. SETTIMANA -3 E -2 Periodo dell’accoglienza presso il D.H. dell’U.O. Emato-Oncologia Periodo della rivalutazione di malattia. Periodo della valutazione delle condizioni generali. Periodo in cui viene definitivamente confermata l’idoneità al trapianto. Periodo in cui viene richiesto il consenso informato al trapianto. Periodo dell’inserimento (o sostituzione) del catetere venoso centrale. Dopo aver definitivamente confermato l’indicazione e l’idoneità del paziente ad effettuare il trapianto, vengono fornite le necessarie informazioni e richiesto il consenso informato a procedere. Nel caso di trapianto da cordone verrà precauzionalmente eseguito al paziente un espianto midollare di back-up; verranno cioè raccolte cellule staminali autologhe da reinfondere al paziente in caso di rigetto. data data data data data 22 data data data data data data data data 23 SETTIMANA -1 Periodo in cui avviene il ricovero presso il reparto di trapianto Periodo in cui viene somministrato il regime di condizionamento Inizia la fase di ricovero presso il reparto di trapianto. In questa settimana cominciano le terapie, che possono essere somministrate sia per via orale sia attraverso il catetere venoso centrale con l’ausilio di pompe infusionali. Se ci sono difficoltà a ingerire le compresse, potranno essere polverizzate e assunte disciolte nell'acqua. I bambini che riceveranno irradiazione corporea totale, si recheranno presso il reparto di radioterapia dell'Istituto Scientifico Tumori dell’Ospedale S. Martino per tre giorni consecutivi; in alcuni casi due volte al giorno, in altri una volta soltanto. In questa fase possono comparire nausea, vomito e diarrea dovuti alle terapie: sono sintomi fastidiosi, ma non preoccupanti perché sono effetti collaterali dei farmaci previsti, e pertanto si attenueranno progressivamente fino a scomparire nei giorni successivi. Vi preghiamo di annotare tutti i sintomi che il bambino avverte, sia quelli di cui si è già discusso insieme, sia altri, imprevisti, che eventualmente compaiono. Tutto ciò va riferito alle infermiere e ai medici durante la visita giornaliera. data data data 24 data data data data 25 GIORNO 0 E’ il giorno del trapianto inteso come infusione delle CSE Il trapianto viene effettuato tra il 7° e il 10° giorno dopo il ricovero. Questo giorno è definito giorno “0” perchè è il punto di riferimento per tutti gli avvenimenti successivi. Le CSE prelevate al donatore durante la mattinata vengono solitamente infuse nel pomeriggio-serata. La durata dell’infusione è variabile ma generalmente si protrae per alcune ore. L'infusione può comportare l’insorgenza di qualche disturbo di natura allergica (prurito, arrossamento cutaneo, orticaria). A volte si possono avere problematiche legate ad una incompatibilità di gruppo AB0. Nel caso di CSE cordonali l’infusione viene fatta molto velocemente, dopo scongelamento delle cellule. data 26 SETTIMANA +1 Periodo della tossicità Periodo dell’ aplasia post-condizionamento Periodo dell’inizio della Nutrizione Parenterale Totale (NPT) Questa settimana è caratterizzata dalla progressiva diminuzione dei globuli rossi, dei globuli bianchi e delle piastrine. Per quanto riguarda i globuli bianchi la loro scomparsa provoca l'insorgenza di infezioni con febbre, che verranno trattate con vari tipi di farmaci: prevalentemente antibiotici e antifungini. In questa settimana comparirà la mucosite quale tossicità causata dalle terapie; è di fondamentale importanza curare scrupolosamente l'igiene del cavo orale. In questo periodo viene generalmente iniziata la nutrizione per via endovenosa che provvederà a rifornire l'organismo di tutte le sostanze e le calorie necessarie. Non bisogna forzare il bambino a mangiare: il suo fabbisogno nutrizionale sarà comunque soddisfatto della NPT. data data data 27 data data data data 28 SETTIMANA +2 Periodo di massima tossicità Periodo di massima trasfusione-dipendenza Periodo delle complicanze infettive Periodo delle complicanze tossiche Periodo delle complicanze emorragiche Periodo dell’iniziale attecchimento (in alcuni casi) Periodo delle sindromi da attecchimento e/o GvHD ) La maggior parte di questa settimana ricalca l’andamento della precedente. Sono necessarie le trasfusioni. Il mal di gola e il fastidio in bocca persistono. Se i dolori saranno particolarmente intensi verrà eseguita una adeguata terapia antidolorifica. Può comparire diarrea. In alcuni casi verso la fine di questa settimana i globuli bianchi potrebbero già cominciare lentamente a risalire. In concomitanza con questa risalita alcuni pazienti possono già iniziare a presentare segni di GvHD acuta (rossore e prurito sul palmo delle mani e sulla pianta dei piedi). Bisogna ricordarsi di continuare ad annotare tutti i sintomi, e soprattutto di riferirli alle infermiere ed ai medici. data data data 29 data data data data 30 SETTIMANA +3 Periodo dell’attecchimento Periodo della GvHD Periodo della risoluzione delle infezioni Periodo della risoluzione delle tossicità d’organo E' la settimana in cui nella maggioranza dei casi avviene l'attecchimento delle CSE che è dimostrato dalla risalita più o meno rapida dei globuli bianchi. Si parla di avvenuto “attecchimento” quando il numero dei neutrofili (che sono un tipo di globuli bianchi) è superiore a 500 per mm/q. I globuli rossi e le piastrine risaliranno più tardi e più lentamente. Se non già insorta è probabile che insorga GvHD acuta della pelle o degli altri organi bersaglio (intestino con diarrea; fegato con alterazione degli esami di funzionalità epatica). data data data 31 data data data data 32 SETTIMANA +4 – PRIMO MESE Periodo di consolidamento dell’attecchimento Riduzione o cessazione della trasfusione-dipendenza Periodo della ripresa dell’alimentazione Periodo della riduzione delle infusioni endovenose Periodo dell’assunzione per os dei farmaci Periodo del trattamento intensivo delle GvHD di grado elevato Periodo delle riattivazioni virali endogene precoci (CMV, EBV) E' la settimana in cui l'attecchimento si consolida. Aumentano ancora i globuli bianchi e si riduce il fabbisogno trasfusionale di globuli rossi e di piastrine. Sono ancora necessari frequenti prelievi di sangue e a volte la nutrizione per via venosa può essere ridotta e sospesa. Alcuni farmaci verranno sospesi (antibiotici) mentre altri verranno somministrati per via orale. In tal modo si riduce gradualmente il numero di infusioni giornaliere. In alcuni casi il CVC può essere chiuso per qualche ora durante il pomeriggio. Se si era presentata GvHD, nella maggioranza dei casi è il momento in cui si può dare un giudizio sulla sua gravità e quindi fornire elementi prognostici e può essere pianificato il trattamento. data data data 33 data data data data 34 SETTIMANA +5 Periodo del primo puntato midollare dopo trapianto Periodo del trasferimento presso altro reparto Periodo della possibile dimissione Periodo dei trattamenti intensivi delle GvHD severe La media della degenza per il trapianto è di 40-45 giorni totali, di cui 10 prima e 30 dopo il trapianto. Quindi è una settimana in cui molti pazienti vengono dimessi dal reparto. Quelli che devono proseguire terapie antibiotiche, antifungine o antivirali verranno trasferiti presso il reparto di malattie Infettive. I pazienti che hanno difficoltà di rialimentazione oppure forme di GvHD in miglioramento ma non adeguatamente regredite posono essere trasferiti presso altri reparti del dipartimento (Ematologia e/o Oncologia) In questa fase è necessario non accelerare troppo i tempi di una dimissione se il paziente non è ancora autonomo nella alimentazione e nell’assunzione dei farmaci. Dimissioni troppo precoci si possono poi pagare con la necessità di un nuovo ricovero presso un altro reparto. Purtroppo per i pazienti affetti da GvHD scarsamente responsiva alle terapie o di gravità alta (3-4 grado) si prospetta un periodo più prolungato di ricovero. Se necessario (dipende dalla patologia di base) prima della dimissione viene eseguito puntato midollare (PM) data data data 35 data data data data 36 SECONDO E TERZO MESE Periodo dei controlli bisettimanali e poi settimanali presso il D.H (sala 2). Periodo dell’eventuale assistenza domiciliare Periodo del trattamento intensivo con linfo-fotoaferesi della GvHD Periodo del monitoraggio delle riattivazioni virali endogene Periodo dell’insorgenza di tipiche complicazioni (PPT, malattia da raggi etc) Periodo di cambiamenti, anche improvvisi, delle dosi dei farmaci. Periodo di possibile nuovo ricovero in altro reparto per problemi intercorrenti. Periodo di preparazione per il ritorno a casa. Questa fase è quella che abbiamo definito “primo periodo post-trapianto”. Spesso il paziente ha necessità di un nuovo ricovero oppure, per evitare il ricovero, essere presente quasi giornalmente in day-hospital. Molto probabile che il bambino necessiti ancora di trasfusioni o di infusione di immunoglobuline. In questo periodo, in base al livello ematico, possono essere aumentate o ridotte le dosi degli immunosoppressori. Se il paziente stava già assumendo cortisone è possibile che si inizi una graduale riduzione fino alla sospensione. In base anche al tipo di patologia e al tipo di protocollo eseguito potrebbe essere necessario eseguire un puntato midollare. In rarissimi casi, quelli a decorso particolarmente favorevole, si potrebbe rimuovere il catetere venoso centrale. Nella maggioranza dei casi viene organizzato il ritorno a casa. data data data 37 data data data data data data data data 38 data data data data data data data data 39 data data data data data data data data 40 data data data data data data data data 41 data data data data data data data data 42 data data data data data data data data 43 data data data data 44 DAL QUARTO MESE FINOA 1-2 ANNI cioè fino al momento di sospensione di tutte le terapie Periodo dei controlli in una struttura sanitaria presso la sede di residenza, con invio di periodici aggiornamenti al Centro Trapianti Periodo del ritorno ogni tre mesi circa presso il centro trapianti, per un controllo di 1 – 2 giorni, in regime ambulatoriale o di D.H. Periodo della rimozione del CVC Periodo della progressiva riduzione e sospensione degli immunosoppressori Periodo di eventuali riprese di GvHD (spesso in forma cronica). Periodo di possibile evoluzione in forma cronica di una precedente GvHD acuta. Anche se a casa, bisogna continuare ad eseguire controlli periodici e assumere ancora diverse terapie per bocca. E' il periodo in cui lentamente, giorno per giorno, si ritorna a dei ritmi di vita "normale". E' comunque un periodo ancora delicato, occorre comunicare tempestivamente al Centro di Trapianto qualsiasi problema o novità, in particolare sintomi a carico dell’apparato respiratorio (tosse, difficoltà a respirare), gastroenterico (nausea, vomito, diarrea, perdita di peso). In questa fase i controlli presso il D.H. saranno prevalentemente rivolti ad escludere recidive della malattia di base e a controllare l’eventuale GvHD. Dopo un anno dal trapianto solo una piccola minoranza ha ancora problemi legati al trapianto stesso. Tali problematiche sono legate prevalentemente alla GvHD o alla insorgenza di un’altra complicazione del trapianto detta “osteonecrosi”. 45 DOPO LA SOSPENSIONE DELLE TERAPIE IMMUNOSOPPRESSIVE (circa 1-2 anni dopo il trapianto) Periodo del “fuori terapia” Periodo dei controlli a frequenza semestrale o annuale presso la sala numero 5 del D.H. Periodo delle vaccinazioni Periodo del monitoraggio degli eventuali effetti tardivi del trapianto. La durata dell’immunosoppressione può variare notevolmente in rapporto alla presenza o meno di GVHD cronica, alla malattia di base e al tipo di trapianto. Dalla fine della terapia immunosoppressiva i controlli presso il nostro D.H. avranno una cadenza semestrale o annuale e saranno orientati al monitoraggio dei possibili effetti tardivi. Gli effetti tardivi sono le conseguenze del tipo di terapia eseguita prima del trapianto, del regime di condizionamento e della presenza o meno di GvHD cronica. In questa fase i controlli vengono effettuati presso la sala N° 5 del D.H. dove il personale medico opera congiuntamente ad una rete di consulenti preparati ad affrontare queste problematiche. 46 DOMANDE COMUNI E RISPOSTE QUANTO DURA UN TRAPIANTO? Il trapianto vero e proprio può durare da pochi minuti a poche ore poiché consiste semplicemente nell'infondere endovena le CSE del donatore. Tuttavia la fase di ripresa può durare molti mesi e talvolta anche anni. Quindi, dovete avere la consapevolezza che probabilmente passerà un anno o più prima di tornare a una vita normale. Naturalmente ciò non vuol dire che dovrete stare un anno in ospedale. Il periodo di ricovero consiste in circa 7-10 giorni nella fase pre-trapianto e 30-40 giorni nella fase post-trapianto. Dopo la dimissione, 2 mesi circa verranno trascorsi presso una residenza protetta situata in vicinanza del Centro Trapianti. Tra i 3 e i 4 mesi dopo il trapianto potrà avvenire il ritorno a casa con controlli presso il Centro Trapianti ogni 1-3 mesi, a seconda delle necessità. Dopo un anno se tutto è a posto le visite diventeranno meno frequenti (ogni 4-6 mesi). Dopo due o tre anni le visite diventeranno annuali e avranno lo scopo di valutare l'eventuale insorgenza di effetti collaterali tardivi. CHE COS'È IL RIGETTO? 48 Dopo l’ infusione, le CSE raggiungono il midollo osseo, si impiantano e cominciano a differenziarsi. A questo punto, nel sangue periferico lentamente aumentano prima i globuli bianchi (giorno 10-30 post-trapianto), poi le piastrine e i globuli rossi (giorno 30-100 post-trapianto). Tutto questo processo viene chiamato “attecchimento”. Se per un qualsiasi motivo le CSE non riescono a raggiungere il midollo oppure lo raggiungono ma non riescono a differenziarsi (magari dopo un iniziale periodo di normale differenziazione) si parla di rigetto. Generalmente è causato da una insufficiente ablazione del sistema immunitario del ricevente durante la terapia di condizionamento. Va tenuto a mente che il rigetto di un trapianto di CSE è una complicanza piuttosto rara, al contrario di quanto avviene nei trapianti d’organo. Una problematica relativamente più frequente è invece rappresentata dallo “scarso attecchimento” che può essere dovuto all’infusione di una quantità insufficiente di CSE oppure è causato dall’’interferenza di qualche evento esterno in fase di attecchimento. Se ciò si verifica, in alcuni casi, è possibile eseguire un “rinforzo” del trapianto con una nuova donazione da parte dello stesso donatore, senza necessità di ulteriori terapie di condizionamento. COS'È LA GVHD? Rispetto alla precedente problematica (rigetto) è molto più frequente il fenomeno opposto, detto “malattia del trapianto verso ospite” o GvHD (Graft = trapianto; versus = verso; Host = ospite; Disease = malattia) che mediamente si sviluppa nella metà dei pazienti trapiantati. In termini molto semplici la GvHD può essere definita la reazione provocata dal sistema immunitario del donatore, originato dalla cellula staminali emopoietica, che non riconosce gli organi e tessuti del ricevente come propri e pertanto li aggredisce (“trapianto contro l'ospite”). La GvHD può essere di gravità variabile e pertanto si va da forme lievi che potrebbero non richiedere terapia fino a forme gravi letali malgrado tutte le terapie instaurate. Al momento, a parità di compatibilità tra donatore e ricevente, non esistono elementi laboratoristici che permettano di prevedere l’insorgenza o la gravità di una GvHD. Strettamente legata alla GvHD è la cosiddetta GvL (graft versus leucemia) e GvT (graft versus tumor) che può teoricamente essere utile ai fini di una eradicazione definitiva delle cellule leucemiche/tumorali. COS’È IL TRAPIANTO AUTOLOGO DI CSE? A differenza del trapianto di CSE allogeniche, argomento di questo opuscolo, il trapianto autologo è una procedura molto più semplice e impropriamente chiamata “trapianto”. Infatti non esistono problemi di compatibilità tra donatore e ricevente poiché è sempre la stessa persona. Tale procedura rappresenta una sorta di artificio per poter eseguire al paziente una terapia antiblastica sovramassimale, cioè non limitata dai problemi di tossicità midollare. Le CSE vengono prelevate al paziente (dal sangue periferico o dal midollo), conservate e infine reinfuse al momento del cosiddetto trapianto autologo. 49 CI POSSONO ESSERE CONSEGUENZE A DISTANZA DOVUTE AL TRAPIANTO? I pazienti che hanno subito un trapianto di midollo possono presentare effetti tardivi in relazione a tipo di terapia eseguita prima del trapianto, tipo di condizionamento e presenza o meno di GvHD cronica. I condizionamenti che utilizzano la radioterapia con irradiazione corporea totale (TBI) e il busulfano sono responsabili dei principali effetti tardivi post-trapianto. Nel 70-80% dei pazienti irradiati compare una opacità posteriore del cristallino (cataratta) che nella maggior parte dei casi è asintomatica e che, solo raramente, necessita di correzione chirurgica; tale complicanza è più frequente nei pazienti che ricevono terapia steroidea prolungata per il trattamento della GvHD. L’insufficienza gonadica si presenta molto frequentemente sia dopo TBI che dopo utilizzo di busulfano, mentre è molto rara dopo altra chemioterapia. Tale complicanza determina nella femmina necessità di terapia sostitutiva estroprogestinica, mentre la sterilità è più frequente se la radioterapia viene erogata in età più avanzata. Nel maschio la necessità di terapia ormonale sostitutiva con testosterone è rara e compare prevalentemente in pazienti trattati con radioterapia testicolare e/o un intervento chirurgico; sia TBI che busulfano, nel maschio, sono frequentemente responsabili di azoospermia. La funzionalità tiroidea può subire alterazioni sia in senso di ipofunzione (ipotiroidismo) ma anche iperfunzione (ipertiroidismo) che necessitano di terapie farmacologiche. Frequentemente, i pazienti irradiati presentano noduli tiroidei che possono necessitare di agobiopsia diagnostica. QUANTO COSTA IL TRAPIANTO? Il trapianto viene eseguito nell'ambito del Servizio Sanitario Nazionale (SSN), e quindi, i soggetti aventi diritto all’assistenza sanitaria sul territorio nazionale, non devono sopportare alcuna spesa diretta per le cure e la degenza. Vi sono tuttavia delle spese che la famiglia deve sostenere per il trasferimento presso il Centro Trapianti e per l'alloggio nelle sue vicinanze nel periodo pre e post-trapianto. Nel caso di famiglie non in grado di affrontare il costo di un alloggio possono essere interpellate le assistenti sanitarie per verificare possibili soluzioni. 50 NOTE NOTE 52 Vocabolario Aferesi: raccolta tramite separazione di una componente cellulare del sangue (piastrino-aferesi, linfo-aferesi, eritreo-aferesi, leuco-aferesi, etc). Alopecia: perdita temporanea dei capelli. Antiemetico: farmaco o combinazione di farmaci utilizzati per controllare la nausea e il vomito. Antigene: qualsiasi elemento capace di provocare una risposta da parte del sistema immunitario. Tale risposta consiste in una produzione di anticorpi o particolari popolazioni di globuli bianchi. Attecchimento: momento in cui le cellule infuse durante il trapianto iniziano a produrre nuove cellule del sangue. Azoospermia: mancata produzione di spermatozoi da parte del testicolo. Catetere venoso centrale (CVC): si tratta di un piccolo tubo di plastica morbida inserito in una grossa vena in modo che la sua estremità raggiunga il cuore. Attraverso di esso possono essere somministrate le terapie ed effettuati i prelievi senza necessità di multiple punture venose. Per il trapianto allogenico viene utilizzato un CVC con due lumi. CD34: è il marcatore che permette di riconoscere la cellula staminali emopoietica. Chemioterapia: farmaco o combinazione di farmaci usato per uccidere le cellule cancerose. Condizionamento: terapia che ha lo scopo di preparate il paziente a ricevere le cellule staminali emopoietiche del donatore. Consenso informato al trapianto: rappresenta la vostra formale autorizzazione al Centro Trapianti a procedere con il trapianto di cellule staminali. 54 Criopreservazione: processo attraverso il quale un prodotto biologico (cellule, embrioni, etc) viene congelato per poterlo utilizzare in un momento successivo. CSE (cellula staminale emopoietica): può essere di origine midollare, periferica, cordonale. Emopoiesi: produzione delle cellule del sangue (globuli bianchi polimorfonucleati, globuli rossi, piastrine). Avviene nel midollo osseo. Eritrociti: globuli rossi. Espianto di midollo: sistema con il quale vengono raccolte le CSE midollari di un donatore. Consiste in multipli prelievi dalle ossa del bacino. Fattore di crescita leucocitario: sostanza che viene somministrata al donatore di cellule staminali con lo scopo di mobilizzarle dal midollo al sangue periferico e successivamente raccoglierle tramite procedura di aferesi. Qualche volta viene somministrata dopo trapianto per accelerare la crescita numerica dei globuli bianchi neutrofili. GvHD (Graft versus Host Disease): effetto collaterale del trapianto che si manifesta quando le cellule del donatore (Graft) attaccano il corpo del ricevente (Host). GVL e GVT (Graft versus Leucemia/ Graft versus Tumor): fenomeno con il quale si ipotizza che il sistema immunitario del donatore, una volta trasferito in un ricevente, riesca a controllare la crescita leucemica/tumorale. HLA (Human Leucocyte Antigen): rappresenta un marcatore genetico presente sui leucociti e su tutti le altre cellule del corpo. Si utilizza per determinare la compatibilità tissutale tra donatore e ricevente. HPC-Apheresis: Hematopoietic Progenitor Cells – Apheresis (Cellule Staminali Emopoietiche raccolte tramite aferesi dal sangue periferico) 55 HPC-BM: Hematopoietic Progenitor Cells – Bone Marrow (Cellule Staminali Emopoietiche raccolte tramite espianto dal Midollo Osseo) HPC-CB: Hematopoietic Progenitor Cells – Cord Blood (Cellule Staminali Emopoietiche raccolte da sangue cordonale) Insufficienza gonadica: insufficiente produzione di ormoni sessuali (estrogeni e progesterone nella femmina; testosterone nel maschio) Intravenoso: attraverso una vena. Ischemia: insufficiente arrivo di sangue in un organo o tessuto. Leucociti: sono i globuli bianchi del sangue. Linfo-foto-aferesi: procedura utilizzata per il trattamento della GvHD. Viene eseguita al Centro trasfusionale utilizzando il separatore cellulare. Microangiopatia: danno della parete dei piccoli basi su base tossica e/o immunoallergica. Può manifestarti con svariati sintomi tra cui quelli della sindrome emolitico-uremica e la PTT. Midollo osseo: tessuto spugnoso che si trova nelle cavità delle ossa. La sua funzione è la produzione globuli bianchi, globuli rossi, piastrine. MUD (Matched Unrelated Donor): è un altro modo di definire il trapianto da donatore non consanguineo HLA compatibile. Neutropenia: assenza di polimorfonucleati neutrofili (popolazione di globuli bianchi prodotti dal midollo). NPT (nutrizione parenterale totale): nutrizione mediante infusione endovenosa diretta di tutti i nutrienti necessari. Osteonecrosi: possibile complicanza del trapianto rappresentata dalla “morte” di porzioni di osso su base ischemico. 56 PBSC (Peripheral Blood Stem Cells): cellule staminali circolanti nei vasi sanguigni. Normalmente sono poche ma aumentano moltissimo dopo procedura “di mobilizzazione”. PTT (porpora trombotica trombocitopenica): piastrinopenia secondaria a una complicanza del trapianto detta microangiopatia. Separatore cellulare: strumento, usato per le aferesi, che separa la frazione di cellule staminali emopoietiche rispetto alle altre cellule del sangue in modo tale che le cellule staminali possano essere usate per trapianto. Lo stesso apparecchio viene utilizzato per la linfoaferesi. Sindrome emolitico-uremica: patologia nella quale si associano sintomi di emolisi (rottura dei globuli rossi) con quelli di una insufficienza renale. Sistema immunitario: con tale termine si intendono le componenti più specializzate delle difese dell’organismo. E’ rappresentato principalmente dai linfociti, a loro volta distinti nelle 3 principali categorie (T, B e NK). TBI (Total Body Irradiation): irradiazione somministrata sull’intero corpo. T-deplezione: rimozione dei linfociti T dal prodotto trapiantato. Può essere effettuata tramite manipolazione del prodotto prima dell’infusione oppure “in vivo” somministrando specifici farmaci prima e dopo l’infusione. Trapianto allogenico: trapianto in cui vengono utilizzate cellule staminali emopoietiche prelevare a un donatore. Trapianto autologo: trapianto in cui vengono utilizzate cellule staminali emopoietiche dello stesso soggetto. Tubo digerente: rappresentato dall’apparato digerente che include la bocca, l’esofago, lo stomaco e l’intestino. E’ sede di mucosite ed inoltre è un organo bersaglio della GvHD 57
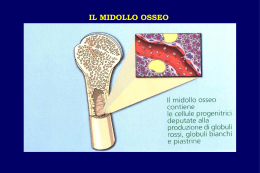
Scarica