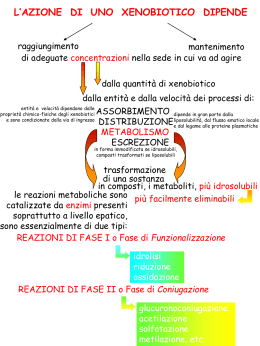
XENOBIOTICI Composti estranei all’organismo Contaminanti ambientali assorbiti attraverso la pelle, i polmoni o introdotti con l’alimentazione Prodotti chimici industriali (pesticidi, inquinanti) Prodotti di pirolisi della cottura dei cibi Alcaloidi (sostanze azotate prodotte nelle piante a partire da aminoacidi aromatici) metaboliti secondari delle piante Tossine prodotte da funghi, piante, animali Farmaci Gli xenobiotici sono spesso SOSTANZE LIPOFILICHE BIOTRASFORMAZIONE degli XENOBIOTICI ASSORBIMENTO METABOLISMO Fase I Xenobiotico Xenobiotico Metabolita con attività diversa Metabolita inattivo Xenobiotico Lipofilico Fase II Coniugato Coniugato Coniugato E L I M I N A Z I O N E Idrofilico Enzimi del metabolismo degli xenobiotici Tipi di reazioni Enzima Fase I Ossidazione Citocromo P450 Alcol deidrogenasi Aldeide deidrogenasi Monossigenasi flaviniche Monoaminossidasi Riduzione Chinone reduttasi (DT diaforasi) Citocromo P450 reduttasi Idrolisi Epossido idrolasi Fase II Coniugazione UDP glucuronil transferasi Solfotransferasi N-acetil transferasi Metiltransferasi Coniugazione con amminoacidi Glutatione transferasi CITOCROMO P450 (emoproteina) Cys SH Protoporfirina: anello tetrapirrolico Protoporfirina IX + Fe = Eme Il Cyt P450 assorbe a 450 nm quando il Ferro è nello stato ridotto (Fe2+) e legato al CO (monossido di carbonio) Caratteristiche spettroscopiche del citocromo P450 Localizzazione intracellulare Il citocromo P450 degli eucarioti è ancorato alle membrane microsomiale e mitocondriale Gli enzimi P450 predisposti al metabolismo degli xenobiotici si trovano soprattutto nel reticolo endoplasmatico del fegato Il citocromo P450 microsomiale è legato alla membrana del reticolo endoplasmatico tramite la regione N-terminale idrofobica che forma un’elica transmembrana. Reazione catalizzata dal P450 Il citocromo P450 è una ossidasi a funzione mista (monossigenasi) XH + O2 + NAD(P)H + H+ XOH + NAD(P)+ + H2O X = Substrato SUBSTRATI DEL CITOCROMO P450 Xenobiotici Farmaci, inclusi antibiotici Carcinogeni Antiossidanti Solventi Anestetici Coloranti Pesticidi Derivanti del petrolio Alcol Odori Composti di origine fisiologica Colesterolo, Steroidi Eicosanoidi (leucotrieni, prostaglandine) Acidi grassi Idroperossidi dei lipidi Retinoidi (vitamina A) Acetone Sistema di trasporto degli elettroni del citocromo P450 • Uno dei problemi: il ferro-eme del gruppo prostetico può accettare un elettrone alla volta mentre l’NADPH trasferisce generalmente due elettroni • Per cui è necessaria una proteina che prende due elettroni dall’NADPH e ne trasferisce uno al citocromo P450 • Questa funzione è svolta da una flavoproteina NADPH-dipendente • Il sistema di trasporto degli elettroni dall’ NADPH al citocromo P450 si trova associato con le membrane mitocondriali o del reticolo endoplasmatico Sistema di trasporto microsomiale del citocromo P450 • Nel reticolo endoplasmatico l’NADPH dona gli elettroni ad una flavoproteina denominata NADPH-citocromo P450 reduttasi • Peso molecolare di 78 kDa • Contiene sia il FAD che l’FMN come gruppi prostetici • N-terminale contiene numerosi residui idrofobici ed è la parte associata alla membrana 1. Il FAD prende elettroni dall’NADPH 2. L’FMN li dona al ferro 3. Gli elettroni possono derivare dal citocromo b5 4. Il citocromo b5 è ridotto: - NADPH-citocromo P450 red - NADH-citocromo b5 red Sistema di trasporto microsomiale del citocromo P450 Citocromo P450 reduttasi Sistema di trasporto microsomiale del citocromo P450 S SOH Non si conosce la ragione dell’esistenza delle due vie H2 O2 O2. S. Xenobiotici metabolizzati dal citocromo P450 Reazione Esempi Ossidrilazione comp. alifatici Ossidrilazione comp. aromatici Formazione di epossidi Dealchilazioni ossidative Deaminazione ossidativa Ossidazione di N o S o P Rimozione di alogeni Ossidazione di alcoli Acido valproico, pentobarbital Benzopirene, fenobarbital Benzene, benzopirene Fenacetina, morfina, caffeina Anfetamina Cloropromazina, paracetamolo Alotano Alcol etilico Riduzione (bassa [O2]) Alotano, CCl4 Ossidrilazione composti alifatici Pentobarbital EPOSSIDAZIONE Fenobarbital (sedativo, analgesico) cancerogeno Reazioni di dealchilazione Dealchilazione dell’atomo di ossigeno Deacetilazione dell’atomo di azoto HCHO Deacetilazione dell’atomo di zolfo HCHO Dealchilazione sull’atomo di azoto REAZIONI DI OSSIDAZIONE Dealogenazione riduttiva del CCl4 (tetracloruro di carbonio) Solvente organico CYP… 10-15% nel fegato 5% 9% SUPERFAMIGLIA Circa 150 geni Cyp 3A4 metabolizza circa il 60% dei farmaci 30% Farmacogenetica: basi ereditarie delle differenze tra gli individui nell’azione dei farmaci Fenotipi del CYP2D6 “polimorfismo per la debrisochina” Metabolizzatori Lenti (PM): incapacità di utilizzare la via del CYP2D6 Metabolizzatori Intermedi (IM): capacità fortemente diminuita Metabolizzatori Normali (EM): capacità normale Metabolizzatori Ultrarapidi (UM): capacità eccessiva Polimorfismo del CYP2D6 nella popolazione caucasica Attività Allele con funzionalità normale Mutante nullo Allele con funzionalità scarsa Polimorfismo del CYP2D6 nella popolazione caucasica Concentrazione nel siero Allele con funzionalità normale Mutante nullo Allele con funzionalità scarsa Induttori del P450: appartengono a 5 classi, con diverso meccanismo d’azione • 3-metilcolantrene, benzopirene, diossina, fumo, alimenti cotti a carbone, crocifere CYP1A1, CYP1A2 • Fenobarbital, DTT CYP2B1, CYP2B2 • Isoniazide, etanolo CYP2E1 • Steroidi, antibiotici CYP3A1, CYP3A2 • Clofibrato, plastificanti CYP4A1, CYP 4A2, CYP4A3 Modalità di regolazione dell’espressione dei citocromi P450 IDENTIFICAZIONE DELLA REGIONE REGOLATRICE DEL GENE DI UN P450 INIBITORI DEL CITOCROMO P450 Inibitori competitivi SKF 525 A sostanze contenenti imidazolo Substrati suicidi trioleandomicina (antibiotico macrolide) cloramfenicolo Si trasforma in un prodotto che si lega al ferro Si trasforma in un prodotto che alchila la proteina e la inattiva Piante di patata transgeniche per CYP1A1(dai mammiferi) diventano resistenti all’erbicida clorotorulon (CT) Enzimi del metabolismo degli xenobiotici Tipi di reazioni Enzima Fase I Ossidazione Citocromo P450 Alcol deidrogenasi Aldeide deidrogenasi Monossigenasi flaviniche Monoaminossidasi Riduzione Idrolisi Fase II Coniugazione Chinone reduttasi (NQO1 o DT diaforasi) Citocromo P450 reduttasi Epossido idrolasi UDP glucuronil transferasi Solfotransferasi N-acetil transferasi Metiltransferasi Coniugazione con amminoacidi Glutatione transferasi Metabolismo dell’etanolo tossica energia Alcol deidrogenasi Aldeide deidrogenasi Alcol deidrogenasi: enzima dimerico, citosolico, contenente Zn 5 geni (α, β, γ, π, κ). β ha 3 alleli, γ 2 alleli Quindi 8 subunità diverse che si combinano a formare isoenzimi con diversa efficienza catalitica. La subunità β è molto attiva. Gli isoenzimi presenti nelle popolazioni asiatiche sono molto efficienti. Aldeide deidrogenasi (16 geni, famiglia di proteine): Allele di classe 2: basso metabolismo delle aldeide, fattore di rischio per il cancro indotto da alcol Nelle popolazioni orientali: intolleranza all’alcol (vasodilatazione, “flushing syndrome”). FMO (MONOSSIGENASI FLAVINICHE) : Ossidazione a livello di eteroatomi nucleofili: S, P, N FMO: MONOSSIGENASI FLAVINICHE DEL RETICOLO ENDOPLASMATICO Monoamminossidasi (MAO A e B) (flavoproteina mitocondriale) Trasformazione di una ammina in una aldeide (substrati fisiologici: serotonina, adrenalina, noradrenalina) RCH2NH2 + FAD RCH=NH + FADH2 RCH=NH + H2O RCHO + NH3 FADH2 + O2 FAD + H2O2 L’atomo di ossigeno incorporato nel substrato proviene dall’ H2O, ed i 2 elettroni sottratti al substrato vengono ceduti all’O2 formando H2O2 Reazione catalizzata dalla monoamminossidasi (MAO): 1-metil-4-fenil-1,2,5,6-tetraidropiridina (MPTP) DT-diaforasi o NAD(P)H:chinone ossidoreduttasi 1 (NQO1) Enzima citosolico Omodimero (27 kDa per subunità) Flavoproteina (FAD) Catalizza la riduzione bielettronica di substrati di natura chinonica, in un singolo passaggio • Spesso i suoi livelli sono più alti nelle cellule tumorali (resistenza ai farmaci antitumorali) Farmaci antitumorali che vengono attivati dalla NQO1 O2 e- e- O2- H2O2 e- OH. e- H2O Autossidazione dell’ossiemoglobina NADPH ossidasi dei leucociti Catena di trasporto degli elettroni •mitocondri ( nei siti dell’ubichinone e della NADH-deridrogenasi ) •microsomi ( citocromo P450 e citocromo P450 riduttasi ) Enzimi citosolici: es. xantina ossidasi, aldeide ossidasi Dismutazione dell’O2- spontanea o enzimatica ( superossido dismutasi ) Ossidasi perossisomiali: es. aminoacido ossidasi, urato ossidasi Amino ossidasi ( diamino ossidasi, lisil ossidasi, monoamino ossidasi ) Reazioni tipo Fenton catalizzate da metalli: Men + O2 O2 H2O2 Men-1 OH- + HO. + Men Ossidasi Citocromo c ossidasi; ceruloplasmina plasmatica Me = rame o ferro Prodotti di degradazione dei lipidi perossidati Ossidazione delle proteine: carbonilazione di residui amminoacidici CONHR1 O CONHR1 N NH COR2 COR2 -prolil- Semialdeide glutamica NH2 NH NH CONHR1 R2CONH -arginil- NH2 O NH CONHR2 CONHR1 R2CONH COR2 -lisil- Semialdeide aminoadipica
Scaricare