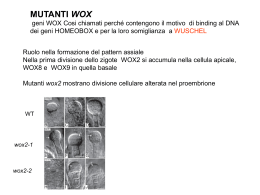
Le funzioni dei geni STM e WUS sono interconnesse a vie di signaling ormonali CITOCHININE GIBBERELLINE Diversi studi indicano che esiste una correlazione positiva tra l’espressione/funzione dei geni KNOX e le CITOCHININE (CK) CK promuovono la divisione cellulare e la morfogenesi Piante overesprimenti KNOX hanno elevati livelli di CK Piante con elevati livelli di CK overesprimono geni KNOX e una correlazione negativa con le GIBBERELLINE (GA) Le GA promuovono l’espansione cellulare e la crescita degli organi, incompatibile con il mantenimento dell’omeostasi meristematica STM reprime la sintesi di gibberelline nel SAM Wt GA spy-1 35S::AtCKX3 spy-1,35S::AtCKX3 CK inibiscono la crescita del meristema spy-1,35S::AtCKX3 spindly: attivazione costitutiva GA signaling mutanti spindly con ridotti livelli di CK (35S::AtCKX3) hanno bassa attività meristematica spy-1 Spy-1,35S::AtCKX3 crescita determinata del meristema della infiorescenza wt spy-1 spy-1;AtCKX3 Piante transgeniche di arabidopsis overesprimenti GR::STM (promotore inducibile) GR= promotore del recettore dei glucocorticoidi DEX= dexametasone RTPCR 10gg 1mM DEX STM nell’apice induce la sintesi di geni della biosintesi delle CK (IPT7) e la sintesi di geni di della via di signaling (ARR5) Piante transgeniche di arabidopsis overesprimenti STM (GR::STM) RTPCR STM nell’apice induce l’espressione di geni (GA2 ossidasi) che inattivano le GA (da studi di espressione di GA2 ossidasi in mutanti wol: effetto non diretto ma mediato da CK ) In tabacco dimostrato che geni KNOX (STM) agiscono come repressori trascrizionali del gene della GA20 ossidasi La GA20 ossidasi è un enzima necessario alla di GA attive Biosintesi delle Gibberelline (dalla GA12- aldeide) GA20 ox Via di Biosintesi delle GA STM nel SAM attiva la biosintesi delle CK e reprime sintesi della GA20ox e quindi la biosintesi delle GA e promuove l’attività meristematica. CK attivano l’espressione di GA2ox stimolando l’inattivazione delle GA. Il risultato è che le GA attive vengono confinate nelle foglie cotiledonari GA2ox controls GA movement into the shoot meristem OsGA2ox1 mRNA GA4 Before the transition to flowering, OsGA2ox1 is expressed just below the shoot meristem, selectively excluding GA1 and GA4. GA5 It has been shown in Lolium that GA5 (which is resistant to deactivation by GA2ox) can move into the meristem despite GA2ox activity. Sakamoto, T., Kobayashi, M., Itoh, H., Tagiri, A., Kayano, T., Tanaka, H., Iwahori, S., and Matsuoka, M. (2001). Expression of a gibberellin 2-oxidase gene around the shoot apex is related to phase transition in rice. Plant Physiol. 125: 1508-1516. FUNZIONE DEL GENE WUSCHEL Piante di arabidopsis overesprimenti WUS con promotore inducibile da etanolo Espressione ectopica di AG::GUS In risposta all’induzione di WUS (AGAMOUS= bersaglio di wuschel) Microarray STM WUS Alc::GUS Alc::CLV3 ARR5 ARR6 ARR7 ARR15 t RT-PCR RT PCR WUSCHEL Reprime la trascrizione dei geni ARR5, ARR6, ARR7 e ARR15 che codificano per regolatori di risposta nel sistema a due componenti attivato dalle citokinine ARR5, ARR6, ARR7, e ARR15 agiscono come regolatori negativi della risposta alle citokinine MECCANISMO DI AZIONE DELLE CK NETWORK REGOLATIVI PER IL MANTENIMENTO DEL SAM SAM NETWORK REGOLATIVO DI WUS STIMPY (STIP/WOX9): necessario per l’aumento delle dimensioni del meristema nel mutante clv3-2 ULTRAPETALA HD-ZIP Regolatori negativi di WUS HANABA TARANU AP2 SPLAYED (SYD) : regolatore diretto di WUS (fattore di rimodellamento della cromatina) INTERAZIONE TRA FATTORI DI TRASCRIZIONE E ORMONI NELL’APICE MERISTEMATICO FORMAZIONE DEL MERISTEMA APICALE DELLA RADICE L'ipofisi, nello stadio globulare tardivo si divide in due cellule, dando una cellula superiore a forma di lente, e una cellula inferiore che va incontro subito ad una divisione longitudinale. La cellula lenticolare si dividerà ulteriormente e formerà la porzione interna del RAM, ovvero le 4 cellule del centro quiescente. Le due cellule inferiori si divideranno sia longitudinalmente sia trasversalmente, formando le iniziali della porzione apicale della cuffia radicale (o columella). Apice radicale di arabidopsis Il segnale di formazione del meristema apicale radicale è generato da alti livelli di IAA nella regione basale del proembrione Elevati livelli di IAA sono causati dal trasporto polare di IAA mediato dalle proteine PIN Espressione geni PIN • Espressi con diversa localizzazione in tempi diversi dello sviluppo dell’embrione; • La sequenza di espressione, regolata temporalmente e spazialmente, è responsabile della variazione della direzione del flusso di IAA durante l’embriogenesi. Trasporto di IAA nella radice Massima concentrazione di IAA nelle iniziali della columella Proteine PIN PIN1 parte basale delle cellule del cilindro vascolare; PIN2 estremità basale delle cellule corticali e all’estremità apicale delle cellule epidermiche e della cuffia laterale; PIN3 espressa, senza polarità apparente, in due file sovrapposte di cellule della columella e nel periciclo; PIN4 localizzazione non polarizzata nelle cellule del centro quiescente e nelle cellule che lo circondano, nonché all’estremità basale nelle cellule provascolari; PIN7 nelle membrane laterali e basali delle cellule provascolari, nella zona di distensione e nelle cellule della columella. CENTRO QUIESCENTE (QC) Nei meristemi del germoglio (SAM) e della radice (RAM) la popolazione di cellule staminali è mantenuta grazie all’attività di un centro organizzatore SAM: centro organizzatore specificato dal gene WUSCHEL RAM: centro quiescente (QC); l’identità di QC è specificata dai geni SHORT ROOT e SCARECROW è richiesta anche l’espressione dei geni PLETHORA1 e PLETHORA2 Codificano per fattori di trascrizione di tipo AP2 Sono espressi inizialmente nella regione basale dell’embrione, poi nel primordio della radice e infine nel centro quiescente CENTRO QUIESCENTE Localizzazione determinata da massimo di concentrazione di auxina Espressione dei geni SHORT ROOT e SCARECROW Espressione dei geni PLETHORA1 e PLETHORA2 SHORT-ROOT (SHR) e SCARECROW (SCR) Le proteine SHR sono prodotte nella stele e traslocano nelle cellule adiacenti Necessarie per la formazione ed il mantenimento delle cellule staminali del CQ. Attivazione espressione SRC Geni PLETHORA (PLT) • Codificano per fattori di trascrizione di tipo AP2; • Richiesti per specificare l’identità delle cellule del QC e per il corretto pattern di divisione delle cellule circostanti; • La loro espressione è controllata da MONOPTEROS; • L’espressione dei geni PLT è modulata e modula l’espressione dei geni PIN. PLETHORA Mutanti plt1 e plt2 hanno alterazioni nel pattern di divisioni cellulari nel QC e nella columella Columella WT: 4 file di cellule la prima di staminali le altre differenziate (accumulo granuli di amido) Columella plt1: ulteriori file di cellule dovute ad aumento di divisioni nello strato 1 QC WT plt1-4 plt2-2 plt1-4 plt2-2 Mutazioni dei geni PLT riducono il numero di cellule meristematiche e la lunghezza della radice La columella contiene più cellule , la struttura a strati è alterata; si accumulano granuli di amido anche negli strati che dovrebbero essere occupati da cellule staminali La crescita della radice è ridotta Il numero delle cellule meristematiche è molto ridotto L’espressione del gene reporter cyclin-GUS (marcatore fase G2/M) è limitata Sviluppo postembrionale Zona meristematica plt1-4 plt2-2 I geni PLT sono espressi nella regione basale dell’embrione nello stadio globulare a 8 cellule sono richiesti per specificare l’identità delle cellule del QC cellula progenitrice del QC Ibridazione in situ PLT1 Espressione di marcatori del centro quiescente nello stadio a cuore (QC25) WT (QC46) plt1-4 plt2-2 WT plt1-4 plt2-2 La funzione PLT è richiesta nello stadio iniziale della determinazione dell’identità del QC e per il corretto pattern di divisione delle cellule circostanti PLT1 e PLT2 agiscono in parallelo con i geni SHORT ROOT/SCARECROW nel pattern di specificazione del centro quiescente SCR e SHR necessari per l’espressione dei marcatori del CQ (QC 25; QC46) I domini di espressione di PLT1 PLT2 e SHR/SCR si stabiliscono in maniera Indipendente wt plt1-4 plt2-2 Espressione di SHR::GFP wt plt1-4 plt2-2 Espressione di SCR::YFP Ibridazione in situ PLT1 wt scr-1 shr-1 3dpg L’espressione dei geni PLT risponde a cambiamenti di distribuzione dell’auxina e dipende dai fattori di risposta all’auxina (ARF) Embrione nello stato di transizione doppio mutante mp-G12 nph4-1 Ibridazione in situ assenza di segnale per PLT1 Necessario doppio mutante per ridondanza proteine ARF L’espressione di PLT è controllata dal gradiente di IAA determinato dalla localizzazione di PIN e da MP; Le proteine SHR sono prodotte nella stele e traslocano nelle cellule adiacenti, dove attivano SRC; Il centro quiescente è specificato nella zona d’intersezione dei domini d’espressione dei geni PLT, SHR e SCR; I pattern d’espressione di SHR, SCR e PLT definiscono le differenti regioni; In presenza dei geni PLT → SHR e SCR sono coinvolti nella specificazione delle cellule staminali; in assenza di PLT → SHR regola il differenziamento delle cellule derivate dalle staminali. MODELLO Le cellule che esprimono PLT SCR e SHR diventano QC QC segnala alle cellule circostanti per mantenere l’identità meristematica Esperimenti di ablazione con laser del centro quiescente alterazione dei flussi auxinici rimodulazione della espressione dei geni PLT (SHR, SCR, PIN) rispecificazione del centro quiescente qc DR5::GFP SHR SCR ablati qc PIN1 PIN2 ablati Ablazione: shift gradiente auxinico; espressione PLT; inibizione espressione PIN; Loc nucleare di SHR; promozione espressione SCR qc Network regolativo nel meristema della radice WOX5 è un omologo di WUSCHEL: contribuisce a mantenere le cellule del CQ in srtato indifferenziato CK nel meristema radicale controllano la velocità di differenziamento delle cellule meristematiche della radice e quindi le dimensioni del meristema Dimensioni del Meristema: N° di 1 fila di cellule del cortex dal QC alla TZ CK esogene riducono il numero di cellule meristematiche senza influenzare Le dimensioni del QC e della Columella quindi senza influire sul loro potenziale meristematico Mutanti biosintetici per le CK o mutanti nella via di signaling hanno meristemi più grandi ahk3 Recettori per le CK (sistema a due componenti Istidina kinasi) AHK4/CREI1/WOL AHK3 AHK2 AHK3 è l’unico espresso in tutti i tessuti della zona di transizione AHK3 ARR1 e ARR12 sono espressi solo nella TZ ARR1 ARR12 MODELLO UN SISTEMA A DUE COMPONENTI DI SIGNALING PER LE CK BASATO SU AHK3/ARR1, AHK3/ARR12 MEDIA IL CONTROLLO DEL NUMERO DELLE CELLULE MERITEMATICHE NELLA ZONA DI TRANSIZIONE LE CK AGISCONO ANTAGONIZZANDO UN SEGNALE DI DIVISIONE CELLULARE (AUXINA) Applicazioni di auxina esogena alla radice incrementano le dimensioni del meristema La riduzione di livelli di CK in tripli mutanti pin non ha effetto sullle dimensioni del meristema CK attivano SHY2 che media la repressione dell’espressione delle proteine PIN IAA media la degradazione tramite proteosoma di SHY2 IAA è il segnale per la divisione cellulare meristematica nella radice SHY2 è una proteina AUXIAA Controlla la biosintesi delle CK Attraverso la IPT5 Gli effetti antagonistici tra IAA e CK Sono spiegati in base al conrollo negativo da parte di CK sulla distribuzione PIN-dipendente di IAA RBR: PROTEINA DEL RETINOBLASTOMA (antagonizza nei mammiferi la funzione meristematica) Mutanti di arabidopsis rbr loss of function mostrano divisioni cellulari in più e ritardo del differenziamento della radice L’overespressione di RBR causa differenziamento precoce RBR proteina regolativa per il differenziamento nella radice Non sono alterati i pattern di espressione di PLT, SCR, SHR RBR agisce a valle di SCR/SHR; PLT mutanti scr hanno livelli più alti di RBR SAM/RAM Le CK promuovono il mantenimento del meristema del germoglio ma hanno la funzione opposta nel meristema radicale dove stimolano il differenziamento nella zona di transizione L’auxina è necessaria per la formazione del meristema radicale ma nel meristema del germoglio promuove l’organogenesi Sia nel germoglio che nella radice il mantenimento del meristema dipende dal bilancio tra CK e auxina ma le risposte sono diverse nei due meristemi Quali funzioni cellulari sono controllate dai due ormoni nei meristemi del germoglio e della radice? DIFFERENZIAMENTO DI CELLULE EPIDERMICHE NELLA RADICE Le cellule epidermiche confinanti con lo spazio tra due corticali diventano TRICOBLASTI SE UN TRICOBLASTO VIENE RIMOSSO (ablazione laser) L’ A TRICOBLASTO VICINO PRENDE IL SUO POSTO ( e viceversa) IL DIFFERENZIAMENTO E’ DIRETTO DALLA INFORMAZIONE POSIZIONALE Mediante l’analisi di mutanti identificati geni regolatori per il differenziamento DEI TRICOBLASTI WEREWOLF (WER) (myb) regolatore negativo dell’identità tricoblastica CAPRICE (CPC) (myb) CPC regolatore negativo dell’identità atricoblastica TTG1: TRANSPARENT TESTA GLABA1 GL3 : GLABRA3 (2) (1) EGL3: ENHANCER OF GLABRA3 SCM: SCRAMBLED CAPRICE: CPC Modello regolativo per il differenziamento dei tricoblasti nella radice LRR-RLK CPC è espresso nelle cellule N nonostante il suo effetto inibitorio sul differenziamento azione non-cell-autonomous del gene CPC WER Gl2 (+) CPC Gl2 (-) ATRICOBLASTO TRICOBLASTO
Scarica