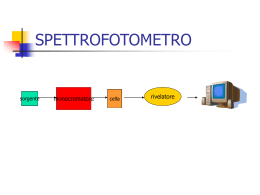
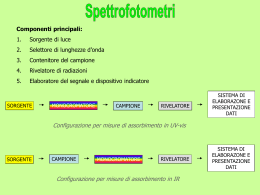
LA SPETTROSCOPIA NELL ’ULTRAVIOLETTO LA TECNICA SPETTROSCOPICA CONSENTE AI CHIMICI DI CONOSCERE IL MONDO MICROSCOPICO Le tecniche spettroscopiche sono basate sullo scambio di energia che si verifica fra l’energia radiante e la materia. Lo Spettrofotometro misura, sotto forma di spettro, l’ASSORBANZA della sostanza in funzione della lunghezza d’onda. In particolare, la SPETTROFOTOMETRIA di ASSORBIMENTO è interessata ai fenomeni di assorbimento delle radiazioni luminose della regione dello spettro elettromagnetico appartenenti al campo del visibile (350 – 700 nm) e del vicino ultravioletto (200 – 350 nm). Viene interessato anche l’UV lontano (10 – 200 nm), anche se in questo caso si opera sotto vuoto o in atmosfera di gas inerte, perché l’ossigeno atmosferico copre i segnali delle altre sostanze. L’assorbimento di questi tipi di radiazioni da parte delle molecole è in grado di produrre delle transizioni energetiche degli elettroni esterni della molecole, sia impegnati che non impegnati in un legame. SPETTROFOTOMETRI Per quanto riguarda gli spettrofotometri usati nell’ UV VISIBILE, i più comuni sono il “monoraggio” e il “doppio raggio”: lo SPETTROFOTOMETRO monoraggio si usa per l’analisi quantitativa, ma è più sensibile alla temperatura, alla luce ed alla stessa misurazione del bianco che deve essere ripetuta per ogni misurazione; mentre lo SPETTROFOTOMETRO a doppio raggio è più complesso e costoso, ma consente una grande precisione e praticità anche nelle analisi quantitative, poiché registra il bianco una sola volta e poi continua in automatico. Uno spettrofotometro è composto da: 1) SORGENTE di radiazione (lampade al Tungsteno o al deuterio) 2) SELETTORE di lunghezze d’onda o MONOCROMATORE 3) un PORTACUVETTE dove vengono inserite le CELLE 4) dei FORI che selezionano le radiazioni che vanno colpire la cuvetta in quarzo 5) LETTORE RIVELATORE, RIELABORAZIONE E PRESENTAZIONE DEI DATI E’ un dispositivo capace di produrre un segnale elettrico che dipende dall'energia delle radiazioni ricevuta. Tale segnale elettrico (proporzionale all'intensità luminosa) viene poi trasferito a un indicatore Analogico. Tramite un convertitore analogico digitale e possibile così ottenere i risultati dell’analisi direttamente su un personal computer che ne elabora i dati. Il segnale proveniente dal rivelatore viene opportunamente amplificato e un amperometro ne rileva l’intensità. Il lettore converte quindi il segnale elettrico in un valore numerico proporzionale all’intensità del segnale, e questo valore va da 0 a 100. Ponendo pari a 100 il valore del segnale in assenza del campione, otteniamo la trasmittanza e da questa l’assorbanza. SORGENTE È la parte dell’apparecchio da cui prende origine la radiazione policromatica (contenenti cioè tutte le lunghezze d'onda del campo richiesto) che viene diretta sul campione. Negli strumenti che misurano la luce visibile e l’ultravioletta, sono presenti due diverse lampade, in modo che la sorgente copra l’intervallo da 190 – 800 nm: -per la regione del visibile si utilizzano lampade a incandescenza a filamento di tungsteno, lampade quarzo-iodio o lampade tungstenoalogeno) -per la regione UV si usano lampade a scarica in un gas (deuterio o a idrogeno); sono costituite da un'ampolla di quarzo contenente il gas rarefatto (ma non troppo) nella quale viene attivata, tra due elettrodi, una scarica elettrica con la conseguente emissione di radiazioni con spettro continuo. Gli SPETTROFOTOMETRI UV-VISIBILE avranno quindi al loro interno queste due lampade, che vengono opportunamente intercambiate dal meccanismo interno. Il valore di “cambio – lampada” è in genere intorno a 350 nm. uso delle LAMPADE Ci sono due LAMPADE: - al Tungsteno - e al Deuterio (che è l’isotopo dell’idrogeno (H) quest’ultima è molto più costosa. Le radiazioni passano attraverso dei fori, poi vengono selezionate e vanno a colpire le cuvette. MONOCROMATORE Il monocromatore è il sistema ottico usato per disperdere la luce policromatica in bande monocromatiche, che vengono inviate in successione sul campione. Essi sono basati su un ELEMENTO DISPERDENTE (prisma o reticolo), che separa le varie componenti della radiazione e permette la successiva selezione della banda desiderata. Consiste nel far incidere il fascio policromatico su un oggetto (un prisma o un reticolo) in grado di deviare le diverse radiazioni con diversi angoli: la radiazione uscente sarà quella che passa attraverso la fenditura di uscita. In questo SPETTROFOTOMETRO non si vede il monocromatore poiché è interno CELLA Le pareti della cuvetta devono essere trasparenti per consentire il passaggio della luce che viene fatta passare attraverso le pareti lisce. In questa cuvetta viene inserito il campione (in soluzione) da esaminare. Poiché il vetro non è trasparente alla radiazione ultravioletta (UV), per quest’ultima si usa la cuvetta al quarzo. ♦ in UV si utilizzano celle in quarzo (SiO2) ♦ nel VISIBILE in vetro o quarzo o alcuni materiali plastici. ♦ in IR si rendono necessarie celle in NaCl, KBr, CaF2..... ESAMINIAMO LO SPETTROFOTOMETRO A DOPPIO RAGGIO Dobbiamo misurare l’assorbanza del soluto e del solvente. Ci sono due cuvette: in una si mette il campione; nell’altra si mette il solvente. Dobbiamo fare: l’AZZERAMENTO (o BIANCO) per misurare l’assorbanza. PORTACUVETTE dove inserire il campione Il MONOCROMATORE in questo caso non si vede perché si trova all’interno. Per fare l’AZZERAMENTO, dobbiamo misurare l’Assorbanza del solvente, per cui l’assorbanza dovrà essere zero. n.b. A = εℓc (legge di Lambert e Beer) I0 /It =1 log1 = 0 Per leggere il BIANCO si mette nella cuvetta solo il solvente (in questo caso usiamo l’Alcool Metilico) TRASMITTANZA Il rapporto tra la luce trasmessa e quella incidente, si definisce TRASMITTANZA T: ♦ %T =100 → non vi è stato alcun assorbimento da parte della sostanza ♦ %T = 0 → significa che il raggio è stato completate assorbito. ASSORBANZA L’assorbanza è il logaritmo negativo della trasmittanza A() = - log(T) Secondo la legge di LAMBERT – BEER l’assorbanza A è proporzionale sia alla concentrazione della sostanza assorbente, sia allo spessore dello strato attraversato, per cui più elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato, maggiore sarà l’assorbanza (maggiore sarà la diminuzione dell’intensità del raggio incidente). CLASSIFICAZIONE SPETTROFOTOMETRI Esistono diversi tipi di spettrofotometro, a seconda di come sono organizzate le varie componenti: ♥ SPETTROFOTOMETRI MONORAGGIO ♥ SPETTROFOTOMETRI A DOPPIO RAGGIO Gli SPETTROFOTOMETRI MONORAGGIO, sono usati prevalentemente in analisi quantitativa e non sono comodi per ottenere spettri di Assorbimento. La difficoltà sta nel fatto che per ogni misura, per ogni λ, si deve ripetere l'azzeramento contro il bianco, oppure registrare prima lo spettro del bianco, poi lo spettro del campione ed infine sottrarre al secondo il primo. Negli SPETTROFOTOMETRI A DOPPIO RAGGIO si ha invece un sistema che invia due raggi, identici per frequenza e intensità, uno attraverso il campione e l'altro attraverso il bianco, per cui si ha un confronto continuo tra l'assorbanza del campione e quella del bianco. Grazie a queste caratteristiche è possibile effettuare misure direttamente a qualsiasi λ senza ripetere azzeramenti, e soprattutto registrare continuativamente lo spettro di assorbimento. SCHEMA DI UNO STRUMENTO A SINGOLO RAGGIO IL MONOCROMATORE è un PRISMA o un RETICOLO DI DIFFRAZIONE 1) Si mette nella cuvetta il solvente e si misura l’Intensità. 2) Si lava la cuvetta. 3) Si mette la soluzione e si misura l’intensità. 4) Si fa il rapporto fra le due Intensità Converte l’Intensità della radiazione in Intensità di corrente SCHEMA DI UNO STRUMENTO A DOPPIO RAGGIO Il bianco (o riferimento) è costituito dal solvente ad eccezione della sostanza di cui si vuol esaminare l’assorbimento La radiazione proveniente dal MONOCROMATORE si divide in due raggi che sono inviati contemporaneamente al campione ed al solvente. Il secondo raggio passa attraverso il campione e fuoriesce con l’Intensità trasmessa Icampione Il computer registra entrambe in modo alterno e calcola il rapporto. PRIMO ESPERIMENTO Analizziamo gli SPETTRI di ASSORBIMENTO di COLORANTI NATURALI e della CLOROFILLA, facendo sempre prima l’azzeramento con il BIANCO (o BACKGROUND). Nella nostra esperienza abbiamo esaminato tre diversi coloranti naturali appartenenti al gruppo delle cianine: verde, rosso e blu. Il range è compreso fra 400 e 800 nm n.b. Il colore è sempre il risultato delle radiazioni non assorbite SPETTRO DEL COLORE COMPLEMENTARE Il colore complementare del blu è l’arancione. L’assorbanza si registra nell’intervallo compreso tra 520 e 600. Lo spettro evidenzia: -i due massimi di assorbimento intorno a 6oo – 560; - i due minimi di assorbimento intorno ai 450-570nm Se ho assorbanza nella regione dell’azzurro (a circa 500 nm) la sostanza appare di colore complementare rosso • I tre coloranti hanno la stessa concentrazione, ma poiché sono cromofori ossia sono molecole organiche che hanno un diverso P.M. , mostrano una diversa assorbanza (varia l’altezza del picco dello spettro dell’assorbanza). • I coloranti hanno un range di assorbimento compreso fra 400 ≤ λ ≤ 700 La sostanza di colore rosso assorbe a λ = 400 (assorbe nell’azzurro) • Abbiamo ottenuto il seguente spettro: I tre coloranti assorbono in zone diverse dello spettro poiché hanno una diversa lunghezza della catena che unisce i due atomi di azoto (N). Gli spettri sono delle gaussiane con altezze diverse. La sostanza che assorbe nel verde (a lunghezza d’onda minore), appare di colore complementare ROSSO; La sostanza che assorbe nell’arancione (a lunghezza d’onda maggiore) appare di colore complementare BLU; La sostanza che assorbe nel rosso (a lunghezza d’onda maggiore) appare di colore complementare VERDE. • Il segnale più intenso di ciascuno SPETTRO deriva da una transizione elettronica della molecola isolata. Gli altri due segnali meno intensi sono attribuiti ad aggregati formati da due o più molecole. • I tre spettri riportati in figura hanno gli stessi colori delle tre sostanze a cui si riferiscono. • Ciascun colorante assume il colore complementare di quello assorbito. • I tre coloranti assorbono in zone diverse dello spettro perché hanno una diversa lunghezza della catena che unisce i due atomi di azoto. DIAGRAMMA con confronto dei colori e delle lunghezze d’onda delle radiazioni assorbite Ogni sostanza assume un colore complementare rispetto a quello che assorbe RUOTA dei colori complementari Ad esempio: la sostanza appare di colore rosso che è il colore complementare rispetto a quello della radiazione assorbita (verde = 510 nm) Alcuni alunni impegnati nell’esperienza sulla spettroscopia CREDITI Partecipazione al “PROGETTO LAUREE SCIENTIFICHE” Liceo Scientifico “G. Salvemini” Bari Università degli Studi di Bari, Dipartimento di Chimica Responsabile PROF. M. CASTAGNOLO Speciale ringraziamento al Prof. Cassidei ed al tecnico di laboratorio sig. Domenico Benedetti Docente referente del Salvemini: prof. G. Rutigliano Alunne: Luisa Lampignano, Simona Spinelli IV C
Scaricare