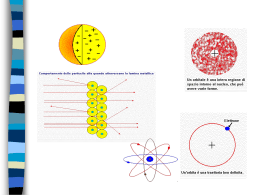
Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE LA STRUTTURA DELLA MATERIA a fine corso… - La struttura dell’atomo: il nucleo - La struttura dell’atomo: gli elettroni - Il legame chimico - Le forze di interazione intermolecolari Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE LA STRUTTURA DELL’ATOMO Abbiamo già visto come l'atomo sia costituito da un nucleo intorno al quale ‘orbitano’ gli elettroni; il nucleo a sua volta è costituito da protoni e neutroni. Gli elettroni hanno carica negativa, i protoni hanno carica positiva, i neutroni non hanno carica. il termine ‘orbitare’ non è corretto, vedi più avanti!! + - ++ atomo di idrogeno: 1 protone nel nucleo + 1 elettrone orbitante atomo di elio: 2 protoni (+ 2 neutroni privi di carica) nel nucleo + 2 elettroni orbitanti Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Ma come si è arrivati a questa visione dell’atomo? La moderna teoria atomica deve le sue origini alle osservazioni di Dalton sulle masse degli elementi che si combinano per formare i composti (leggi ponderali). TEORIA ATOMICA (Dalton, 1807) Punti principali della Teoria Atomica di Dalton: 1) La materia è costituita da particelle piccolissime "elementari“ che non sono ulteriormente scomponibili - gli atomi; 2) gli atomi si combinano secondo numeri piccoli e interi per formare i diversi composti; 3) gli atomi di un certo elemento sono uguali e il loro peso non cambia durante la trasformazione chimica nella visione di Dalton l’atomo è l’entità più semplice e indivisibile che costituisce la materia Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Diverse osservazioni sperimentali effettuate fra fine 800 e inizio 900 (JJ Thomson, RA Millikan) confutarono la teoria di Dalton mettendo in evidenza come l’atomo fosse costituito da “entità” ancora più piccole dotate di carica positiva e negativa. schema del dispositivo di Thomson che prova l’esistenza degli elettroni: una scarica elettrica attraversa un gas rarefatto all’interno di un tubo di vetro; la scarica elettrica produce particelle dotate di carica che risentono del campo elettrico applicato; le particelle con carica negativa e massa molto piccola sono proprio gli elettroni (identificati per la prima volta) Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE L’evoluzione dei modelli dell’atomo JJ Thomson (1899): a seguito delle sue osservazioni, Thomson formulò un primo modello (sbagliato!) per la struttura degli atomi secondo cui gli elettroni (particelle di carica negativa che lui stesso scoprì) sono immersi in una sfera di carica positiva (“come i canditi nel panettone”) panettone=sfera di carica positiva uniforme canditi=elettroni Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE L’evoluzione dei modelli dell’atomo E Rutherford (1911): dai risultati di una serie di esperimenti risultò evidente che la carica positiva non può essere distribuita uniformemente come suggerito da Thomson; la carica positiva deve essere localizzata in uno spazio ridotto al centro dell’atomo (il nucleo) intorno al quale ruotano gli elettroni (modello planetario). schema dell’esperimento di Rutherford Risultato atteso se il modello di Thomson fosse corretto fascio di particelle alfa (He2+) atomo a panettone Risultato effettivo le particelle alfa sono nuclei di elio (con doppia carica positiva, He2+) Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Secondo il modello planetario di Rutherford, l'atomo è formato da un nucleo intorno al quale ruotano uno o più elettroni; il nucleo è molto piccolo (dimensioni ~ 10-12-10-13 cm), ha carica positiva ed è molto pesante (quasi tutta la massa dell'atomo vi si trova concentrata); gli elettroni sono carichi negativamente, hanno una massa quasi trascurabile, ma occupano la quasi totalità del volume dell'atomo (dimensioni ~ 10-8510-8 cm) Anche il modello di Rutherford è stato superato. Resta però il grande merito di aver messo in evidenza l’esistenza del nucleo. Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Il modello di Rutherford, tuttavia, non era consistente con i principi della fisica allora noti: secondo tale modello gli elettroni (dotati di carica negativa) non precipitano per attrazione elettrostatica sul nucleo (dotato di carica positiva) perché la forza di attrazione elettrostatica è bilanciata dalla forza centrifuga associata al movimento di rotazione intorno al nucleo (come i pianeti intorno al sole). Tuttavia, secondo la fisica classica, una particella elettricamente carica in movimento perde incessantemente parte della sua energia. Quindi, gli elettroni in movimento circolare intorno al nucleo dovrebbero perdere energia fino a "collassare" sul nucleo stesso. In quello stesso periodo storico, altri fenomeni fisici ponevano il problema del superamento della fisica classica. Per esempio, la radiazione del corpo nero, gli spettri di emissione dell’atomo di idrogeno etc. Tutto ciò portò al concetto di QUANTIZZAZIONE dell'ENERGIA: (Planck e Einstein) 1) l'energia non è una grandezza continua ma è quantizzata, cioè può essere ceduta o trasmessa solo in quantità discrete, multiplo di un valore fisso detto quanto 2) la radiazione elettromagnetica, che in precedenza veniva considerata come un'onda, ha anche una natura corpuscolare natura dualistica della luce Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Modello dell'atomo di Bohr (1913) 1) Per il moto di un elettrone sono permessi solo alcuni stati stazionari in corrispondenza di orbite circolari (o ellissoidali, Sommerfeld); a ciascuno di questi stati stazionari corrisponde un valore definito di energia; 2) quando l'atomo è in uno di questi stati stazionari, non emette luce; quando invece passa da uno stato a più alto contenuto energetico a uno a più basso contenuto energetico, l'atomo emette un quanto la cui energia è pari alla differenza di energia fra i due stati; spiegazione dello spettro di Balmer 3) gli stati permessi di moto degli elettroni sono caratterizzati da un momento angolare dell'elettrone multiplo di h/2 (quantizzazione del momento angolare) Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Il modello proposto da Bohr riusciva a spiegare alcune delle osservazioni sperimentali dell’epoca, come lo spettro di emissione degli atomi di idrogeno o di atomi idrogenoidi. Tuttavia non era esauriente rispetto ad altre osservazioni e inoltre introduceva l’idea di orbita o stato stazionario con dei postulati, cioè assunzioni fatte per rendere conto dei fenomeni osservati, ma non riconducibili ad alcuna spiegazione. Il modello attualmente accettato per la struttura dell’atomo è il modello ondulatorio proposto da Schroedinger pochi anni dopo. Il modello proposto da Schroedinger è stato reso possibile dal lavoro precedente di altri studiosi; in particolare De Broglie (natura ondulatoria dell’elettrone, dualismo onda particella) e Heisenberg (principio di indeterminazione). Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Schroedinger: modello ondulatorio dell'atomo (1925) Nel nuovo modello di atomo non si parla di orbite ma di ORBITALI; essi sono una espressione matematica che permette di calcolare la probabilità di trovare un elettrone in un certo istante in un punto dello spazio che circonda il nucleo considerato (più precisamente, è il quadrato della funzione associata all’orbitale che rappresenta tale probabilità); ad ogni elettrone si associa una onda stazionaria la cui frequenza ne determina l’energia e la cui ampiezza dà una misura della probabilità di trovare la particella. Le funzioni matematiche che descrivono gli orbitali sono dette autofunzioni e sono definite dalle soluzioni della equazione di Schroedinger H = E Vedi libro di testo, Cap 3 per ulteriori dettagli Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE I numeri quantici Risolvendo l'equazione di Schroedinger per l'atomo di idrogeno, si trovano diverse funzioni d'onda (orbitali) che la soddisfano; ciascuno di essi è caratterizzato da una serie di numeri detti numeri quantici che ne descrivono compiutamente le proprietà: numero quantico principale, n n=1,2,3,... è relazionato alla dimensione e alla energia dell'orbitale: maggiore è il valore di n, maggiore è la dimensione dell'orbitale e quindi l'elettrone ha meno probabilità di trovarsi vicino al nucleo; quindi un valore grande di n implica anche un valore grande di energia numero quantico azimutale, l per ogni valore di n, l=0, 1, ..., n-1 è relazionato alla forma degli orbitali atomici l=0 s l=1 p numero quantico magnetico, ml l=2 d l=3 f ml= -l, -l+1, ..., 1, 0, 1, ..., l-1, l è relazionato alla orientazione relativa degli orbitali nello spazio Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE coordinate polari Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE orbitale 1 s funzione d’onda dell’ orbitale 1 s quadrato della funzione d’onda dell’ orbitale 1 s distribuzione di probabilità di trovare l’elettrone in quel punto dello spazio intorno al nucleo orbitale2 s funzione d’onda dell’ orbitale 2 s quadrato della funzione d’onda dell’ orbitale 2 s ci sono dei punti in cui la probabilità è nulla Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Orbitali s l=0 forma sferica Gli orbitali si rappresentano graficamente con una “superficie limite” = superficie che delimita la zona dello spazio equivalente al 90% di probabilità di trovare l'elettrone 1s 2s 3s n=1 l=0 ml=0 n=2 l=0 ml=0 n=3 l=0 ml=0 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Orbitali p l=1 Gli orbitali p sono 3 poichè l=1 e quindi sono possibili i valori di ml=-1,0,+1 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Orbitali d l=2 Gli orbitali d sono 5 poichè l=2 e quindi sono possibili i valori di ml=-2,-1,0,+1,+2 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Orbitali f l=3 Gli orbitali f sono 7 poichè l=3 e quindi sono possibili i valori di ml=-3,-2,-1,0,+1,+2,+3 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Schema degli orbitali n l ml numero di orbitali autofunzioni 1 0 0 1 100 2 0 1 0 -1,0,+1 1 3 200 21-1,210 , 211 3 0 1 2 0 -1,0,+1 -2,-1,0,1,+1 1 3 5 300 31-1,310 , 311 32-2,32-1 , 320,321 , 322 4 0 1 2 3 0 -1,0,+1 -2,-1,0,1,+1 -3,-2,-1,0,+1,+2,+3 1 3 5 7 400 41-1,410 , 411 42-2,42-1 , 420,421 , 422 53-3,53-2 , 53-1,530 , 531 532,533 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE n dimensione ed energia n=1,2,3,4 l forma s=0 sferica p=1 lobata d=2 f=3 ml orientazione nello spazio s 1 orbitale p 3 orbitali d 5 orbitali f 7 orbitali Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Atomi polielettronici Il modello ondulatorio si applica con successo anche alla trattazione di atomi con più di un elettrone; la trattazione in questo caso è più complessa perché è necessario considerare anche la repulsione fra elettroni (hanno la stessa carica). Dalla soluzione dell'equazione di Schroedinger si derivano gli orbitali atomici che sono qualitativamente simili agli orbitali dell'atomo di idrogeno; in questo caso, tuttavia, anche il numero quantico azimutale l concorre a determinare l'energia dell'elettrone nell'orbitale. Inoltre, nel caso di atomi con più di un elettrone è necessario introdurre un altro numero quantico per caratterizzare compiutamente un elettrone numero quantico di spin, ms ms= +1/2, -1/2 gli elettroni girano intorno al proprio asse secondo due possibili orientazioni principio di esclusione di Pauli: un orbitale contiene al massimo due elettroni ed essi hanno spin opposto Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE L’energia degli orbitali poliettronici Nel caso degli orbitali idrogenoidi anche il numero quantico azimutale l concorre a determinare l'energia dell'elettrone nell'orbitale. Lo schema corretto diventa lo schema di riempimento progressivo (che segue l’ordine crescente di energia degli orbitali) è pertanto: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Configurazione elettronica Ogni atomo è caratterizzato da una particolare disposizione degli elettroni nei suoi orbitali. La configurazione elettronica rappresenta tale disposizione ed è una specie di “carta di identità” dell’atomo. Si può attribuire la configurazione elettronica di ciascun elemento disponendo i suoi elettroni negli orbitali a disposizione in ordine crescente di energia (principio dell’Aufbau) ricordando: 1) Il principio di esclusione di Pauli: ciascun orbitale (definito dai tre numeri quantici n, l e ml) può contenere al massimo due elettroni (con spin opposto); 2) La regola di Hund: il riempimento di orbitali con la stessa energia (ad es. i 3 orbitali p) avviene ponendo un elettrone in ogni orbitale, tutti con spin parallelo. Eventuali altri elettroni vengono accoppiati solo se tutti gli orbitali di quel gruppo contengono almeno un elettrone. Es. L’atomo di elio ha due elettroni. Essi vanno ad occupare (nella loro configurazione stabile) l’orbitale a più bassa energia, cioè l’orbitale 1s. L’orbitale 1s può “ospitare” due elettroni quindi entrambi gli elettroni dell’atomo di elio occupano l’orbitale con minore energia La configurazione elettronica dell’elio è 1s2 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Es. L’atomo di boro ha 5 elettroni. Essi vanno ad occupare (nella loro configuzione stabile) gli orbitali a più bassa energia, cioè l’orbitale 1s che può ospitare al massimo 2 elettroni l’orbitale 2s che può ospitare al massimo 2 elettroni gli orbitali 2p che possono ospitare al massimo 6 elettroni La configurazione elettronica del boro è 1s22s22p1 Es. L’atomo di neon ha 10 elettroni. Essi vanno ad occupare (nella loro configuzione stabile) gli orbitali a più bassa energia, cioè l’orbitale 1s che può ospitare al massimo 2 elettroni l’orbitale 2s che può ospitare al massimo 2 elettroni gli orbitali 2p che possono ospitare al massimo 6 elettroni La configurazione elettronica del neon è 1s22s22p6 Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Es. L’atomo di sodio ha 11 elettroni. Essi vanno ad occupare (nella loro configuzione stabile) gli orbitali a più bassa energia, cioè La configurazione elettronica del sodio è 1s22s22p63s1 Tratto da De Paoli Chimica Generale e Inorganica Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Tavola periodica e configurazione elettronica degli elementi L’ordine con cui gli elementi compaiono della tavola periodica riflette la loro struttura elettronica: - lungo un periodo (righe) si assiste al progessivo riempimento degli orbitali in base al loro contenuto energetico NB i periodi sono caratterizzati dallo stesso numero quantico principale n, ma anche il valore di l concorre a determinare il valore di energia assunto dall’elettrone in quegli orbitali (maggiore è il valore di l, maggiore è il contenuto energetico) quindi 3s ha una energia inferiore al 3p - gli elementi di un gruppo hanno la stessa configurazione elettronica “esterna” NB ciò conferisce agli elementi dello stesso gruppo un comportamento chimico simile poiché le proprietà chimiche risentono principalmente degli elettroni esterni Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Tavola periodica in forma estesa (Z crescente) Ad ogni periodo è associato un valore di n; il numero di elementi per periodo corrisponde al numero di elettroni che può essere ospitato nel set di orbitali con quel numero quantico n. Il primo periodo ha solo due elementi perchè l’orbitale 1s può allocare solo due elettroni; il secondo periodo ha 8 elementi perché l’orbitale 2s alloca 2 elettroni e gli orbitali 2p allocano fino a 6 elettroni; il terzo periodo ha 8 elementi, perché gli orbitali 3d si riempono solo successivamente ecc. Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Blocco s Gli elementi del primo gruppo hanno la stessa configurazione esterna s1, cioè hanno un elettrone spaiato che occupa un orbitale s (metalli alcalini). Gli elementi del secondo gruppo hanno configurazione elettronica esterna s2, cioè hanno due elettroni nell’orbitale s (metalli alcalino-terrosi). Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Blocco p Sono gli elementi che si ottengono per riempimento degli orbitali p. Ad es. il gruppo degli alogeni (F, Cl, Br, I) con configurazione esterna s2p5) e il gruppo dei gas nobili (He, Ne, Ar, Kr, Xe, Rn) con configurazione esterna s2p6) progressivo riempimento degli orbitali p Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Blocco d Sono gli elementi che si ottengono per riempimento degli orbitali d. Sono tutti metalli e sono detti metalli di transizione. progressivo riempimento degli orbitali d Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Blocco f Sono gli elementi che si ottengono per riempimento degli orbitali f. Sono tutti metalli e sono detti terre rare (lantanidi e attinidi). progressivo riempimento degli orbitali f Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Le proprietà periodiche degli elementi Alcune proprietà degli elementi sono caratterizzate da una variazione sistematica lungo il periodo oppure lungo il gruppo, proprio perché dipendono dalla configurazione elettronica (e in particolar modo dagli elettroni esterni). Raggio atomico e raggio degli ioni Il raggio atomico aumenta lungo un gruppo (perché aumenta il numero quantico principale e quindi la dimensione degli orbitali), diminuisce lungo un periodo (perché aumenta la carica positiva del nucleo e il numero di elettroni che occupano orbitali con lo stesso numero quantico principale poco efficienti nello schermare tale carica). gli ioni negativi sono sempre più grandi e gli ioni positivi sempre più piccoli dei relativi atomi neutri Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Potenziale di ionizzazione Per strappare un elettrone ad un atomo è necessario fornire una certa quantità di energia. Tale energia è detta potenziale di ionizzazione. Quanto più è alto il potenziale di ionizzazione, tanto più sarà difficile strappare l’elettrone dall’atomo. Es. Na Na+ + 1 e- PI = +492 kJ/mol Il potenziale di ionizzazione aumenta lungo un periodo e diminuisce lungo un gruppo Cs ha il PI più basso Chimica Generale CORSO DI LAUREA TRIENNALE IN ATTIVITÀ DI PROTEZIONE CIVILE Affinità elettronica Alcuni atomi hanno una tendenza spiccata ad acquistare un elettrone. L’energia che viene liberata in questo processo è detta affinità elettronica. Quanto più è negativa l’affinità elettronica, tanto più sarà facile che l’atomo acquisti l’elettone. Es. Cl + 1 e- Cl- AE=-394 kJ/mol L’affinità elettronica diminuisce lungo un periodo e aumenta lungo un gruppo F ha la AE più negativa
Scarica