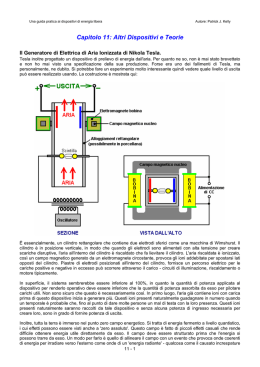
Tra il 1880 e il il 1932 sono stati compiuti grandi passi nell’investigazione del mondo microscopico. •Balmer nel 1845 osserva che la luce viene emessa con lunghezze d’onda precise •Thomson nel 1897 propone un modello dell’atomo e conferma l’esistenza dell’elettrone misurando il rapporto tra la sua carica e la massa. • Rutherford nel 1909 verifica e corregge il modello di Thomson •Bohr nel 1913 propone un nuovo modello in parte classico e in parte quantistico dell’atomo di idrogeno. Rutherford Strumenti utilizzati: •cameretta chiusa ermeticamente •sorgente radioattiva (americio 241) •lamina di metallo (Al, d= 7 mm) • pompa rotativa per il vuoto • goniometro • sensore di particelle a particelle Grafico sperimentale 1600,0 1400,0 1200,0 1000,0 800,0 600,0 400,0 200,0 0,0 -20,0 -10,0 0,0 angolo 10,0 20,0 Confronto tra Grafico Teorico e Sperimentale Rutherford 1000,0 particelle 800,0 600,0 400,0 200,0 0,0 -20,0 -10,0 0,0 angolo 10,0 20,0 angolo angolo t particelle teorica 15,0 12,7 2,5 4,6 12,5 10,2 5,5 9,5 10,0 7,7 32,0 23,1 7,5 5,2 309,0 72,9 5,0 2,7 911,0 368,3 2,5 0,2 1363,0 5887,4 0,0 -2,3 1077,0 -2,5 -4,8 430,0 5887,4 -5,0 -7,3 48,0 368,3 -6,5 -8,8 5,0 129,1 -7,5 -9,8 9,0 72,9 -10,0 -12,3 2,0 23,1 -12,5 -14,8 0,5 9,5 -15,0 -17,3 0,7 4,6 CONCLUSIONI Il 99% delle particelle a attraversa non deviata la pellicola, altre particelle vengono deviate o respinte. Questo comportamento non spiegabile dal modello di Thomson permette a Rutherford di capire che le cariche positive sono concentrate in uno spazio ristretto (nucleo) e non sparse uniformemente nel vuoto. 2 4 N i ntA 4Z e 1 Nd 2 2 2 2 4 4 4 R 16 0 m v0 sin ( / 2) Noi abbiamo verificato che il numero di particelle a che hanno superato la lamina segue la formula determinata da Rutherford nel 1911. Thomson Apparato per l’esperimento: •tubo riempito di elio (pressione 10^-2 mm Hg) con cannone di elettroni e piastre di deflessione •bobine di Helmoltz per produrre un campo magnetico uniforme (r=15cm, 130spire) •alimentatori per corrente e voltaggio VALORE ATTESO V (V) I (A) R1 (m) R2 (m) 200 1,81 0,035 0,031 200 1,74 0,037 0,035 200 1,6 0,043 0,041 200 1,6 0,038 0,037 200 1,44 0,04 0,041 200 1,2 0,049 0,045 200 1,07 0,047 0,055 214 1,83 0,036 0,034 235 1,83 0,034 0,035 251 1,82 0,039 0,037 278 1,82 0,039 0,04 290 1,82 0,04 0,041 178 1,67 0,03 0,032 178 1,52 0,038 0,035 178 1,42 0,042 0,039 178 1,31 0,045 0,041 178 1,18 0,048 0,045 178 1,06 0,048 0,055 178 0,93 0,06 0,045 160 1,53 0,033 0,035 299 1,85 0,041 0,04 INTERVALLO DI CONFIDENZA 1,67E+11 MEDIA 2,10E+11 DEV ST 1,756E+11 e/m (C/Kg) D% 1,84283E+11 4,9 1,67559E+11 4,6 1,4559E+11 17,1 1,82628E+11 4,0 1,93302E+11 10,1 2,06687E+11 17,7 2,20782E+11 25,7 1,71481E+11 2,3 1,93806E+11 10,4 1,72506E+11 1,8 1,76827E+11 0,7 1,75463E+11 0,1 2,18325E+11 24,3 1,90103E+11 8,3 1,76919E+11 0,8 1,84409E+11 5,0 1,94353E+11 10,7 1,96352E+11 11,8 2,45457E+11 39,8 1,94366E+11 10,7 1,75089E+11 0,3 1,88871E+11 2,15E+10 7,6 CONCLUSIONI e 2V 2 2 m B R Nm0I -4 B ( 7 . 8 × 10 )I 3/ 2 (5/ 4) a R1 +R2 R 2 m permeabilità magnetica I = intensità di corrente N = numero delle spire (130) a = raggio delle bobine Abbiamo misurato il rapporto tra carica e massa degli elettroni. Spettri a righe Spettrofotometro composto da: •collimatore •elemento diffrangente •telescopio •lampada a gas (Sodio, Mercurio, Idrogeno, Krypton) MERCURIO COLOREq1A arancione-15,760 verde -16,989 viola1 -20,682 viola2 -21,790 viola3 -23,020 q2A -55,768 -54,537 -50,474 -49,489 -48,130 qA 20,004 18,774 14,896 13,850 12,555 q1B 80,476 79,210 75,400 74,310 73,050 q2B 40,250 41,500 45,500 46,770 48,220 VALORE q medio l dsenqATTESO q 20,113 18,855 14,950 13,770 12,415 20,059 18,815 14,923 13,810 12,485 571,6 590 537,5 500; 560 429,2 460 397,8 450 360,3 450 IDROGENO COLORE q1 q2 q rosso -11,52 -57,3 verde -17,65 -51,08 viola -19,41 -49,22 l dsenq VALORE ATTESO 22,89 648,3 670 16,715 479,4 490 14,905 428,7 420; 440 KRYPTON COLORE q1 q2 q IR1 -22,71 -93,38 IR2 -26,63 -89,27 IR3 -29,25 -86,84 IR4 -31,12 -84,78 giallo -37,48 -95,47 verde -38,6 -96,59 35,335 31,32 28,795 26,83 28,995 28,995 l dsenq VALORE ATTESO 963,9 866,4 802,8 752,2 807,9 590 807,9 560; 570 Postulati del modello atomico di Bohr •Gli elettroni dell’atomo si muovono su orbite circolari attorno ad un nucleo •un elettrone in moto sutale orbita non irraggia •le orbite sono soggette ad una condizione di quantizzazione del movimento angolare- orbitale L=n h / 2 h= costante di Plank= 6.63 x 10^-3 Js •gli elettroni possono emettere o assorbire radiazione elettromagnetica quando passano da un’orbita all’altra. E2-E1 =hn Conclusioni Bohr mediante questo esperimento, studiando gli spettri a righe, ha costruito un nuovo modello dell’atomo di idrogeno. Ha quindi confermato i suoi quattro postulati e posto le basi della meccanica quantistica. Falsetti Chiara Grandi Sonia Serrano Elisa
Scaricare