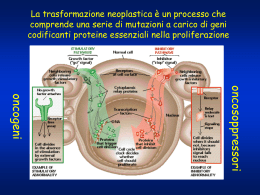
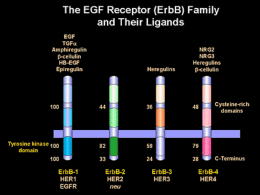
Dr. Francesco Graziano Medical Oncology Hospital of Pesaro Biotecnologie ed Evoluzione della Terapia Medica dei Tumori Solidi GSEC - GENETIC SUSCEPTIBILITY TO ENVIRONMENTAL CARCINOGENS UNIVERSITY OF PITTSBURGH European Commette for Genetic Cancer Research Terapia dei tumori Stadio I-II chirurgia Stadio III Stadio IV chemioterapia primaria chemioterapia della malattia metastatica radioterapia guarigione chirurgia chirurgia guarigione prolungamento della sopravvivenza prolungamento della sopravvivenza palliazione Obiettivi della chemioterapia antitumorale negli stadi avanzati (stadio IV) Riduzione della massa tumorale Aumento della sopravvivenza Beneficio sui sintomi Sviluppo storico della chemioterapia antineoplastica Mecloretamina 1945 Metotrexato 6-Mercaptopurina Busulfan 1950 Clorambucil Ciclofosfamide 1955 Vinblastina, vincristina Fluorouracile, actinomicina D Melfalan 1960 Procarbazina, 6-tioguanina Citosina arabinoside Adriamicina 1965 • Prima chemioterapia adiuvante con actinomicina D nel tumore di Wilms 1970 Bleomicina, dacarbazina da G. Bonadonna, 1999 (modificata) Sviluppo storico della chemioterapia antineoplastica (II) CCNU, BCNU, cisplatino Etoposide, mitoxantrone Carboplatino Ifofosfamide + MESNA Paclitaxel, docetaxel Topotecan, irinotecan Gemcitabina Oxaliplatino Target therapy 1975 1980 1985 • CMF adiuvante nel ca. mammario • Terapia adiuvante nell’osteosarcoma • Trapianto di midollo osseo • PVB nei tumori del testicolo • Inizio chemioterapia primaria in vari tumori solidi resecabili • Trapianto autologo con GM-CSF • Espansione chemioterapia primaria 1990 • Terapia antiemetica 1995 2000 da G. Bonadonna, 1999 (modificata) PENTOSTATINA •Inibisce l’adenosina deaminasi 6-MERCAPTOPURINA 6-TIOGUANINA •Inibisce la biosintesi dell’anello purinico •Inibiscono le intercorversioni nucleotidiche METOTREXATO •Inibisce la riduzione dell’acido diidrofolico •Blocca la sintesi purinica e dell’acido timidilico BLEOMICINA ETOPOSIDE TENIPOSIDE •Danneggiano il DNA e ne impediscono il riparo DACTINOMICINA DAUNORUBICINA DOXORUBICINA MITOXANTRONE •Si intercalano nel DNA •Inibiscono la sintesi dell’RNA Sintesi ACIDO FOSFONACETIL-L-ASPARTICO pirimidinica •Inibisce la biosintesi purinica Sintesi purinica IDROXIUREA •Inibisce la ribonucleotide reduttasi ribonucleotidi desossiribonucleotidi DNA RNA (transfer, messaggero, ribosomiale) proteine enzimi (ecc.) microtubuli 5-FLUOROURACILE •Inibisce la sintesi dell’acido timidilico CITARABINA FLUDARABINA 2-CLORODEOXIADENINOSINA •Inibiscono la sintesi del DNA AGENTI ALCHILANTI MITOMICINA C CISPLATINO PROCARBAZINA DACARBAZINA •Formano addotti con il DNA L-ASPARAGINASI •Deamina l’asparagina •Inibisce la sintesi proteica PACLITAXEL ALCALOIDI DELLA VINCA COLCHICINA •Inibiscono le funzioni dei microtubuli Farmaci NON target! Tossicità arigenerativa dei chemioterapici antitumorali MIDOLLO OSSEO EMATOPOIETICO •Leucopenia, immunodepressione, •Piastrinopenia •Anemia MUCOSA GASTROINTESTINALE •Stomatite •Enterite arigenerativa •Colite mucosa-membranosa •Diarrea CUTE ED ANNESSI CUTANEI •Alopecia GONADI •Amenorrea, azoospermia Changing of the Guard A Paradigm Shift in the Treatment of Cancer • Conventional cytotoxic drugs interact with DNA to prevent cell replication but are not specific to cancer cells • We are moving to targeted therapies which specifically target cancer cells Target therapy: 1) Identificazione del bersaglio 2) Sopravvivenza e crescita delle cellula tumorale dipendono dal bersaglio …. la comparsa degli “inib” e degli “umab” ... Targeted Therapies • Gli “umab • Monoclonal antibodies: proteine che si legano a recettore o altra molecola di segnale extracellulare • Gli “inib” • Tyrosine Kinase Inhibitors: molecola che lega e inibisce attività enzimatiche intracellulari Dalla biologia alla biotecnologia ai nuovi farmaci umab I I umab I Second messanger ……….inib I Transcription I Translation I Proteolysis From JB Gibbs, 2000, modified Lo sviluppo degli “umab” e degli “inib” segue quello dei chemioterapici antitumorali Acquisizione Screening Produzione e Formulazione Studi clinici di fase I Studi clinici di fase II Studi clinici di fase III Pratica medica Valutazione farmacologico-clinica dei chemioterapici antitumorali (I) FASE I TOLLERABILITA’ •Dose massima tollerata •Tipo della tossicità limitante •Schema di somministrazione ottimale •Dose consigliata per la fase II FARMACOCINETICA FASE II ATTIVITA’ ANTITUMORALE •Spettro di attività •Relazione dose-risposta Valutazione farmacologico-clinica dei chemioterapici antitumorali (II) FASE III-IV EFFICACIA TERAPEUTICA •Valutazione comparativa con terapia standard •Integrazione della chemioterapia nel trattamento primario •Monitoraggio farmacocinetico TOLLERABILITA’ •Farmacovigilanza •Monitoraggio farmacocinetico Drug Development Timeline 2-4 yrs 3-6 yrs Farmaci a Berasglio Molecolare Anticorpi monoclonali ….gli “umab” Inibitori della trasduzione del segnale …” gli “inib” Rituximab (CD20) Imatinib mesilato ( bcr-abl -, c-kit-, PDGF-TKs) Trastuzumab (HER2) Gefitinib ( EGFR-TK) Erlotinib ( EGFR-TK) Cetuximab (EGFR) Bevacizumab (VEGF) Bortezomib ( proteasoma) Sorafenib, Sunitinib Targeted Therapies Carcinoma Renale The Von-Hippel Lindau Gene • Located in the short arm of chromosome 3 • Tumor suppressor function • Found in up to 80% of sporadic (non-hereditary) renal cell cancers Sporadic Renal Cell Cancer: VHL Two-Hit Hypothesis At birth First Hit Second Hit: Cancer Inactivation of VHL: An Early Step in Kidney Carcinogenesis Loss of remaining VHL allele VHL (+/-) VHL (-/-): Cysts Mutation/s at nonVHL loci VHL (-/-): Tumor Consequences of VHL Gene Mutation HIF Accumulation VEGF, PDGF Angiogenesis Elongin B/C Cul2 Rbx1 Ubiquitin Ligase Complex Disrupted XX pVHL-E pVHL-A HIF HIF HIF HIF HIF HIF Glut-1, Erythropoietin Increased Metabolism TGF-, CXCR4 Autocrine Growth Metastasis Sunitinib VEGF PDGF Vascular Endothelial Cell Pericyte/Fibroblast/ Vascular Smooth Muscle VEGFR ↑ VEGF PDGFR ↑ PDGF Sunitinib Vascular permeability Cell survival, proliferation, migration Vascular formation, maturation Inhibition of RCC pathogenesis and progression Horizontal “Targeted” Strategy pVHL HIF VEGF PDGF TGF KDR PDGFR EGFR TARGETs Single, Planned Progression-Free Survival* Analysis Proportion of patients progression free 1.00 Median PFS** Sorafenib = 24 weeks 0.75 Placebo = 12 weeks Hazard ratio = 0.44 p-value <0.000001 0.50 0.25 Sorafenib Placebo Censored observation 0 0 6 12 18 24 36 48 54 60 66 Time from randomization (weeks) *Independently assessed **PFS analysis performed March, 2005 (data cut-off Jan 28, 2005) Escudier B et al. Oral presentation, ASCO, 2005 EGFR Epidermal Growth Factor Receptor Extracellular Domain Transmembrane Domain TK Intracellular Domain Human Epidermal Growth Factor Receptor Family EGF, TGF , Cellulin Amphiregulin, HB-EGF TK erbB1 HER1 EGFR No specific ligands often acts as dimer partner Heregulins TK erbB2 HER2 neu NRG2 NRG3 Heregulins β-cellulin TK erbB3 HER3 erbB4 HER4 Epidermal Growth Factor Receptor Normal Cell Cancer Cell EGFR expression in solid tumors Colorectal Lung (NSCLC) Head & Neck (SCC) EGFR is expressed in a variety of solid tumors Colorectal cancer (advanced) 75-82% Lung cancer (NSCLC) 40-91% Head & neck cancer (SCCHN) 90-100% Gastric cancer 33-74% Ovarian cancer 35-70% Structure of the EGF receptor and its mechanism of activation EGFR HER2 HER3 HER4 Ligand (e.g. EGF, TGF) 1. receptor dimerization Extracellular domain Cell membrane Tyrosine kinase domain C-terminus domain ATP ATP P P P P P P P P Inactive monomers From E. Raymond et al., 2000 (modified) 2. tyrosine kinase domain activation • transphosphorylation Cytoplasmatic region • phosphorylation of substrate tyrosines • signal transduction EGFR: FUNZIONE FISIOLGICA Una delle principali vie molecolari attivate dall’EGFR è quella di ras. Ras viene reclutata attraverso il legame con la molecola SOS. EGFR: FUNZIONE FISIOLGICA A sua volta, ras determina l’attivazione della serina/treonina chinasi raf, delle MAPKK 1 e 2 e delle MAPK ERK 1 e 2. EGFR: FUNZIONE FISIOLGICA Il risultato dell’attivazione di questa via molecolare è l’espressione di varie proteine nucleari, inclusa la ciclina D1 (necessaria per il passaggio G1-S nel ciclo cellulare). EGFR: FUNZIONE FISIOLGICA Un altro target di EGFR è il PI3K EGFR: FUNZIONE FISIOLGICA Il reclutamento di PI3K porta all’attivazione di Akt, una serina/treonina kinasi con forte attività antiapoptotica. N.B. la via di segnale di Akt svolge un ruolo nel determinare la chemioresistenza/ sensibilità della cellula neoplastica. Targeting Cellular Signal Pathways umab inib EGFR Ras MEKK Raf PI3K Rho-B ERK Akt intermediates Apoptosis sek MAP kinase jnk/sapk C-myc C-jun N U C L E U S Ki-67 Anti-EGFR Cetuximab Panitumumab Anti EGFR antibody Mouse Chimeric Humanized Fully Human 100% Mouse 34% Mouse 10% Mouse 100% Human cetuximab matuzumab panitumumab Colorectal cancer: cetuximab BOND Trial • Cunningham et al. ASCO 2003 – Randomized trial in 329/577 pts screened for EGFR+ tumors refractory to 5-FU/CPT-11 CPT-11+cetuximab R cetuximab 1 1 surviving (%) Patients PROPORTION PROPORTION Patients free of progression (%) Cetuximab vs. CPT-11+Cetuximab in CPT-11 refractory CRC 0,8 0,6 0,4 0,8 0,6 0,4 0,2 0,2 0 0 0 2 4 6 8 10 12 0 2 4 N No. events Median 8 10 12 14 MONTHS MONTHS Mono 111 92 1.5 6 Combo 218 152 4.1 N No. events Median Mono 111 75 6.9 Combo 218 140 8.6 HR (95% CI): 0.54 (0.42; 0.71) HR (95% CI): 0.91 (0.68; 1.21) log rank p-value < 0.0001 log rank p-value = 0.48 16 KRAS Mutations As an Independent Prognostic Factor in Patients With Advanced Colorectal Cancer Treated With Cetuximab Monoclonal antibodies R K K-ras mutato è sfavorevole Strategie anti-EGFR Anticorpi monoclonali TK TK PI3-K pY pY GRB2 pY SOS RAS STAT3 PTEN Piccole molecole anti-TK RAF AKT MEK Gene transcription G1 M Proliferation/ maturation Chemotherapy / radiotherapy resistance MAPK S G2 Angiogenesis Survival (anti-apoptosis) Metastasis Gefitinib (piccola molecola anti-EGFR TK) Farmaco studiato nei carcinomi polmonari non a piccole cellule (esprimono EGFR) Small molecule TKIs R K Differenze di risposta al gefitinib Group Women vs men Japanese vs caucasian Adenocarcinoma vs others Non-smokers vs former/current 1Fukuoka Response p value Study 19% vs 3% 0.001 IDEAL 21 27.5% vs 10.4% 0.0023 IDEAL 12 13% vs 4% 0.046 IDEAL 21 36% vs 8% < 0.001 MSKCC3 et al., JCO 2003; 2Kris et al., JAMA 2003; 3Miller et al., JCO 2004 Overexpression + mutation Normal Cell Cancer Cell MUTAZIONI DI EGFR • l’effetto delle mutazioni di EGFR sulla funzione della proteina è ancora oggetto di ricerca; • le cellule che presentano forme mutanti di EGFR, vanno incontro a massiva apoptosi sotto l’azione di farmaci inibitori della via di segnale Akt e STAT-mediata. MUTAZIONI DI EGFR 85% circa di queste mutazioni delezioni multinucleotidiche “in-frame” (ESONE 19) mutazioni puntiformi (ESONE 21) MUTAZIONI DI EGFR • > frequenza nel sesso femminile; • > frequenza nelle popolazioni dell’est asiatico; • > frequenza nei non fumatori; • > frequenza nel tipo istologico adenocarcinoma. 2 classi differenti di molecole anti-EGFR Carcinoma del polmone (NSCLC) Small molecule TKIs Carcinoma del colon Monoclonal antibodies R R K K EGFR mutato è favorevole K-ras mutato è sfavorevole Drug-related in >5% Tossicità dei adverse farmaci events anti-EGFR of patients: IDEAL 1 (250 mg/day) Patients 50 (%) All grades Grade 3 40 30 20 10 0 Rash Diarrhoea Pruritus Dry skin No grade 4 drug-related adverse events were recorded Acne Nausea Fukuoka et al 2003a Adverse skin effects after gefitinib (ZD1839) treatment A A. Mild (grade 1) acne-like rash in the breast area of a 52-year-old patient treated with 225 mg/d B. More severe (grade 2) facial acne-like rash in a patient treated with 1,000 mg/d for 8 months Neo-angiogenesi tumorale Normal tissue Tumor tissue Jain: Science; 307: 58-62, 2005 ANGIOGENESI: formazione di nuovi vasi sanguigni a partire da pre-esistenti vasi capillari normali aggressività della malattia esito clinico sfavorevole ridotta sopravvivenza globale Il controllo dello switch angiogenetico dipende dall’equilibrio tra fattori PRO- ed ANTI-ANGIOGENETICI VEGF • è il più potente e specifico fattore mitogeno per le cellule endoteliali; • è un fattore di sopravvivenza per le cellule dei vasi neoformati; • induce un aumento della permeabilità vasale, facilitando l’immissione delle cellule neoplastiche nel torrente circolatorio. Bevacizumab (Avastin™): rhuMAb VEGF • Recombinant Humanized Monoclonal Antibody to VEGF • 93% human, 7% murine • Recognizes all isoforms of VEGF, Kd = 8 x 10-10 M • Terminal half life 17-21 days Bevacizumab (Avastin™): rhuMAb VEGF • Somministrato e.v. insieme a chemioterapci • Approvato per il trattamento dei pazienti con carcinoma del colon-retto avanzato Bevacizumab + chemioterapia vs. Placebo + chemioterapia Sopravvivenza libera da progressione: IFL + placebo, 6,2 mesi; IFL + bevacizumab, 10,6 mesi (p<0,001) Risposta obiettiva: IFL + placebo, 34,8%; IFL + bevacizumab, 44,8% (p=0,004) Hurwitz e coll. New Engl J Med, 2004 GIST: Gastrointestinal Stromal Tumors • GI sarcoma • Highest incidence in the 40-60 year age group • Expression of c-KIT (CD117) in ~95% of cases Kit Receptor Phenotype ADP ATP + P Proliferation Survival Adhesion Invasion Metastasis Angiogenesis Kit Receptor Phenotype ATP Proliferation Survival Adhesion Invasion Metastasis Angiogenesis = imanitib contact point Imatinib Mesylate (STI 571: Glivec) Formula: N N NH N NH O C30H35N7SO4 N MW: CH3SO3H N Inhibitor of selective tyrosine kinases bcr-abl Potent (IC50 0.1M) PDGF-R c-kit 589.7 PET Before and after Glivec for GIST 7/12/00 9/1/01 EORTC study: Imatinib for Advanced GIST Survival Benefit Verweij, et al 2004 c-Kit Receptor Structure Extracellular Domain (exon 9, 10.2%) Juxtamembrane Domain (exon 11, 66.1%) ATP Tyrosine Kinase Domain I (exon 13/14, 1.2%) Tyrosine Kinase Domain II (exon 17, 0.6%) = common mutation site Overall Survival by Genotype Survival Days Number at Risk 0 250 500 750 1000 1250 Exon 11 86 82 81 73 64 53 Exon 9 No Mutation 23 9 22 5 18 3 14 3 11 3 11 3 Median Survival P-value = 0.0012 100 Exon 11 Not reached Exon 9 1347 days No mut 250 days 90 Exon 1111 Exon Overall Survival (%) 80 70 60 Exon 9 50 40 30 No Mutation 20 10 0 0 250 500 750 Days 1000 1250 1500 Target therapy”? ….quale bersaglio?
Scaricare