Introduzione alle misure strumentali Metodi e strumenti per l’analisi strumentale Campionamento e preparazione dei campioni Presentazione dei risultati Introduzione alle separazioni cromatografiche Gas - Cromatografia Cromatografia liquida HPLC (High Performance Liquid Chromatography) Altri metodi di separazione cromatografica Lab. Chimica Analitica II Ottenere un campione rappresentativo Trasformare il campione in forma adatta all’analisi Rimuovere o mascherare le interferenze Eseguire l’analisi per interpretare correttamente i risultati occorre conoscere la storia del campione Lab. Chimica Analitica II La “misura” è un’invenzione, non una scoperta è convenzionale, come il linguaggio Non scopre nulla dell’oggetto, ma gli attribuisce un numero secondo delle regole Scopo: conoscenza dell’oggetto tipica della scienza, cioè attraverso un modello nell’ambito scientifico il modello è matematico Lab. Chimica Analitica II Natura convenzionale della misura necessità di una definizione operativa MISURARE indica qualunque processo che permetta di attribuire ad una data grandezza un numero La misura porta sempre ad un numero razionale o intero, mai al numero reale (inteso come separazione tra le due classi convergenti) Misurare Calcolare Es: 2 = 1.414213562… Uno strumento produce solo numeri con un numero finito di cifre significative Lab. Chimica Analitica II MISURA = numero composto da un insieme finito di cifre significative attribuito, tramite una convenzione operativa, ad una delle qualità di oggetti o di fenomeni per caratterizzarla quantitativamente Date due grandezze è sperimentalmente possibile stabilire: a) se sono uguali b) se una è maggiore dell’altra c) quale è la maggiore, quale la minore Lab. Chimica Analitica II Procedure operative - scala di confronto - numerosità degli insiemi di parti semplici - tramite un fenomeno fisico tali procedure presuppongono sempre una grandezza di riferimento Misure indirette Calcolate mediante la relazione matematica che sintetizza quel fenomeno nel modello Hanno valore solo nell’ambito di validità del modello Lab. Chimica Analitica II STRUMENTO: apparecchio o dispositivo per l’osservazione di fenomeni o grandezze fisiche 1. Accuratezza e precisione richiesta 2. Quantità di campione disponibile 3. Campo di concentrazione dell’analita 4. Presenza nel campione di componenti che possono causare interferenze 5. Proprietà fisiche e chimiche della matrice del campione 6. Numero di campioni da analizzare Lab. Chimica Analitica II Componenti di uno strumento tipo Lab. Chimica Analitica II Lab. Chimica Analitica II Esempi di parti componenti di uno strumento Lab. Chimica Analitica II Lab. Chimica Analitica II Distorsione: è definita dall’equazione distorsione = - x = media della popolazione dell’analita x = concentrazione reale del campione Sensibilità: Sensibilità di calibrazione: S = mc + Sb Sensibilità analitica: = m/ss Lab. Chimica Analitica II Limite di rivelabilità: Sm = Sb + k b (k = 3) S Sm = = k R Sb Sm - S b cm = m Limite quantitativo LQ 10 x b RSD 10 % Lab. Chimica Analitica II Selettività: S = maca + mbcb + mccc + Sb Ora, se: kb,a = mb/ma kc,a = mc/ma Otterremo: S = ma(ca + kb,a cb + kc,a cc) + Sb k 0 nessuna interferenza k >1 Lab. Chimica Analitica II Limite di utilizzabilità: Ulteriori fattori: 1. Velocità 2. Facilità e praticità 3. Abilità richiesta all’operatore 4. Costo e disponibilità della strumentazione 5. Costo per campione Lab. Chimica Analitica II Lab. Chimica Analitica II Per gli errori casuali la varianza è data da: s0 = deviazione standard globale sa = deviazione standard del procedimento analitico ss = deviazione standard del campionamento s02 sa2 ss2 In presenza di una miscela: nA nA nB nB q(B) 1 p nA nB p(A) Esempio: 1% KCl n npq 99% KNO3 KCl np (10 4 )(0.01) 100 npq (10 4 )(0.01)(0.99) 9.9 KCl ± 9.9% KNO3 Lab. Chimica Analitica II ± 0.1% 104 particelle = quanto campione? Ipotesi: Øparticelle = 1 mm Date: V 4 3 r 0.524l 3 dKCl = 1.984 g/ml dKNO3 = 2.109 g/ml g/ ml Lab. Chimica Analitica II
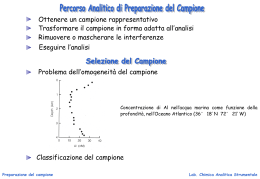
Scaricare