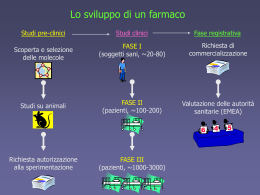
Facoltà di Scienze Motorie Università degli Studi di Verona Corso di “Farmacologia” Farmacologia Generale e Sperimentazione Clinica Docenti: Guido Fumagalli e Roberto Leone DEFINIZIONE DI FARMACO dell’Organizzazione Mondiale della Sanità “Qualunque sostanza usata allo scopo di modificare o studiare funzioni fisiologiche o stati patologici a beneficio di chi la riceve” DEFINIZIONE DI PLACEBO “Sostanza farmacologicamente inerte che può provocare un effetto sul paziente, sintomo, malattia” L’EFFETTO DI UN FARMACO E’ LEGATO SIA ALLA SUA ATTIVITA’ SPECIFICA CHE ALL’EFFETTO PLACEBO Origine dei farmaci I farmaci possono essere NATURALI o di SINTESI I naturali possono essere di origine: • Minerale es. bicarbonato • Vegetale es. digitale • Animale es. insulina • Biologica es. penicillina I sintetici possono essere: Analoghi di sostanze naturali (es. aspirina) Molecole chimiche non presenti in natura (es. diazepam) Va anche ricordato che farmaci (es. insulina, interferone, ecc.) possono essere prodotti utilizzando la BIOTECNOLOGIA (uso integrato di microbiologia, biochimica e ingegneria genetica in ordine all’applicazione della potenziale capacità di microrganismi, colture di tessuti o loro parti a produrre proteine) Specialità medicinale E’ il nome di fantasia con il quale le industrie farmaceutiche mettono in commercio un farmaco. Una specialità medicinale è costituita dal farmaco o principio attivo e da eccipienti (sostanze solide o semisolide quali vaselina, amido, ecc.) o veicoli (sostanze liquide, quali acqua, olio, alcool, ecc.) Esempio: il VALIUM (specialità medicinale) in capsule contiene DIAZEPAM (principio attivo) + amido, talco, lattosio (eccipienti) Una specialità medicinale può essere presente sul mercato sotto forma di diverse confezioni che differiscono tra loro o per la forma farmaceutica (compresse, supposte, sciroppo, iniezioni, ecc.) e/o per il dosaggio Esempio: il TENORMIN (atenololo, beta-bloccante, antiaritmico) Compresse da 100 mg Fiale per somm. endovenosa 5mg/10ml Uno stesso farmaco (principio attivo) può essere contenuto in più specialità medicinali, che possono essere identiche tra di loro o differire per dosaggio e/o formulazione Esempi AMOXICILLINA (principio attivo, penicillina): Alfamox, Amoflux, Amosol, Amox, Amoxillin, Amoxina, Bradimox solutab, Dodemox, Drupox, Genimox, Hydramox, Mopen, Moxiren, Neo-ampiplus, Neotetranase, Oralmox, Pamocil, Simoxil, Simplamox, Sintopen, Velamox, Zimox (specialità medicinali) ACIDO ACETILSALICILICO (principio attivo, FANS): Acesal, ASA Ratio, Aspirina, Aspirinetta, Aspro, Bufferin, Cardioaspirin, Cemirit, Kilios (specialità medicinali) Le specialità medicinali possono essere MONOCOMPOSTE, cioè contenere 1 principio attivo solamente o POLICOMPOSTE, cioè contenere più di un principio attivo. Queste ultime sono anche dette di ASSOCIAZIONE Esempi di specialità policomposte: BACTRIM (specialità medicinale) contiene due principi attivi con attività antibatterica: sulfametoxazolo + trimetoprim RIFATER (specialità medicinale) contiene tre principi attivi con attività antitubercolare: isoniazide + pirazinamide + rifampicina BLOPRESID (specialità medicinale) contiene due principi attivi con attività antiipertensiva: candesartan cilexetil + idroclorotiazide Specialità monocomposta Specialità policomposta Con il termine di farmaci generici si intendono i principi attivi commercializzati con la loro denominazione comune internazionale o con la denominazione scientifica seguita dal nome del produttore. Esempi: AMOXICILLINA (denominazione comune internazionale) NIMESULIDE DOROM (denominazione comune internazionale + nome del produttore). Per essere commercializzato in Italia un farmaco a denominazione generica deve avere le seguenti caratteristiche: • protezione brevettale scaduta • uguale composizione in termini di principi attivi, forma farmaceutica ed indicazioni terapeutiche rispetto ad una specialità medicinale autorizzata Sia le specialità medicinali che i farmaci a denominazione generica sono accompagnati da un foglietto illustrativo che contiene: • la descrizione dei principi attivi e degli eccipienti (o veicoli) da cui è composto; • l’indicazione della forma farmaceutica, del dosaggio e della via di somministrazione; • le indicazioni terapeutiche per le quali è autorizzato l’uso; • le controindicazioni, le avvertenze, le reazioni avverse principali e l’eventuali interazioni con altri farmaci Non sempre quanto riportato nei foglietti illustrativi è sufficientemente chiaro e/o veritiero (soprattutto questo avveniva in un recente passato); per questo i foglietti illustrativi vengono anche chiamati “bugiardini” La credibilità della brochure studio tedesco recensito sul BMJ 43 MMG hanno raccolto 175 brochure su 520 farmaci 15% delle brochure non avevano bibliografia 22% citava referenze inesistenti 57% citavano studi originali ma ne alteravano i risultati 58% dava immagine distorta del farmaco in esame Solo il 6% faceva affermazioni corrette sostenute da referenze rintracciabili BMJ 2004; 328: 425 Da un punto di vista terapeutico e quindi sulla base dei loro effetti i farmaci possono essere classificati come: ALCUNI ESEMPI SOSTITUTIVI insulina, ormoni tiroidei PREVENTIVI vaccini CURATIVI antibatterici SINTOMATICI FANS, benzodiazepine, antiipertensivi DIAGNOSTICI solfato di bario, tolbutamide, mezzi di contrasto Classificazione dei farmaci Gruppo A - APPARATO GASTROINTESTINALE E METABOLISMO STOMATOLOGICI (sodio fluoruro, clorexedina, benzidamina) ANTIACIDI (magnesio idrossido, alluminio ossido, magaldrato) ANTIULCERA PEPTICA • Antagonisti dei recettori H2 (ranitidina, famotidina) • Prostaglandine (misoprostolo) • Inibitori della pompa protonica (omeprazolo, pantoprazolo) • Altri (sucralfato, acido alginico) ANTIMETEORICI (simeticone) ANTISPASTICI (scopolamina butilbromuro, trimebutina, otilonio bromuro, tiropramide) PROCINETICI (metoclopramide, domperidone) ANTIEMETICI ED ANTINAUSEA (ondansetron, ganisetron) TERAPIA BILIARE ED EPATICA (acido ursodesossicolico, silimarina, ademetionina) LASSATIVI • Di contatto (bisacodil, senna, cascara) • Di volume (ispaghula, policarbofil) • Osmotici (magnesio, lattulosio, macrogol) • Clismi (glicerolo, sodio fosfato, docusato sodico) ANTIDIARROICI (loperamide) ANTIMICROBICI INTESTINALI (paranomicina, neomicina, miconazolo) ANTIINFIAMMATORI INTESTINALI (budesonide, sulfasalazina, mesalazina) FARMACI CONTRO L’OBESITÀ • Ad azione centrale (sibutramina) • Ad azione periferica (orlistat) DIGESTIVI (enzimi pancreatici, pepsina, betaina) FARMACI USATI NEL DIABETE • Insuline e analoghi (ad azione rapida, ad azione intermedia, ad azione lenta) • Ipoglicemizzanti orali (clorpropamide, metformina, glibenclamide, acarbosio) VITAMINE (A, B1, B6, B12, C, D, E) INTEGRATORI MINERALI (calcio, potassio) TONICI (arginina, cianocobalamina, levoglutamide) ANABOLIZZANTI SISTEMICI (nandrolone) STIMOLANTI DELL’APPETITO (assenzio, rabarbaro) Classificazione dei farmaci Gruppo B - SANGUE ED ORGANI EMOPOIETICI ANTITROMBOTICI • Anticoagulanti (warfarin, eparina) • Antiaggreganti piastrinici (ac. acetilsalicilico, ticlopidina) • Trombolitici (streptochinasi) ANTIEMORRAGICI (acido tranexamico, vitamina K) ANTIANEMICI (ferroso solfato bivalente, acido folico, eritropoietina) SUCCEDANEI DEL SANGUE E SOLUZIONI PERFUSIONALI (albumina, aminoacidi, soluzioni elettrolitiche) Gruppo C – SISTEMA CARDIOVASCOLARE GLICOSIDI CARDIACI (digitalici, strofantinici) ANTIARITMICI (chinidina di classe I, flecainide di classe II, amiodarone di classe III) STIMOLANTI CARDIACI (dopamina, dobutamina, adrenalina, isoprenalina, noradrenalina) VASODILATATORI USATI NELLE MALATTIE CARDIACHE (nitrati) ANTIPERTENSIVI (clonidina, doxazosina, minoxidil) DIURETICI (idroclorotiazide, clortalidone, indapamide, furosemide, ac. etacrinico, spironolattone) VASODILATATORI PERIFERICI (buflomedil, pentoxifillina) VASOPROTETTORI (idrocortisone e lidocaina come antiemorroidali, eparina come antivaricoso) BETABLOCCANTI (atenololo, metoprololo, labetalolo, carvedilolo) CALCIOANTAGONISTI (amlodipina, nifedipina, verapamil, diltiazem) SOSTANZE AD AZIONE SUL SISTEMA RENINA-ANGIOTENSINA (captopril, enalapril, losartan) SOSTANZE IPOLIPEMIZZANTI (statine come la simvastatina, e atorvastatina, fibrati come il gemfibrozil) Classificazione dei farmaci Gruppo D - DERMATOLOGICI ANTIMICOTICI PER USO DERMATOLOGICO (econazolo, miconazolo, griseofulvina) EMOLLIENTI E PROTETTIVI (zinco ossido, acido salicilico e zinco ossido) PREPARATI PER IL TRATTAMENTO DI FERITE ED ULCERAZIONI (acido ialuronico) ANTIPRURIGINOSI, INCLUSI ANTISTAMINICI E ANESTETICI (antistaminici come la prometazina, anestetici locali come la lidocaina, antipruriginosi come il levomentolo+ talco) ANTIPSORIASICI (calcipotriolo, metoxsalene, acitretina) ANTIBIOTICI PER USO DERMATOLOGICO (clortetraciclina, neomicina) CORTICOSTEROIDI PREPARAZIONI DERMATOLOGICHE (idrocortisone, betametasone, desametasone) ANTISETTICI E DISINFETTANTI (clorexidina, povidone-iodio, benzalconio cloruro) ANTIACNE (ictammolo, benzoile perossido idrato, isotretinoina) Gruppo G - SISTEMA GENITO-URINARIO ED ORMONI SESSUALI ANTIMICROBICI ED ANTISETTICI GINECOLOGICI (metronidazolo, econazolo, povidone-iodio) OXITOCICI (ergometrina, dinoprostone) TOCOLITICI (ritodrina) INIBITORI DELLA PROLATTINA (bromocriptina) CONTRACCETTIVI ORMONALI SISTEMICI (levonorgestrel ed etinilestradiolo, gestodene ed etinilestradiolo, desogestrel ed etinilestradiolo) ANDROGENI (testosterone) ESTROGENI (estradiolo, etilnilestradiolo) PROGESTINICI (medrossiprogesterone, progesterone) GONADOTROPINE ED ALTRI STIMOLANTI L’OVULAZIONE (gonadotropina corionica, follitropina alfa e beta) UROLOGICI •Antispastici urinari (flavoxato, oxibutinina) • Solventi dei calcoli biliari (kalnacitrato) • Farmaci usati nelle disfunzioni dell’erezione (sildenafil, alprostadil) • Farmaci usati nell’ipertrofia prostatica benigna (terazosina, finasteride) Classificazione dei farmaci Gruppo H - PREPARATI ORMONALI SISTEMICI ESCLUSI ORMONI SESSUALI ORMONI IPOFISARI, IPOTALAMICI ED ANALOGHI (ormoni ipofisari come la ACTH-adrenocorticotropina, e la vasopressina, ormoni ipotalamici come la somatostatina) CORTICOSTEROIDI SISTEMICI (mineralcorticoidi come il desossicortone, ed i glucocorticoidi come il cortisone ed il betametasone) TERAPIA TIROIDEA • Preparati tiroidei (levotiroxina sodica) • Preparati antitiroidei (tiamazolo) • Terapia iodica (iodiocaseina+tiamina) ORMONI PANCREATICI (glucagone) CALCIO-OMEOSTATICI (calcitonina) Gruppo J - ANTIMICROBICI GENERALI PER USO SISTEMICO ANTIBATTERICI (classi di farmaci: tetracicline, penicilline, cefalosporine, sulfamidici, macrolidi, antibiotici aminoglicosidici, fluorochinoloni, antibiotici glicopeptidici) ANTIMICOBATTERICI (isoniazide, rifampicina) ANTIVIRALI (aciclovir, zidovudina) SIERI IMMUNI ED IMMUNOGLOBULINE (come sieri il siero antivipera Pur.Nism, e come immunoglobuline le IGgamma, le IGM, antitetanica, ecc.) VACCINI • Batterici (vaccini dell’Hemophilus influenzae tipo B, vaccino meningococcico tetravalente, vaccino diftericotetanico-pertosse) • Virali (vaccino dell’influenza, dell’epatite A e B, vaccino del morbillo-parotite-rosolia, vaccino poliomielitico) Classificazione dei farmaci Gruppo L - ANTINEOPLASTICI ED IMMUNOMODULATORI ANTINEOPLASTICI (ciclofosfamide, metotrexato, fluorouracile, paclitaxel, cisplatino, ecc) TERAPIA ENDOCRINA • Ormoni (ormoni progestinici come il medrossiprogesterone, analoghi dell’ormone liberatore delle gonadotropine come la buserelina) • Antagonisti degli ormoni (antiestrogeni come il tamoxifene, ed antiandrogeni come la flutamide) IMMUNOSTIMOLANTI (citochine come la filgrastim e gli interferoni) IMMUNOSOPPRESSIVI (ciclosporina, tacrolimus) Gruppo M - SISTEMA MUSCOLO-SCHELETRICO FARMACI ANTIINFIAMMATORI NON STEROIDEI (nimesulide, diclofenac, ibuprofene, rofecoxib, celecoxib) SOSTANZE ANTIREUMATICHE SPECIFICHE (sali d’oro) FARMACI PER USO TOPICO PER DOLORI ARTICOLARI E MUSCOLARI (ketoprofene, diclofenac) MIORILASSANTI (atracurio besilato, baclofene, tiocolchicoside, dantrolene) ANTIGOTTOSI (allopurinolo, colchicina) FARMACI CHE AGISCONO SULLA MINERALIZZAZIONE (acido clodronico acido alendronico) Classificazione dei farmaci Gruppo N – SISTEMA NERVOSO ANESTETICI GENERALI (isoflurano, sevoflurano, propofol, tiopentale) ANESTETICI LOCALI (bupivacaina, lidocaina, mepivacaina) ANALGESICI OPPIOIDI (morfina, buprenorfina, fentanil, tramadolo) ALTRI ANALGESICI E ANTIPIRETICI • Acido salicilico e derivati (acido acetilsalicilico, diflunisal) • Pirazoloni (metamizolo, propifenazone) • Anilidi (paracetamolo) ANTIEMICRANICI (diidroergotamina, sumatriptan) ANTIEPILETTICI (fenobarbitale, fenitoina, carbamazepina, acido valproico) ANTIPARKINSONIANI (levodopa+benserazide, levodopa+carbidopa) PSICOLETTICI ANTIPSICOTICI (clorpromazina, aloperidolo, clozapina, litio, risperidone) ANSIOLITICI (benzodiazepine come il diazepam, lorazepam, alprazolam) IPNOTICI E SEDATIVI (benzodiazepine come il flurazepam, triazolam, midazolam) PSICOANALETTICI ANTIDEPRESSIVI • Triciclici non selettivi della monoammino ricaptazione (amitriptilina, clomipramina) • Inibitori selettivi della ricaptazione della serotonina (fluoxetina, citalopram, paroxetina) • Altri (trazodone, venlafaxina) PSICOSTIMOLANTI E NOOTROPI (piracetam, citicolina, acetilcarnitina) FARMACI ANTIDEMENZIA (donepezil, rivastigmina) FARMACI USATI NEI DISTURBI DA DISSUEFAZIONE (nella dipendenza da nicotina: nicotina; nella dipendenza da alcool: disulfiram; nella dipendenza da oppioidi:metadone) PREPARATI ANTIVERTIGINE (betaistina, flunarizina) Classificazione dei farmaci Gruppo P – FARMACI ANTIPARASSITARI, INSETTICIDI E REPELLENTI ANTIPROTOZOARI (contro l’ameba ed altre affezioni il metronidazolo, contro la malaria la clorochina) ANTIELMINTICI (mebendazolo, niclosamide) ECTOPARASSITICIDI, COMPRESI ANTISCABBIA, INSETTICIDI E REPELLENTI (prodotti contenenti zolfo o cloro) Gruppo R - SISTEMA RESPIRATORIO PREPARATI RINOLOGICI (oximetazolina, nafazolina, beclometasone, betametasone) PREPARATI PER IL CAVO FARINGEO (dequalinio cloruro, alcool diclorobenzilico, cetilpiridinio cloruro) ANTIASMATICI ADRENERGICI PER AREOSOL • Agonisti dei recettori beta2-adrenergici (salbutamolo, salmeterolo) ALTRI ANTIASMATICI PER AREOSOL • Glicocorticoidi (beclometasone, flunisolide, fluticasone) • Anticolinergici (ipratropio bromuro) • Sostanze antiallergiche (acido cromoglicico, nedocromil) ADRENERGICI PER USO SISTEMICO (efedrina, salbutamolo, clembuterolo) DERIVATI XANTINICI (teofillina, aminofillina, bamifillina) ANTAGONISTI DEI RECETTORI LEUCOTRIENICI (montelukast, zafirlukast) PREPARATI PER LA TOSSE E LE MALATTIE DA RAFFREDDAMENTO ESPETTORANTI (associazioni tra guaifenesina o solfoguaiacolo con eucaliptolo, canfora, timo) MUCOLITICI (acetilcisteina, carbocisteina, ambroxolo, sobrerolo) SEDATIVI DELLA TOSSE (destrometorfano, codeina in associazione con edera o feniramina, diidrocodeina, clobutinolo, oxalamina) ANTISTAMINICI PER USO SISTEMICO (difenidramina, desclorfeniramina, loratadina, ketotifene) SURFATTANTI POLMONARI (colfosceril palmitato, poractant alfa) STIMOLANTI RESPIRATORI (pretcamide, metacolina cloruro) Classificazione dei farmaci Gruppo S – ORGANI DI SENSO OFTALMOLOGICI ANTIMICROBICI (cloramfenicolo, gentamicina) ANTINFIAMMATORI (corticosteroidi: desametasone, fluorometolone; Fans: diclofenac) PREPARATI ANTIGLAUCOMA E MIOTICI (pilocarpina, timololo) MIDRIATICI E CICLOPLEGICI (atropina, tropicamide) DECONGESTIONANTI ED ANTIALLERGICI (nafazolina, ketotifene) DIAGNOSTICI (fluorescina) OTOLOGICI ANTIMICROBICI (neomicina e polimixina B) CORTICOSTEROIDI (flumetasone, desametasone in associazione con antimicrobici) ANALGESICI ED ANESTETICI (fenazone+procaina) Gruppo V - VARI ALLERGENI ANTIDOTI DIAGNOSTICI • Tests per il diabete (glucosio) • Tests di funzionalità ipofisaria (sermorelina) • Tests di funzionalità epatica (bromosolfoftaleina sodica) • Diagnostici della tubercolosi (tubercolina) • Tests per la funzionalità renale (fenolsolfonftaleina) • Tests per la funzionalità tiroidea (tireotropina alfa) • Tests allergologici AGENTI NUTRIZIONALI (proteine, aminoacidi come la lisina, treonina, tiroxina) SOLVENTI, DILUENTI E DETERGENTI (acqua per le preparazioni iniettabili) MEZZI DI CONTRASTO RADIOLOGICI •Iodati (iodamide, ioexolo, iopamidolo) • Non iodati (bario solfato) MEZZI DI CONTRASTO PER RISONANZA MAGNETICA (acido gadopentetico, acido gadoterico) MEZZI DI CONTRASTO PER ULTRASONOLOGIA (octofluoropropano) RADIOFARMACEUTICI DIAGNOSTICI • Sistema nervoso centrale (tecnezio e iodio) • Sistema renale (tecnezio) • Sistema cardiovascolare (tecnezio) • Rilevazione di tumori (tecnezio e indio) RADIOFARMACEUTICI TERAPEUTICI (trattamento palliativo del dolore) (samario lexidronam) L’arte di servirsi dei medicamenti per guarire le malattie è antica quanto l’umanità. Ippocrate nel De Veterum medicina scrive che: “ipsa necessitas coegit medicinam inquirere ac invenire”. In alcuni insediamenti preistorici, Parma, Varese, Moosseedorf, si sono rinvenuti i semi di Sambucus nigra e di Sambucus ebulus, che forse venivano utilizzati dall’uomo primitivo come medicamenti. Così come sono stati rinvenuti semi del Papaver somniferum . Nelle palafitte di Casale, in quelle di Bourget, che risalgono all’epoca del bronzo, si sono trovati i semi delle prugnole (Prunus spinosa) con i quali molto probabilmente venivano preparate quelle stesse pozioni e tisane medicamentose che nel medioevo Santa Ildergarda ricorda nel suo ricettario. Nelle palafitte di Lagozza ed in quelle di Robenhausen si sono rinvenuti i semi del Chenopodium, noto come purgante. Dalla necessità terapeutica al consumismo farmacologico Con l’avvento dell’industria farmaceutica i farmaci sono progressivamente diventati dei beni di consumo al pari di altri prodotti industriali. Una propaganda sempre più spinta, al limite del lecito, a portato ad un iperconsumo di farmaci, che vengono indicati come soluzione per qualsiasi problema (dalla mancanza di memoria, all’aumento della performance). Il numero di farmaci in commercio è elevato e non sempre i dati sulla loro efficacia sono supportati da evidenze scientifiche. L’altra faccia del problema è rappresentata dalla diseguaglianza nella disponibilità dei farmaci a livello mondiale (differenza tra i Paesi ricchi e quelli poveri). N. di sostanze medicinali in commercio in Italia nel 2006 707 1371 Sostanze medicinali singole Associazioni di sostanze medicinali N. di confezioni di specialità medicinali in commercio in Italia nel 2006 8092 Totale 9.495 1403 Confezioni monocomposte Confezioni policomposte Medicinali e parafarmaceutici confezioni in commercio in Italia nel 2006 293.314 3.119 118.465 9.495 Parafarmaceutici Medicinali generici Omeopatici Specialità Medicinali Ripartizione dei medicinali in Italia nel 2006 secondo la classificazione del SSN 7.143 4.434 Non concedibili SSN (classe C) Concedibili SSN (classe A) Concedibili SSN (classe H) 1.037 Ripartizione dei medicinali in Italia nel 2006 secondo le modalità di vendita 1300 10% 1028 8% 733 6% 1397 11% Ricetta medica ripetibile (RR, RRL) Ricetta medica non ripetibile (RNR, RNRL) Senza ricetta medica (SOP) Medicinali di automedicazione (OTC) 8156 65% Farmaci da ambiente ospedaliero o specialistico (OSP, USPL) OTC= Over the Counter (letteralmente “sopra il bancone”) è l’espressione inglese per i farmaci da banco vendibili senza prescrizione medica, sono i tipici farmaci da automedicazione; SOP= Senza Obbligo Prescrizione. La differenza con gli OTC è unicamente dovuta al fatto che per i SOP non si può fare la pubblicità Andamento del mercato farmaceutico italiano 30000 25000 N. Specialità N. Confezioni 20000 15000 10000 5000 0 0 60 70 80 90 98 99 00 01 02 03 04 05 06 4 19 19 19 19 19 19 19 20 20 20 20 20 20 20 Ricerca e Sviluppo (1975-1999): 1.393 farmaci commercializzati, 435 innovazioni terapeutiche (31,2%) Farmaci commercializzati che non sono innovazioni terapeutiche: 69% Innovazioni terapeutiche per Malattie Tropicali: 1% Innovazioni terapeutiche per altre patologie: 30% Fatturato del mercato farmaceutico ed incidenza della spesa per attività di ricerca – anno 2001 Paesi USA Giappone Germania Francia Italia Gran Bretagna Spagna Belgio Fatturato complessivo % spesa per ricerca 178.2 47.6 17.8 17.5 11.9 11.8 7.5 2.5 22.1 21.5 10.4 14.2 4.5 21.5 4.4 8.4 Farmaci commercializzati in Italia nel 2002 Copie (inclusi generici) Conf. Complementari Nuove Entità Terapeutiche 14% 14% 72% Giudizio della redazione di “Dialogo sui Farmaci” sui farmaci NET e conf. complementari del 2002 Inutili Ruolo incerto Disaccordo Più convenienti Innovativi 3% 25% 38% 8% 26% Giudizio della redazione di “Dialogo sui Farmaci” sui farmaci NET NET NET innovativi Numero di principi attivi 40 35 30 25 20 15 10 5 0 1999 2000 2001 anno 2002 Lo sviluppo di un farmaco Studi pre-clinici Studi clinici Fase registrativa FASE I (soggetti sani, ~20-80) Richiesta di commercializzazione Studi su animali FASE II (pazienti, ~100-200) Valutazione delle autorità sanitarie (EMEA) Richiesta autorizzazione alla sperimentazione FASE III (pazienti, ~1000-3000) Scoperta e selezione delle molecole Obiettivi degli studi pre-clinici DURATA: 2-3 anni 1a FASE 2a FASE • Caratteristiche farmacodinamiche – Effetto principale – Effetti collaterali – Durata dell’effetto Parametri farmacocinetici Assorbimento Distribuzione Metabolismo Eliminazione • Tossicità acuta – Variazioni dei parametri vitali – Determinazione DL50 •Stabilità chimica Tossicità subacuta e cronica Alterazioni funzionali Alterazioni anatomopatologiche Effetti teratogeni Effetti sulla fertilità Effetti sul periodo peri- e postnatale Prove di mutagenesi Prove di cancerogenesi Tecnica farmacuetica Formulazione Dosaggio Sperimentazioni cliniche di fase I OBIETTIVI • Tollerabilità nell’uomo • Dati di farmacocinetica • Schema di dosaggio da impiegare nella fase II SOGGETTI • Da 20 a 80 volontari sani (o pazienti in caso di farmaci ad alta tossicità) DURATA • 1-2 anni Sperimentazioni cliniche di fase II OBIETTIVI • Definizione della efficacia e tollerabilità nei pazienti • Individuazione del rapporto dose/effetto SOGGETTI • 100-200 pazienti DURATA • 1-2 anni Sperimentazioni cliniche di fase III OBIETTIVI • Acquisizione di dati di efficacia e tollerabilità su un ampio campione • Verifica del significato clinico delle interazioni farmacologiche prevedibili • Definizione finale del rapporto dose/effetto SOGGETTI • 1000-3000 pazienti DURATA • 3-4 anni Il dilemma della Farmacologia: la verifica dell’efficacia dei farmaci I PRIMI “STUDI CLINICI CONTROLLATI” In un testo di medicina del XVI sec si legge una delle più antiche esperienze farmacologiche fatte sull’uomo. Nell’antico Egitto a due condannati a morte fu donato da una donna un cedro, lo mangiarono e le morsicature degli aspidi non furono mortali. Saputa la cosa il re il giorno dopo diede del cedro ad uno dei due e non all’altro e li fece accompagnare nello stesso luogo. “quello che non aveva gustato cedro restò morto e quello che si haveva mangiato uscì vivo”. Nel 1545 Ambrose Parè, chirurgo francese, testa la capacità delle cipolle di guarire le ferite e le scottature avvolgendo alcune ferite, lasciandone scoperte altre e altre ancora trattandole con rimedi più tradizionali. Nel 1753 James Lind, un chirurgo navale scozzese, sceglie 12 marinai con lo scorbuto, il più simili possibile fra di loro, e confronta 6 trattamenti diversi per la malattia. I due marinai che ricevettero aranci e limoni guarirono più velocemente degli altri. 1948: spartiacque per gli studi clinici (da un editoriale del BMJ, 1998) Costituzione dello “Streptomycin in Tuberculosis Trial Committee” in Inghilterra Studio sulla streptomicina sulla tubercolosi polmonare su 107 pazienti di cui 55 trattati con streptomicina e riposo a letto (Gruppo S) e 52 solo con il riposo a letto (Gruppo C). Caratteristiche dello studio: Tubercolosi polmonare acuta progressiva bilaterale Età compresa fra 15 e 25 anni (in seguito 30) Randomizzazione nell’assegnazione ai gruppi Analisi dei risultati dopo 6 mesi Risultati: Morirono 4 su 55 pazienti del gruppo S e 14 su 52 pazienti del gruppo C. Il risultato è statisticamente significativo e la probabilità che sia dovuto al caso è inferiore a 1 su 100. L’evoluzione nel tempo delle sperimentazioni cliniche Fino agli anni 30 Trials non controllati Anni 30-50 Trials controllati non randomizzati Anni 50-80 Trials controllati randomizzati Anni 80- Mega trials, Meta-analisi, Review sistematiche Evidence Based Medicine Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Il controllo Gruppi paralleli: ciascuno dei quali assume un trattamento diverso Trattamento Gruppo A (farmaco X) Gruppo B (farmaco Y o placebo) Cross-over: ciascun gruppo riceve entrambi i trattamenti I fase trattamento Gruppo A (farmaco X) Gruppo B (farmaco Y o placebo) II fase trattamento Il vantaggio di un disegno cross-over è essenzialmente quello di consentire un campione più limitato, in quanto si sfruttano maggiormente i pazienti arruolati e si diminuisce la variabilità (si confrontano nello stesso gruppo gli effetti del secondo trattamento rispetto al primo) Gli svantaggi sono l’applicabilità solo a trattamenti cronici, la possibilità che il primo trattamento influenzi il secondo (effetto carry-over), la complessità nella gestione e nell’analisi. Per evitare l’effetto carry-over sarebbe necessario un periodo di wash-out (no trattamento) Sperimentazioni con controlli storici (HCTs) Tutti i pazienti elegibili ricevono il trattamento sperimentale Si utilizzano come controlli pazienti osservati in precedenza e trattati con terapia tradizionale I dati dei controlli sono retrospettivi, di solito ricavati dalle cartelle cliniche Sperimentazioni con controlli storici (HCTs): limiti Limiti di completezza e attendibilità delle cartelle cliniche Bias di risultati falsi positivi: i pazienti che ricevono il trattamento sperimentale si avvantaggiano di progressi diagnostici e terapeutici successivi al periodo di osservazione dei controlli BIAS Con questo termine si indica una forma di distorsione introdotta nei risultati I bias possono essere prevenuti attraverso un adeguato disegno sperimentale e una corretta esecuzione dello studio I bias non si possono evitare attraverso l’ampliamento della casistica Sperimentazioni non controllate prospettabili solo se: • Malattia con decorso prevedibile ad esito fatale • Efficacia del nuovo trattamento drammaticamente evidente in osservazioni iniziali • Effetti sfavorevoli accettabili in confronto al beneficio • Assenza di trattamenti alternativi di confronto • Plausibilità biologica e farmacologica di efficacia Byar DP. NEJM 1990; 323: 1343 Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Randomizzazione dei pazienti (assegnazione casuale) Randomizzazione (random = a caso) Rappresenta, assieme al controllo, la caratteristica fondamentale dei trial clinici I pazienti, reclutati sulla base dei criteri di inclusione ed esclusione stabiliti a priori, vengono assegnati al trattamento sperimentale o a quello di controllo mediante una forma più o meno sofisticata di sorteggio (ad esempio generazione da parte di un computer di sequenze numeriche casuali) La procedura di randomizzazione deve essere tale da rendere imprevedibile a quale trattamento verrà assegnato il paziente successivo Con la randomizzazione si riescono ad ottenere (almeno teoricamente) gruppi omogenei tra di loro per tutte le caratteristiche note ed ignote (es. età, sesso, gravità patologia, abitudini di vita, ecc.) L’omogeneità tra i gruppi sarà maggiore anche in relazione alla numerosità del campione La stratificazione: suddividere, prima di randomizzare, il campione in sottogruppi Il paradosso della umpredictability: La randomizzazione nell’assegnazione del trattamento introduce l’imprevedibilità con lo scopo di evitare l’imprevedibilità nel numero e tipo di errori nei trial clinici Kunz and Oxman, BMJ, 1998 Sperimentazioni controllate, non randomizzate: limiti L’assegnazione non random dei trattamenti è prevedibile e può essere modificata dalla preferenza del ricercatore a favore di uno dei due trattamenti: i gruppi a confronto non sono più comparabili Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Randomizzazione dei pazienti (assegnazione casuale) Cecità La cecità: per vedere bene Singolo cieco: solo il soggetto sotto sperimentazione non sa quale trattamento sta ricevendo Doppio cieco: sia il soggetto sotto sperimentazione che gli sperimentatori non sanno quale trattamento si assume/somministra Doppio simulato: metodica utilizzata per mantenere la cecità quando si confrontano farmaci somministrati per vie diverse tra di loro In aperto: sperimentazione senza cecità. Accettabile quando si confrontano terapie diverse e/o complesse La cecità: per vedere bene Non conoscere il trattamento che si riceve (paziente) o che si somministra (sperimentatore) impedisce di essere influenzati dalle aspettative che si hanno rispetto al trattamento Altrettanto importante è essere ciechi nella valutazione dei risultati della sperimentazione, soprattutto se gli end-points sono sfumati o di difficle interpretazione Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Randomizzazione dei pazienti (assegnazione casuale) Cecità Definizione dei criteri di inclusione ed esclusione dei pazienti Criteri di inclusione ed esclusione I criteri di inclusione, es. donne di età tra 18 e 45 anni con tumore al seno di grado II senza metastasi con coinvolgimento linfonodale (3-6 linfonodi positivi), e i criteri di esclusione, es. precedenti patologie tumorali, diabete, ipertensione arteriosa, gravidanza o allattamento vanno definiti con chiarezza prima di iniziare la sperimentazione. Generalmente i criteri di esclusione tendono a salvaguardare determinati soggetti a rischio dai possibili danni del trattamento sperimentale Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Presenza di un gruppo di controllo (miglior farmaco già esistente o in sua mancanza il placebo) Randomizzazione dei pazienti (assegnazione casuale) Cecità Definizione dei criteri di inclusione ed esclusione dei pazienti Rappresentatività del campione rispetto alla popolazione che assumerà il farmaco e sua adeguata dimensione Popolazione studiata Sottogruppo della popolazione generale determinato dai criteri di inclusione/esclusione Popolazione Generale Criteri di elegibilità Popolazione studiata Arruolamento Campione studiato Dimensione del campione Ricordarsi che lo studio è un esperimento che coinvolge persone La numerosità del campione deve essere tale da rispondere agli obiettivi dello studio Non dovrebbero mai essere arruolate più persone di quelle necessarie La dimensione del campione è una stima basata su criteri statistici INFERENZA STATISTICA CAMPIONE POPOLAZIONE La popolazione è la collettività di soggetti oggetto di studio Il campione è il gruppo di soggetti estratti dalla popolazione La casualità del campione consente di utilizzare le procedure dell’inferenza statistica trasferendo i risultati alla popolazione Il problema dei trial clinici è la definizione della popolazione (criteri di inclusione ed esclusione) e l’estrapolazione dei risultati ad una popolazione più generale rispetto a quella oggetto dello studio MONDO IRREALE MONDO REALE Sperimentazioni cliniche premarketing Pratica medica quotidiana Numero limitato di pazienti Durata limitata e stabilita Pazienti selezionati Numero illimitato di pazienti Durata variabile Pazienti non selezionati Patologie multiple Politerapia Rappresentatività del campione I risultati di uno studio sono estrapolabili solo a pazienti simili a quelli reclutati Criteri di inclusione troppo rigidi non permettono di sapere se l’intervento in sperimentazione avrebbe gli stessi risultati nella popolazione Problema donne in gravidanza, ultra anziani, bambini, spesso esclusi dalle sperimentazioni ma poi trattati quando i farmaci entrano in commercio Efficacy = il grado di miglioramento e la proporzione di “responsivi” in una ben definita e selezionata popolazione (‘clinical trial’) Effectiveness = la performance del farmaco in un determinato paziente o nella popolazione reale Una medicina efficace può , per diversi motivi, essere inefficace in un determinato paziente o in un determinato gruppo di pazienti Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Definizione chiara degli obiettivi (end-points) dello studio End points Diretti efficacy (mortalità totale, mortalità causa-specifica, eventi non fatali) Indiretti o surrogati variazioni parametri di laboratorio Hard di sicura determinazione, per la verifica dei quali l’errore è minimo (mortalità) Soft possono essere influenzati da imprecisioni o soggettività (es. miglioramento di un quadro sintomatologico) Esempi di end points surrogati Trattamento Encainide, Flecainide, Moricizina: Extrasistolia ventricolare post-IMA (1) End point surrogato Soppressione extrasistoli End point clinico mortalità Milrinone: insufficienza Cardiaca (2) portata circolatoria mortalità Na fluoruro: Osteoporosi (2) densità minerale ossea incidenza fratture (1) Epstein AE & al. JAMA 1993; 270:2451 (2) Da: Fleming TR & al Ann Intern Med 1996;125:605 La qualità della vita come obiettivo dei trial Qualità della vita La qualità della vita viene indagata attraverso questionari complessi che tengono conto dei diversi domini che compongono la sfera della salute I questionari devono essere somministrati prima, durante e dopo il trattamento che si vuole valutare Uno dei campi dove maggiormente viene studiata la qualità della vita correlata ad una terapia è quello oncologico Eventi che possono interferire nelle misurazioni della Qualità della Vita (in ordine crescente d’influenza) Studio americano su 824 maschi ipertesi Infrazioni della Legge Importanti modificazioni nelle abitudini del sonno Importanti modificazioni nelle condizioni lavorative Problemi con il capoufficio (o equivalente) Morte di un amico Difficoltà sessuali Licenziamento Importanti malattie personali Morte di un familiare Divorzio Morte della moglie Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Definizione chiara degli obiettivi (end-points) dello studio Analisi dei risultati in base a “intention to treat” o “by treatment” Analisi dei risultati Intention to treat: i risultati vengono analizzati tenendo conto anche dei soggetti che si intendevano trattare e che per qualche motivo non sono stati trattati In questo modo la randomizzazione è l’unico elemento che determina la formazione dei gruppi Fornisce una stima pragmatica del beneficio di un intervento piuttosto che dei potenziali benefici nei pazienti che lo ricevono effettivamente Si può applicare solo quando sono disponibili i dati di esito per tutti i soggetti randomizzati Molti trials mancano dei dati sugli esiti e l’analisi dei risultati spesso non è descritta né applicata adeguatamente (vedi esempio diapositiva successiva) Molti trial clinici, ancora oggi, non sono analizzati in base all’intention to treat Randomised controlled trials identified for assessment Journal No of trials No (%) reporting intention to treat BMJ 42 18 (43) JAMA 35 15 (43) Lancet 84 45 (54) N Engl J Med 88 41 (47) Total 249 119 (48) Criteri fondamentali per una corretta sperimentazione clinica sui farmaci Definizione chiara degli obiettivi (end-points) dello studio Analisi dei risultati in base a “intention to treat” o “by treatment” Eticità della sperimentazione Consenso informato dei partecipanti Sperimentazione clinica ed etica: un dibattito che nasce nel ‘800 Gli sperimenti di Neisser su prostitute non consenzienti 29 dicembre del 1900: circolare del Ministero degli affari sociali, educazione e medicina della Prussia che vieta la sperimentazione senza consenso Albert Neisser (1855-1916) Ai primi del ‘900 il medico russo Smidovich pubblica The confessions of a physician dove ricostruisce le pratiche cliniche in tutto il mondo e in vari settori della ricerca, mettendo in luce i notevoli problemi etici esistenti In Italia nel 1871 il Monitore dei Tribunali si interroga, in un editoriale, sugli aspetti etici e giuridici delle sperimentazioni farmacologiche Le tragedie della sperimentazione non etica La sperimentazione umana nei lager nazisti e giapponesi Dr. Joseph Mengele (1911-?) Nel 1972 il New York Times dà notizia di uno studio, iniziato nel 1932, condotto a Tuskegee (Alabama) su ignari uomini neri ammalati di sifilide che non vengono trattati per seguire l’evoluzione naturale della malattia Nel 1953 sempre negli USA viene autorizzata la sperimentazione degli effetti di armi chimiche, biologiche e atomiche su “volontari” (progionieri comuni o militari Secondo una recente inchiesta negli USA dal 25 al 50% dei soggetti coinvolti negli studi clinici non sanno a cosa hanno dato il consenso, ne sanno citare un possibile rischio o complicazione del trattamento cui hanno aderito Requisiti etici per una corretta sperimentazione clinica Validità scientifica e valore scientifico Bad science = bad ethics La validità scientifica non comporta inevitabilmente l’eticità di una sperimentazione, è necessaria anche una eticità del metodo Good science non sempre = good ethics CONSENSO INFORMATO LIMITI • ATTO BUROCRATICO • PRETESTO PER ESCLUDERE UNA COMUNICAZIONE IDEALE • PREVARICAZIONE DELLA VOLONTA’ DEL PAZIENTE I trial clinici randomizzati condotti secondo i criteri esposti rappresentano lo strumento migliore a disposizione per ottenere delle evidenze scientifiche Altri tipi di studio sono tuttavia possibili e possono dare dei risultati importanti Evidence Based Medicine La “forza” dell’evidenza in relazione al tipo di studi effettuati Livello Tipo di studi 1 Megatrial 2 Meta-analisi 3 Trial Clinici Randomizzati 4 Studi di coorte controllati 5 Studi caso-controllo 6 Serie di casi 7 Opinioni di esperti senza riferimenti ad un tipo di studio sopracitato Rassegne tradizionali • Mix inestricabile tra studi originali e opinione dell’autore, perché non sono basate su una ricerca sistematica delle evidenze disponibili, ma su una selezione Obiettivi molto ampi (epidemiologia, eziologia, anatomia patologica, presentazione clinica, diagnosi, prognosi, prevenzione e trattamento) • Il processo di selezione, interpretazione e sintesi delle evidenze non è reso esplicito e risulta poco riproducibile e non verificabile Strumento utile per una conoscenza generica, ma poco utile per fornire risposte quantitative a specifici quesiti clinici. Studi di coorte e studi caso-controllo Esposizione al farmaco STUDI DI COORTE Reazione avversa Esposizione al farmaco STUDI CASO-CONTROLLO Reazione avversa Gli studi di coorte sono tipicamente prospettici mentre gli studi caso-controllo sono retrospettivi (anche se il reclutamento può essere prospettco) Revisioni sistematiche e meta-analisi Una revisione sistematica è una overview degli studi primari che usa espliciti e riproducibili metodi Una meta-analisi o revisione sistematica quantitativa, è una sintesi matematica dei risultati di due o più studi che affrontano una stessa ipotesi con la stessa metodologia Sebbene le meta-analisi possano aumentare la precisione di un risultato, è importante assicurarsi che la metodologia sia applicata correttamente L’efficacia dei farmaci è un piatto della bilancia. L’altro piatto è rappresentato dalle reazioni avverse
Scaricare