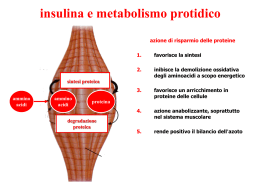
PANCREAS ENDOCRINO ANATOMIA FUNZIONALE DEL PANCREAS E’ formato da due tipi di tessuto: gli acini, che secernono enzimi digestivi e gli isolotti di Langerhans che secernono nel sangue insulina e glucagone. Nell’uomo ci sono 1-2 milioni di isole (diametro 0.3 mm) organizzate attorno a piccoli capillari. Le isole di Langerhans contengono tre tipi di cellule che secernono ormoni diversi. Cellule beta (60%) che secernono insulina Cellule alfa (25%) che secernono glucagone Cellule delta (10%) che secernono somatostatina Le strette relazioni tra queste cellule consentono un controllo reciproco. Ad es. l’insulina inibisce la secrezione di glucagone e la somatostatina inibisce la secrezione sia di insulina che di glucagone. INSULINA SINTESI DELL’INSULINA E’ una piccola proteina (PM 5.808) composta da 2 catene lineari di aminoacidi unite da ponti disolfurici. Se vengono separate perdono la loro attività. L’insulina viene impacchettata in granuli secretori. Durante la maturazione nei granuli secretori l’insulina si associa a zinco. La sintesi di insulina è stimolata dal glucosio e inibita dal digiuno. SECREZIONE DELL’INSULINA E’ promossa da vari fattori. Il più importante e studiato è il glucosio. Sulla membrana delle cellule beta è presente un trasportatore specifico per il glucosio, il Glut-2 che facilita l’entrata di glucosio. L’enzima glucochinasi provoca la fosforilazione di glucosio. Aumenta l’ossidazione di glucosio. Aumentano i livelli di ATP. Un canale K+ sensibile all’ATP si chiude e la membrana di depolarizza. Si apre un canale del Ca++ voltaggio-dipendente e entra calcio. Il calcio attiva il processo di secrezione per esocitosi. Tutti questi processi avvengono entro 1 minuto. Acidi grassi e aminoacidi. Si ritiene evochino un effetto analogo a quello del glucosio tramite aumento di ATP. I farmaci che chiudono/aprono il canale stimolano/inibiscono la secrezione di insulina. per K+ TRASPORTO E METABOLISMO DELL’INSULINA. Per la maggior parte circola non legata a proteine di trasporto ed ha emivita di 6 minuti. Viene degradata nel fegato e nel rene. Una quota viene degradata anche nelle cellule bersaglio (internalizzazione dell’insulina legata al recettore). RECETTORI PER L’INSULINA L’insulina si combina con una proteina recettrice di membrana e la attiva. Il recettore per l’insulina è una combinazione di 4 subunità. Due subunità alfa sono all’esterno della membrana e due subunità beta protrudono nel citoplasma. Quando l’insulina si lega alle subunità alfa ciò provoca un processo di autofosforilazione delle subunità beta. Le subunità beta vengono attivate ed assumono la funzione di proteinchinasi. La proteinchinasi provoca la fosforilazione di enzimi del citosol. L’effetto netto è l’attivazione di alcuni enzimi e l’inattivazione di altri. L’insulina inoltre determina un aumento di fattori di trascrizione che stimolano la trascrizione di geni fondamentali per la crescita cellulare. AZIONI CELLULARI DELL’INSULINA Rende più permeabili al glucosio le membrane di molte cellule del corpo, in particolare le cellule muscolari e le cellule adipose (nel tessuto muscolare e adiposo è espresso uno specifico trasportatore di membrana, il Glut-4, che facilita l’entrata di glucosio lungo il suo gradiente chimico. L’insulina determina un rapidissimo trasferimento di Glut-4 dal pool di vescicole del citoplasma alla membrana plasmatica. Pertanto, nel giro di 1 minuto aumenta l’entrata di glucosio nelle cellule. Il glucosio viene subito fosforilato ed utilizzato nei processi del metabolismo glucidico. Aumenta la permeabilità della membrana cellulare agli amino acidi, potassio, magnesio, fosfato, con un meccanismo indipendente dal precedente. Modifica (entro 10-15 min) i livelli di attività di molti enzimi del metabolismo intracellulare, per variazioni del loro stato di fosforilazione. Modifica (entro ore-giorni) i processi di traduzione di RNA messaggeri a livello dei ribosomi e di trascrizione del DNA nucleare. EFFETTI DELL’INSULINA SUL METABOLISMO DEI CARBOIDRATI Dopo un pasto ricco di carboidrati il glucosio assorbito nel sangue provoca un aumento di secrezione di insulina. L’insulina determina la rapida assunzione, l’immagazzinamento o l’utilizzazione del glucosio da parte di quasi tutti i tessuti, ma in particolare da parte di •muscoli • fegato • tessuto adiposo Effetti nel muscolo In condizioni basali la membrana delle cellule muscolari è poco permeabile al glucosio. Il muscolo a riposo e nel periodo lontano dai pasti dipende per le sue richieste di energia dagli acidi grassi. Nel periodo postprandiale aumenta la concentrazione plasmatica di glucosio, il pancreas secerne molta insulina. L’insulina provoca rapido ingresso di glucosio nelle cellule muscolari. Le cellule muscolari utilizzano glucosio preferendolo agli acidi grassi, la cui mobilizzazione è inibita dall’insulina. Se il muscolo non è in attività il glucosio viene immagazzinato in glicogeno. Effetti sul fegato La maggior parte del glucosio assorbito dopo un pasto viene immagazzinato nel fegato come glicogeno. Inibisce la fosforilasi epatica, l’enzima che promuove la scissione del glicogeno epatico in glucosio. Provoca aumento dell’assunzione di glucosio da parte delle cellule epatiche in quando induce un aumento dell’attività della glucochinasi, l’enzima che promuove la fosforilazione iniziale del glucosio. Aumenta l’attività degli enzimi che promuovono la sintesi di glicogeno (fosfofruttochinasi, responsabile della fosforilazione del glucosio e la glicogenosintatasi, responsabile della polimerizzazione). Con questi processi l’insulina aumenta il glicogeno epatico che può arrivare a 100 grammi. Il fegato, pertanto, provvede a rimuovere l’eccesso di glucosio dal sangue dopo un pasto, per restituirlo se necessario nell’intervallo tra i pasti. Altri effetti dell’insulina nel fegato. Promuove la conversione del glucosio in eccedenza in acidi grassi, se la quantità di G che entra nelle cellule epatiche è maggiore rispetto a quella che può essere convertita in glicogeno. Questi acidi grassi vengono poi trasportati al tessuto adiposo e immagazzinati come grassi di deposito. Inibisce la gluconeogenesi. Ciò avviene in quanto l’insulina 1) diminuisce gli enzimi epatici necessari per tale processo e 2) inibisce la liberazione di aminoacidi dai muscoli e da altri tessuti. Effetti sul tessuto adiposo e altri tessuti. L’insulina promuove l’entrata di glucosio e la sua utilizzazione anche nelle cellule adipose e altri tessuti analogamente a quanto avviene nelle cellule muscolari. L’entrata di glucosio nelle cellule adipose è essenziale per la deposizione di grasso. Mancanza di effetti dell’insulina sul tessuto cerebrale. L’insulina ha effetto scarso o nullo sull’assunzione di glucosio da parte delle cellule cerebrali le quali sono permeabili al glucosio in assenza di insulina. Normalmente le cellule cerebrali usano solamente glucosio per le loro richieste energetiche. Perciò è essenziale che la concentrazione ematica di glucosio sia sempre sopra un certo livello critico. Se la glicemia scende sotto 20-50 mg/100 ml compaiono i sintomi di shock ipoglicemico, caratterizzato da irritabilità, perdita della coscienza, convulsioni, coma. EFFETTI DELL’INSULINA SUL METABOLISMO DEI GRASSI L’insulina agisce sul metabolismo dei grassi e questa azione a lungo termine è importante quanto quella sul metabolismo dei carboidrati. Gli effetti dell’insulina portano tutti all’immagazzinamento di grassi nel tessuto adiposo. Ciò avviene in quanto l’insulina: Aumenta l’assunzione di glucosio. Questo porta a risparmio dei grassi. Aumenta nel fegato la sintesi di acidi grassi che verranno convertiti in trigliceridi e trasportati con le lipoproteine alle cellule adipose. Aumenta la sintesi di acidi grassi nelle cellule adipose. Effetti dell’insulina sulla sintesi epatica di acidi grassi. Poichè l’insulina promuove il trasporto di glucosio nelle cellule epatiche, aumenta la sintesi di glicogeno. Quando la concentrazione epatica supera il 5-6% viene inibita una ulteriore sintesi e tutto il glucosio che entra è disponibile per la formazione di grassi. Quando viene usato molto glucosio a scopo energetico, si forma malonil-CoA, che è la prima tappa della sintesi dei grassi. Gli acidi grassi vengono convertiti in trigliceridi, liberati dal fegato e trasportati nel plasma con le lipoproteine. L’insulina attiva la lipoproteinlipasi presente nelle pareti dei capillari del tessuto adiposo. Gli acidi grassi liberati entrano nelle cellule adipose dalle quali sono di nuovo convertiti in trigliceridi e immagazzinati. Effetti dell’insulina sul deposito di grassi nelle cellule adipose. L’insulina esplica due effetti essenziali per il deposito di grassi. Inibisce l’azione della lipasi ormono-sensibile. Questo enzima promuove l’idrolisi dei trigliceridi già depositati nelle cellule adipose. La sua inibizione pertanto inibisce la liberazione di grassi nel plasma. Promuove il trasporto di glucosio nelle cellule adipose. Una piccola parte del glucosio viene utilizzata per formare acidi grassi. La degradazione di glucosio tramite la glicolisi porta alla formazione di glicerolo che si combina con gli acidi grassi a formare trigliceridi. Perciò quando manca insulina è bloccato l’immagazzinamento degli acidi grassi trasportati dal fegato con le lipoproteine. EFFETTI DELL’INSULINA SUL METABOLISMO DELLE PROTEINE L’insulina promuove la sintesi di proteine e ne impedisce la degradazione. Effetti dell’insulina sulla sintesi di proteine. Durante le prime ore dopo un pasto vengono immagazzinati nei tessuti non solo carboidrati e grassi, ma anche proteine. I meccanismi sono i seguenti. l’insulina: promuove il trasporto attivo di molti aminoacidi nelle cellule. provoca un aumento della traduzione di RNA messaggero, con formazione di nuove proteine. provoca aumento della trascrizione di determinate sequenze di DNA dando luogo alla formazione di maggiori quantità di RNA e quindi sintesi di proteine. inibisce il catabolismo delle proteine, riducendo la quantità di aminoacidi liberati dalle cellule (in particolare muscolari). deprime la gluconeogenesi epatica in quanto riduce l’attività degli enzimi che ne sono alla base. Questo concorre a conservare il patrimonio proteico dell’organismo. Effetto dell’insulina sulla crescita Poichè è necessaria per la sintesi di proteine, l’insulina è essenziale per la crescita, analogamente all’ormone somatotropo. Questi due ormoni hanno una azione sinergica nel promuovere la crescita. CONTROLLO DELLA SECREZIONE DI INSULINA La secrezione di insulina viene regolata da parte dei principi nutritivi introdotti con la dieta tramite un meccanismo a feedback. Quando l’apporto di substrati è elevato, aumenta la secrezione di insulina. Glucosio plasmatico. Il glucosio è il principale fattore stimolante. La secrezione di insulina viene controllata con un meccanismo di feedback dal glucosio plasmatico. Stimolazione della secrezione di insulina da parte del glucosio plasmatico. Se la glicemia aumenta bruscamente e viene mantenuta elevata, si può osservare che la secrezione di insulina aumenta in due fasi distinte. Ai valori normali di glicemia a digiuno, 80-90 mg/100 ml, la secrezione di insulina è minima. Se la glicemia aumenta bruscamente e viene mantenuta elevata, si può osservare che la secrezione di insulina aumenta in due fasi distinte. Il primo aumento avviene entro 3-5 minuti ed è dovuto all’insulina preformata e immessa in circolo dalle cellule beta. Il secondo aumento raggiunge in 2-3 ore un plateau ed è dovuto alla sintesi e liberazione di nuova insulina. Relazione tra glucosio ematico e secrezione di insulina. L’andamento della relazione tra glucoaio plasmatico e insulina è di tipo sigmoide. Aminoacidi plasmatici. Molti aminoacidi stimolano la secrezione di insulina. Tuttavia l’effetto è molto modesto in assenza di iperglicemia. La associazione degli aminoacidi e dell’iperglicemia provoca un effetto doppio rispetto a quello della sola iperglicemia. Ormoni gastrointestinali. Dopo un pasto si liberano dall’apparato gastrointestinale vari ormoni. Gastrina Secretina Colecistochinina Peptide gastrico inibitorio Provocano aumento della secrezione di insulina, facendola aumentare in anticipo in vista dell’assorbimento intestinale di glucosio e di aminoacidi. Altri ormoni Ormone della crescita Cortisolo Glucagone Stimolano la secrezione di insulina o direttamente o indirettamente. L’importanza dell’effetto stimolante sta nel fatto che una prolungata/eccessiva secrezione di uno di essi può portare ad esaurimento le cellule beta degli isolotti e provocare perciò diabete. Somatostatina. E’ un peptide (14 AA) prodotto dalle cellule delta degli isolotti. La sua secrezione è stimolata da tutti i fattori correlati all’ingestione di cibo. Agisce localmente deprimendo la secrezione di insulina. MALATTIE DEL PANCREAS ENDOCRINO Una disfunzione del pancreas endocrino può causare diabete mellito. Nella maggior parte dei casi il diabete mellito è dovuto a diminuita secrezione di insulina da parte delle cellule beta. Fisiopatologia del diabete mellito. La carenza di insulina provoca alterazioni metaboliche accompagnate da specifiche conseguenze e segni. Alterazioni metaboliche. Diminuita utilizzazione del glucosio e quindi aumento della glicemia (300-1200 mg/100 ml). Aumento della mobilizzazione dei grassi con deposizione di lipidi nelle pareti vasali e aterosclesori. Deplezione del patrimonio proteico dei tessuti. Glicosuria. Il glucosio filtrato di norma viene riassorbito completamente dal rene. Quando la glicemia supera il valore di 180 mg/100 ml il sistema di trasporto non è in grado di riassorbire tutto il glucosio filtrato che di conseguenza viene perso con le urine. Disdratazione. Nel diabete grave la glicemia può diventare pari a 1200 mg/100 ml. Poichè il glucosio non può diffondere nelle cellule esercita forze osmotiche e provoca il richiamo di acqua con conseguente disidratazione cellulare. Inoltre, la presenza di glucosio a livello dei tubuli renali esercita forze osmotiche che riducono il riassorbimento di acqua. Di conseguenza aumenta la diuresi (diuresi osmotica). Acidosi e coma. Quando l’organismo usa a fini energetici prevalentemente i grassi, aumenta nei liquidi corporei la concentrazione di acido acetoacetico, beta-idrossibutirrico e di acetone. I primi due sono acidi e di conseguenza si abbassa il pH del sangue e si instaura uno stato di acidosi. Nei casi gravi di diabete non trattato questo può portare a coma acidotico e morte nel giro di poche ore. Altri sintomi. Come conseguenza egli effetti sopra citati, nel diabete si manifestano i seguenti sintomi. Poliuria Polidipsia Polifagia Dimagramento Astenia Diagnosi del diabete mellito. Si basa sui risultati di analisi chimiche sull’urina e sul sangue. Glicosuria. In genere nei soggetti normali non sono presenti quantità apprezzabili di glucosio nelle urine. Glicemia a digiuno. Il tasso glicemico a digiuno è di 80-90 mg/100 ml. Un valore superiore a 110 mg/100 ml è spesso indicativo di diabete mellito. Prova di tolleranza al glucosio. Si somministra un carico di glucosio (in genere 1g per Kg di peso) e si osserva la velocità con la quale la glicemia si riduce nel sangue. Nel soggetto normale la glicemia aumenta fino a 120-140 mg/100 ml e ricade al valore normale entro circa due ore. Nel soggetto diabetico la glicemia, già alta in partenza. aumenta molto più che nel soggetto normale e ridiscende al valore iniziale solo dopo 4-6 ore. GLUCAGONE Il glucagone ha azione opposta a quella dell’insulina. La sua funzione più importante è di aumentare il tasso glicemico. Dopo iniezione di glucagone si manifesta una forte iperglicemia. SINTESI E LIBERAZIONE E’ prodotto dalle cellula alfa. E’ un grosso polipeptide (PM 3.500), formato da una catena lineare di 29 AA. E’ immagazzinato in granuli densi e liberato per esocitosi. TRASPORTO E METABOLISMO La maggior parte del glucagone circola nel plasma in forma libera. ha una emivita di circa 6 minuti. Come avviene per l’insulina, il 50% viene captato dal fegato. Il rene e il fegato sono la sede dove viene degradato. RECETTORI Si lega a un recettore glicoproteico sulla membrana dell’epatocita. Il complesso ormone-recettore porta alla formazione di AMPc. L’aumento di AMPc attiva la proteinchinasi A che a sua volta inizia una cascata di fosforilazioni che portano alla attivazione/deattivazione di numerose chinasi o fosfatasi. EFFETTI DEL GLUCAGONE Gli effetti principali del glucagone si osservano nel fegato. Le sue azioni sul tessuto adiposo e muscolare hanno significato molto inferiore. EFFETTI DEL GLUCAGONE SUL METABOLISMO DEL GLUCOSIO Il glucagone esercita due effetti sul metabolismo del glucosio: glicogenolisi e gluconeogenesi. Glicogenolisi. L’effetto più eclatante del glucagone è la promozione della glicogenolisi epatica con conseguente rapido aumento del tasso glicemico. La formazioine di AMPc porta alla formazione della fosforilasi che promuove la degradazione del glicogeno a glucosio-1-fosfato. Gluconeogenesi. Anche se tutto il glicogeno epatico è stato esaurito sotto azione del glucagone, l’iperglicemia si protrae sotto azione dell’ormone. Ciò dipende dal fatto che il glucagone promuove la gluconeogensi epatica. Questo effetto è dovuto all’attivazione di enzimi necessari per la gluconeogenesi. all’aumento della captazione di aminoacidi parte delle cellule epatiche. CONTROLLO DELLA SECREZIONE DI GLUCAGONE Il glucosio è il fattore di controllo più importante. Effetto inibitorio del glucosio. La diminuzione del glucosio plasmatico al di sotto dei valori del digiuno (90 mg/100 ml) aumenta la secrezione di glucagone. L’aumento di glucosio fa diminuire la secrezione di glucagone. Effetto stimolante degli aminoacidi. Concentrazioni elevate di aminoacidi, quali si verificano dopo un pasto ricco di proteine, stimolano la secrezione di glucagone. Gli analogo hanno effetto analogo per la secrezione di insulina. Quindi le risposte del glucagone e dell’insulina sono dello stesso segno. Somatostatina. Agisce localmente deprimendo la secrezione di glucagone.
Scaricare