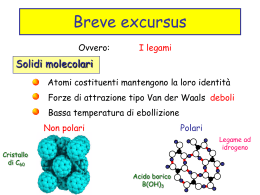
Gli stati di aggregazione della materia • Solido • Liquido • Gas Stato solido Sostanza cristallina in cui esiste una disposizione ordinata delle unità costituenti la sostanza che si ripete nello spazio in maniera periodica (ordine a lungo raggio) Tale regolarità determina la forma dei cristalli su scala macroscopica Materiali amorfi stati vetrosi o liquidi ad alta viscosità Hanno ordine solo a corto raggio, cioè nelle immediate vicinanze di un atomo o molecola. Non hanno T di raffreddamento ben definite (in quanto il disordine è generato da legami diseguali e quindi energie di legame diverse) Condizione necessaria perché una sostanza possa essere usata nelle fabbricazione di vetri e la lenta cristallizzazione (cioè che la struttura cristallina finale rimanga il più a lungo possibile simile a quella dello stato liquido) fabbricazione vetro: T 1200-1500°C miscela di polveri di SiO2,Na2CO3, CaO e Al2O3 vetro pyrex: aggiunta di B2O3 (anidride borica), molto resistente agli sbalzi di T ossidi di Cr(III) per vetri verdi ossidi di Mn(III) vetri bruni ossidi di Co(II) per vetri blu Stato solido • • • • Solidi covalenti (es. C) Solidi ionici (es. NaCl) Solidi molecolari (es. I2, ghiaccio) Metalli Stato solido • Modello a sfere rigide • Le sfere si dispongono in modo da dare luogo a diversi impacchettamenti • Strutture compatte: le sfere sono sistemate in modo da rendere minimi gli spazi vuoti (princ. Minima E: maggiori sono le interazioni) • Alla tendenza al massimo impacchettamento si oppongono: direzionalità delle interazioni, la forma non sferica delle particelle, le diverse dimensioni degli ioni • Tutto questo fa si che si abbiano diverse strutture cristalline Struttura Solidi Struttura non a max impacchettamento Struttura a max impacchettamento Strutture compatte •In uno strato compatto ogni sfera (es. A) e’ a contatto con altre 6 C BA B C B C •Esistono 6 spazi vuoti, indicati con le lettere B e C. •Nello strato successivo le sfere tenderanno a disporsi in corrispondenza degli spazi vuoti tra le sfere del primo strato. Indipendentemente dal fatto che le sfere occupino spazi B o C, la sfera A sara’ in contatto con altre tre sfere del piano adiacente. In totale la sfera A e’ in contatto con 12 sfere, 6 del suo strato, 3 in quello superiore e tre in quello inferiore. Numero di coordinazione 12 Strutture compatte STRUTTURA ESAGONALE COMPATTA: • Secondo strato in corrispondenza dei vuoti B • Terzo strato nella posizione del primo • Sequenza di tipo ABABAB per strati successivi • Numero di coordinazione 12 STRUTTURA CUBICA COMPATTA (o CUBICA A FACCE CENTRATE): • Secondo strato in corrispondenza dei vuoti B • Terzo strato in corrispondenza dei vuoti C • Sequenza di tipo ABCABC per strati successivi • Numero di coordinazione 12 Alcune sostanze presentano strutture diverse da quelle compatte, non a max impacchettamento STRUTTURA CUBICA SEMPLICE: • Una particella ai vertici di ciascun vertice del cubo • Numero di coordinazione 6 STRUTTURA CUBICA A CORPO CENTRATO: • Struttura cubica con l’aggiunta di una sferetta al centro di ogni cubo • Numero di coordinazione 8 STRUTTURA TETRAEDRICA: • Ogni particella e’ circondata da altre 4 disposte ai vertici di un tetraedro • Numero di coordinazione 4 Struttura cubica a facce centrate Posizione dei siti interstiziali ottaedrici (sinistra) e quelli tetraedrici (destra) relativi ad una cella cubica a facce centrate Reticolo spaziale La disposizione degli atomi può essere descritta immaginando gli atomi come punti d’intersezione delle linee in una maglia immaginaria chiamata reticolo spaziale Ogni reticolo spaziale può quindi essere descritto specificandole posizioni degli atomi nell’unità, che poi si ripete in tutto il cristallo Reticolo spaziale e cella elementare Le dimensioni e la forma della cella elementare vengono descritte tramite tre vettori reticolari a,b,c che hanno origine da un angolo della cella elementare Costanti reticolare: - Lunghezza assi a,b e c - Angoli La cella elementare è perciò l’unità più semplice del reticolo che contiene tutte le informazioni necessarie per generare l’intero reticolo Reticoli bravasiani A.J. Bravais cristallografo Assegnando diversi valori alle lunghezze degli assi e agli angoli compresi tra essi si ottengono celle elementari diverse 7 diversi sistemi cristallini danno origine a tutti i tipi di possibili di reticolo, 14 tipi di celle Quattro tipi fondamentali di celle elementari: • semplice; • a corpo centrato:contiene 2 punti reticolari, uno al centro della cella; • a facce centrate: contiene 4 punti reticolari, uno al centro di ogni faccia; • a basi centrate: contiene 2 punti reticolari,uno al centro di una coppia di facce opposte. 7 sistemi cristallini Tipi fondamentali di celle Strutture cristalline metalli Metalli (90%) cristallizza in situazioni molto compatte: -CCC -CFC -EC Dimensioni cella ferro: l=0,28 nm Cubica a corpo centrato (CCC) Metalli con struttura CCC: Cr, Fe, Mo, K, Na, Ta, V, W Numero coordinazione 8 Per ogni cella elementare un totale di due atomi La relazione tra il lato del cubo a e il raggio atomico R è: a = 4R/√3 Il 68% del volume della cella è occupato da atomi ( per cui potrebbero essere compattati di più) Cubica a facce centrate (CFC) 74% spazio occupato 4 atomi per cella Numero di coordinazione 12 a = 4R/√2 Al, Cu, Au, Pb, Ni, Pt, Ag Esagonale compatta (EC) Numero di coordinazione 12 come si riportano le posizioni degli atomi nelle celle cubiche Piani nelle celle cubiche Per identificare i piani cristallini o orientamento cristallografico si usa il sistema di notazione di Miller: gli indici di Miller (hkl) per un piano cristallino sono definiti come i reciproci delle intersezioni frazionarie del piano con gli assi cristallografici x, y e z relativi ai tre spigoli della cella cubica Indici di Miller di alcuni importanti piani cristallografici del cubo faccia fondametale Esempio piano (632) da notare che tutti i piani paralleli hanno gli stessi indici gli indici col segno meno indicano che incontrano gli assi sul lato negativo allotropia Fenomeno per cui molti elementi esistono in più di una forma cristallina Ca Co Fe CFC EC CCC Na CCC CCC(>447°C) CFC(>427°C) CFC(912-1394°C) CCC(>1394°C) EC(<-233°C) Materiali amorfi Nei quali manca ordine a lungo raggio nella struttura. In questi materiali gli atomi sono legati in modo disordinato (diversi gradi) perché ci sono fattori che inibiscono la formazione periodica - Materiali polimerici - vetro SiO2: i tetraedri SiO44- Vetro metallico ( Si+Fe) strutture composti ionici si analizzano per semplicità composti monoatomici, atomi assimilabili a sfere con forze di legame adirezionale anioni:massimo impacchettamento cationi: nelle cavità (tetraedriche o ottaedriche) generate NaCl cubica a facce centrate; in prima approssimazione si può considerare il reticolo del Cl a max impacchettamento e quindi l’anione è a contatto con altri 12 ioni uguali più di 200 composti diversi hanno questa struttura LiO2 struttura diversa da NaCl tutte le cavità ottaedriche vuote mentre le cavità tetradriche occupate da Li+ (sia perché ha raggio <, sia per i rapporti stechiometrici diversi) numero coord Li+ =4 numero coord O= 8 ZnS (Blenda) tipico dei solfuri degli elementi di transizione e del secondo gruppo si ricava dalla struttura del LiO2 togliendo i cationi da uno strato ogni due cavità tetraedriche numero coordinazione ioni=4 reticoli solidi con struttura molecolare o covalente la struttura delle sostanze molecolari dipende - dalla geometria delle molecole - dalla direzionalità dei legami intermolecolari se le molecole sono assimilabili a sfere si ha un max impacchettamento; es i gas nobili: He esagonale, gli altri cubico. Anche H2, N2, O2 e gli alogeni allo stato solido sono assimilabili a max impacchettamento quando poi esistono legami più forti e direzionali, come legami a ponte a idrogeno, la loro struttura non può essere a max impacchetamento solidi con struttura covalente quando i solidi sono costituiti da atomi legati da legami covalenti, ci allontaniamo molto dal max impacchettamento, in quanto il legame covalente è altamente direzionale I solidi covalenti sono in numero minore rispetto agli ionici e molecolari; dato che le interazioni dipendono dal tipo di atomo e dalla direzione del legame, non è possibile definire un modello es polimorfismo C: diamante e grafite diamante: ogni C legato ad altri 4, non esistono molecole discrete (macromolecola) grafite è la forma termodinamicamente più stabile a T amb; impacchettamento a strati planari tenuti insieme da forze di Van der Waals. Schema ripetizione ABAB Struttura ricollegabile ad una esagonale, ma non compatta densità minore del diamante numero coordinazione 4 entro ciascun strato ogni C è legato ad altri 3; sistema di elettroni delocalizzati sul tutto il piano grazie agli orbitali di legame π d= 142 pm C stesso strato d= 340 pm C strati adiacenti
Scaricare