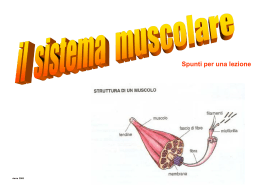
IL TESSUTO MUSCOLARE Aspetti generali Il muscolo è l’organo che assolve alla funzione del movimento tramite contrazione. Mediamente, in un uomo adulto normale il tessuto muscolare costituisce circa i 2/5 dell’intero peso corporeo. L’intera massa muscolare è soggetta ad un notevole sforzo metabolico anche in condizioni di riposo, ed è stato stimato che più dei ¾ del metabolismo totale dell’organismo può essere attribuito al tessuto muscolare. Principali componenti(%): Scheletrico Cardiaco Liscio Acqua 72-79 73-79 72-75 Proteine 16-20 16-20 16-20 Lipidi 7.5 8.3 8.0 Fosfolipidi 1.0 1.5 3.3 Glicogeno 0.5-1.0 0.1-1.2 0.3-0.8 Creatina+creatinina 0.3 0.19 0.42 K 0.25 0.35 0.15 Na 0.10 0.17 0.11 Ca 0.007 0.01 0.007 Mg 0.019 0.024 0.011 In base all’aspetto microscopico distinguiamo due tipi di tessuto: striato e liscio Tessuto muscolare striato L’unità morfologica scheletrica è la fibra muscolare striata, caratterizzata lungo l’asse maggiore dall’alternanza di bande chiare e scure; all’interno di ogni fibra si trovano elementi fibrillari longitudinali, le miofibrille, che con la loro disposizione parallela determinano le striature. Organizzazzione generale: Le fibre muscolari sono disposte parallelamente e sono tenute insieme da connettivo diviso in: EPIMISIO: guaina connettivale molto consistente posta esternamente PERIMISIO: sepimenti provenienti dalla faccia interna dell’epimisio che rivestono più fasci di fibre ENDOMISIO: sottili setti che si estendono dal perimisio a circondare le singole fibre. Struttura della cellula muscolare: La membrana plasmatica, il sarcolemma, racchiude il sarcoplasma. La fibra muscolare è un sincizio contenente numerosi nuclei situati immediatamente sotto la membrana. La maggior parte del sarcoplasma è occupata dalle miofibrille, strutture specializzate per la contrazione. La restante porzione del sarcoplasma contiene piccoli apparati di Golgi, gruppi di mitocondri, gocce lipidiche, granuli di glicogeno e mioglobina. Un esteso REL, detto reticolo sarcoplasmatico, circonda le miofibrille. Le miofibrille: Presentano una successione di bande scure(bande A) e bande chiare (bande I); ciascuna banda I risulta divisa in due parti uguali da una stria detta stria Z. La banda A appare occupata nella parte centrale da una banda più chiara, che prende il nome di banda H attraversata a sua volta da una linea trasversale netta e sottile, la linea M. Il tratto di miofibrilla, compreso tra due linee Z contigue, prende il nome di sarcomero e rappresenta l’unità funzionale del tessuto muscolare striato. Ciascuna miofibrilla consta di una successione ininterrotta di sarcomeri. Nella fibra muscolare, le miofibrille mostrano le bande allineate esattamente allo stesso livello. I miofilamenti: Le miofibrille risultano costituite a loro volta da miofilamenti anch’essi disposti longitudinalmente e paralleli fra loro e sono di due tipi diversi per dimensione e composizione chimica. MIOFILAMENTI SPESSI: Prevalentemente miosina, vanno a costituire la banda A. Tali filamenti presentano dei piccoli prolungamenti laterali detti ponti che permettono il contatto con i miofilamenti sottili durante la contrazione. MIOFILAMENTI SOTTILI: Actina, tropomiosina e troponina. Vanno a costituire la banda I e si ancorano al sarcomero a livello della linea Z. Struttura tridimensionale dei miofilamenti: Ogni filamento spesso è costituito da due fasci opposti polari di molecole di miosina, uniti al centro del filamento. La miosina è un esamero costituito da due catene pesanti e da due coppie di catene leggere: le due metà C terminali delle due catene pesanti, si avvolgono tra loro a formare la coda della molecola. Le due metà N terminali, si avvolgono separatamente a formare due teste. Nelle teste si concentra l’attività ATPasica; associate alle teste si trovano le catene leggere. Ogni miofilamento sottile è costituito da due filamenti elicati, risultanti dalla polimerizzazione di G-actina; in ogni miofilamento sottile, si trovano due filamenti di tropomiosina alloggiati in prossimità dei solchi tra le due catene intrecciate. Nel muscolo a riposo la tropomiosina impedisce il contatto tra actina e testa della miosina. La troponina (proteina globulare) è legata alla tropomiosina e il suo legame con il calcio, consente la liberazione del sito di legame per le teste della miosina situate sull’actina. Reticolo sarcoplasmatico: Il rel della fibra scheletrica prende il nome di reticolo sarcoplasmatico; risulta formato da una serie di strutture globulari che circondano ogni miofibrilla in maniera regolare formando una rete. A intervalli regolari i tubuli longitudinali confluiscono in canali orientati trasversalmente costituenti ciascuno una cisterna terminale. Nella parte mediana della loro faccia esterna, le cisterne terminali si associano con un altro elemento tubulare disposto trasversalmente, il tubulo T. Il lume del tubulo T si apre a livello del sarcolemma, permettendo la comunicazione con lo spazio extra-cellulare. La funzione del reticolo sarcoplasmatico, si evidenzia a livello della triade. A muscolo rilasciato, nella cavità delle cisterne terminali vengono immagazzinati ioni calcio. Nella membrana che delimita tali cavità si trova una ATPasi calcio dipendente in grado di pompare due ioni calcio dal citosol, idrolizzando un ATP. Il lume contiene calsequestrina, in grado di sequestrare ioni calcio. MECCANISMI DI CONTRAZIONE DEL MUSCOLO SCHELETRICO L’impulso nervoso che dal nervo motore giunge alla placca neuromuscolare trasmette il potenziale d’azione alle fibrocellule del muscolo scheletrico depolarizzando il sarcolemma. A questo fenomeno elettrofisiologico segue la contrazione muscolare. Per questo motivo questo processo viene definito con il termine: ACCOPPIAMENTO ECCITAZIONE-CONTRAZIONE. Il processo si può dividere in 4 fasi: -DEPOLARIZZAZIONE/RIPOLARIZZAZIONE -RILASCIO DI IONI CALCIO -MODIFICAZIONI CONFORMAZIONALI DELLE PROTEINE REGOLATRICI -CICLO CONTRATTILE POLARIZZAZIONE E DEPOLARIZZAZIONE La polarizzazione consiste in una diminuzione dell’elettronegatività all’interno della cellula a riposo. Essa è seguita poi dalla ripolarizzazione, cioè il ritorno del potenziale di membrana alle condizioni iniziali. Tale fenomeno è dovuto ad una complessa serie di cambiamenti nei flussi ionici transmembrana. Questo complesso sistema permette di inviare un segnale elettrico alle cisterne di ioni calcio. RILASCIO IONI CALCIO L’arrivo del segnale elettrico causa l’immediata liberazione di ioni calcio, la cui concentrazione aumenta di 100 volte. Il calcio si accumula attorno alle miofibrille, saturando le TnC e scatenando la contrazione muscolare. MODIFICAZIONI CONFORMAZIONALI DELLE PROTEINE REGOLATRICI La terza fase comporta la modificazione conformazionale delle proteine regolatrici, per cui i siti di legame dell’actina si rendono liberi per l’interazione con la miosina. Non essendo più inibita l’actina, il ciclo contrattile può avere inizio. CICLO CONTRATTILE Il ciclo contrattile inizia con la formazione di un intermedio energizzato della miosina dovuto al legame con l’ATP. La miosina poi si legherà all’actina, prima tramite un legame semplice, poi con un legame forte, che determinerà un “colpo di frusta” che accorcerà il sarcomero. Il complesso di actina e miosina è l’ACTOMIOSINA. Terminato l’accorciamento si ha il distacco della miosina a causa della sostituzione dell’ADP con ATP, che ricaricherà la miosina che sarà pronta ad un altro ciclo contrattile. IL MUSCOLO CARDIACO Caratteristiche intermedie tra Muscolo liscio Contrazioni potenti Richiesta molta energia Muscolo striato Contrazioni continue Meccanismo intrinseco Nell’adulto il miocardio consiste in una fitta rete anastomizzata di cellule muscolari cardiache che si biforcano e si dispongono in strati (LAMINE) Il connettivo tra le varie cellule è ricco di capillari, nervi e fibre del sistema di conduzione del cuore Miocardiocita FORMA: cilindrica NUCLEO: centrale; mono/bi-nucleata MORFOLOGIA: estremità irregolarmente ramificate Disposizione pseudo-striata DIAMETRO: 5-10 µm La metà del volume della cellula cardiaca è occupata da MITOCONDRI Abbondante è la quantità di GLICOGENO e TRIGLICERIDI Alto contenuto di MIOGLOBINA Nelle cellule atriali è contenuto il PEPTIDE NATRIURETICO ATRIALE, che stimola il riassorbimento di acqua a livello renale Giunzioni intercellulari Dischi intercalari: giunzioni termino-terminali a decorso • TRASVERSALE: numerosi desmosomi - - -> offre continuità meccanica alle cellule • LONGITUDINALE: gap-junctions - - -> permettono una rapida diffusione dello stimolo contrattile da una cellula all’altra (SINCIZIO FUNZIONALE) Sarcomero • Struttura identica a quella del muscolo striato (banda A + banda I) • Il reticolo sarcoplasmatico forma con il tubulo T strutture dette diadi, in corrispondenza della stria Z Metabolismo • Il muscolo cardiaco è il tessuto a più elevato metabolismo aerobico • L'attività del muscolo cardiaco può essere regolata dalle catecolamine (si legano principalmente ai recettori β1adrenergici favorendo, tramite l'attivazione della proteina chinasi AMPc dipendente, la fosforilazione di strutture come il fosfolambano) EFFETTI DELLE CATECOLAMMINE MUSCOLO CARDIACO CATECOLAMINE • Dopamina • Noradrenalina • Adrenalina Questi ormoni sono di origine proteica e sono sintetizzati a partire dalla fenilalanina. La dopamina è una ammina biogena ottenuta dalla decarbossilazione della 3,4 Idrossi – fenilalanina (DOPA). La noradrenalina, è ottenuta per idrossilazione della dopamina. Dopamina a noradrenalina sono intermedi della adrenalina. GLI EFFETTI • DOPAMINA neurotrasmettitore sintetizzato dai gangli del simpatico • ADRENALINA E NORADRENALINA Sintetizzata per la maggior parte dalla midollare surrenale, in minor parte anche da cervello e gangli del simpatico. Le catecolamine hanno una notevole importanza perché sono in grado di influenzare il metabolismo e la funzionalità del cuore e dei vasi. Dal punto di vista metabolico esse sono fattori di attivazione dei siti recettoriali di diverse tipi di cellule. I recettori delle catecolamine sono detti adrenergici e distinti in due tipi α e β. RECETTORI (α) e (β) CARDIACI • (α) • Effetto inotropo del miocardio senza tachicardia • (β) • Lipolisi, effetto inotropo del miocardio con tachicardia • Accelerazione della fase di rilassamento (fosfolambano) STIMOLAZIONE DEI RECETTORI CARDIACI (β) In ogni cellula miocardica si trovano parecchie migliaia di recettori (β). La stimolazione del recettore (β) porta all’attivazione dell’adenilato ciclasi, che determina l’aumento dei livelli di AMPc. L’aumento del nucleotide ciclico determina l’attivazione della proteina chiansi AMPc dipendente, che fosforila proteine coinvolte nel meccanismo contrattile del miocardio. Tali fosfoproteine sono presenti sia nella membrana (per modulare il flusso di ioni calcio), sia nelle fibre (per modificare la sensibilità al calcio). Il questo modo i canali del calcio sono più sensibili all’onda di depolarizzazione. Il calcio, inoltre, stimola l’azione della fosfodiesterasi che inattiva il nucleotide ciclico in AMP, interrompendo così la risposta amplificata del segnale ormonale. IL FOSFOLAMBANO REGOLA LA FASE DI RILASSAMENTO MUSCOLARE Un’altra proteina coinvolta nel meccanismo contrattile è il fosfolambano, situato nella membrana del reticolo sarcoplasmatico. La proteina funziona da “sensore” di ioni calcio. Questa proteina viene fosforilata da una proteina Cdk attivata dall’AMPc. Nella forma fosforilata non esercita più l’effetto inibitore della pompa del calcio nel reticolo sarcoplasmatico, accelerando così la fase di rilassamento muscolare. STIMOLAZIONE RECETTORI CARDIACI (α) La stimolazione dei recettori (α) da parte delle catecolamine genera effetti simili alla stimolazione (β) – adrenergica. Gli effetti della (α) – stimolazione sono però più blandi. Il legame ormone – recettore genera una risposta amplificata che attiva la fosfolipasi C del sarcolamma, portando alla formazione di Inositolo trifosfato (IP3) e di Diacilglicerolo (DAG), che a sua volta attiva un proteina chinasi che fosforila proteine che partecipano alla contrazione del miocardio. A differenza della muscolatura scheletrica, che è specializzata in contrazioni relativamente intense e di breve durata ed è sotto un fine controllo della volontà, la muscolatura viscerale è specializzata in contrazioni continue, relativamente deboli, in grado di produrre movimenti diffusi che determinano la contrazione dell’intera massa muscolare piuttosto che di singole unità motorie. La contrattilità è una proprietà intrinseca della muscolatura viscerale, indipendente dall’innervazione, con un andamento peristaltico. Essa è influenzata dall’attività del sistema nervoso autonomo, da ormoni e da metaboliti locali che la modulano in relazione alle differenti domande funzionali. Le cellule del tessuto muscolare sono relativamente piccole, con un singolo nucleo. Le fibre, unità funzionali contrattili, sono riunite in fascicoli irregolarmente ramificati, la cui disposizione varia considerevolmente da un organo all’altro, in relazione alle richieste funzionali. Queste si presentano di forma allungata, fusiforme, con estremità appuntita o talora biforcata, più corte delle fibre muscolari. Nei fascicoli le singole fibre sono disposte più o meno parallelamente le une alle altre con la parte più spessa di una cellula accostata alla parte più sottile di della cellula adiacente. Le proteine contrattili del muscolo liscio non sono disposte in miofibrille in regolare registro come nel muscolo scheletrico e cardiaco. Tra le singole fibre muscolari e tra i fascicoli è presente tessuto connettivo di supporto. Muscolatura liscia unitaria e multiunitaria A seconda del tipo di impulso che ricevono, le cellule muscolari lisce si possono dividere in unitarie e multiunitarie. Nella muscolatura liscia unitaria le cellule tendono ad autogenerare il proprio livello di contrazione ritmica il quale è trasmesso da una cellula all’altra attraverso le giunzioni gap. Questo tipo di muscolatura è caratterizzata da contrazioni lente ed è detto muscolo liscio tonico. Nella muscolatura liscia multiunitaria l’impulso nervoso raggiunge ogni singola cellula, controllando in maniera precisa lo stato di contrazione. Questo tipo di muscolatura è detto muscolatura liscia fasica ed è caratterizzata da una rapida velocità di contrazione. Contrazione del muscolo liscio Le proteine contrattili delle cellule muscolari lisce si ancorano ad addensamenti all’interno del citoplasma detti addensamenti focali. La forza generata dalla contrazione viene trasmessa dagli addensamenti alla membrana plasmatica e da qui alla lamina esterna, facendo così lavorare una massa di cellule muscolari lisce come una singola unità funzionale. A differenza dei muscoli striati, la contrazione delle cellule muscolari lisce si esercita in tutte le direzioni a causa del diverso orientamento delle fibre contrattili. Il meccanismo della contrazione può essere così schematizzato: I filamenti sottili di actina sono associati alla tropomiosina I filamenti spessi sono costituiti da miosina e si legano all’actina solo se fosforilati Il calcio, presente nel reticolo sarcoplasmatico, in seguito a eccitamento della membrana plasmatica, viene rilasciato nel citoplasma dove si lega alla proteina calmodulina. Il complesso così formato stimola la formazione del legame tra actina e miosina i quali, scorrendo fra loro, provocano la contrazione muscolare Creatina e Fosfocreatina A partire dal 1907 sono stati effettuati diversi studi sul metabolismo muscolare che hanno portato a tre conclusioni fondamentali: 1-la contrazione muscolare anaerobica porta alla formazione di acido lattico; 2-l’acido lattico deriva dal glicogeno e in anaerobiosi la quantità di acido lattico prodotto uguaglia la quantità di glicogeno scomparso; 3-l’energia per la contrazione deriva dalla metabolizzazione del glicogeno in acido lattico. Intorno al 1927 l’attenzione dei ricercatori fu attratta dai composti fosforati e, due gruppi di questi, indipendentemente isolarono dal muscolo la fosfocreatina (PCr): Sorprendentemente ulteriori analisi condotte sui muscoli non dimostrarono l’aspettata formazione di acido lattico. A questo punto l’ipotesi che la contrazione muscolare derivasse dall’energia liberata dal processo glicolitico non poteva più tenere. Doveva essere le scissione della fosfocreatina a creatina e Pi la responsabile del processo: Fosfocreatina Pi+creatina = energia per la contrazione A quel tempo il processo glicolitico doveva quindi essere considerato secondario, con funzione di recupero della creatina e fosfato prodotti a fosfocreatina. Infatti la scissione della fosfocreatina è più rapida di quella del gliocogeno e la risintesi della fosfocreatina avviene quando il muscolo è a riposo, e questo tanto in anaerobiosi che aerobiosi. Nel 1934 Lohmann dimostrò che “la primaria operativa sostanza” nella contrazione muscolare non è la fosfocreatina, ma l’ATP! La fosfocreatina non è idrolizzata prima dell’ATP, la fosfocreatina rifosforila l’ADP ad ATP secondo la reazione (catalizzata dalla creatinacinasi): ATP + creatina ADP + fosfocreatina Dal Krebs si producono ATP e la fosfocreatina costituisce una “riserva energetica” per consentire in modo costante il mantenimento della concentrazione di ATP nelle cellule muscolari. La fosfocreatina, che una volta scissa si ricostruisce a spese solo dell’ATP e perciò rappresenta una riserva temporanea di d’energia, è contenuta in quantità 3-4 volte superiore all’ATP, e questo consente di mantenere, entro certi limiti, il normale livello di ATP. Le iniziali sequenze metaboliche di un muscolo che si contrae sono quindi così rappresentabili: ATP ADP + Pi (ATPasi) fosfocreatina + ADP creatina + ATP (creatina cinasi) 2ADP ATP + AMP (miocinasi, adenilato, cinasi) AMP IMP + NH4+ (adenosindeaminasi). Metabolismo Amminoacidico nel Muscolo Gli amminoacidi sono assunti nel muscolo scheletrico attraverso meccanismi di trasporto che sono sotto il controllo dell’insulina. Una volta entrati nella cellula, essi sono utilizzati in parte per ripristinare il pool proteico e in parte per fornire energia. Sintesi proteica Amminoacidi Fonte energetica (α-chetoacidi) A tale scopo…gli amminoacidi non essenziali sono degradati ad α-chetoacidi per transaminazione e desaminazione e poi ossidati nel Krebs. essenziali ramificati (valina, leucina, isoleucina) sono transaminati nel muscolo stesso, ma gli α-chetoacidi che ne derivano sono metabolizzati nel fegato. I gruppi amminici derivati da queste reazioni sono trasferiti al piruvato, con formazione di alanina. PIRUVATO + AA ALANINA + α-CHETOACIDO L’alanina viene quindi trasferita al fegato per essere convertita ad acido piruvico attraverso transamminazione o desamminazione; l’acido piruvico intraprende poi la via gluconeogenica. Anche il muscolo cardiaco è in grado di utilizzare amminoacidi come fonte di energia, tuttavia preferenzialmente glucosio mancanza di esso, corpi chetonici. utilizza e, in Metabolismo energetico del muscolo Esistono due tipi di cellule striate muscolari: le fibre a contrazione rapida glicolitiche e quelle a contrazione lenta ossidative. Le fasce glicolitiche sono bianche, perché contengono una rete capillare poco sviluppata, meno mitocondri e meno mioglobina rispetto alle fibre ossidative lente, che appaiono rosse. Le fibre veloci hanno inoltre pochi depositi di lipidi e un elevato contenuto di glicogeno. Il loro metabolismo impiega il glicogeno e la glicolisi anaerobia per sostenere improvvise contrazioni, richieste da condizioni di stress. Le fibre ossidative sono rosse perché abbondantemente perfuse con sangue, hanno numerosi mitocondri e mioglobina. Queste fibre muscolari hanno la capacità di sostenere sforzi, non troppo intensi, per lunghi periodi. Le fibre ossidative lente utilizzano acidi grassi per sintetizzare ATP e quindi richiedono la presenza di abbondanti mitocondri. IL MUSCOLO CARDIACO Il muscolo cardiaco, che si contrae continuamente, possiede caratteristiche metaboliche e contrattili molto simili alle fibre muscolari ossidative lente. Infatti dispone di una fitta rete vascolare (seni coronarici), è ricco di mitocondri e utilizza maggiormente acidi grassi della circolazione. L’ampio uso di acidi grassi avviene in presenza di elevate concentrazioni di ossigeno, che sono normalmente presenti nel miocardio, a scapito della degradazione del glucosio. Questo fenomeno viene detto “effetto Pasteur“ per inibizione della fosfofruttochinasi (PFK) da parte sia dell’O2 ,sia dell’ATP e del citrato. I MUSCOLI SCHELETRICI I muscoli scheletrici, deputati a compiere un lavoro meccanico, sono la sede del maggior consumo d'energia. Essi possono utilizzare acidi grassi, corpi chetonici o glucosio a seconda del grado di attività muscolare. Nel muscolo a riposo i principali nutrienti sono gli acidi grassi forniti dal tessuto adiposo e i corpi chetonici provenienti dal fegato. In caso di moderata attività il muscolo può utilizzare invariabilmente corpi chetonici epatici, acidi grassi o glucosio. Quando il muscolo esegue un'attività massima, l'apporto di ossigeno e di sostanze nutrienti provenienti dal sangue, è insufficiente ai bisogni immediati. In tal caso il muscolo, dopo aver demolito glicogeno endogeno, demolisce il glucosio a lattato nella via anaerobica. Questo sforzo massimo può continuare, dipendendo dall'allenamento, solo per poco tempo provocando accumulo di acido lattico che deve essere smaltito. Dopo lo sforzo, il soggetto deve continuare in una respirazione accelerata per un po' di tempo. La maggior parte dell'ossigeno così assunto viene utilizzato principalmente dal fegato per produrre ATP da destinare alla sintesi conversione del lattato, giunto dal muscolo, in glucosio (ciclo di Cori). Durante il periodo di intensa attività il muscolo scheletrico, che contiene fosfocreatina, può produrre ATP nella reazione catalizzata dalla creatina chinasi: fosfocreatina + ADP → creatina + ATP ma durante la fase di recupero la fosfocreatina viene rigenerata tramite la reazione inversa: creatina + ATP —→ fosfocreatina + ADP PROVENIENZA E TRASPORTO DEGLI ACIDI GRASSI Gli acidi grassi, esterificati a trigliceridi (TG), sono trasportati nel sangue per mezzo delle lipoproteine (chilomicroni e VLDL). I chilomicroni trasportano i TG della dieta dall’intestino ai tessuti periferici. In seguito a idrolisi dei chilomicroni, mediata dall’enzima lipoproteina lipasi, vengono liberati gli acidi grassi, trasportati poi nel sangue ai tessuti mediante l’albumina. Le VLDL trasportano i TG, sintetizzati a livello epatico, dal fegato alla periferia dell’organismo. Le VLDL perdono i TG attraverso l’azione dell’enzima lipoprotein lipasi, che li trasforma in IDL e successivamente in LDL. Gli acidi grassi così liberati possono essere utilizzati dal muscolo per scopi energetici. METABOLISMO DELLE LIPOPROTEINE Metabolismo degli acidi grassi La funzione energetica dei lipidi si esplica nell’ossidazione degli acidi grassi La gran parte dei trigliceridi è depositata nel tessuto adiposo che, idrolizzandoli, fornisce energia ad altri tessuti, sotto forma di acidi grassi Il processo di ossidazione degli acidi grassi è detta: β ossidazione mitocondriale La resa energetica di tale processo è molto elevata (circa 9 Kcal/g contro le 4 Kcal/g ricavate dall’ossidazione di glucidi e proteine) Le fonti principali di acidi grassi per la β-ossidazione sono: dieta (esogeni) riserve cellulari (endogeni) (essenzialmente trigliceridi negli adipociti). • Gli acidi grassi della dieta vengono trasportati sotto forma di trigliceridi tramite i chilomicroni, dapprima attraverso il circolo linfatico e poi ematico, dall'intestino agli organi, dove i trigliceridi vengono idrolizzati da specifiche lipoprotein-lipasi ad acidi grassi e glicerolo. • Nei tessuti epatico, adiposo e muscolare le cellule procedono al loro utilizzo o al loro deposito. Gli acidi grassi liberi sono trasportati agli organi complessati all'albumina. Giungeranno ai diversi organi, ove verranno ossidati: muscolo scheletrico, cuore e fegato. Attivazione degli acidi grassi Al loro ingresso nel citosol, gli acidi grassi vengono attivati per conversione dell’acil-CoA mediante legame tioestere con il coenzima A per azione di un enzima acilCoA sintetasi (chiamata anche tiocinasi) Acido grasso + ATP + HS-CoA -------> Acyl-CoA + PPi + AMP comporta il consumo di due molecole di ATP, perchè l'intermedio di reazione è un acil-AMP. TRASLOCAZIONE Il trasporto all'interno del mitocondrio avviene in forma di: acilcarnitina Con l'intervento di due enzimi (carnitina acil-transferasi I e II ) e di una traslocasi (carnitina-acilcarnitina traslocasi). La carnitina permette all’Acil-CoA di attraversare la membrana mitocondriale interna e di entrare nella matrice dove avviene la β-ossidazione L’acil-CoA in eccesso può venire ritrasformato in trigliceride Trasporto degli acili tramite carnitina Trasporto degli acidi grassi attivati, tramite lo shuttle carnitina all’interno del mitocondrio con un trasportatore di membrana. All’interno del mitocondrio la carnitina viene liberata e trasportata di nuovo nel citosol. L’acido grasso viene unito al Coenzima A, per ricostituire l’AcilCoA Carnitina β-ossidazione E’ la rottura ossidativa che consente il graduale distacco di frammenti a 2 atomi di C, in forma di acetil-CoA, dall’acido grasso attivato ad acil-CoA β-ossidazione Il processo consta di 4 reazioni (stage 1) L’ossidazione completa di un acido grasso a catena pari (n) porta alla formazione di n/2 molecole di acil-CoA Le molecole di acilCoA formatesi entrano nel ciclo di Krebs β-ossidazione enzimi 1. acil-CoA deidrogenasi 2. enoil-CoA idratasi 3. b-idrossiacilCoA deidrogenasi 4. tiolisi dell’acilCoA β-ossidazione: tappa 1 β-ossidazione: tappa 2 β-ossidazione: tappa 3 β-ossidazione: tappa finale OSSIDAZIONE DI ACIDI GRASSI A NUMERO DISPARI E POLIINSATURI La β ossidazione di acidi grassi a numero dispari di atomi di carbonio porta alla formazione di propionil-CoA che viene convertito a succinilCoA. Propionyl-CoA (3:0) (S)-D-Methylmalonyl-CoA Methylmalonyl-CoA Epimerase (R)-L-Methylmalonyl-CoA Succinil CoA Gli acidi grassi poliinsaturi vanno incontro a β ossidazione,ma richiedono l'intervento di specifici enzimi che rendono l'acido grasso aggredibile dagli enzimi della β ossidazione. 1° caso: β-ossidazione acidi grassi insaturi Problema della configurazione cis 2° Caso REGOLAZIONE DELLA β-OSSIDAZIONE REGOLAZIONE A BREVE TERMINE: 1) inibizione della carnitina-aciltransferasi I da malonyl-CoA, i cui livelli aumentano in seguito all'attivazione da parte dell' insulina della acetil-carbossilasi. 2) Gli ormoni adrenalina e glucagone attivano la lipasi ormonosensibile del tessuto adiposo e quindi rendono disponibili gli acidi grassi per la β ossidazione REGOLAZIONE A LUNGO TERMINE: 1) I livelli della lipoprotein lipasi del tessuto adiposo aumentano in seguito a stimolazione insulinica (diminuiscono, invece durante il digiuno). 2) I livelli della lipoprotein lipasi del cuore aumentano durante il digiuno e diminuiscono in presenza di insulina. • Il muscolo scheletrico, in condizioni di riposo o di moderata attività utilizza, oltre agli acidi grassi, corpi chetonici per preservare le riserve di glicogeno per un eventuale sforzo intenso. • I corpi chetonici vengono sintetizzati a livello epatico e utilizzati dalla corticale del surrene, dal muscolo scheletrico e cardiaco, dal cervello. I corpi chetonici sono utilizzati dai tessuti extraepatici convertendo il beta-idrossibutirrato in acetoacetato e l'acetoacetato in acetoacetilCoA. La prima reazione è catalizzata dalla beta-idrossibutirrato deidrogenasi, mentre la seconda è catalizzata dalla acetoacetato:succinil-CoA transferasi: Acetoacetato + Succinyl-CoA <------> Acetoacetyl-CoA + succinato (Il fegato non possiede la acetoacetato:succinil-CoA transferasi). L'acetoacetil-CoA viene poi convertito in due molecole di acetilCoA dalla tiolasi: Acetoacetil-CoA + HS-CoA <------> 2 Acetil-CoA Molto spesso si sente parlare di acido lattico nei riguardi della prestazione atletica; ad esso spesso viene data la colpa del dolore muscolare durante l’esercizio, quindi della fatica: GLICOLISI ANAEROBICA La glicolisi anaerobica può portare ad un accumulo di acido lattico che è veicolato al fegato attraverso il flusso ematico. Nel fegato viene riconvertito a glucosio attraverso la via gluconeogenetica e ritorna nel circolo sanguigno per raggiungere nuovamente i muscoli. Questa serie di reazioni è detta “Ciclo di Cori”. Semplificando si può affermare che il lattato si accumula nel citoplasma quando la via aerobica (di cui fanno parte complesso della piruvato deidrogenasi, ciclo di Kerbs, catena di trasporto elettronico e fosforilazione ossidativa) situata nel mitocondrio non riesce a smaltire il piruvato prodotto; in questo modo il piruvato interagisce con la lattico deidrogenasi e si trasforma in lattato. Facendo un paragone si potrebbe paragonare il rubinetto di un lavandino alla glicolisi, lo scarico alla via aerobica e il lavandino al citoplasma; fino a quando lo scarico (via aerobica) riesce a svuotare l’acqua che esce dal rubinetto (piruvato), questa se ne va, ma quando il flusso del rubinetto sarà maggiore della portata dello scarico allora l’acqua (lattato) si accumulerà nel lavandino. Il glucosio trasformato in piruvato entra nel ciclo di Krebs tramite la piruvato deidrogenasi(PDH),trasformando il piruvato in acetil-coA. l’acetil-coA in eccesso blocca la PDH attivando invece la lattico deidrogenasi(LDH)… CH3 C=O COOPiruvato LDH CH3 HCOH COOLattato LDH spinge la reazione verso il Piruvato,che entra nel ciclo dei TCA,favorito da un elevato rapporto NAD+ /NADH La lattico deidrogenasi(LDH) è un isoenzima ubiquitario, un tetramero formato da due tipologie di monomeri: il tipo H,maggiormente presente nel cuore,e il tipo M,maggiormente presente nel muscolo. Da ciò ne derivano 5 forme isoenzimatiche,che differiscono per composizione strutturale, proprietà biochimiche e cinetiche, e per diffusione tissutale: LDH1,LDH2,LDH3,LDH4,LDH5 LDH1 è prevalente nel miocardio e nei globuli rossi. Presente anche nella corteccia renale e nel muscolo scheletrico. LDH2 è prevalente nel miocardio e nelle emazie, oltre ad essere presente in pancreas, corteccia renale, polmone e muscolo scheletrico. LDH3 è presente in polmoni, placenta, muscolo scheletrico e pancreas. LDH4 si trova nella midolla renale, muscolo scheletrico, polmone e placenta. LDH5 è caratteristico del fegato. Presente anche nella midolla renale, muscolo scheletrico e pancreas Muscolo bianco Fibre bianche: •Utilizza ATP prodotto per via anaerobica •Alti livelli di enzimi glicolitici che degradano glicogeno ad acido lattico con liberazione di energia( causa delle contrazioni brevi) •Nella fase di riposo l’acido lattico viene ossidato nel muscolo e nel fegato (debito d’O2) •Basso contenuto di mitocondri •Alto livello di fosfocreatina( riserva di energia) o fosfocreatina + ADP cpk creatina +ATP DG =-11 Kcal/mol massima velocità di formazione di ATP pH= 6-7 (condizione di “ipossia”) miochinasi •Alternativa di emergenza per la formazione di ATP 2ADP ATP + AMP l’AMP prodotta da questa reazione stimola allostericamente la PFK e la glicogenolisi •alternativa per produrre ATP durante un esercizio molto intenso: AMP + H2O Adenilico deaminasi IMP + NH3 Una diminuzione del ph cellulare,determinata dalla produzione di acido lattico, e un’aumentata concentrazione di ADP favoriscono questa reazione attivando la adenilico deaminasi. Gli ioni ammonio prodotti stimolano la glicolisi,più in particolare la fosfofruttochinasi. L’acido inosinico(IMP) può essere degradato o nuovamente trasformatoin AMP. •Elevata concentrazione di glicerofosfato deidrogenasi che catalizza la reazione di riduzione del diidrossiacetonfosfato a glicerolo – 3 fosfato con ossidazione di NADH. In questa maniera si ha un recupero di NAD+ che viene utilizzato dalla fosfogliceraldeide deidrogenasi, prima che lo faccia la lattico deidrogenasi. Nella fase di riposo muscolare il glicerolo – 3 fosfato può essere riconvertito a diidrossiacetonfosfato nel processo della gluconeogenesi o essere utilizzato nei mitocondri per produrre FAD. Il muscolo nell’attività sportiva Meccanismo Anaerobico Lattacido E’ un meccanismo di emergenza che si attiva: • Nei primi istanti di un lavoro muscolare, prima che si attivi il metabolismo aerobico • Quando il lavoro muscolare aumenta fino a raggiungere la massima prestazione, per cui la quantità di ossigeno richiesta dalle fibre muscolari è superiore a quello che gli apparati respiratorio e cardiocircolatorio sono in grado di fornigli • Quando si interrompe il flusso di ossigeno, che arriva al muscolo attraverso il torrente ematico a causa di una forza talmente elevata che provoca la chiusura dei vasi sanguigni Con questo meccanismo (anaerobico lattacido) il muscolo compie la glicolisi, con necessità di rigenerazione di NAD+ attraverso la formazione di lattato da parte della lattato-DH. Si ha così un accumulo di acido lattico che causa un abbassamento del pH fino a valori incompatibili con la contrazione. Meccanismo Anaerobico Alattacido Con questo meccanismo si ricava ATP senza utilizzo di ossigeno né produzione di acido lattico. Si utilizza fosfocreatina, che viene idrolizzata a creatina: Fosfocreatina Pi+creatina = energia per la contrazione Meccanismo Aerobico L’energia derivante da questo processo è frutto della completa demolizione degli zuccheri e dei lipidi utilizzando O2 La massima potenza aerobica che un atleta può sviluppare nell’unità di tempo è direttamente proporzionale al massimo consumo di O2 nella stessa unità. Ciò a causa dell’effetto Pasteur DUE SPORTIVI A CONFRONTO Il maratoneta La maratona si può definire come una specialità tipicamente aerobica. Ciò significa che l’atleta, per sopportare oltre due ore di gara, attinge energia quasi esclusivamente dal meccanismo aerobico. La presenza di O2, trasportato fino alle fibre, consente alla muscolatura di privilegiare l’utilizzo di grassi e zuccheri (glicogeno).Infatti la muscolatura del maratoneta è prevalentemente costituita da fibre rosse, molto più ricche di mitocondri e mioglobina. Con l’allenamento, l’atleta dovrà incrementare la funzionalità ed il numero di fibre rosse, più adatte al metabolismo aerobico. E’ da tener presente che adottando andature troppo elevate, le limitate scorte di glicogeno epatico e muscolare, andrebbero ben presto incontro ad esaurimento. In fase di preparazione è indispensabile adottare un allenamento che consenta di sostenere andature elevate, con il minimo dispendio di energia di origine glucidica. L’obiettivo è di far bruciare grassi in percentuale maggiore rispetto agli zuccheri, per averne una buona disponibilità nella parte finale della gara, notoriamente più impegnativa. Alimentazione di gara E’ la dieta che lo sportivo deve seguire in prossimità della competizione, per ottimizzare la performance atletica Alimentazione pre-gara: la possibilità di mantenere a lungo un’elevata performance aerobica è direttamente proporzionale alla concentrazione di glicogeno muscolare presente all’inizio della gara. Per aumentare la quantità di glicogeno, si fa seguire una dieta ipoglucidica con allenamento gravoso, in modo da abbassare la concentrazionedi glicogeno muscolare, procedendo poi ad un carico iperglicemico. Per ottenere un aumento glicogenico è sufficiente aumentare la percentuale di carboidrati complessi nei 3 giorni che precedono la gara, con carichi di lavoro brevi e a bassa intensità. Il pasto pre-gara, consumato almeno 3 ore prima, deve essere ricco di zuccheri complessi, facilmente digeribile, non molto abbondante e povero di fibra. E’ opportuno, dopo il pasto pre-gara, fornire all’atleta, a circa 30-40 min prima della competizione, una razione d’attesa glucidico-idrica, per prevenire il possibili rischio ipoglicemico e di eccessiva glicogenolisi. Questo combatte anche gli effetti dello stress pre-gara che causa secrezione di adrenalina (effetto ipoglicemizzante). Terminata la prova, è necessario restituire rapidamente all’organismo acqua, sali minerali zuccheri semplici. L’alimentazione dopo la gara è fondamentale soprattutto se l’atleta deve ripetere a breve termine la prestazione, in quanto la velocità con cui il glicogeno muscolare si riforma è massima nelle prime ore dopo lo sforzo fisico ed aumenta in proporzione alla quantità di zuccheri introdotti. Si consiglia perciò di assumere 50-100 gr di zuccheri entro i primi 30 min, fino ad un totale di 600 gr nelle prime 20 ore (8-10 gr di carboidrati per kg di peso corporeo). DUE SPORTIVI A CONFRONTO Il velocista Le fibre muscolari di un velocista sono prevalentemente bianche, con una rete capillare poco sviluppata, poca mioglobina e meno mitocondri. Il muscolo bianco trae energia dall’ATP prodotto per via anerobica. Infatti gli alti livelli dei suoi enzimi glicolitici, che degradano il glicogeno fino ad acido lattico con liberazione di energia, permettono al muscolo bianco di contrarsi attivamente per brevi periodi. L’acido lattico che si forma è in gran parte ossidato nella fase di riposo. Durante i loro intensi, ma brevi sforzi, i muscoli bianchi attingono energia anche dal metabolismo della fosfocreatina. Chi pratica sport di resistenza necessita di una gran quantità di carboidrati che garantisca un apporto di glicogeno sufficiente per garantire l’energia durante gli sforzi prolungati. L’apporto di macronutriuneti deve essere così suddiviso: 60% carboidrati, 15% proteine e 25% grassi. E’ possibile quindi un abbondante consumo di pane, pasta, riso, patate, muesli, verdura, frutta fresca e frutta secca. Chi pratica attività di forza e di scatto necessita di un giusto apporto di carboidrati per garantire energia immediata col minor dispendio di ossigeno. E’ molto importante anche assumere sali minerali e vitamine, quindi è consigliato consumare molta frutta e verdura fresca, pesce, carne magra e cereali. Chi pratica sport di forza necessità di un maggior apporto di proteine per sviluppare la massa muscolare. Naturalmente è necessaria anche l’assunzione di carboidrati che forniscono il giusto apporto di energia senza i quali l’organismo è costretto ad utilizzare le riserve di proteine. L’apporto di grassi invece deve essere moderato. La preziosa fonte di sali minerali ed elemento essenziale che invece non deve mancare assolutamente nella dieta di uno sportivo qualsiasi sia l’attività praticata è l’acqua. Eccessiva produzione di radicali liberi L’attività sportiva aumenta i livelli di radicali liberi di un fattore che può andare da 6 a 30 volte. Essi ostacolano il normale metabolismo, impedendo il ripristino delle condizioni ottimali. In molti runners la produzione di radicali liberi durante la corsa è così alta che i danni alle strutture cellulari vengono riparati in 2-3 giorni. La capacità di opporsi alla produzione di radicali liberi diminuisce con l’età. Con un apporto vitaminico elevato (vitamina E + vitamina C) si riduce alla metà il tempo di ripristino. La creatina (Cr) è la molecola che, arricchita da un gruppo fosforico, diventa "fosfocreatina" (Pcr), unica fonte di energia di pronto utilizzo per il muscolo (sistema anaerobico alattacido). Infatti, in caso di necessità, la liberazione del gruppo fosforico della fosfocreatina fornisce energia sufficiente a resintetizzare ATP, molecola a sua volta altamente energetica; la scissione dell'ATP nelle cellule muscolari (con perdita del gruppo fosforico) libera l'energia necessaria alla contrazione. Il fabbisogno giornaliero di un adulto è di 2 grammi al giorno e viene coperto da: 50% tramite sintesi endogena (che avviene nel fegato e nel rene) 50% tramite assunzione col cibo (250 grammi di carne contengono 1 grammo di creatina) La creatina viene poi trasportata attivamente all'interno della cellula muscolare. I riscontri sperimentali più rilevanti sono stati sino ad ora i seguenti: se aumenta la creatina nel muscolo aumenta anche la fosfocreatina l'enzima responsabile della trasformazione di creatina in fosfocreatina nel mitocondrio è "accoppiato" alla fosforilazione ossidativa: questo significa che quando questo processo è attivo occorre una minor quantità di ADP per avviare la produzione di ATP l'incremento del livello di Pcr nel muscolo induce un incremento delle doti anaerobiche alattacide, ma non ha effetti né sul sistema anaerobico lattacido né sulle doti aerobiche aumenta la risintesi di Pcr (la perdita di Creatina dal muscolo è dell'ordine del 3%), ed in tal modo i vantaggi risultano stabili la somministrazione di Creatina diminuisce i livelli di iperammoniemia da sforzo (minor degradazione di ATP e minor produzione di ammonio) La Creatina rende più "stabili" i livelli di ADP nel muscolo, in modo che non siano mai elevati (rifosforilazione continua). Si è inoltre evidenziato un ritardo nella comparsa di affaticamento durante serie ripetute di esercizi ad alta intensità. Esiste tuttavia un problema pratico legato alle alti dose necessarie per raggiungere un effetto: la creatina assunta viene infatti solo parzialmente assorbita; di quella assorbita parte viene metabolizzata al fegato e parte arriva al muscolo; di quella che arriva al muscolo infine solo una parte viene trasformata in fosfocreatina. Il fabbisogno dell'atleta oscilla tra i 2 - 3 grammi al giorno. Gli steroidi anabolizzanti sono sostanze con azione simile a quella dell'ormone maschile testosterone. Le sostanze, come d'altra parte l'ormone, legandosi a specifici recettori cellulari inducono modificazioni tipiche legate alla differenziazione sessuale, principalmente un aumento della massa muscolare e della forza. Negli steroidi di sintesi viene ridotto l'effetto mascolinizzante mantenendo però l'effetto stimolante sul metabolismo proteico (deposizione di matrice muscolare). Le dosi dopanti (50-200 mg al giorno) sono dieci volte superiori a quelle consigliate per uso terapeutico. L'assunzione di ormoni steroidei induce un aumento della massa muscolare e questo, a sua volta, consente di affrontare allenamenti più pesanti e di conseguenza miglioramenti più marcati derivanti dall'allenamento stesso nelle prove di scatto e potenza. Inoltre gli steroidi inducono riduzione della massa grassa. L’uso dei diuretici induce disidratazione; si tratta di una forma di doping specificamente adottata negli sport ove esistono categorie di peso come la lotta, il sollevamento pesi e il pugilato: il vantaggio che ne deriva è quello di gareggiare in una categoria inferiore sfruttando la struttura fisica che competerebbe ad una categoria superiore. Tuttavia, la disidratazione è causa di ridotta funzione neuromuscolare e di difficoltà di termoregolazione in quanto il processo di sudorazione è meno efficiente. LA GLICOGENOLISI Nel muscolo Si trova sotto il controllo della glicogeno fosforilasi Questo enzima è presente in due forme: • INATTIVA fosforilasi b • ATTIVA fosforilasi a Garantisce un supplemento di glucosio per il metabolismo energetico ESCLUSIVAMENTE a livello delle cellule muscolari. Infatti il glicogeno muscolare non viene mobilizzato per ripristinare l’omeostasi del glucosio nel sangue. Il passaggio da una forma molecolare all’altra dipende da tre tipi di segnali: Ormonali Metabolici Neuronali Ormonali Le catecolamine attivano l’adenilato ciclasi per produrre AMP ciclico che a sua volta attiva una proteincinasi specifica. il controllo ormonale consente di superare il controllo metabolico della fosforilasi e il glicogeno può essere degradato a dispetto anche di normali concentrazioni di ATP e glucoso-6-P. Il processo è generalizzato sull’intera massa muscolare, in quanto i recettori adrenalinici sono ampiamente diffusi, è inoltre dispendioso in termini di consumo delle riserve energetiche ma funzionale a risposte di emergenza. METABOLICI Un aumentato utilizzo di ATP durante l’attività muscolare breve porta ad un rapido accumulo di ADP che viene convertito in AMP, modificando il rapporto ATP/AMP. Questo comporta la stimolazione: • Della fosfofruttochinasi, inducendo di conseguenza la glicolisi • Della glicogenolisi per attivazione allosterica della glicogeno fosforilasi b NEURONALI Sono dipendenti dal Ca2+, questo intorno alle concentrazioni di 108/10-6 M esso è in grado di attivare l’ATPasi miofibrillare (actomiosina) e dare inizio alla contrazione. Nello stesso tempo viene stimolata la fosforilasi-b-cinasi e come risultato la fosforilasi b è convertita in a dando inizio alla glicolisi. Il rilassamento del muscolo è dovuto invece al trasporto del Ca2+ nuovamente nel reticolo sarcoplasmatico, processo questo richiedente energia. Il controllo dipendente dal calcio della fosforilasi assume un carattere di economicità rispetto a quello ormonale; esso viene utilizzato quando limitati muscoli entrano in funzione per specifiche esigenze, senza l’impegno dell’intera massa muscolare.
Scaricare