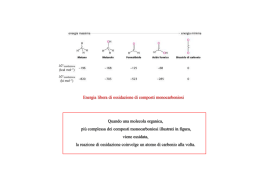
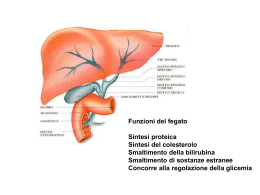
METABOLISMI TESSUTO-SPECIFICI Ogni tessuto ha una sua funzione specifica che riflette la sua funzione specifica che si riflette nella sua anatomia e nella sua attività metabolica. mantenimento potenziale di membrana, invio segnali ad altri organi ruolo centrale nel metabolismo sintesi, raccolta e molbilizzazione dei trigliceridi Intestino tenue: assorbimento dei nutrienti Sistema linfatico: trasporto dei lipidi dall’intestino al fegato T. Adiposo lavoro meccanico mediante utilizzazione di ATP Riepilogo delle principali vie metaboliche FEGATO Funzioni metaboliche del fegato 1. Metabolismo dei carboidrati 2. Metabolismo dei lipidi 3. Metabolismo delle proteine 4. Metabolismo eme 5. Deposito Fe 6. Fattori coagulazione 7. Detossificazione 8. Deposito vitamina Fegato • • • • Organo altruista Centralità funzionale Grande flessibilità metabolica Modulazione dell’espressione degli enzimi avviene a una velocità 5-10 superiore a quella degli altri tessuti • La vena porta è la via di trasporto che collega gli organi della digestione con il fegato Vie metaboliche che utilizzano glucosio nel fegato Il fegato tampona i livelli di glucosio nel sangue • Assume e rilascia glucosio in risposta agli ormoni e alla concentrazione di glucosio • Glucosio è intrappolato nel fegato come G-6-P dalla glucochinasi – Glucochinasi ha un’alta Km ( 5 mM: bassa affinità) per il glucosio e non è inibita da G6P.Attività aumenta con la concentrazione del glucosio. – Esochinasi in molte cellule hanno un’alta affinità per il glucosio (Km ~ 0.1 mM:alta affinità) e sono inibite da G6P • Ad alta [glucosio], il fegato assume glucosio a una velocità più o meno proporzionale alla sua concentrazione Metabolismo degli amino acidi nel fegato Metabolismo dei lipidi nel fegato Catabolismo dell’eme • L’eme viene trasformato in bilirubina. • Il 75% della bilirubina deriva dall’emoglobina degli eritrociti vecchi che vengono fagocitati dai macrofagi della milza, del fegato e del midollo osseo. • 1.2 108 eritrociti /ora distrutti (6g di emoglobina /die) • Concentrazione plasmatica di bilirubina: 1 mg/dl • Se la concentrazione di bilirubina supera 3 mg/dl si ha l’ittero (riconoscibile dalla colorazione gialla della pelle) La bilirubina è il prodotto del metabolismo dell’eme, il gruppo prostetico dell’emoglobina. È un pigmento giallo-verde che dà il colore alla bile stessa. Prende origine dalla distruzione dei globuli rossi ad opera dei macrofagi: il gruppo dell’eme viene aperto: • Il ferro viene catturato dalla transferrina • La catena lineare di 4 anelli pirrolici viene metabolizzata a 1. Biliverdina 2. Bilirubina La bilirubina, nel giro di poche ore, viene quindi catturata dal fegato dove viene coniugata, essenzialmente con acido glucuronico: la bilirubina glucuronide viene escreta nella bile Catabolismo dell’eme Eme Fe (pool) emoglobina urine biliverdina rene Feci sangue bilirubina (insol) Bilirubina/albumina stercobilina(colorato fegato intestino Bilirubina/ac. glucuronico Canalicolo biliare stercobilinogeno (incolore Ittero • L’ittero è inequivocabilmente evidente su base clinica quando la concentrazione plasmatica di bilirubina è supera la soglia di 3 mg/dl • Classificazione: • Pre-epatico: eccessiva produzione di bilirubina conseguente a episodi emolitici • Intra-epatico: riflette una disfunzione epatica generalizzata • Post-epatico: provocata dalla ostruzione delle vie biliari Pre-epatico cause: emolisi Intra-epatico cause: infezione epatiti sostanze chimiche alcol difetti genetici metabolismo bilirubina sindrome di Gilbert sindrone di Grigler sindrome di Dubin-J sindrome di Rotor proteine specifiche morbo di Wilson neonatale fisiologico autoimmune epatite cronica Post-epatico cause: dotti biliari intraepatici dotti biliari extraepatci (molto comune) comune) (1/20) (raro) (raro) (raro) (1/200.000) (molto comune) farmaci (molto comune) cirrosi calcolosi cistifellea (comune) • I difetti genetici sono associati ad anomalie nella coniugazione o nella secrezione delle bilirubina. • Sindrome di Gilbert (5% delle popolazione) consiste in un modesto aumento della bilirubina non coniugata a causa di una diminuita attività della UDP-glucuronil trasferasi • Sindrome di Crigler-Najjar è causata dall’assenza completa o dalla marcata diminuzione delle capacità di coniugazione delle bilirubina (può essere fatale) • Ittero neonatale (comune nei neonati) dovuto alla immaturità del sistema enzimatico responsabile della coniugazione della bilirubina. La bilirubina non coniugata è tossica per il cervello e provoca uno stato patologico (kernittero). Fototerapia con UV per ossidare la bilirubina Azione detossificante del fegato: metabolismo dell’Etanolo • E’ un alcol a elevato contenuto energetico (7kcal/g), intermedio fra quello dei glucidi e dei lipidi, • Non viene accumulato, viene subito eliminato attraverso le urine, l’aria e metabolizzato • 80% del metabolismo avviene nel fegato (2 mmoli di alcol/g di tessuto/ min) e in minor misura nella mucosa gastrica, polmoni e rene • Viene assorbito dal cavo orale, stomaco e intestino tenue per semplice diffusione • La velocità di assorbimento è proporzionale alla quantità ingerita • Alcol deidrogenasi: dimero di 4 distinte catene polipeptidiche, ognua delle quali ha 4 atomi di Zn :2 per legare etanolo e NAD e 2 per stabilizzare la struttura terziaria) – Alcol + NAD+ Diverse forme di acetaldeide deidrogenasi. matrice mitocondri (Km<1mM) membrana mitocndri (Km 2mM) citoplasma Km elevata NADH + H+ + acetaldeide Concentrazione elevata di etanolo Nel fegato sono presenti altri due enzimi in grado di trasformare l’etanolo in acetaldeide che sono attivi solo ad elevata concentrazione di alcool: -catalasi, che utilizzando H2O2 ha anche un ruolo detossificante Etanolo + H2O2 acetaldeide + 2acqua alcool idrossilasi a funzione mista (MEOS:sistema microsomiale ossidante etanolo), che utilizza O2 e NADPH e costituisce il sistema microsomiale ossidante dell’etanolo: etanolo + NADPH + H+ + O2 acetaldeide + NADP+ + H2O Meos è un sistema specifico che catalizza anche la detossificazione di molti farmaci e composti tossici ed inducibile dell’etanolo stesso Cambiamenti metabolici durante l’ossidazione dell’etanolo 1-Aumento del rapporto NADH/NAD+ (spostamento del potenziale redox verso uno stato più ridotto, condizione che determina variazioni nel rapporto di substrati NAD dipendenti) 2-Aumento della sintesi di acidi grassi e trigliceridi 3-blocco della gluconeogenesi 4-inattivazione della glutammico deidrogenasi 5- formazione di radicali liberi dell’ossigeno e il radicale idrossietilico, responsabili entrambi dell’aumento dei processi di perossidazione lipidica e di una riduzione delle difese antiossidanti del fegato Riduzione difese antiossidanti del fegato Azione Detossificante del fegato: Metabolismo degli xenobiotici • Il fegato presiede alla rimozione di svariate sostanze "non nutritive" presenti nell’organismo riducendone o annullandone l’eventuale tossicità. • Le reazioni di biotrasformazione di farmaci, ormoni steroidei, steroidi endogeni e sostanze tossiche, comprendono processi – di detossicazione esplicati mediante idrossilazioni, ossidazioni, riduzioni – coniugazioni che avvengono principalmente nei microsomi del fegato. Reazione della fase I: IDROSSILAZIONE SH + O2 + NADPH + H+ S-OH + H2O NADP+ Serie successiva di reazioni red-ox: SOH NADPH+H+ NADP+ Flavoproteina ossidata Flavoproteina ridotta NHP-Fe2+ P450-Fe3+ NHP-Fe3+ P450-Fe2+ SH Il 50% dei farmaci viene metabolizzato con il sistema P450 H2O O2 Protezione da danno ossidativo • Nella cellula si formano radicali liberi provenienti da parziale riduzione dell’O2 molto reattivi e tossici per lipidi, acidi nucleici, proteine • Mitocondri sono molto esposti a questo danno • In condizioni normali se ne formano pochi e sono rapidamente rimossi • In particolari condizioni si formano molti radicali liberi con uno o più elettroni spaiati e molto reattivi – radicale superossido molto reattivo e non tossico poiché rimosso dalla SOD (superossido dismutasi) – da questo radicale si formano altri specie reattivi e tossici, come l’ossigeno singoletto, molto reattivo e tossico Rimozione di acqua ossigenata Nell’uomo, esistono 15 o più isoenzimi CYP450, che differiscono, parzialmente, per specificità, induttori, inibitori. CYP450 NOMENCLATURE Based upon Nelson et al. DNA & Cell Biology 12:1-51, 1993. CYP3A4 CYP – abbreviation for cytochrome P450 3 – designates family (> 40% sequence identity) A – designates sub-family (> 55% sequence identity) 4 – designates specific gene/enzyme CYP – designates mRNA or protein CYP – designates gene CYP1A1 – gene that codes for cytochrome P450 1A1 CYP1A1 – mRNA or protein product of CYP1A1 gene 19 • Ciascun isoenzima è caratterizzato dai substrati metabolizzati, dagli induttori ed inibitori. • Tuttavia, data la scarsa specificità delle varie isoforme, spesso 2 o più isoforme partecipino al metabolismo di un singolo xenobiotico. • Le varie isoforme possono catalizzare reazioni diverse sullo stesso substrato. • In molti casi predomina il metabolismo operato da un’isoforma. Il contributo delle varie isoforme dipende dai valori di Km e Vmax. Variabilità del CYP450 • Fattori genetici (variabilità interindividuale) • Se il metabolismo di un farmaco è regolato principalmente da un solo gene (un solo enzima o isoenzima), si possono avere tre casi generali: • 1. Il gene è presente in una sola forma, espressa in modo simile in tutti gli individui; • 2. Il gene è presente, nella popolazione, in due o più forme (alleli), i cui prodotti hanno attività enzimatica nettamente diversa; • 3. Il gene è presente in una sola forma ma mutazioni dei geni regolatori causano una marcata riduzione dell’espressione genica. • Nel caso 1), la variabilità è determinata da fattori non genetici e la distribuzione della capacità metabolizzante nella popolazione sarà normale (gaussiana). • Nei casi 2) e 3) si osserva una distribuzione non normale; sono presenti due (o più) popolazioni . • Sono quindi presenti almeno due fenotipi. In questo caso si ha polimorfismo genetico • • • • • • Reazioni di coniugazione (fase II): glucuronidazione solfatazione acetilazione metilazione coniugazione con glutatione (formazione di acidi mercapturici) • coniugazione con aminoacidi (glicina, taurina, acido glutammico) Le reazioni di coniugazione consistono nella combinazione di sostanze non fisiologiche o xenobiotiche con gruppi polari per formare un coniugato inattivo più facilmente eliminabile dal rene. Le principali reazioni di questo tipo sono: 1-fenoli, alcooli, acidi carbossilici, amine e tioli con acido glucuronico con formazione di glucuronidi 2-la coniugazione di fenoli, alcooli, amine con solfati per dare origine a formazione di solfati assai solubili in acqua PAPS: fosfoadenosina-5’-fosfosolfato PAP: fosfoadenosina-5’-fosfato APS:adenosina-5’-fosfosolfato 3) l’acetilazione di amino composti catalizzata dall’acetiltransferasi; 4) la metilazione di alcuni fenoli, catecolamine e di acido nicotinico a spese della metionina; 5) l’attacco di glicina ad acidi aromatici quali l'acido benzoico o l'acido salicilico con formazione di un’amide sostituita 6) l’attacco di glutatione a composti alogenati e a nitrocomposti come il 2-4 dinitro-1-clorobenzene per formare un coniugato attraverso il legame con l’atomo di zolfo del residuo di cisteina Glutathione è un tripeptide formato da glutamateo, cisteina, e glicina Reazione del glutatione con un elettrofilo Alcuni parametri utili per testare la funzionalità epatica AST ( o GOT): aspartico amino trasnferasi ALT (o GPT): alanina amino transferasi: AST è libero nella frazione mitocondriale; ALT è libero nel citosol degli epatociti.Solo AST si trova anche nel cuore, Muscolo scheletrico, rene…ALT è abbondante nel fegato (specifico:utile nelle apatopatie) ALP:fosfatasi alcalina Presente in molti organi. I levelli aumentano nelle epatopatie PT: tempo di protrombina Importante per valutare il la funzionalità epatica (produzione Dei fattori II, VII, IX, X da parte del fegato) GGT: gamma-glutamil-transferasi Glicoproteina legata alla mebrana plasmatica. Il suo livello Aumenta negli alcolisti per elevata produzione da parte delfegato DANNO EPATO CELLULARE ACUTO CRONICO Albumina normale o diminuita normale o fortemente diminuita Bilirubina normale o fortemente aumentata normale o aumentata Transaminasi fortemente aumentata aumentata ALP normale normale GGT leggermente aumentata leggermente aumentata Ig leggermente aumentata normale PT normale leggermente aumentata COLESTASI normale aumentata leggermente aumentata fortemente aumentata fortemente aumentata normale leggermente aumentata Tessuto adiposo Il tessuto adiposo: un deposito di materiale energetico In un individuo di 70 kg la quantità di grasso accumulata è di circa 15kg (21% del peso), in gran parte sotto forma di Trigliceridi Distinguiamo: tessuto adiposo bianco tessuto adiposo bruno Differenze Funzione Risp. Freddo Distribuzione Vascolarizzazione Gocce lipidiche Mitocondri Meta. Ac. Grassi UCP T.A. bianco T.A. bruno riserve energetiche lieve estesa scarsa uniloculari scarsi rilasci acidi grassi assente termogenesi intensa limitata estesa multiloculari numerosi oss. in situ presente Adipociti umani Composizione biochimica dell’adipocita Oltre ai lipidi, il t.a. contiene 10% di acqua, 2% collagene, o.1% di glicogeno Gli acidi grassi utilizzati per la sintesi dei Trigliceridi provengono dai chilomicroni (intestino) e dalle VLDL (fegato) L’idrolisi dei Tg avviene ad opera di una Lipoproteina Lipasi (fatt. chiarificante) L’attività della lipoproteina lipasi dipende dallo stato nutrizionale e metabolico dell’organismo e, in particolare, dall’azione ormonale di glucagone e insulina Condizioni post-prandiali: attività LPL aumenta (azione dell’insulina) Condizioni di digiuno: attività LPL diminuisce (azione glucagone) Km LPL del tessuto adiposo è 10 volte> Km tessuto cardiaco Punti chiave: La produzione di gliceloro 3-fosfato controlla l’esterificazione La lipolisi è controllata dalla lipasi ormono-sensibile L’aumento del metabolismo del glucosio diminuisce il rilascio di acidi grassi liberi Metabolismo del tessuto adiposo Glucosio-6-P Tessuto adiposo (non ha la glicerolo chinasi) Acetil-CoA b-ox lipogenesi Ciclo pentosi Glicerolo-3-P Acil.CoA esterificazione Ciclo continuo Idrolisiesterificazione FFA (Pool2) Lipasi ormono-sensibile TG glicerolo FFA (Pool1) esterificazione<lipolisi + LPL FFA glucosio + insulina glicerolo TG Chilomicroni, VLDL plasma Fegato, reni Regolazione della lipolisi 5’AMP insulina + - fosfodiesterasi Caffeina teofillina Lipasi ormono-sensibile (inattiva) Proteina Chinasi cAMP-dip cAMP Adenilato ciclasi + ATP insulina - - Glucagone Adrenalina, ACTH, TSH fosfatasi P Lipasi ormono-sensibile (attiva) TG insulina + DG + FFA DG lipasi MG + FFA MG lipasi FFA + glicerolo • Il tessuto adiposo bruno promuove la termogenesi, quando è richiesta pa produzione di calore • Molto attivo in alcune specie durante il risveglio dal letargo, animali esposti al freddo, nei neonati • Molto probabilmente reposnabile della termogenesi indotta dalla dieta • Ridotta negli obesi • Disaccoppiamento dell’ossidazione e della fosforilazione ossidativa • Importante la proteina UCP (uncoupling protein; termogenina) • L’ossidazione produce essenzialmente calore Cervello • I neuroni utilizzano solo glucosio come nutriente • Dipende in gran parte dal glucosio che arriva col sangue • Metabolismo respiratorio molto attivo • Non utilizzano direttamente acidi grassi come nutrienti • Utilizza corpi chetonici nel digiuno prolungato • Utilizza la maggior parte della sua energia sotto forma di ATP per il trasporto attivo di ioni Na e K al fine di mantenere il potenziale elettrico delle membrane neuronali Fonti energetiche nel cervello in base allo stato nutrizionale Soggetto a riposo Soggetto sveglio da 48h Metabolismo del glucosio nel cervello Sangue • Trasporta metaboliti, ossigeno, ormoni • Metà del volume è occupato da – Eritrociti – Leucociti – Piastrine La concentrazione del glucosio nel sangue è sottoposta a stretto controllo • Sistemi ormonali di controllo Effetti della bassa concentrazione del sangue REGOLAZIONE ORMONALE DEL METABOLISMO ENERGETICO M aturazione di insulina + peptide C I nsulina • Cellule b delle isole di Langerhans • Polipeptide con 2 catene legate da ponti S-S • Fortemente conservata (si può usare sull’uomo insulina bovina e suina) Ribosomi Pre-pro-insulina Pro-insulina Pro-insulina Reticolo endoplasmico Insulina + C Insulina + C Apparato di Golgi Circolazione Secrezione normale di insulina • • • • Semivita plasmatica di insulina: 3-5 minuti Semivita plasmatica di pro-insulina: molto maggiore Pro-insulina dà reazioni crociate con insulina Livello di peptide C discrimina insulina eso- ed endogena Ribosomi Pre-pro-insulina Pro-insulina Pro-insulina 5% Reticolo endoplasmico Insulina + C Insulina + C 95% Apparato di Golgi Circolazione Risposta delle cellule b alle modificazioni di concentrazione di glucosio Granuli di insulina Glucosio: ALTA Glucosio: BASSA K+ Canali K ATP-dip. G-6-P K+ + ATP ADP depolarizzazione ATP ADP Ca ++ + + + Ca++ polarizzazione 70mV Canale Ca Meccanismo di secrezione dell’insulina dalle cellule b del pancreas K+ depolarizzazione Ca++ diazossido sulfonilurea + Somatostatina Ca antagonisti KIR SUR K ++ Ca + GK glucosio ATP/ADP G-6-P Ins + NADP Glu NADPH aKG + NH4 + GDH Insulina + leucina GK: sensore del glucosio Ins. Ins. Membrana cellulare Y Y PY YP autofosforilazione IRS: Insulin Receptor Substrate Segnali intracellulari -metabolici -DNA (trascrizione. Proliferazione…..) Effetti cellulari Effetti metabolici PDE3b=fosfodiesterasi 3b PI3K=fosfoinositolo 3 chinasi PP1=proteina fosfatasi GSK3= glicerolo sintasi chinas i glucosio glucosio Glicogeno sint. + glicogeno glicolisi piruvato + c. Acetil CoA krebs + Glicogeno sint. Glicerolo-3.P + + TG + Ac.grassi c. Acetil CoA krebs lipogenesi + + Lipopr. lipasi lipogenesi + Acidi grassi TG MUSCOLO + piruvato lipogenesi c. Acetil CoA krebs + Sint.prot. glicerolo Glut 4 K+ glicolisi piruvato Sint.prot. FEGATO + glicogeno glucosio K+ + VLDL glicerolo aa. aa. Glut 4 Glut 2 + TESSUTO ADIPOSO Acidi grassi TG Effetti metabolici dell’insulina Effetti metabolici del Glucagone glucosio Sintesi glicogeno glicogeno glicogenolisi + - glicerolo gluconeogenesi glicolisi alanina + lattato piruvato c. krebs Acetil CoA chetogenesi Ossidaz. + lipogenesi + Corpi chetonici Acidi grassi Glucagone adrenalina P Inibitore-1 cAMP Inibitore-1-P Fosforilasi Chinasi b Glicogeno Sintetasi b Inibizione delle fosfatasi P P P Proteina Chinasi cAMP dip. Proteina fosfatasi Proteina fosfatasi Fosforilasi Chinasi a Glicogeno Sintetasi a P glicogeno UDP-glc Ciclo del glicogeno Fosforilasi a Fosforilasi b P P Glucosio-1-P Controllo della glicogenolisi e glicogenosintesi Proteina fosfatasi Glucagone recettore Regolazione da parte del fruttosio-2,6-difosfato Proteine G Adenilato c. ATP cAMP Attivazione della proteina chinasi A Fosforilazione del complesso fosfofruttochinasi-2/ Fruttosio-2,6difosfatasi Attivazione della fruttosio-2,6dPasi inattivazione della PFK-2 Diminuzione di F-2,6.dP Attivazione della F-1,6 dPasi Aumento della gluconeogenesi Inibizione PFK-1 Diminuzione della glicolisi Inibita dalla fosforilazione cAMP dipend. epatocita c.K citrato citrato Attivata dalla Acetil-CoA defosfor. insul. dip. Acetil-CoA carbossilasi c.chet. Acetil.CoA Malonil.CoA palimitato Corpi chetonici Acil-CoA stearato oleato Acil-CoA Acido grasso TG VLDL Lipoproteina lipasi Acidi grassi liberi Lipasi Or. sen Attivata dalla fosforilazione cAMP-dipendente TG adipocita
Scaricare