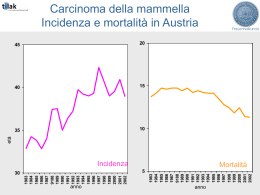
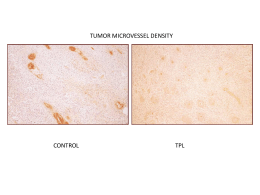
Università degli Studi di Urbino Carlo Bo Corso di laurea in Biotecnologie e Biotecnologie Industriali A.A. 2008/2009 Filomena Porchia Il tumore al seno “ Caratterizzazione, diagnosi, terapia e terapia innovativa (trastuzumab e gli inibitori dell’aromatasi)” Che cos’è un tumore? TUMORE o NEOPLASIA: è una massa abnorme di tessuto la cui crescita è incontrollata (la proliferazione sfugge a qualsiasi controllo) • Tumore benigno: cellule neoplastiche raggruppate in un’unica massa • Tumore maligno: cellule neoplastiche con capacità invasiva nei confronti dei tessuti circostanti. Che cosa si intende per metastasi? Cosa si intende per anaplasia? E per displasia? Il danno genetico non letale rappresenta il fulcro della cancerogenesi PROTOONCOGENI GENI CHE REGOLANO L’APOPTOSI I PRINCIPALI BERSAGLI GENI PER LA RIPARAZIONE DEL DNA ONCOSOPPRESSORI Geni coinvolti nei tumori Mutazioni in un oncosoppressore Mutazioni in un proto-oncogene Gene soppressore del tumore Controllo normale della crescita proto-oncogene Controllo normale della crescita Controllo normale della crescita Entrambi gli alleli sono mutati PERDITA DI CONTROLLO DELLA CRESCITA proto-oncogene mutato un oncogene PERDITA DI CONTROLLO DELLA CRESCITA La proliferazione cellulari in condizioni fisiologiche Protoncogeni • Fattori di crescita(es.PDGF) • Recettori dei fattori di crescita (es. c-erbB) • Proteine che inviano segnali di trasduzione (es. c-ras) • Fattori regolatori nucleari(es. myc) • Cicline e CKD Oncosoppressori • Fattori che inibiscono la crescita (es. BRCA-1) • Molecole che regolano l’adesione cellulare (es. DCC) • Molecole che regolano i segnali di trasduzione (es. NF-1) • Molecole che regolano la trascrizione nucleare e il ciclo cellulare (es. pRb, p53) Fattori genetici • Sovraespressione del protoncogene cerbB2(o c-neu ) • Mutazioni del gene oncosoppressore p53 • Mutazioni del gene oncosoppressore BRCA1- BRCA-2 La mammella umana Che cos’è il tumore al seno? La neoplasia in situ Carcinoma duttale in situ CDIS Carcinoma lobulare in situ CLIS La neoplasia invasiva Carcinoma duttale infiltrante Carcinoma lobulare infiltrante Esistono poi: • • • • • • • c. midollare c. mucinoso c. tubulare mastite carcinomatosa morbo di Paget fibroadenoma Papilloma intraduttale Localizzazioni più frequenti delle metastasi del carcinoma della mammella QUANTO è DIFFUSO? I PRINCIPALI FATTORI DI RISCHIO • • • • • L’età Il fattore genetico Gli ormoni La storia riproduttiva e il clima ormonale L’influenza dell’alimentazione e dell’obesità • Radiazioni ionizzanti • Anamnesi di tumore della mammella • Densità della mammella SINTOMI • Protuberanza o ispessimento nella mammella o nella zona ascellare • Variazioni delle dimensioni o della forma della mammella • Secrezione • Cambiamento dell’aspetto DIAGNOSI PRECOCE • La mammografia è il metodo attualmente più efficace per la diagnosi precoce • L’autopalpazione DIAGNOSI • • • • • • • Esame clinico Mammografia Ecografia Agoaspirazione Agobiopsia Biopsia escissionale Galattografia LE RACCOMANDAZIONI DELL'AMERICAN CANCER SOCIETY Le linee guida dell'American Cancer Society raccomandano: · l'autopalpazione mensile alle donne sopra i 20 anni · l'esame mammografico ogni due anni alle donne tra i 40 e i 49 anni · l'esame mammografico annuale alle donne sopra i 50 anni · la visita al seno ogni tre anni dai 20 ai 40 anni · la visita al seno annuale sopra i 50 anni La prognosi è influenzata dai seguenti fattori: • • • • • • • • Dimensione del carcinoma primario Interessamento dei linfonodi e numero dei linfonodi metastatici Grado del carcinoma Tipo istologico di carcinoma Invasione dei vasi linfatici Presenza o assenza di recettori per estrogeni o progestinici Indice proliferativo del carcinoma Sovraespressione di ERBB2 A cosa servono i fattori prognostici? • Tutti questi aspetti vengono usati per classificare le pazienti in gruppi prognostici al fine di decisioni terapeutiche , per l’inserimento in protocolli di trattamento e per valutare i risultati. Stadiazione del carcinoma della mammella • Stadio I Tumore piccolo (inferiore ai 2 cm), rimovibile, confinato al seno e linfonodi negativi • Stadio II Tumore di dimensioni inferiori ai 5 cm ma esteso ai linfonodi ascellari • Stadio III Tumore localmente avanzato con interessamento dei muscoli del petto e coinvolgimento dei linfonodi ascellari • Stadio IV Presenza di metastasi Classificazione clinica T Tumore primitivo • TxIl tumore primitivo non può essere definito • T0Non segni del tumore primitivo • TisCarcinoma in situ; carcinoma intraduttale, o carcinoma lobulare in situ o malattia di Paget (1) del capezzolo senza che sia evidenziabile il tumore • T1Tumore di 2 cm o meno nella dimensione massima T1a Tumore di 0,5 cm o meno nella dimensione massinia T1b Tumore superiore a 0,5 cm ma non più di 1 cm nella dimensione massima T1c Tumore superiore a 1 cm ma non più di 2 cm nella dimensione massima • T2Tumore superiore a 2 cm ma non più di 5 cm nella dimensione massima • T3Tumore superiore a 5 cm nella dimensione massima • T4Tumore di qualsiasi dimensione con estensione diretta alla parete toracica o alla cute (2) T4a Estensione alla parete toracica T4b Edema (inclusa la pelle a buccia d’arancia), od ulcerazione della cute della mammella o noduli satelliti della cute situati nella medesima mammella T4c Presenza contemporanea delle caratteristiche di T4a e T4b T4d Carcinoma infiammatorio (3) N Linfonodi regionali • NiI linfonodi regionali non possono essere definiti (ad esempio se precedentemente asportati) • N0Non metastasi nei linfonodi regionali • N1Metastasi in linfonodi ascellari omolaterali mobili • N2Metastasi in linfonodi ascellari omolaterali fissi tra di loro o ad altre strutture • N3Metastasi nei linfonodi marninari interni omolaterali M Metastasi a distanza • MiLa presenza di metastasi a distanza non può essere accertata • M0Non metastasi a distanza • M1Metastasi a distanza (comprese le metastasi nei linfonodi sopraciaveari) · Come si cura il tumore al seno? • Le tecniche chirurgiche attuali prevedono due tipi di intervento: la chirurgia demolitiva e quella conservativa. La demolitiva consiste nell'asportazione totale della mammella e viene eseguita se il tumore è particolarmente esteso o aggressivo. Se il tumore è invece di piccole dimensioni si utilizzano interventi conservativi: la quadrantectomia o la tumorectomia. Glossario degli interventi chirurgici • • • • • • • • • • Resezione mammaria limitata Asportazione di una piccola porzione di tessuto mammario comprendente il tumore. Sinonimi: tumorectomia, biopsia escissionale. Resezione mammaria ampia Asportazione di una porzione di tessuto mammario comprendente il tumore, con un margine non inferiore ad un centimetro di parenchima mammario circostante macroscopicamente sano. Quadrantectomia Asportazione di un ampio settore di ghiandola mammaria con la cute soprastante e la sottostante fascia del muscolo pettorale. Il margine di tessuto sano circostante il nodulo non deve essere inferiore ai 3 centimetri. Mastectomia totale o semplice Asportazione della ghiandola mammaria e di una losanga di cute soprastante. Mastectomia radicale Il termine radicale non è oggi più impiegato, in quanto il concetto di radicalità va considerato un obiettivo sia della chirurgia demolitiva sia della conservativa. Mastectomia sottocutanea Asportazione della ghiandola mammaria rispettando la cute soprastante. Mastoplastica riduttiva Riduzione di parte della ghiandola mammaria per ridurne la ptosi. Mastopessi Rimodellamento ghiandolare con riduzione della cute per ridurre la ptosi mammaria. Dissezione ascellare di primo livello Asportazione dei linfonodi situati lateralmente al muscolo piccolo pettorale. Dissezione ascellare totale Asportazione di tutti i linfonodi ascellari con o senza asportazione del muscolo piccolo pettorale. Come si cura il tumore al seno? • La radioterapia ha lo scopo di evitare una recidiva locale. È particolarmente indicata dopo la chirurgia conservativa perché esiste il pericolo che nel tessuto mammario non asportato siano rimaste cellule tumorali non visibili. Radioterapia Radioterapia dopo chirurgia radicale Radioterapia dopo chirurgia conservativa La radioterapia nel trattamento della Malattia metastatica La tossicità attesa con la combinazione di La chemioterapiachemioterapia si distingue inclassica : CMF (cielofosfamide, • Chemioterapia adiuvante metotrexate, 5fluorouracile) comprende • Chemioterapia neoadiuvante o primaria soprattutto nausea e vomito, una modesta Come si cura il tumore al seno? alopecia, frequentemente leucopenia e piastrinopenia, a volte stomatite, a volte diarre più raramente congiuntivite edi cistite. consiste nell'impiego • La chemioterapia farmaci anti-cancro per distruggere le cellule tumorali. Nel caso di carcinoma mammario, si somministra di solito una combinazione di farmaci, per bocca oppure per endovena. In entrambi i casi, la chemioterapia è una terapia sistemica, perché i farmaci entrano nel circolo ematico diffondendosi per tutto l'organismo. Come si cura il tumore al seno? • L'endocrinoterapia mira a bloccare l'azione degli ormoni sulle cellule tumorali. Questo tipo di terapia prevede in certi casi l'uso di farmaci che modificano il funzionamento ormonale, oppure l'asportazione chirurgica delle ovaie, produttrici degli ormoni femminili. Come la chemioterapia, anche la terapia ormonale si può definire sistemica, perché interessa tutte le cellule dell'organismo. L’endocrinoterapia • tamoxifen • Le nuove prospettive: gli inibitori dell'aromatasi LO STUDIO 024 Questo studio è stato realizzato in donne in postmenopausa con tumore al seno non candidate ad intervento chirurgico al fine di verificare l'efficacia di letrozolo verso tamoxifene, somministrati per quattro mesi una volta al giorno, nel ridurre la massa tumorale permettendo una chirurgia di tipo conservativo. Lo studio ha dimostrato la maggiore efficacia di letrozolo rispetto a tamoxifene sia in termini di percentuale di risposta obiettiva (risposta completa o parziale) sia in una maggiore possibilità di sottoporsi a una terapia chirurgica conservativa. Obiettivi: analizzare l'efficacia di letrozolo e tamoxifene sulla riduzione della massa tumorale in donne in menopausa con tumore del seno e verificare la opportunità fornita dai due trattamenti a confronto di sottoporre la paziente dichiarata eleggibibile per un intervento radicale ad una chirurgia conservativa. Caratteristiche dello studio: lo studio, multicentrico internazionale, in doppio cieco, randomizzato, controllato. Pazienti coinvolte: 337 donne in postmenopausa con tumore al seno non candidate a chirurgia conservativa sono state coinvolte nello studio in 55 centri in Europa (9 Paesi), negli Stati Uniti e in altre 6 Paesi. Periodo dello studio: lo studio è durato dal marzo 1998 all'agosto 1999. Le donne hanno assunto i trattamenti per via orale per 4 mesi. Risultati: I risultati dello studio hanno dimostrato che letrozolo è risultato significativamente superiore rispetto a tamoxifene nel ridurre la massa tumorale rilevata mediante palpazione clinica o tecnica ecografica e mammografica. · Risposta valutata mediante esame clinico. letrozolo ha dimostrato una migliore risposta valutata mediante esame clinico rispetto a tamoxifene (55% verso 36% p<0.001). · Chirurgie conservative. Prima di iniziare lo studio, la maggior parte delle donne avrebbe dovuto sottoporsi a mastectomia. Lo studio ha dimostrato che il numero delle donne eleggibili per la chirurgia conservativa era aumentato in modo significativamente più consistente nel gruppo letrozolo rispetto a tamoxifene (45 verso 35% p=0.022). · Risposta valutata mediante ecografia. La valutazione effettuata mediante ecografia ha dimostrato che letrozolo e stato significativamente superiore rispetto a tamoxifene (35% verso 25% p=0.042). · Risposta valutata mediante mammografia. Le donne in trattamento con letrozolo hanno dimostrato una risposta significativamente maggiore, valutata mediante mammografia, rispetto a quelle in trattamento con tamoxifene (34% verso 17% p<0.001). Effetti collaterali: entrambi i farmaci sono stati ben tollerati. Gli effetti collaterali più frequenti, evidenziati in meno del 3% delle donne trattate, sono stati vampate di calore (letrozolo 20%, tamoxifene 24%), nausea (5% entrambi) e leucorrea (letrozolo 0%, tamoxifene 4%). • LO STUDIO 025 Questo studio, che ha coinvolto più di 900 pazienti, è il più ampio mai realizzato con gli inibitori dell'aromatasi. Lo studio ha dimostrato la maggiore efficacia di letrozolo rispetto a tamoxifene come terapia di "prima linea" nelle donne con tumore al seno in fase avanzata, sia in termini di progressione della malattia che di beneficio clinico. Obiettivi: valutare l'efficacia di letrozolo verso tamoxifene come trattamento di prima linea in pazienti in postmenopausa con tumore della mammella allo stadio avanzato sui parametri: tempo alla progressione, tempo al fallimento, risposta obiettiva, beneficio clinico, durata della risposta, durata del beneficio clinico, sopravvivenza totale e tollerabilità. Caratteristiche dello studio: lo studio, multicentrico internazionale, è stato realizzato in doppio cieco, randomizzato, Pazienti coinvolte: 939 donne in postmenopausa con tumore al seno sono state coinvolte nello studio. Il trial si è svolto in 201 centri in Europa (18 Paesi), Nord America (2 Paesi) e in altri 9 Paesi. Periodo dello studio: dal novembre 1996 a gennaio 1999. Risultati: I risultati dello studio dimostrano che letrozolo ha un'efficacia maggiore di tamoxifene in termini di tempo alla progressione del tumore, tempo di fallimento della terapia, risposta obiettiva e beneficio clinico. · Tempo alla progressione (tempo che intercorre tra l'inizio dell'assunzione del trattamento e la comparsa documentata di progressione della malattia). Letrozolo ha ridotto il rischio di progressione di della malattia di circa il 30% rispetto al tamoxifene e ha prolungato il tempo di comparsa di progressione del tumore di circa il 50% rispetto la tamoxifene (9,4 mesi nel gruppo letrozolo contro 6 mesi del gruppo tamoxifene). · Tempo al fallimento (tempo che intercorre tra l'inizio dell'assunzione del trattamento e l'interruzione dello stesso per qualunque motivo). Letrozolo ha ridotto il rischio di fallimento della terapia di circa il 30% comparato al tamoxifene (9.1 mesi di letrozolo verso 5.7 mesi di tamoxifene). · Risposta obiettiva (risposta totale o parziale misurata obiettivamente ). Letrozolo ha dimostrato una percentuale di risposta obiettiva positiva superiore a quella di tamoxifene (30% contro 20%), indipendentemente dal sito principale di metastasi, dalla precedente somministrazione di terapia anti-estrogenica adiuvante e dallo stato recettoriale. Sovrapponibile invece è risultata la durata della risposta con entrambi i trattamenti. · Beneficio clinico. Le donne in terapia con letrozolo hanno dimostrato maggiore beneficio clinico comparate a quelle in trattamento con tamoxifene (49% contro 38%) Effetti collaterali: entrambi i farmaci sono stati ben tollerati. Gli effetti collaterali più frequenti, evidenziati in meno del 3% delle donne trattate, sono stati vampate (letrozolo 16%, tamoxifene 13%), nausea (6% entrambi) e indebolimento dei capelli (letrozolo 5%, tamoxifene 3%). Inoltre nel gruppo trattato con letrozolo sono stati segnalati 3 eventi tromboembolici seri pari allo 0.65%, mentre nel gruppo tamoxifene 9 casi, pari all'1.98%. • Quando un tumore del seno viene asportato, viene mandato in laboratorio per studiare la presenza di vari recettori, in particolare dei recettori per gli estrogeni e per il progesterone, due degli ormoni femminili. • Il tumore viene esaminato dall'anatomo patologo anche per individuare la presenza di un recettore chiamato HER-2/neu. Se questo è presente in grandi quantità, è maggiore il rischio di incorrere in una ricaduta. TRASTUZUMAB Trastuzumab: il primo anticorpo monoclonale per il tumore della mammella • Un anticorpo monoclonale è un anticorpo concepito per riconoscere e legarsi a una sostanza specifica. Referenze • • • • • Epidemiologia e fattori di rischio 1. Decarli A., La Vecchia C. Cancer Mortality in Italy, 1991 Tumori, 80: 405-415, 1994. 2. Zanetti R., Crosignani P. Il Cancro in Italia, Cancer in Italy, I dati di incidenza dei registri Tumori 1983-1987. Lega Italiana per la Lotta Contro i Tumori. 3. Kelsey J.L. Breast cancer epidemiology: summary and future directions Epidemiol. Rev., 15: 256-263, 1993. 4. King R.J. A Discussion of the roles of estrogen and progestin in hunlail inaillmary carcinogenesis J. Steroid. Biochem. Mol. Biol., 39: 811-818, 1991. • 5. Colditz G.A., Hankinson S.E., Hunter D.I., Willet W.C., Manson J.E., Stamper MJ, Hennekens C., Rosner B., Speizer F.E. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N. Engl. J. Med., 332: 1589-1593, 1995. • 6. Rosenberg L., Palmer J.R., Rao R.S., Zauber A.G., Strom B.L., Warshauer M.E., Harlap S., Shapiro S. Case control study of oral contraceptive use and risk of breast cancer Am. J. Epidemiol., 143: 25-37, 1996. • 7. Advances in Benign Breast Disease Cancer Detection and Prevention (suppl.) 16, 1992. • 8. Langston A.A., Malone K.E., Thompson J.D., Dailing JR., Ostrander E.A. BRCAI mutations in populations based sample of young women with breast cancer N. Engl. J. Med., 334: 137-142, 1996. • 9. Ford D., Easton D.F., Peto J. Estimates of the gene frequency of BRCAI and its contribution to breast and ovarian cancer incidence Am. J. Hum. Genet. , 57: 1457-1462, 1995. • 10. Shattuck-Eidens D., McClure M., Simard J., Labrie F., Narod S., Couch F., Hoskins K., Weber B., Castilla L., Erdos M., et al. A collaborative survey of 80 mutations in the BRCAI breast and ovarian cancer suseptibility gene. Implications for presymptomatic testing and screening JAMA, 273: 535-541, 1995. • • Anatomia patologica • 1. Gamel I., Meyer J.S., Province M.A. Proliferative rate by S-phase measurement may affect cure of breast carcinoma Cancer, 76: 1009-1018, 1995. • 2. Balslev I., Christensen I.J., Rasmussen B.B., Larsen J.K., Lykkesfeldt A.E., Thorpe S.M., Rose C., Briand P., Mouridsen H.T. Flow cytometric DNA ploidy defines patients with poor prognosis in nodenegative breast cancer Int. J. Cancer, 56: 16-25, 1994. • 3. Gasparini G., Harris A. Clinical importance of the determination of tumor angiogenesis in breast carcinoma: much more than a new prognostic tool J. Clin. Oncol., 13: 765-782, 1995. • • 4. Collins E. BRCAI--lots of mutations, lots of dilemmas N. Engl. J. Med., 334: 186-188, 1996. • 5. Lindbloom A. Familial breast cancer and genes involved in breast carcinogenesis Breast Cancer Res. Treat., 34: 171-183, 1995. • 6. Rowell S., Newman B., Boyd J., King M.C. Inherited predisposition to breast and ovarian cancer Am. J. Hum. Genet., 55: 861-865, 1994. • 7. Elston C.W., Ellis I.O. Pathological prognostic factor in breast cancer. The value of histological grades in breast cancer. Experience from a large study with long term followup Histopathology, 19: 403-410, 1991. • 8. Dupont W.D., Parl F.F., Hartmann W.H., Brinton L.A., Winfield A.C., Worrell J.A., Schuyler P.A., Plummer W.D. Breast cancer risk associated with proliferative breast disease and atypical hyperplasia Cancer, 71: 1258-1265, 1993. • 9. Holland R., Peterse J.L., Millis R.R., Eusebi V., Faverly D., van de Vijver M.J., Zafrani B. Ductal carcinoma in situ. A proposal of a new classification Semin Diagn Pathol, 11: 167-180, 1994. • 10. Page D.L, Dupont W.D., Rogers L.M., Rados M.S. A Typical hyperplastic lesions of the breast. A long term followup Cancer, 55: 2698-2708, 1985. • 11. Thor A.D., Moore II D.H., Edgerton S.M., Kawasaky E.S., Reihsaus E., Lynch H.T., Marcus J.N., Schwartz L., Chen L.C., Mayall B.H, et al. Accumulation of p53 tumor suppressor gene protein. An independent marker of prognosis in breast cancen J. Natl. Cancer Inst., 84: 845-855, 1992. • • Caratterizzazione biologica • 1. McGuire W.L., Tandon A.K., Allred D.C., Chamness G.C., Ravdin P.M., Clark G.M. Prognosis and treatment decisions in patients with breast cancer without axillary node involvement Cancer, 70: 1775-1781, 1992. • 2. Silvestrini R., Daidone M.G., Costa A. Determination of the proliferative fraction in human tumors. In: G.P. Studzinski (Ed). Cell Growth and Apoptosis. A Practical Approach IRL Oxford University Press, pp. 59-77, 1995. • 3. Silvestrini R., Daidone M.G., Linsi A., Boracchi P, Mezzetti M., Di Fronzo G., Andreola S. Veronesi U. Biologic and clinicopathologic factors as indicators of specific relapse types in nodenegative breast cancer J. Clin. Oncol., 13: 697-704, 1995. • 4. Clark G.M., Mathieu M.C., Owens M.A., et al. Prognostic significance of Sphase fraction in goodrisk, nodenegative breast cancer patients J. Clin. Oncol., 10: 428-432, 1992. • Diagnostica del carcinoma mammario 1. Bonelli L., Bruzzi P., Catarzi S., et al. Editoriale: Linee guida comportamentali per un servizio di senologia diagnostica. Attualità in senologia, 5: 120, 1993. • 2. Ciatto S. Guidelines on detection and diagnosis of breast cancer. The Breast, 1: 207-210, 1992. • 3. Forza Operativa Nazionale sul Carcinoma Mammario I tumori della mammella: protocollo di diagnosi, trattamentoriabilitazione Milano, 1993. • 4. Morrone D., Ambrogetti D., Bravetti P., Catarzi S., Ciatto S., Rosselli del Turco M. L’errore nella mammografia. I falsi negativi Radiol. Med. (Torino), 82: 212-217, 1991. • 5. Paci E., Zappa M., Giorgi D., et al. Stima dell’impatto potenziale di uno screening mammagrafico nazionale sull’incidenza e sulla mortalità per cancro al seno Attualità in senologia, Suppl. 1 al n.2: 79, 1992. • 6. Rutqvist L.E., Miller A.R., Andersson L., Hamaka M., Hakulinen I., Sigfrisson B.F., Tabar L. Reduced breast cancer mortality with mammography screening. An assessment of currently available data Int. J. Cancer Suppl., 5: 76-84, 1990. • 7. Smart C.R., Hendrick R.E., Ruledge J.H., Smith R.A. Benefit of mammography screening in women ages 40 to 49 years: current evidence from randomized controlled trials Cancer, 75: 1619-1626, 1995. • 8. Tabar L., Fagerberg G., Chen H., Duffy S.W., Gad A. Screening for breast cancer in women aged under 50: mode of detection, incidence, fatality, and histology J. Med. Screen., 2: 94-98, 1995. • 9. Wald N.I., Chamberlain I., Hackshaw A. Report of the European Society for Mastology Breast Cancer Screening Evaluation Comittee (1993) The Breast, 2: 209-216, 1993. • • Trattamento chirurgico • 1. Veronesi U. Manuale di Senologia Oncologica Masson, 1994. • 2. Veronesi U., Salvadori B., Luini A., Greco M., Saccozzi R., del Vecchio M., Mariani L., Zurrida S., Rilke F. Breast conservation is a safe method in patients with small cancer of the breast: Longterm results of three randomized trials on 1.973 patients Eur. J. Cancer, 31A: 1574-1579, 1995. • 3. Ciatto S., Del Turco M.R., Bonardi R., Cataliotti L., Distante V., Cardona G., Bianchi S. Non palpable lesions of the breast detected by mammography review of 1182 consecutive h istologically confirmed cases Eur. J. Cancer, 30A: 40-44, 1994. • 4. Paci E., Zappa M., Palli D., et al. Changes in stage and treatment of breast cancer in florence from 1985-1990 The Breast, 3: 109-12, 1994. •
Scarica