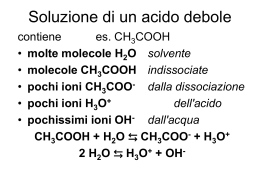
Elementi di Elettrochimica 09/12/2009 Reazioni di ossido-riduzione (redox) Reazioni in cui i reagenti si scambiano elettroni per formare i prodotti. Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq) Zn(s) Zn2+(aq) + 2 e- ossidazione Cu2+(aq) + 2 e- Cu(s) riduzione Cu Zn2+ Zn Cu2+ Cu(s) Cu(s) + Zn2+(aq) Cu2+(aq) + Zn(s) Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq) potere ossidante di Cu2+/Cu > potere ossidante di Zn2+/Zn Cu Zn H2 H3O+ H3O+ 2 H3O+(aq) + Cu(s) H2(g) + Cu2+(aq) + 2 H2O(l) 2 H3O+(aq) + Zn(s) H2(g) + Zn2+(aq) + 2 H2O(l) pot ox Cu2+/Cu > pot ox H3O+/H2 > pot ox Zn2+/Zn 2 Ag+(aq) + Zn(s) 2 Ag(s) + Zn2+(aq) 2 Ag+(aq) + Cu(s) 2 Ag(s) + Cu2+(aq) Zn Ag Ag+ pot ox Ag+/Ag Cu > pot ox Cu2+/Cu Ag Ag+ > pot ox H3O+/H2 > pot ox Zn2+/Zn scala qualitativa del potere ossidante Ag+/Ag Ag(s) Ag+(aq) + e- Cu2+/Cu Cu(s) Cu2+(aq) + 2 e- H3O+/H2 2 H3O+(aq) H2(g) + 2 H2O(l) + 2 e- Zn2+/Zn Zn(s) Zn2+(aq) + 2 e- Si può fare una scala quantitativa? Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq) Zn(s) Zn2+(aq) + 2 e- ossidazione Cu2+(aq) + 2 e- Cu(s) riduzione Zn Zn2+ Cu Cu2+ Se la reazione è spontanea, gli elettroni hanno la tendenza ad andare spontaneamente da sinistra a destra. - Voltmetro Zn + Cu V = 0 Cu2+ Zn2+ Cl- ponte salino K+ Anodo Ossidazione Catodo Riduzione Schematizzazione di una pila: Composti allo stato solido o gassoso Composti in soluzione Composti in soluzione Anodo Composti allo stato solido o gassoso Catodo Esempio: Zn Zn 2 Cu 2 Cu Elettrodo standard di riferimento: 2 H3O+(aq) + 2 e- H2(g) + 2 H2O(l) Pt H 3O(aq) .... a 25C H 2 (1 atm) pH 0 H2(1 atm) Pt 25°C pH=0 Potenziale standard di riduzione: Cu2+(aq) + 2 e- Cu(s) = + 0,3419 V H2(1 atm) Cu Pt 25°C pH=0 [Cu2+]=1,0 M Potenziale standard di riduzione: Zn2+(aq) + 2 e- Zn(s) = - 0,7618 V H2(1 atm) Zn Pt 25°C pH=0 [Zn2+]=1,0 M Potenziale standard di riduzione: NO3-(aq) + 3 e- + 4 H3O+(aq) NO(g) + 6 H2O(l) = + 0,960 V H2(1 atm) NO(1 atm) Pt Pt 25°C pH=0 pH=0 [NO3-] = 1,0 M V 0.3419 0.7618 1,1037 V o o – + Zn [Zn2+]=1,0 M Cu 25°C Ossidazione (anodo) [Cu2+]=1,0 M Riduzione (catodo) Leggi di Faraday • La massa, prodotta o consumata ad un elettrodo, è proporzionale alla quantità di carica elettrica che è passata attraverso la cella. • Masse equivalenti di sostanze diverse vengono prodotte e consumate ad un elettrodo dal passaggio di una quantità definita di carica ellettrica attraverso la cella. Massa equivalente = massa molare di una sostanza diviso le moli di elettroni trasferite per mole di sostanza nella relativa semireazione. F = 96485 C mol-1 Welettr = - Q = - I t = - n F G = H - TS = E + PV - TS T e P costanti G = E + PV - T S E = q + welettr - PV G = q + welettr - T S G = welettr = - n F cella reversibile qrev=TS G = - n F Condizioni standard G° = - n F ° G° = - R T ln K RT 0.0592 log K ln K n nF Per calcolare il potenziale di un elettrodo non allo stato standard si usa l’equazione di Nernst: Quoziente della semireazione di riduzione Potenziale standard RT ln Q nF Walter Hermann Nernst Briesen 1864 – Berlino 1940 Premio Nobel per la Chimica 1920 Numero degli elettroni Costante di Faraday 0,059 log A 25°C: n 10 Q Per esempio: MnO4-(aq) + 8 H3O+(aq) + 5 e- Mn2+(aq) + 12 H2O(l) =1,491 V 2 0,059 [Mn ] 1,491 log 10 8 5 [MnO 4 ][ H3O ] PbO2(s) + 4 H3O+(aq) + 2 e- Pb2+(aq) + 6 H2O(l) =1,460 V 2 0,059 [Pb ] 1,460 log 10 4 2 [ H 3O ] Pt [ NO3 ] [Cl ] Pt Cl2 NO [H3O ] NO3-(aq) + 3 e- + 4 H3O+(aq) NO(g) + 6 H2O(l) = + 0,960 V Cl2(g) + 2 e- 2 Cl-(aq) = + 1,358 V 0,059 PNO 1 0,960 log 10 3 [ NO3 ][ H 3O ]4 0,059 [Cl ]2 2 1,358 log 10 2 PCl 2 catodo anodo Pile a concentrazione: Ag [Ag ] c1 [Ag ] c 2 Ag 0,059 1 o log 10 1 [Ag ] c1 = c2 c1 < c2 c1 > c2 Pt [H3O ] [H3O ] Pt H 2 pH1 pH 2 H 2 pila scarica catodo a destra catodo a sinistra Elettrolisi dell’acqua ×2 2 H2O(l) + 2 e- H2(g) + 2 OH-(aq) (catodo) 6 H2O(l) O2(g) + 4 H3O+(aq) + 4 e- (anodo) 10 H2O(l) 2 H2(g) + O2(g)+ 4 OH-(aq) + 4 H3O+(aq) 2 H2O(l) 2 H2(g) + O2(g) (reazione totale) 2 H2O(l) + 2 e- H2(g) + 2 OH-(aq) (catodo) 6 H2O(l) O2(g) + 4 H3O+(aq) + 4 e- (anodo) 2 H2O(l) 2 H2(g) + O2(g) (reazione totale) O2 acqua con blù di bromotimolo (giallo in ambiente acido e blù in ambiente basico) H2 – catodo + anodo PILE ZINCO-CARBONE (Pile Leclanché) Catodo metallico (ottone) Chiusura in plastica Impasto di ZnCl2, NH4Cl e polvere di carbone Zn(s) Zn2+(aq) + 2 eMnO2(s) + 2 NH4+(aq) + 2 e- Mn2O3(s) + 2 NH3(aq) + H2O(l) Involucro di zinco (anodo) Grafite MnO2(s) PILE ALCALINE (a voltaggio costante) Catodo metallico (ottone) Chiusura in plastica Impasto di ZnCl2, KOH e polvere di carbone Zn(s) + 2 OH-(aq) Zn(OH)2(s) + 2 eMnO2(s) + H2O(l) + 2 e- Mn2O3(s) + 2 OH-(aq) Involucro di zinco (anodo) Grafite MnO2(s) BATTERIE AL PIOMBO processo di scarica (pila) Pb(s) + SO42-(aq) PbSO4(s) + 2 e- PbO2(s) + SO42-(aq) + 4 H3O+(aq) + 2 e- PbSO4(s) + 6 H2O(l) soluzione di acqua e H2SO4 + – PbO2(s) Pb(s) CELLA A COMBUSTIBILE IDROGENO-OSSIGENO Anodo: H2(g) + 2 OH-(aq) 2 H2O(l) + 2 e- Vapore H2O(g) Catodo: O2(g) + 2 H2O(l) + 4 e 4 OH-(aq) H2(g) Elettrodi di carbone poroso contenenti nichel O2(g) Soluzione calda con K+(aq) e OH -(aq)
Scarica