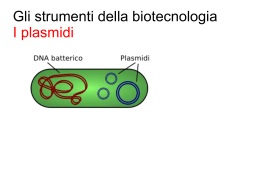
Anteprima Estratta dall' Appunto di Biochimica Università : Facoltà : Indice di questo documento L' Appunto Le Domande d'esame ABCtribe.com e' un sito di knowledge sharing per facilitare lo scambio di materiali ed informazioni per lo studio e la formazione.Centinaia di migliaia di studenti usano ABCtribe quotidianamente per scambiare materiali, consigli e opportunità Più gli utenti ne diffondono l'utilizzo maggiore e' il vantaggio che ne si può trarre : 1. Migliora i tuoi voti ed il tempo di studio gestendo tutti i materiali e le risorse condivise 2. Costruisci un network che ti aiuti nei tuoi studi e nella tua professione 3. Ottimizza con il tuo libretto elettronico il percorso di studi facendo in anticipo le scelte migliori per ogni esame 4. Possibilità di guadagno vendendo appunti, tesine, lezioni private, tesi, svolgendo lavori stagionali o part time. www.ABCtribe.com ABCtribe.com - [Pagina 1] L' Appunto A partire dalla pagina successiva potete trovare l' Anteprima Estratta dall' Appunto. Se desideri l'appunto completo clicca questo link. Il numero di pagina tra le parentesi tonde si riferisce a tutto il documento contenente l'appunto. Sull'appunto stesso in alcuni casi potrete trovare una altra numerazione delle pagine che si riferisce al solo appunto. Grafico dei voti medi per questo esame: Grafico dei giorni medi per la preparazione di questo esame: Grafico Copyright © ABCtribe.com. Vietata la riproduzione. Grafico Copyright © ABCtribe.com. Vietata la riproduzione. Clicca qui per i grafici aggionati su Biochimica >> ABCtribe.com - [Pagina 2] e.c om SBOBINATURE del corso di BIOCHIMICA I Ct rib (Lezioni del Prof. Raugei) AB A/A 2008/09 ATTENZIONE Queste sbobinature sono state realizzate da studenti, e come tali possono contenere errori. Lo scopo di queste sbobinature NON è quello di sostituire la frequenza personale dei corsi, ma di fornire del materiale in più utile alla preparazione dell'esame; gli studenti sono pertanto invitati a seguire le lezioni e a prendere personalmente gli appunti, rimediando così agli errori e alle imprecisioni che possono essere presenti in queste pagine. ABCtribe.com - [Pagina 3] Biochimica - Lezione del 28-04-09 [Prof. Raugei] La volta precedente avevamo esaminato la struttura del DNA, la cui comprensione è molto importante per gli argomenti che andremo ad affrontare, e da qui riprendiamo. Prima di andare avanti, ricordiamo che il DNA ha una sua direzionalità o polarità che dir si voglia: è molto importante la direzione 5'--> 3', lungo la quale usualmente si svolge la sintesi. Ricordiamo anche che DNA ed RNA sono molto simili: le differenze principali consistono nella presenza della timina e un -H in posizione 2' nel DNA, laddove nell'RNA abbiamo uracile (che si ottiene togliendo un gruppo -CH3 dalla timina), e la presenza di un -OH in posizione 2'. e.c om Concentriamo adesso la nostra attenzione sui legami ad idrogeno: si formano due legami ad idrogeno tra adenina e timina e tre legami ad idrogeno tra guanina e citosina. Si tratta di legami deboli – in generale, i legami deboli rivestono una grandissima importanza nelle interazioni molecolari; sono gli enzimi, che entrano in gioco nel metabolismo, ad agire soprattutto sui legami covalenti. Nella struttura del DNA sono importanti sia legami covalenti, nella costruzione della sua impalcatura di pentoso-fosfato-base azotata (quest'ultima intrattiene un legame N-glicosidico), sia i legami deboli, che tengono insieme le due catene a formare una doppia elica. La caratteristica del legame debole è quella di essere facilmente reversibile. Il legame debole tipicamente è spezzato tanto facilmente quanto facilmente può essere riformato. In effetti, i legami ad idrogeno che tengono insieme le due catene del DNA sono importanti, grazie a quest'ultima caratteristica, per numerosi processi che interessano questa molecola (es. trascrizione), mentre zone a doppio filamento intramolecolari invece danno la peculiare forma al tRNA. rib Il legame ad idrogeno tipicamente coinvolge (1) un H legato ad un atomo elettronegativo come N, O o, più raramente, S e (2) un atomo con parziale carica negativa. AB Ct Rottura e formazione di legami covalenti entrano in gioco solamente durante la replicazione. Nel normale funzionamento del DNA (cioè, il funzionamento in cellule in fase G) si rompono e si formano legami deboli. Per “normale funzionamento” si intende soprattutto la trascrizione, processo che implica la rottura di legami deboli preesistenti per l'apertura della doppia elica, e il nuovo instaurarsi di altri legami deboli per dirigere la sintesi dell'RNA – dal punto di vista di quest'ultimo, entrano in gioco anche legami covalenti, ma dal punto di vista del DNA sono coinvolti solo legami deboli. Il DNA è, come abbiamo visto, una doppia elica. All'esterno abbiamo l'impalcatura di zucchero-fosfato, mentre all'interno sono poste le basi. Le basi sono orientate parallelamente al piano immaginario su cui poggia la molecola, e sono impilate una sopra l'altra. La doppia elica può esistere in diverse forme, si parla di DNA A, DNA Z e DNA B, dove quest'ultimo è quello più interessante perché fisiologicamente presente nelle cellule. La struttura a doppia elica del DNA B ha una particolarità: l'asse dei legami ad idrogeno non passa per l'asse della doppia elica. L'elica in qualche modo si avvolge intorno al suo asse, senza però toccarlo, perché i legami ad idrogeno che legano le due basi affacciate verso l'interno passerebbero per l'asse se i due zuccheri fossero a 180°; in realtà, gli zuccheri stanno a 120°. Quindi l'elica ha una sorta di andamento a zig zag, con la formazione di un solco maggiore e uno minore. Questa nozione ci permette di introdurre un altro concetto. Il DNA è una molecola che funziona interagendo con proteine, che sono in grado di “leggerlo”. Un esempio è l'RNA polimerasi, che deve legarsi ad un promotore per iniziare la trascrizione: deve quindi esistere un meccanismo che renda le proteine capaci d riconoscere particolari sequenze del DNA ancora chiuso. Questo riconoscimento è reso possibile in quanto particolari posizioni delle basi azotate sono esposte all'esterno della molecola grazie alla presenza dei solchi a cui abbiamo accennato. Non è facile da visualizzare. Un osservatore esterno che si ponesse nel solco maggiore potrebbe osservare, a livello di una purina, le posizioni 6, 7 e 8. La posizione 6 permette di distinguere tra le due purine (l'adenina ha un -NH2, la guanina un doppio legame con l'O), mentre le posizione 7 e 8 non sono “diagnostiche”. Anche il solco minore consente delle esposizioni, a livello del carbonio in posizione 2. Le proteine hanno una conformazione tale da poter interagire selettivamente con ABCtribe.com - [Pagina 4] certi gruppi funzionali, così da distinguere i nucleotidi. Per quando riguarda le pirimidine, solo la parte esposta nel solco maggiore permette di differenziare una citosina e una timina. La differenza è molto grande: la posizione 4 è diversa, inoltre la timina è metilata in posizione 5, dove la citosina ha solo un H. A livello del solco minore invece questa distinzione non può essere fatta. Tutto questo fa sì che una certa sequenza di DNA sia riconoscibile grazie ai gruppi chimici esposti a livello del solco maggiore (sia per purine che per pirimidine) o del solco minore (solo per le purine), offrendo siti di lettura anche per il DNA chiuso. Ci sono poi delle sequenze aminoacidiche, conservate in molte proteine diverse, che sono tanto diffuse da consentire, qualora vengano ritrovate su proteine dalla funzionalità ignota, di dedurre con una certa sicurezza che queste abbiano a che fare con il DNA. Queste strutture sono essenzialmente di tre tipi: – rib AB Ct – e.c om – Elix-Turn-Elix; ovvero, una zona costituita da un dominio ad α-elica, seguita da una corta sequenza aminoacidica senza una struttura secondaria particolare, che permette una certa libertà di piegamento, seguita a sua volta da una seconda α-elica. In genere queste proteine sono dei dimeri. Le α-elica sono le zone della proteina che prendono contatto con i gruppi chimici esposti a livello dei solchi. Zinc Fingers, una struttura curiosa, dove si hanno delle zone quasi a forma di “dita”, che si inseriscono nelle scanalature del solco maggiore e del solco minore prendendo contatto con i gruppi chimici esposti. Si tratta di una struttura di tipo terziario, dove uno ione zinco si coordina con gruppi -SH di cisteine, formando le “dita”. Le cisteine per ogni dito in genere sono quattro: due sono separate da 3-4 aminoacidi circa, poi è in genere presente un loop (qualche decina di aminoacidi), e infine le altre due, sempre vicine tra loro. Questa struttura è piuttosto peculiare, ed è spesso ripetuta a distanze regolare (ognuna rappresenta un dito) permettendo così di riconoscere gli zinc fingers già a livello della struttura primaria. Si possono trovare fino a 9 zinc fingers. Leucyn Zipper (cerniere a leucina); in realtà questa struttura non serve tanto per interagire con il DNA, quanto per formare dimeri. La struttura sfrutta interazioni tra leucine, che è un aminoacido dotato di una lunga catena di tipo idrocarburico, quindi apolare. Questo significa che formerà facilmente interazioni di tipo Van der Waals con altre leucine. In genere, le strutture di tipo leucyn zipper coinvolgono delle α-eliche, in cui tra le leucine sono interposti aminoacidi in numero tale da far sì che queste sporgano tutte dalla stessa parte dell' α-elica. In genere ci sono 3,5 aminoacidi per ogni giro di α-elica, per un totale di 7 aminoacidi per ogni 2 giri. È facile immaginare come le leucine siano presenti ogni 7 aminoacidi, così da risultare impilate una sopra l'altra. Alla fine, si hanno due α-eliche, con una fila di leucine su un lato, che si interagiscono tra loro attraverso interazioni di tipo idrofobico. Ricordiamo inoltre che in genere le proteine che interagiscono con il DNA sono cariche positivamente (hanno cioè un punto isoelettrico di tipo basico)– al contrario della gran parte delle altre proteine, cariche negativamente. Ovviamente la carica positiva facilita di per sé l'interazione con il DNA, dato che quest'ultima molecola è carica negativamente: una proteine carica negativamente genererebbe interazioni di tipo repulsivo. Il funzionamento del DNA, come abbiamo visto, coinvolge essenzialmente legami deboli; tuttavia, il DNA ha un suo metabolismo: viene prodotto e può essere anche catabolizzato. In genere in un organismo quest'ultima attività viene evitata. A differenza di tutte le altre molecole (proteine, RNA, etc.), che sono in gran parte “usa e getta”, il DNA tende ad essere mantenuto. La replicazione del DNA è infatti di tipo semiconservativo, il che significa, tra l'altro, che da qualche parte nel nostro organismo due cellule probabilmente contengono uno dei due filamenti di DNA che si trovava nello zigote da cui ci siamo originati. Il catabolismo del DNA entra in gioco soprattutto quando ci nutriamo: quasi sempre ingeriamo anche cellule, il cui DNA deve essere digerito. Deve esistere quindi una classe di enzimi in grado, all'occorrenza, di smantellare la struttura del DNA. Si tratta di idrolasi (quindi in grado di agire a livello del legame fosfodiesterico), nucleasi (agiscono sugli acidi nucleici), fosfodiesterasi (agiscono su un legame fosfodiesterico). Si possono poi distinguere esonucleasi, endonucleasi, desossiribonucleasi, ribonucleasi, etc. ABCtribe.com - [Pagina 5] La classificazione è comunque molto varia. Ad ogni modo, è particolarmente importante la distinzione tra esonucleasi ed endonucleasi. Sono esonucleasi quegli enzimi che, avendo un filamento con entrambe le estremità libere, tagliano il primo legame fosfodiesterico dopo il primo o l'ultimo nucleotide: esistono infatti le esonucleasi 5' (che iniziano a digerire il DNA a partire dall'estremità 5'), e le esonucleasi 3' (che iniziano a digerire il DNA dall'estremità 3'). Il taglio di tipo P, di gran lunga il più comune, taglia tra il 3' e il fosfato, lasciando attaccato il gruppo fosfato al 5'; il taglio di tipo T, molto più raro, taglia tra il 5' e il fosfato, lasciando attaccato il gruppo fosfato al 3'. Le endonucleasi sono enzimi che tagliano il legame fosfodiesterico all'interno della catena. Anche in questo caso, esistono tagli di tipo P e T, ed esistono endonuclasi specifiche per RNA e DNA, così come endonucleasi aspecifiche. In entrambi i casi, l'azione è soltanto su UNO solo dei due filamenti di DNA. In sintesi, si tratta di due classi di enzimi che hanno lo scopo di frammentare il DNA a scopi catabolici, ottenendo un pool di dNTP, monomeri che consistono di deossinucleosidi dei quattro tipo possibili (nel caso del DNA) proprio come le proteasi catabolizzando le proteine portano ad ottenere un pool di aminoacidi. rib e.c om La differenza tra endonuclesi ed esonucleasi è anche nella specificità riguardo alla sequenza di basi azotate di DNA. Come si può immaginare, il DNA può essere danneggiato. Uno dei danni più tipici che può subire questa molecola è la rottura di un singolo legame fosfodiesterico, cosa che di solito è, fortunatamente, priva di conseguenze. La rottura in sé infatti non è un grosso danno, in quanto il DNA è una doppia elica che trova stabilità nella interazione tra i due filamenti singoli. La struttura della molecola non viene turbata dal nick; la sua struttura stessa garantisce, attraverso i legami ad idrogeno, che la conformazione rimanga inalterata; i nick sono in genere riparate da ligasi. Un filamento di appena 20 nucleotidi implica decine di legami ad idrogeno. Se, tuttavia, il nick avviene in corrispondenza di un altro nick, oppure molto vicino, si può verificare un danno gravissimo: una soluzione di continuità nella doppia elica; i legami a idrogeno non sono abbastanza numerosi da garantire l'integrità. Tuttavia, in condizioni normali, è estremamente improbabile che avvenga una cosa del genere. AB Ct L'azione di una endonuclasi si esplica su uno dei due filamenti, casualmente, introducendo dei nick, che possono o meno portare ad una rottura. Le endonucleasi in genere non riescono a frammentare il DNA sino a portare al singolo monomero; in genere frammentano il filamento in oligomeri, e poi delle esonucleasi finiscono il lavoro. Tuttavia, per la funzionalità del DNA, anche una singola rottura è un evento disastroso. Esiste poi una classe particolare di endonucleasi che hanno la caratteristica di essere estremamente specifiche riguardo alla sequenza di taglio: sono le endonucleasi di restrizione. Questi enzimi tagliano la doppia elica con due nick ravvicinati (uno su un filamento e uno sull'altro) in corrispondenza di particolari sequenze. In altre parole, se si mettono in contatto questi enzimi con un filamento di acido desossiribonucleico di sequenza conosciuta, saremo in grado di predire i punti in cui saranno creati i nick, e il numero di pezzi in cui verrà tagliata la molecola. Questi enzimi sono stati, e anche se in misura minore, ancora sono, un importantissimo strumento per l'ingegneria genetica; sono utilizzate spesso per rompere il DNA in modo da poter inserire delle sequenze desiderate all'interno delle molecole. Sono presenti in moltissimi batteri, che esprimono questi enzimi per difendersi dagli attacchi mediati dal DNA. Tipici agenti di questi attacchi sono virus, come i batteriofagi. Questi infettano la cellule trasferendo il proprio materiale genetico all'interno di esse e sfruttando i loro apparati metabolici per riprodursi. Diviene intuibile come avere degli enzimi di restrizione in grado di frammentare certe sequenze aiuti i batteri a difendersi. EcoR1 è stato uno dei primi enzimi di restrizione scoperti e attualmente è uno dei meglio conosciuti; è stato fondamentale per la comprensione della struttura di questi enzimi, e della struttura della sequenza che viene riconosciuta. Il nome di questi enzimi è costituito da un acronimo che deriva dal nome del batterio da cui sono stati isolati. EcoM1 deriva da Escherichia coli, ceppo R, 1 in quanto è stato il primo ad essere scoperto (finora ne sono stati caratterizzati 4); HinD3 deriva da Haemophilus influentiae, etc. Ognuno di questi enzimi ha un suo sito di restrizione (le sequenze nucleotidiche specifiche che sono in grado di riconoscere), la cui struttura è peculiare: deve essere infatti a simmetria centrale; sono dei palindromi, in sostanza. Il sito di restrizione riconosciuto da EcoR1 ad esempio è questo: ABCtribe.com - [Pagina 6] 5'-G A A T T C-3' 3'-C T T A A G-5' Questa struttura fa sì che su due filamenti ci sia esattamente la stessa sequenza (letta secondo 5'--> 3'). Grazie alla loro simmetria centrale le due sequenze sono identiche. Questo sito di restrizione come vediamo ha 6 basi di riconoscimento; altri siti sono solo a 4 basi di riconoscimento. Il taglio della endonucleasi può essere di due tipi. Un primo tipo (è il caso di EcoR1) prevede che la endonucleasi tagli un certo legame fosfodiesterico (es. quello tra la G e la A, vedi freccia) sia su un filamento che sull'altro: quindi la endonucleasi riconosce uno dei due filamenti e taglia tra G ed A; in un secondo momento, riconosce la stessa sequenza sull'altro filamento ed effettua il secondo taglio. Nel caso che abbiamo visto sopra, saremo in una situazione di due nick ravvicinati su due filamenti: pochi legami ad idrogeno tengono insieme la doppia elica in seguito all'inserimento dei due nick. Un secondo tipo di taglio prevede che i due nick avvegano in corrispondenza dello stesso legame fosfodiesterico. rib e.c om Il taglio del primo tipo tipicamente produce le cosiddette estremità coesive: i legami ad idrogeno non sono sufficienti per tenere insieme i due monconi, ma esiste una certa complementarietà, che rende “appiccicosi” le due estremità, anche se il legame, di fatto, non può tenere insieme la doppia elica. Nel tempo, ci possono essere tuttavia degli istanti in cui questo legame diviene stabile. Il taglio del secondo tipo invece porta alle estremità piatte: in questo caso, i due monconi non hanno possibilità di riunione, dato che non si formano legami ad idrogeno. AB Ct L'importanza di questi enzimi sta anche nel fatto che si formano delle estremità coesive specifiche, che potranno essere riunite da delle ligasi, enzimi che in pratica effettuano un'azione antagonista rispetto alle endonucleasi, restaurando i legami fosfodiesterici e revertendo l'azione di taglio. Notare tuttavia che si può riunire il DNA tagliato da un solo enzima di restrizione; far agire due diverse endonucleasi di restrizione significherebbe compromettere la compatibilità delle estremità coesive. Un'altra cosa interessante da notare riguardo l'utilizzo di endonucleasi e ligasi è che, se separiamo una molecola di DNA in due monconi utilizzando EcoR1, possiamo poi sfruttare una ligasi per unire queste estremità ai monconi di una molecola di DNA di origine diversa, tagliata con lo stesso enzima di restrizione, formando una nuova molecola di DNA. Questo è il principio su cui si basa la tecnica del DNA ricombinante: mettere insieme frammenti di DNA che in natura non si incontrerebbero mai, creando per esempio plasmidi batterici con geni umani, etc. Nel nostro organismo, la ricombinazione genica avviene praticamente solo a livello della gametogenesi e nelle cellule deputate alla produzione di anticorpi. In generale, la ricombinazione del DNA proveniente da organismi diversi è possibile perché, dal punto di vista chimico, il DNA è identico in tutte le forme di vita. Quello che cambia tra gli organismi è soltanto la sequenza. A questo punto, adesso che abbiamo esaminato a grandi linee gli enzimi di restrizione, sorge spontanea una domanda. Gli enzimi endonucleasici sono enzimi potenzialmente pericolosi, come tutti gli enzimi litici in generale. Per esempio, nella necrosi dovuta ad ipossia, il contenuto lisosomiale viene riversato al di fuori dei lisosomi, liberando pericolosissime proteasi e anche nucleasi; la necrosi è quindi anche dovuta alla digestione degli acidi nucleici. Come possono quindi le cellule produrre degli enzimi potenzialmente letali per il proprio DNA? Questo è possibile perché si sono evoluti sistemi di protezione del DNA. Questi sistemi sono interessanti anche perché ci permettono di prendere in esame una prima forma di modifica del DNA: la metilazione. In questo corso parleremo di metilazione in almeno tre casi diversi tra loro, ma vedremo sempre che la metilazione ha una funzione di marker, una sorta di “bandierina” che serve a segnalare qualcosa. A questo punto, possiamo precisare che l'attività di restrizione non comprende solamente il taglio endonucleasico, di cui abbiamo parlato finora, ma anche la modificazione del DNA, a livello della sequenza ABCtribe.com - [Pagina 7] di riconoscimento, la quale consiste di una metilazione. Cioè, il batterio ha un enzima che riconosce la sequenza EcoR1 ed esercita a livello di questa un'attività endonucleasica, ed un secondo enzima che riconosce la stessa sequenza ma esercita un'attività di metilazione, in particolare sulla prima adenina del sito di restrizione. Quindi, dobbiamo immaginare che il DNA del batterio sia metilato a livello di ogni adenina di ogni sito di restrizione. Questa modificazione impedisce il taglio da parte dell'enzima di restrizione che il batterio stesso produce. Cosa succede quando il batterio si duplica? Le due cellule figlie, in seguito al processo di replicazione del DNA, che, come sappiamo, avviene con meccanismo semiconservativo, posseggono ciascuna una molecola di DNA formata da un filamento vecchio e uno nuovo; quest'ultimo non è metilato. In altre parole, un filamento è protetto, ed uno no. Questo però non costituisce un problema: al massimo, potrà formarsi un solo nick, che da solo non è sufficiente a compromettere la struttura dell'acido desossiribonucleico, e sarà riparato da una ligasi. Possiamo essere ragionevolmente sicuri che prima della successiva replicazione del DNA, con il tempo, la attività di metilasi sarà esercitata anche sul filamento nuovo. Alla successiva duplicazione, entrambi i filamenti saranno protetti. om Se dall'esterno giunge del materiale genetico esogeno (è il caso del DNA virale, ma anche di altro DNA batterico), questo sarà un DNA nudo dal punto di vista della metilazione e sarà prontamente digerito. Gli enzimi di restrizione furono proprio scoperti grazie alla caratteristica di alcuni batteri di restringere la capacità infettiva dei virus. rib e.c Biochimica - Lezione del 29-04-09 [Prof. Raugei] AB Ct La volta scorsa avevamo parlato degli enzimi di restrizione, che avevamo visto essere un interessante sistema di difesa batterico contro agenti infettivi che utilizzano il DNA. Essendo questa molecola una componente essenziale del virus (che è formato da materiale genetico contenuto in capside proteico), in quanto porta con sé le informazioni necessarie alla sintesi delle proteine virali, se il batterio possiede un sistema per frammentare il DNA virale può neutralizzarne l'attacco e rendere inoffensivo il virus. Avevamo anche visto come il sito di restrizione, ovvero la sequenza di DNA che normalmente viene attaccata dall'enzima di restrizione, venga protetto dall'azione delle endonucleasi da una metilazione sulla prima adenina della sequenza stessa: questo impedisce che il DNA del batterio stesso venga frammentato. La metilazione è a carico di enzimi detti metilasi, enzimi di modificazione del DNA che riconoscono le stesse sequenze riconosciute dagli enzimi di restrizione, ma invece che eseguire un taglio, metilano. Avevamo visto anche come, quando il DNA va incontro a replicazione semiconservativa, vi sia un momento iniziale in cui uno solo dei due filamenti (il filamento parentale, o stampo) è metilato; con il tempo, la metilasi agirà anche sul filamento nuovo. Nel frattempo, è vero che solo un filamento è protetto dai tagli, mentre l'altro no, ma sappiamo anche che un taglio su un solo filamento non è sufficiente a compromettere la stabilità della struttura della doppia elica, e in definitiva non è un danno preoccupante. Tra parentesi, vi sono varî tipi di metilazione del DNA: l'adenina diviene N-6-metil-adenina; in altre situazioni si possono avere metilazioni a livello della guanina e della citosina – peraltro, la metil-citosina è estremamente simile alla timina. In tutti i casi comunque la metilazione utilizza come donatore di metili la Solfo-adenosin-metionina, che nel processo di donazione del metile diventa Solfo-adenosin-omocisteina. I siti di restrizione sono, in gran parte, a 4 o a 6 basi; statisticamente, nel DNA, sarà più frequente trovare dei siti di restrizione formati casualmente dalla giustapposizione delle basi quando sono a 4 basi che non quando sono a 6. La probabilità teorica di trovare una sequenza particolare di 4 basi in un DNA casuale è 1/256, da 44. La stessa probabilità teorica calcolata per una sequenza di 6 basi dà come risultato 1/4096, da 4 6. La probabilità di trovare sequenze di un numero maggiore di basi cala esponenzialmente, come si può immaginare. Naturalmente, queste sono soltanto stime che forniscono un'ordine di grandezza, se non altro perché la sequenza del DNA di un organismo non è casuale (tanto è vero che la ricchezza relativa in GC ABCtribe.com - [Pagina 8] varia da organismo a organismo). Possiamo affermare comunque che, tendenzialmente, una certa sequenza di 4 basi comparirà ogni qualche centinaia di basi, una a 6 basi ogni qualche migliaio di basi, una a 8 ogni qualche decina di migliaia di basi. Per cui, un enzima che ha un sito di restrizione di 4 basi taglia in media ogni qualche centinaia di basi, etc. Ci sono diverse classi di enzimi di restrizione. Quelli di cui stiamo parlando sono gli enzimi di tipo II; in questa classe di enzimi, vi sono due diversi enzimi, uno che taglia e uno che protegge la stessa sequenza. Entrambi quindi presenteranno almeno due domini: uno, in comune, che avrà una di quelle strutture viste la volta scorsa e che è in grado di riconoscere la stessa sequenza; un secondo dominio, diverso tra i due enzimi, che in un caso sarà endonucleasico, in un caso avrà la capacità di metilazione. Vi sono altri enzimi di restrizione in cui c'è un unico enzima con tre domini: uno di riconoscimento, uno di taglio, e uno di modificazione. Nelle biotecnologie si utilizzano solo gli enzimi di restrizione di tipo II. om Soffermiamoci, prima di andare avanti, su questa domanda: quante molecole di DNA ci sono in una cellula somatica umana? Nel nucleo vi sono normalmente 46 molecole (ogni cromosoma è una molecola, quindi in caso di aberrazioni questo numero può variare), più una molecola per ogni mitocondrio (ogni mitocondrio possiede il suo piccolo cromosoma circolare); il numero di mitocondri varia da cellula a cellula, ma, mediamente, siamo nell'ordine delle migliaia. E in un batterio? In genere una, perché ha un solo cromosoma circolare (anche se nel momento appena precedente la scissione cellulare abbiamo due cromosomi nella stessa cellula), più i plasmidi, il cui numero può variare: in genere ne abbiamo decine. Ricordiamo che i plasmidi sono elementi genetici accessori che alcuni batteri possono contenere. Ct rib e.c Al di fuori del numero di molecole, qual è la grandezza del genoma? Un genoma batterico tipico è dell'ordine di grandezza del milione di basi. Nell'ambito degli eucarioti, si ha una grande variazione. I lieviti, eucarioti molto semplici, hanno genomi dell'ordine di grandezza delle decine di milioni di basi, mentre il genoma dei mammiferi è di qualche miliardo di basi (circa 3 miliardi come corredo aploide). Un cromosoma, in media, ospita centinaia di milioni di basi (108). Il più piccolo cromosoma umano, il cromosoma 22, è grande 3 x 107 basi; molti altri cromosomi sono grandi 5-6 x 108. Questo significa che una molecola di DNA tendenzialmente è più lunga di 100 milioni di basi. AB Per quanto riguarda procarioti, il genoma è in entrambi i casi costituito da DNA a doppio filamento; la differenza sta nel fatto che il genoma procarioti è circolare, negli eucarioti è lineare. Nei virus, il genoma è, in molti casi, costituito da RNA. Peraltro, questa è la ragione per cui i virus mutano così velocemente: l'enzima che sintetizza le molecole di RNA, detto RNA polimerasi, commette molti più errori della DNA polimerasi. Prima abbiamo menzionato i plasmidi; ne parliamo adesso perché è stato l'altro elemento decisivo per l'ingegneria genetica e la nascita della tecnologia del DNA ricombinante. L'enzima di restrizione è lo strumento che ci serve per aprire una molecola di DNA, inserirvi un DNA diverso, e richiuderlo; il plasmide è il vettore di questo DNA. Fare questa operazione a livello cromosomico è un problema: come abbiamo visto i cromosomi sono molecole enormi; un plasmide invece è una sorta di piccolo cromosoma, anche questo circolare: ospita dei geni, ma rispetto ai cromosomi umani è più gestibile e maneggevole, in quanto ha una grandezza di qualche migliaio di basi. In genere i plasmidi contengono geni cosiddetti dispensari: geni non strettamente necessari alla vita del batterio, ma che possono rivelarsi utili in certe condizioni. Qual'è la struttura di un plasmide? Prima di tutto abbiamo un'origine di replicazione, una zona che rende possibile il processo di inizio della duplicazione del DNA; se rimuoviamo questa sequenza, il plasmide non si duplica e prima o poi sparirà da una popolazione batterica. I plasmidi in genere si duplicano quando avviene la duplicazione del DNA, e al momento della scissione della cellula vengono ripartiti tra le cellule; in questo modo, la quantità di plasmidi rimane costante nel tempo. Se la loro sintesi cessa di essere messa in atto, con i cicli di divisione il loro numero si ridurrà progressivamente finché non scompariranno. Oltre all'origine, in un plasmide vi sono varî geni. La differenza tra il cromosoma batterico e un plasmide è che il primo contiene molti più geni (un batterio ha circa 8-10,000 geni); un plasmide ha pochi ma caratteristi geni. Geni classici che si trovano a livello dei plasmidi sono quelli per la resistenza agli antibiotici. Come sappiamo, gli antibiotici sono strumenti farmacologici attivi contro le malattie batteriche; funzionano perché ABCtribe.com - [Pagina 9] discriminano tra i meccanismi metabolici di procarioti ed eucarioti. In pratica, sono veleni cellulari (che possono colpire ad es. la trascrizione o la traduzione) per i procarioti, ma che hanno poco o nessun effetto sugli eucarioti. Purtroppo, gli antibiotici sono sempre meno efficaci perché i batteri diventano resistenti: il loro DNA muta, e, casualmente, si può sviluppare un qualche sistema di difesa. Per questo motivo, l'abuso di antibiotici è sconsigliato, in quanto aumenta la probabilità che vengano selezionati ceppi resistenti anche a farmaci di nuova generazione. Tornando ai plasmidi, la resistenza agli antibiotici spesso è veicolata da queste molecole. Dato che in molti batteri è abbastanza facile il trasferimento di plasmidi da un batterio all'altro, la resistenza ad un antibiotico si può rapidamente espandersi ad una intera popolazione batterica molto rapidamente. Il fenomeno che rende possibile tutto questo è la coniugazione, il passaggio di un plasmide da un batterio ad un altro. Facciamo un esempio: supponiamo che un batterio possegga un plasmide con un gene per la resistenza all'amphicilina; significa che è in grado di crescere in presenza di amphicilina, in quanto i geni producono sostanze in grado di proteggere il batterio dall'azione dell'antibiotico. In questo caso, l'amphicilina è un antibiotico β-lattamico; il gene per la resistenza all'amphicilina codifica per una βlattamasi che viene riversata dal batterio sul terreno di coltura e idrolizza la molecola dell'antibiotico. om Altri geni classici che possono essere veicolati da plasmidi sono quelli per la produzione di tossine; i batteri, nella loro evoluzione, hanno sviluppato meccanismi che consentissero loro di occupare tutto lo spazio possibile. Oltre alla crescita estremamente rapida, un altro sistema, utile per eliminare altre specie batteriche o microorganismi, è proprio quello di eliminare la concorrenza attraverso sostanze venefiche. Infine, sono molto diffusi i geni che consentono di utilizzare fonti di carbonio atipiche, come il petrolio. Es. lo pseudomonas è in grado di utilizzare il petrolio come fonte di carbonio grazie a dei geni che consentono l'espressione di particolari enzimi idrolitici. Questi geni ovviamente aumentano la fitness dei batteri. AB Ct rib e.c Ritornando all'ingegneria genetica, vediamo come si possono utilizzare i plasmidi come vettori di DNA esogeno. Supponiamo di avere un plasmide di 4000 basi circa; grazie al computer, si possono ricercare i siti di restrizione dei varî enzimi di restrizione (EcoR1, EcoR5, etc.). In altre parole, si viene a creare una mappa dove sono segnate le posizioni a livello delle quali tagliano gli enzimi di restrizione. A questo punto, si può scegliere un enzima che riconosca un sito di restrizione che compare una sola volta; in questo modo siamo sicuri che taglierà in un solo punto, in modo da rendere il plasmide un filamento lineare anziché circolare. Questo si può verificare effettuando un'elettroforesi su gel di agarosio. L'agar è un polisaccaride che si ottiene da un'alga chiamata Agar agar; è una sorta di gelatina, che forma una maglia e contrasta la migrazione di molecole di DNA; queste, essendo cariche negativamente, vengono trascinate verso il polo positivo quando sottoposte ad un campo elettrico. Le maglie del gel tendono a frenare questa migrazione in maniera inversamente proporzionale alla carica del DNA: per cui le più piccole si fanno strada più facilmente attraverso il gel di agarosio e migrano più velocemente; quelle più grandi procedono più lentamente. Il DNA viene visualizzato perché trattato con bromuro di etidio, una molecola che lo colora. Eseguendo un'elettroforesi su gel, si può verificare quante volte è stato tagliato il DNA: se vediamo una sola striscia, vuol dire che c'è un solo tipo di molecola. In generale, avremo tante strisce quanti sono i frammenti in cui è stato tagliato il DNA. Abbiamo introdotto i plasmidi a questo punto soprattutto per accennare ad un argomento in particolare: una superstruttura del DNA che è molto importante. Abbiamo esaminato la struttura del singolo filamento; abbiamo poi visto la doppia elica formata da due filamenti; in vivo però il DNA ha una superstruttura. Il DNA di cui abbiamo parlato finora è un DNA rilassato, in una situazione di equilibrio; in vivo, il DNA è una molecola che ha accumulato dell'energia, che lo fa assomigliare ad una molla: stiamo parlando del superavvolgimento del DNA. Ci sono degli enzimi che, con spesa di ATP, torcono il DNA, che accumula tensione; altri enzimi eseguono il lavoro inverso, senza spesa di energia (è un processo esoergonico) e fanno sì che il DNA rilasci la tensione. Abbiamo parlato dei plasmidi perché questo fenomeno, nonostante sia valido per tutte le molecole di DNA, è più facile da capire se ci si riferisci ai plasmidi. In effetti, è nei plasmidi che questo fenomeno è stato scoperto. Il plasmide è una molecola di DNA relativamente piccola, di qualche migliaio di basi, di cui è possibile calcolare il peso molecolare. Effettuando l'elettroforesi su gel dei plasmidi, emergeva un fatto apparentemente inspiegabile: le specie molecolari sembravano due. Il fatto si spiegò ipotizzando che il DNA, nella cellula batterica, non fosse in una stato rilassato, ma superavvolto. Con superavvolto si intende che, oltre all'avvolgimento destrorso, intrinseco alla doppia elica, la molecola di DNA nel suo complesso può avere degli ulteriori avvolgimenti; questi superavvolgimenti possono essere positivi se sono nello stesso senso dell'avvolgimento della doppia elica (questo in natura non esiste), oppure ABCtribe.com - [Pagina 10] negativi se sono nel senso opposto. Il superavvolgimento negativo fa sì che si crei una ultrastruttura: il DNA tende a compattarsi. Una delle ragioni dell'esistenza del superavvolgimento infatti è proprio quella di avere un DNA più compatto. Nella cellula il superavvolgimento si ottiene aprendo il plasmide; il resto del doppio filamento viene poi fatto passare attraverso la rottura, che infine viene riparata. In altre parole, le cellule creano dei nodi; il DNA in questo modo non è in equilibrio, accumula energia; la sua struttura viene distorta da un punto di vista tridimensionale in modo che diventi più compatto. Gli enzimi che si occupano di queste attività enzimatiche sono le topoisomerasi di tipo II (dette girasi in E. coli); il nome è eloquente: gli enzimi di questa famiglia non cambiano niente dal punto di vista chimico; cambiano solo la topologia della molecola. Le girasi sono topoisomerasi che con spesa di energia superavvolgono negativamente il DNA. Le topoisomerasi di tipo I invece eseguono il lavoro inverso, togliendo i superavvolgimenti del DNA. Nella cellula batterica comunque le girasi sono più attive, sicché il plasmide è, per la maggior parte del tempo, superavvolto – così come il cromosoma. Ct rib e.c om Come dicevamo prima, una prima ragione per l'esistenza di questo fenomeno è quella di avere un DNA più compatto. Il DNA infatti è una molecola gigantesca: è difficile anche solo immaginare come questa struttura possa compattarsi all'interno di un batterio. Per quanto riguarda la seconda ragione, prima dobbiamo chiarire un concetto. Il superavvolgimento negativo (ribadiamo che con “negativo” si intende che avviene in senso opposto rispetto all'avvolgimento della doppia elica) fa sì che nella cellula ci sia un equilibrio non enzimatico tra la forma superavvolta negativamente e una forma più rilassata. La forma rilassata però non può essere uguale alla forma rilassata del DNA che conosciamo, dato che la molecola ha acquistato energia: dove viene spesa l'energia accumulata? Nella rottura di alcuni legami ad idrogeno. Notiamo che un superavvolgimento positivo porterebbe ad una maggiore chiusura della doppia elica, con il risultato che per aprire la doppia elica sarebbe necessario spendere ancora più energia. Invece, il superavvolgimento negativo sottrae energia: per aprire la doppia elica basta una energia minore. Quindi, la seconda probabile ragione che spiega l'esistenza di questo fenomeno è che il DNA così può anche essere più facilmente aperto a singolo filamento. Questo è importante perché le due principali attività in cui è coinvolto il DNA sono la replicazione e la trascrizione, ed entrambe prevedono come prima tappa l'apertura della doppia elica. Questo sembra confermato anche dal fatto che, sperimentalmente, si vede che i batteri che hanno delle topoisomerasi II difettose si duplicano molto più lentamente del ceppo di controllo. AB In un plasmide, introdurre superavvolgimenti è abbastanza facile, in quanto è un dominio topologico chiuso, ovvero una molecola che non ha estremità libere. Se, con un enzima di restrizione, si linearizzasse un plasmide per poi tentare di superavvolgerlo, la molecola semplicemente ruoterebbe su sé stessa. La topoisomerasi II è un enzima eterotetramerico che con consumo di ATP taglia un filamento e forma un nodo facendo passare l'altro filamento attraverso il taglio. Questo equivale a superavvolgere il DNA: da un plasmide rilassato, la girasi, con consumo di ATP, è in grado di produrre la struttura superavvolta. Il superavvolgimento in natura è stato osservato solo negativo; un superavvolgimento positivo sarebbe una sorta di inibizione all'apertura di una doppia elica, dunque poco conveniente. Le topoisomerasi I, come abbiamo visto, tolgono i superavvolgimenti. Questa è una operazione piuttosto semplice. Già soltanto tagliando uno dei due filamenti si può svolgere la doppia elica. Inoltre, l'enzima non ha nemmeno bisogno di ATP: il processo è spontaneo. Il superavvolgimento del DNA non riguarda solo i plasmidi batterici: è un fenomeno comune a tutto il DNA di tutti gli organismi, compreso il nostro. Tuttavia, sorge spontanea una domanda: come possiamo pensare a dei domini topologici chiusi, dato che i cromosomi sono lineari? Non abbiamo ancora esaminato la struttura della cromatina, ma per il momento ci basti sapere che i nostri cromosomi possono essere considerati dei domini topologici chiusi. Una molecola lineare può diventare un dominio topologico chiuso qualora se ne fissino le estremità così da tenerle ferme. Nel nucleo c'è una gigantesca quantità di proteine; il DNA nel nucleo non è certo una molecola libera, ma è strettamente legata ad altre molecole. Questo fa sì che il DNA, di fatto, sia costituito da tanti domini topologici chiusi, e questo permette l'avvolgimento. Se assumiamo che i cromosomi siano domini topologici chiusi, questo significa che la topoisomerasi II può agire su di essi, e quindi anche per i cromosomi avremo un equilibrio tra una ultrastruttura compatta e una forma rilassata con una zona a singolo filamento. Si può capire che il DNA è superavvolto esaminandolo a livello degli ottameri nucleosomici, intorno ai quali il DNA è avvolto a rocchetto. Non a caso, quando il DNA viene trascritto, la struttura nucleosomica deve essere smantellata. La trascrizione quindi anche negli eucarioti viene favorita ABCtribe.com - [Pagina 11] Questo documento e' un frammento dell'intero appunto utile come anteprima. Se desideri l'appunto completo clicca questo link. ABCtribe.com - [Pagina 12] Preparati con le domande di ABCtribe su Biochimica. 1. Sapreste dirmi quali problemi comporta la racemizzaz Risposta: Le proteine naturali sono composte solo di L-amminoacidi. Durante la sintesi di una proteina può accadere che uno o più amminoacidi subiscano accidentalmente racemizzazione al momento di essere introdotti nella catena peptidi [Clicca qui >> per continuare a leggere]. 2. Cosa si intende per rezione di 'capping' nella s Risposta: Il 'capping' è un trattamento con Ac2O che ha lo scopo di [Clicca qui >> per continuare a leggere]. * Carica Appunti,Domande,Suggerimenti su : Biochimica e guadagna punti >> * Lezioni Private per Biochimica >> Avvertenze: La maggior parte del materiale di ABCtribe.com è offerto/prodotto direttamente dagli studenti (appunti, riassunti, dispense, esercitazioni, domande ecc.) ed è quindi da intendersi ad integrazione dei tradizionali metodi di studio e non vuole sostituire o prevaricare le indicazioni istituzionali fornite dai docenti. Il presente file può essere utilizzato in base alle tue necessità ma non deve essere modificato in alcuna sua parte, conservando in particolare tutti i riferimenti all’autore ed a ABCtribe.com; non potrà essere in alcun modo pubblicato tramite alcun mezzo, senza diverso accordo scritto con l’autore ed i responsabili del progetto ABCtribe.com. Per eventuali informazioni, dubbi o controversie contattate la redazione all’indirizzo [email protected]. ABCtribe.com - [Pagina 13]
Scarica