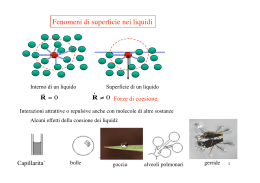
FORZE MOLECOLARI E TENSIONE SUPERFICIALE Antonio Ballarin Denti [email protected] FORZE MOLECOLARI Van der Waals (1837-1923) Forze di origine elettrica risultanti da interazioni tra cariche elettriche elementari costituenti la materia f(r) Forza repulsiva r < r0 Forza attrattiva r > r0 r0 r V(r) r0 ≈ 10-10m Forze di coesione tra molecole entro un raggio d’azione ~ 10-7 m TENSIONE SUPERFICIALE Le molecole che si trovano sulla superficie di un liquido hanno risultante ≠ 0 delle forze esercitate dalle altre molecole e sono attratte verso l’interno Energia potenziale U = υV + τS V = componente di U proporzionale a Vliquido S = componente di U proporzionale a Sliquido υ, τ = costanti positive caratteristiche del fluido Se V è costante, avremo, a meno di una costante arbitraria: U = τS τ = τ(T) è il coefficiente di tensione superficiale Rappresenta l’energia potenziale del liquido per unità di superficie dF = τ ds Forza agente su un segmento di superficie del liquido ds, ad esso e tangente alla superficie. τH O ≈ 7 2 τ alcool≈ 2 La superficie di un liquido, se non è piana, esercita una pressione verso l’interno. Una bolla ad esempio ha una pressione interna > patm = Lavoro per aumentare il volume della bolla di dv = 4 πr2 dr Lavoro dovuto alla tensione superficiale. Il fattore 2 indica le due facce della superficie In generale vale la formula di Laplace: la pressione dovuta alla tensione superficiale, per una sola faccia della superficie, sarà R1, R2: raggi di curvatura di una superficie sferica Se R1≈ R2 E per le due facce: La pressione cresce al calare di R TENSIONE SUPERFICIALE: applicazioni Filo leggero su una membrana, per esempio di acqua saponata. rotta la membrana interna al filo, esso assume una forma circolare essendo soggetto a tensioni interne Vale: τ31 > τ12 + τ23 Quindi una goccia d’olio su una superficie di acqua si stenderà sempre di più fino a diventare molto sottile τ31 τ12 aria olio τ23 acqua
Scarica