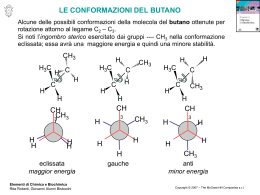
FARMACI ANTIINFIAMMATORI NON STEROIDEI - FANS - Membrana della cellula TRAUMA Interno della cellula Istamina Risposta infiammatoria Precursori della Bradichinina Acido Arachidonico Fosfolipasi A2 PG sintetasi Cascata PGE2 Bradichinina Recettori del dolore Effetti dei mediatori infiammogeni sui vasi e sulla migrazione cellulare Stimolo (ormonale, immunologico, neuronale) CELLULE AGGREGAZIONE SISTEMA DI MEDIATORI CASCATA DEL LIPIDICI COMPLEMENTO COAGULAZIONE MASTOCITARIE PIASTRINICA Membrana fosfolipidica Acido Arachidonico LTB4 PGG2 LTC4 PGE2 C3a, C5a (Attivazione cellulare) Fattore di Hageman PAF Chinine Istamina PGI2 Permeabiltà vascolare Vasodilatazione Edema Migrazione dei leucociti 5-HT Cascata dell’Acido Arachidonico Biosintesi e Metabolismo delle Prostaglandine e dei Trombossani Membrana fosfolipidica COX -1/C OX2 Attività biologiche dei metaboliti dell'acido arachidonico PRODOTTI DELLA CICLOOSSIGENASI PGE2, PGF2D, PGI2 Vasodilatazione, Antiaggregazione, Riassorbimento osseo, Regolazione delle risposte immunitarie TXA2 Aggregazione piastrinica, Vasocostrizione, Broncocostrizione PRODOTTI DELLA LIPOOSSIGENASI LTB4 Chemotassi dei leucociti, adesione e degranulazione Leucotrieni solfuropeptidici LTC4, LTD4 Permeabilità vascolare, Vasocostrizione, Broncocostrizione CLASSIFICAZIONE DEI FANS NON SELETTIVI COX-1/COX-2 Derivati di acidi carbossilici Derivati acidici Vari (enoli) di acidi aromatici pirazolici salicilati fenamati Fenilbutazone Proquazone Ac. salicilico Ac. mefenamico Ossifenilbutazone Ciproquazone Diflunisal Ac. flufenamico Azapropazone Benzidamina Benorilato Ac. niflumico Ac. meclofenamico di acidi aril ed eteroaril Diftalone Paracetamolo Oxicams acetici propionici Piroxicam Diclofenac Ibuprofen Isoxicam Alclofenac Naprossene Sudoxicam Fenclofenac Flurbiprofen Indometacina Sulindac Tolmetin Fentiazac CLASSIFICAZIONE DEI FANS IN BASE ALL'EFFICACIA CLINICA FANS maggiori Salicilati Pirazolici Indometacina FANS minori Fenamati Acidi aril ed eteroarilpropionici Acidi aril ed eteroarilacetici Composti vari CLASSIFICAZIONE DEI FANS IN BASE ALL'EFFICACIA ED ALLA TOLLERABILITA' TOLLERABILITA' Pirazolici (Fenilbutazone) Indolici (Indometacina) Salicilici (Aspirina) Arilpropionici Arilpropionici decrescente EFFICACIA Arilacetici Fenamati Indolici Arilacetici Salicilici Fenamati Pirazolici a. Sia la COX-1 che la COX-2 esistono come dimeri. Il sustrato acido arachidonico arriva al sito catalitico della cicloossigenasi attraverso un canale idrofobico. L’Aspirina acetila irreversi-bilmente un residuo di serina, vicino, ma distinto dal sito catalitico. Questo previene l’accesso del substrato al sito catalitico dell’enzima. Modello del sito attivo della cicloossigenasi con legata la PGG2 "Sito recettoriale" ipotetico della cicloossigenasi A H COOH H H COOH H CH3 B O O 5A° 8 15 C 11 H 12 H3CO N 5A° CH3 O 9 13 Cl H 7A° 7A° A = Cavità cationica B = Superficie idrofoba Acido Arachidonico Indometacina C = Tasca idrofoba COOH OH H3C NH H3C Acido Mefenamico N N COOH C4H9-n O CO CH3 O Fenilbutazone Acido Acetilsalicilico FARMACI ANTIINFIAMMATORI NON-STEROIDEI (FANS) I principali gruppi di sostanze che appartengono ai FANS sono: - Derivati dell'Acido Salicilico - Derivati Pirazolidin-3,5-dionici - Derivati dell'Acido Antranilico - Derivati degli Acidi Arilacetici e Arilpropionici Queste sostanze hanno in comune le seguenti proprietà: 1. Agiscono per via sintomatica 2. Presentano oltre all'attività antiinfiammatoria, attività analgesica, antipiretica, antiaggregante piastrinica e azione sulla dismenorrea primaria (mestruazione dolorosa). Gli effetti collaterali più comuni sono: nausea, vomito, dispepsia e ulcerazioni della mucosa gastrica. Quest'ultimo effetto è connesso al meccanismo d'azione. Inoltre presentano tossicità a livello renale ed epatico e disordini nel quadro ematico. Fra le varie proposte di meccanismo d'azione quella che trova maggior credito prende in considerazione l'inibizione della CICLOOSSIGENASI. DERIVATI DI ACIDI AROMATICI Derivati dell'Acido Salicilico (Ac. 2-Idrossi Benzoico) Derivati dell'Acido Fenamico (Ac. N-FenilAntranilico) Derivati dell'Acido Salicilico Lo sviluppo di farmaci derivanti dall'Acido salicilico ha avuto inizio dalla scoperta del glicoside SALICILINA presente nella corteccia di Salix Alba che presentava attività antipiretica. CH2OH CH2OH Idrolisi COOH Ox OH O(C6H11O5) OH Alcool Salicilico Salicilina Acido Salicilico L'Acido Salicilico viene sintetizzato secondo la sequenza di KOLBE. OH O- Na+ CO2 OH COO- Na+ + COOH H 4.4 bar, 135°C E' molto irritante (come tale viene somministrato solo per uso esterno) per cui si usano i sali di sodio, magnesio, colina e trietanolamina. In terapia si usano anche gli esteri di metile e propile. ACIDO ACETILSALICILICO (Aspirina) OCOCH3 COOH Sintesi OH + OCOCH3 (CH3CO)2O / H ' , toluene COOH COOH L'Aspirina è il composto più diffuso e largamente utilizzato. Viene impiegato anche come antiaggregante piastrinico. Si usa alla dose di 1gr per 24h come analgesico-antipiretico e alla dose di 4 gr per 24h come antireumatico. Irrita la mucosa gastrica. Per limitare i danni gastrointestinali sono state preparate varie formulazioni contenenti i sali di calcio o magnesio o preparando compresse a rivestimento gastroresistente. L'Aspirina inibisce la cicloossigenasi mediante una reazione di transesterificazione, pertanto è un inibitore irreversibile della cicloossigenasi. COOH + CICLOOSSIGENASI Nu OCOCH3 Nu = OH di una Serina529 COOH + OH CH3 CO Nu CICLOOSSIGENASI METABOLISMO DELL'ACIDO SALICILICO Salicilato libero HO COOH Ossidazione OH OH COOH Coniugazione con Ac. glucoronico Glucoronato estereo Glucoronato etereo Coniugazione con glicina CONHCH2COOH OH Acido Salicilurico DIFLUNISAL COOH OH F F Sintesi OH 1. NaOH 2. CO2 + Diflunisal 3. H F F E' quattro volte più attivo dell'Aspirina, presenta una minore attività gastroirritante e possiede una durata d'azione più lunga. Ha scarsa attività antipiretica e antiaggregante piastrinica. Viene somministrato in compresse da 250-500 mgr, 2-3 volte al dì. BENORILATO COO NHCOCH3 OCOCH3 Unisce con un legame labile l'Aspirina e il Paracetamolo. E' meno irritante dell'Aspirina. Derivati dell'Acido Fenamico Sono derivati dell'Acido N-fenilantranilico ed agiscono in modo analogo ai salicilati, inibendo la cicloossigenasi. COOH COOH CF3 NH R3 N R1 NH Ac. Niflumico R2 R1 = R2 = CH3; R3 = H Ac. Mefenamico R1 = R3 = Cl; R2 = CH3 Ac. Meclofenamico (Lenidolor) R1 = R3 = H; R2 = CF3 Ac. Flufenamico Le relazioni struttura-attività possono essere così riassunte: 1. La funzione amminica è essenziale in quanto la sua sostituzione con O, CH2, SO2, ..... N-COCH3 determina una significativa diminuzione di attività. 2. I sostituenti R1, R2, R3 aumentano l'attività. La ragione potrebbe essere la mancanza di coplanarità dei due anelli. 3. I due anelli aromatici non devono essere coplanari. HOOC H N CH3 CH3 Inattivo 4. Il gruppo carbossilico deve essere in posizione orto. ACIDO MEFENAMICO COOH - COO K + + H2N Br (AcO)2Cu H3C N H CH3 H3C CH3 E' il capostipite di questa classe e viene utilizzato principalmente come analgesico. Viene metabolizzato rapidamente per ossidazione a COOH del gruppo CH 3 in meta. Il tempo emivita è circa 2h. ACIDO FLUFENAMICO CF3 COOH + COOH Cu K2CO3 H2N Cl CF3 2' 3' N H 4' 6' 5' Possiede buona attività antiinfimmatoria. Viene metabolizzato per ossidrilazione in 4' ed ha un'emivita di circa 3h. ACIDO NIFLUMICO CF3 COOH + N Cl H2N COOH N CF3 N H E' un bioisostero dell'acido flufenamico. Ha mostrato buona attività antiinfiammatoria. DERIVATI DI ACIDI ARIL- ED ETEROARILACETICI E PROPIONICI Inibitori competitivi e reversibili della cicloossigenasi. - I derivati Arilacetici sono identificati dal suffisso FENAC (R = H) - I derivati D-Arilpropionici sono identificati dal suffisso PROFEN (R = CH3) D CH X COOH R Y Î Sostituenti in D più voluminosi del CH3 causano una netta diminuzione di attività. Î X è un gruppo con carattere prevalentemente idrofobico. Î Y può essere un alogeno. IBUFENAC H3C CH CH2 CH2 COOH H3C E' il capostipite degli acidi Fenilacetici. E' stato introdotto in terapia nel 1963 ed è stato ritirato dal commercio nel 1968 a causa della sua tossicità (epatotossico). IBUPROFEN (Brufen) CH3 H3C CH CH2 CH COOH * H3C E' il capostipite degli acidi Arilpropionici. E' utilizzato (300 mg 3-4 volte al dì) nell'artrite reumatoide, nell'osteoartrite, etc...... E' un farmaco ben tollerato e viene eliminato per via renale prevalentemente inalterato. La somministrazione del racemo porta alla escrezione di una miscela dei due enantiomeri in cui prevale la forma (S)-(+). Uno studio approfondito del problema ha permesso di scoprire che in vivo si verifica una inversione d configurazione (R)-(-) Î (S)-(+). Enantiomero Somministrazione Rapporto (S)/(R) Escrezione Rapporto (S)/(R) (S)-(+) 95:5 95:5 (R)-(-) 6:94 80:20 Racemo 50:50 70:30 In vitro l'enantiomero (S)-(+) è circa 60 volte più attivo dell'enantiomero (R)-(-). In vivo questa differenza di attività fra i due enantiomeri è decisamente meno pronunciata. Meccanismo di inversione COOH Ar Acil-CoA transferasi CoA-SH C CH3 H COSCoA Ar C CH3 H Idrolasi (R) Racemasi COOH Ar C H CH3 (S) Acil-CoA transferasi CoA-SH Idrolasi COSCoA Ar C H CH3 Metodi generali di sintesi dei racemati O 1- Ar OH NaBH4 C Ar Br PBr3 CH CH3 CH3 Ar CH3 NaOH CH Ar CH CN COOH CH3 2- Ar CH2 COOR 1. NaH 2. CH3I CH3 NaOH Ar CH COOH Ar CH CH3 CH3 NaCN Ar CH COOH RO 3- Ar OR C X shift 1,2 del gruppo Ar CH CH3 Ar CH CH3 COOR Per la trasposizione si usano acidi di Lewis e solventi polari protici. Con tale metodologia sono stati sintetizzati Ibuprofen e Naproxen. Br O O CH3 CH3 Br2 EtOH H+ EtO Br CH3 EtO shift 1,2 ZnBr2 EtO O Ibuprofen Et Br Br Zn CH3 YO OY Br YOOC H X R Ar H R Ar Metodi generali di sintesi dei singoli enantiomeri 1. Classica risoluzione con Cinconidina. 2. Risoluzione cinetica degli esteri con enzimi (lipasi). 3. Idrogenazione asimmetrica di precursori insaturi. 4. Trasposizione asimmetrica di chetali derivanti da D-alogeno chetoni. 1. Classica risoluzione con Cinconidina. H2C H2C H H COOH CH3 N HO . H H3CO (S)-(+)-Naproxene N Cinconidina Il Naproxene è il primo FANS commercializzato come singolo enantiomero. Ha un tempo di emivita lungo (12-15h) rispetto agli altri componenti della classe (2-4h). L'enantiomero (S)-(+) è molto più attivo dell'enantiomero (R)-(-). 2. Risoluzione cinetica degli esteri con enzimi (lipasi). COOH H CH3 CH COOCH3 Carboxylesterasi NP CH3 Resa: <50% H3CO H3CO +- Naproxene 100% e.e. COOH H CH3 CH3 CH COOCH3 Carboxylesterasi NP Resa: <50% H3C +- Ibuprofen CH3 CH3 H3C 95% e.e. 3. Idrogenazione asimmetrica di precursori insaturi. Processo MONSANTO (elettrocarbossilazione + idrogenazione asimmetrica) O O . eH3CO e-, 2CO2 H3CO OOC OCOO HO COOH H+ H3CO -H2O H3CO H CH3 COOH H2, cat.* COOH MeOH, 135 atm sub/cat. = 215 H3CO 12h H3CO PPh2 cat.* O Ru PPh2 92% resa 97% e.e. O Atropisomerismo O O Ru (-S-BINAP) (OAc)2 H3C H O COOH COOH H2 cat.* 96% e.e. 4. Trasposizione asimmetrica di chetali derivanti da D-alogeno chetoni. H3C Ar H Cl AlCl3 H + ClOC MeOH C C CH3 ZnCl2 CH3 COOCH3 C C OMe H Cl Ar H+ Ar CO H MeO H Ar Cl H H2O CH3 Ar + H COOH C CH3 Ibuprofen: 82% e.e. Naproxen: 96% e.e. Processo ZAMBON H3COOC O O COOCH3 O 1a fase H3CO H3CO H3COOC O COOCH3 O H3COOC O + COOCH3 O 2a fase Br2 Br H3CO Br H3CO Br Br 1 94% >> 2 6% 2 1 3a fase H2O/H+ HOOC HOOC COOH O COOH O O Br H3CO H2O/H+ O Br H3CO Br Br 4a fase 100 °C Trasposizione + H2O/H Sostituzione HOOC COOH CH3 COOH O COO O OH H3CO HOOC OH H3CO Br Br 1. MeOH 2. H2 - Pd/C 3. CH3SO2Cl / NEt3 H3COOC CH3 O COOH COOCH3 O H3CO Br OSO2CH3 H3CO H2 - Pd/C 5a fase H Trasposizione + H2O/H CH3 COOH H3CO 99% e.e. DERIVATI DI ACIDI ARILACETICI DICLOFENAC (Voltaren) CH2COOH NH Cl Cl E' un ibrido tra la serie degli acidi Arilacetici e quella dei Fenamati. Ne è risultato un composto molto attivo che si utilizza alla dose di 25mg 3-4 volte al dì. Sintesi COCl NH Cl + COCl N COCl Cl Cl C O Cl O NH2 AlCl3 N Cl 1. KOH 2. HCl Diclofenac O NH2 , KOH Cl ' W.K. N Cl O Cl ALCLOFENAC Cl H2C CH CH2 O CH2 COOH Sintesi OH Cl Cl OCH2 CH CH2 + H2C base CH CH2Br Cl OCH2 CH CH2 CH2O, HCl 1. NaCN 2. KOH 3. HCl ClH2C Cl OCH2 CH CH2 HOOC H2C FENCLOFENAC CH2 COOH O Cl Cl INDOMETACINA CH2 H3CO N C COOH CH3 O Cl Viene usata nel trattamento della gotta, dell'artrite reumatoide, osteoartrite e spondilite. Si somministra in capsule (200 mgr) o in supposte (100 mgr). Possiede un'emivita di circa 2h ed il 20% viene escreto inalterato. I metaboliti derivano da: demetilazione, N-deacilazione e glucoronazione. I principali effetti collaterali sono disturbi a carico del tratto gastrointestinale e del sistema emopoietico e reazioni di sensibilizzazione. Sintesi dell'Indometacina 1. Processo MERCK NH NH2 + HCl H3C CO CH2 CH2 COOCH3 CH3OH Fisher OCH3 CH2 COOH CH2 COOCH3 H3CO 1. NaOH H3CO 2. HCl N N CH3 H H t-C4H9OH CH3 COCl CH2 COOC4H9 H3CO NaH + ZnCl2 N CH3 H Cl CH2 COOC4H9 H3CO N CO Cl CH3 ' 210 °C Indometacina Sintesi Indolica di Fisher CH3 NH NH2 NH N C CH3 CH3 + C O CH3 + CH2 H NH NH2 H H C H C C + CH3 N H NH2 CH -H C CH3 NH2 NH NH 2 CH3 CH3 NH2 - NH3 N H CH3 2. Processo SUMITOMO NH N NH NH2 . HCl CH CH3 CH3CHO + OCH3 OCH3 N N Piridina COCl Cl CH CH3 CO HCl Cl C2H5OH H3CO NH2 . HCl N CH3 CO Cl + H3CO CO CH2 CH2 COOH H3CO N N C CO Cl HCl Fisher Indometacina CH2 CH2 COOH CH3 Sono stati preparati e saggiati più di 350 composti con struttura simile all'Indometacina. L'introduzione di un gruppo CH3 sulla catena laterale non aumenta la potenza, ma l'enantiomero (S)-(+) è il più attivo. CH3 CH COOH H3CO CH3 N C O Cl Da misure chimico-fisiche si è osservato che la conformazione più stabile dell'Indometacina è cisoide non planare. CH2 COOH H3CO N CH3 C O Cl Infatti l'analogo rigido è inattivo. CH2 COOH H3CO N CH3 O Cl Relazioni struttura-attività nell'Indometacina CH2 COOH R3 R2 N R1 R1 VANTAGGIOSO SFAVOREVOLE X Acile alifatico CO (X = Alog., CF3, SCH3) CH2 ; S Alchile CO R2 CH3 H, R3 5-CH3O-; 5-CH3CO-; 5-Cl, 5-H 5-F; 5-(CH3)2N-; Sostituzione nelle altre posizioni 5-CH3- Nel corrispondente derivato indenico dell'Indometacina la forma cisoide A è circa 5 volte più attiva della corrispondente forma transoide B, anche se l'attività di A è circa la metà di quella dell'Indometacina. CH2COOH H3CO CH2COOH H3CO CH3 CH3 H H Cl Cl A B Da questi composti si è arrivati al Sulindac. SULINDAC CH2 COOH F CH3 C H H3C S O Il Sulindac è meno attivo dell'Indometacina, però è meglio tollerato. E' un profarmaco in quanto il prodotto attivo è il corrispondente tioetere che deriva dalla riduzione enzimatica del Sulindac. Il corrispondente solfone ed il suo glucoronato costituiscono i principali metaboliti. CH2 COOH F CH3 C H H3C S Metabolita attivo CH2 COOH F Rid. enzimatica CH3 C H CH2 COOH F H3C S Ox. enzimatica O CH3 C H H3C O2S Prodotto di escrezione Sintesi H2C O F CN CN F COOH COOH H3C COO-NH4+ CH3 CH3 CH2 CN F - CO2 CH2 COOH F 1. KOH 2. HCl CH3 CH3 CHO CH2 COOH F H3CS CH3 - H2O H H3CS NaIO4 Sulindac TOLMETIN CH2 COOH N CH3 O H3C Ottimo analgesico, antipiretico e antiinfiammatorio. E' ben tollerato. Sintesi (CH2O)X N CH3 NH(CH3)2.HCl Mannich N CH3 CH2 N N CH3 CH3I CH3 CH3 + CH3 CH2 N CH3 I- CH3 NaCN ' N CH2 CN CH3 CH2 CN H3C COCl N AlCl3 CH3 O H3C 1. NaOH 2. HCl Tolmetin DERIVATI DI ACIDI ARILPROPIONICI IBUPROFEN (Brufen) CH3 CH COOH S = R per inversione in vivo. Dose di mantenimento: 1.2 gr/dì. NAPROXEN (Xenar, Naprosin) CH3 CH COOH S>R Dose di mantenimento: 500 mgr/dì. H3CO FLURBIPROFEN (Froben) CH3 CH COOH S>R Dose di mantenimento: 150 mgr/dì. F FENOPROFEN (Fepron) CH3 CH O COOH S=R Dose di mantenimento: 1.8 gr/dì. CHETOPROFEN (Orudis, Ketangel) O CH3 CH COOH S>R Dose di mantenimento: 150 mgr/dì. BENOXAPROFEN (Coxigon) CH3 CH O N Cl COOH Dose di mantenimento: 600 mgr/dì. DERIVATI ENOLICI FENILBUTAZONE (Butazolidina) Il Fenilbutazone è il primo rappresentante della classe di antiinfiammatori a struttura Pirazolidin-3,5-dionica. H3C H O nC4H9 C6H5 N N O C6H5 Fenilbutazone H3C H3C CH3 N N N O C6H5 Aminofenazone Nel 1949 il Fenilbutazone fu immesso sul mercato come solubilizzante (componente acido) dell'Aminofenazone che è un composto con attività analgesica e antipiretica. Successivamente si è osservato che anche il Fenilbutazone possiede ottime caratteristiche antiflogistiche e può essere impiegato nel trattamento di forme reumatiche e nella gotta. Viene somministrato alle dosi di 300-400 mgr/dì, però a causa dell'emivita particolarmente lunga (72h) si ha pericolo di accumulo. I principali effetti collaterali sono danni epatici, ulcera, variazioni del quadro ematologico con anemia aplastica e agranulocitosi. Relazioni struttura-attività nel Fenilbutazone H O nC4H9 5 N1 2 N 4 3 O La funzione E -dicarbonilica enolizzabile è essenziale. Tale funzione ha carattere acido. Per eliminazione (sostituzione) dell'atomo di H in 4 si ha perdita di attività. Il radicale butile può essere sostituito con un radicale a tre atomi di carbonio anche insaturo. E' possibile, ma comunque non migliora l'attività, introdurre in para all'anello aromatico in posizione 1 un sostituente (CH3, Cl, NO2). Permane l'attività (minore) se si elimina il fenile in posizione 1 all'eterociclo; quello in posizione 2 è essenziale. I due anelli aromatici non sono coplanari, ma formano un angolo di circa 45°. Il radicale butilico si dirige verso la stessa direzione del fenile in 2. OSSIFENBUTAZONE (Tanderil) H O C4H9 N O N OH E' fra i metaboliti del Fenilbutazone quello che si è dimostrato attivo quanto il Fenilbutazone stesso e viene impiegato alla dose di 300 mgr/dì. SUXIBUTAZONE FECLOBUZONE BUMADIZONE CALCICO C4H9 O RCO2 O COO C4H9 H2C . 1/2 Ca N N NH O C6H5 N C6H5 R = HOOC CH2 CH2 Suxibuzone R = Cl Feclobuzone Bumadizone calcico Questi composti sono dei profarmaci in quanto la funzione E -dicarbonilica enolizzabile essenziale non è presente, ma si forma in vivo. C4H9 O C4H9 O R C O O HO O N O N N N -CH2O Retroaldolica C4H9 O O N N O C4H9 O O H N N C6H5 . 1/2 Ca C6H5 PRODOTTI COMMERCIALI FENILBUTAZONE (Butazolidina) O C4H9 N O N 300/400 mgr/dì C6H5 C6H5 Sintesi C6H5 COOC2H5 CH C4H9 HN RO-Na+ HN ' + COOC2H5 Fenilbutazone C6H5 OXIFENBUTAZONE (Tanderil) O C4H9 O 300 mgr/dì N N OH SUXIBUTAZONE (Solurol) O C4H9 C HOOC O O 800 mgr/dì N O C6H5 N C6H5 FECLOBUZONE O C4H9 Cl C O O N O N 1 gr/dì C6H5 C6H5 BUMADIZONE CALCICO (Eumotol) C4H9 COO . 1/2 Ca NH O N C6H5 C6H5 300 mgr/dì FEPRAZONE (Zepelin) O H3C H3C N O C6H5 N 300-400 mgr/dì C6H5 SULFINPIRAZONE (Enturen) O C6H5 O S N O N 300-400 mgr/dì C6H5 C6H5 Sintesi COOC2H5 CH CH2 CH2 S C6H5 + COOC2H5 C6H5 1. RO-Na+ HN 2. H2O2 HN C6H5 Sulfinpirazone AZAPROPAZONE (Prolixan) C3H7 O N O CH3 N 600-900 mgr/dì H3C N N CH3 Sintesi O O2N CH3 + CH3 N N H3C H2N N CN CH3 H3C N N CH3 H rid. Sn H H3C N N N COOC2H5 CH3 + CH C3H7 COOC2H5 N CH3 Azapropazone PARACETAMOLO (Femidol, Saridon, Tachipirina) NHCOCH3 OH Il Paracetamolo ha buone attività analgesiche e antipiretiche. L'attività antiinfiammatoria è nulla. E' un inibitore rapido, reversibile e non-competitivo della cicloossigenasi. Infatti esplica la sua azione sull'enzima attraverso la riduzione della concentrazione degli idroperossidi che sono essenziali nell'attività della cicloossigenasi.. E' un metabolita sia dell'Acetanilide che della Fenacetina. NHCOCH3 NHCOCH3 OC2H5 Acetanilide (Antifebbrina) Fenacetina Questi composti sono stati ritirati dal commercio in quanto sono nefrotossici. Inoltre la 4-etossianilina, un metabolita della fenacetina, trasforma l'emoglobina in meta-emoglobina che non possiede la capacità di trasportare ossigeno. NH2 NHCOCH3 0.1% OC2H5 p-Fenetidina OC2H5 Fenacetina NHCOCH3 NHCOCH3 NHCOCH3 Solfato OH Glucuronide Paracetamolo P-450 Ossidasi HO N COCH3 OH Intermedi tossici NCOCH3 G Glutatione NHCOCH3 O Macromolecole nucleofile cellulari NHCOCH3 Glutatione OH Acido Mercapturico OH Macromolecole cellulari Morte cellulare OXICAMS Evoluzione delle strutture che hanno portato agli Oxicams. H C C C C C C + O R O- H O R O O H X Arile O O H X Arile S O O O CONHR N S O CH3 O OH CONHR S O N O CH3 OXICAMS OH CONHR S O N CH3 O Piroxicam R= N R= 20-40 mg/dì in dose unica t1/2 45h Isoxicam N CH3 O N Sudoxicam R= t1/2 24h S Sono inibitori rapidi e reversibili della cicloossigenasi. Vengono impiegati nel trattamento della osteoartrite e dell'artrite reumatoide e possono essere utilizzati per lunghi periodi. Mostrano effetti collaterali a carico del tratto gastrointestinale. La ricerca attuale è orientata alla preparazione di appropriati profarmaci che migliorano sensibilmente il profilo farmacocinetico degli Oxicams sopra riportati. CH3 O OCO CH OCOOEt CONH CH CH C6H5 CONH N N S N CH3 O O N S O O Ampiroxicam CH3 Cinoxicam O O N N O N S O CH3 O Droxicam Sintesi O N O ClCH2COOCH3 H S O N - OH CH2 S O O Saccarina O OH O - COOCH3 COOCH3 + RO Na N DMSO CH COOCH3 S O S O O CH3I R-NH2 OXICAMS NH O COMPOSTI VARI PROQUAZONE (Biarison) C6H5 N 900 mgr/dì H3C N O CH CH3 H3C BENZIDAMINA (Tantum) O (CH2)3 N N CH3 CH3 150 mgr/dì N CH2 C6H5 DIFTALONE (Aladione) O N 500-750 mgr/dì N O Nuovi approcci per lo sviluppo di FANS con ridotta tossicità gastrointestinale: FANS che rilasciano NO FANS inibitori selettivi della COX-2 FANS che rilasciano NO L'ossido d'azoto (NO) è capace di esercitare effetti citoprotettivi simili a quelli osservati con le prostaglandine. Infatti l'NO modula il flusso di sangue, il rilascio di muco e ripara i danni della mucosa. Flurbiprofen nitrossibutilestere (HTC-1026) CHCOO(CH2)4 ONO2 CH3 F E' in fase II di sperimentazione clinica come antiinfiammatorio ma possiede ulteriori indicazioni terapeutiche per incontinenza urinaria ed osteoporosi (NO inibisce gli osteoclasti). Chetoprofen nitrossibutilestere CH3 CHCOO(CH2)4 O C ONO2 NITROASPIRINE CH2 ONO2 R= NCX 4016 COOR OCOCH3 R=H Acido Acetilsalicilico R = (CH2)4 ONO2 NCX 4215 1. NO che si libera può controbilanciare l'effetto negativo dell'aspirina dovuto all'inibizione delle prostaglandine a livello gastrointestinale. 2. Le NO-aspirine mostrano un potenziato effetto antiinfiammatorio dovuto al ruolo che l'NO gioca nei processi patologici infiammatori. 3. Le NO-aspirine sono potenziali nuovi agenti antitrombotici. NCX-4016 O H3C O O O O NO2 Il suo profilo farmacologico indica che l'introduzione del gruppo che rilascia NO non solo elimina la tossicità gastrointestinale, ma anche aumenta l'attività analgesica e antitrombotica. A differenza dell'aspirina l'NCX-4016 non potenzia la risposta ulcerogenica gastrica allo stress ipotermico (28-30 °C), ma anzi mostra una protezione dose dipendente contro le lesioni gastriche indotte da HCl/Etanolo. E' in fase clinica I in Inghilterra. FANS inibitori selettivi della COX-2 Acido Arachidonico Enzima COSTITUTIVO nello stomaco, piastrine e rene. COX-1 COX-2 Enzima INDOTTO dalle citochine, endotossine, mitogeni Celecoxib Rofecoxib Indometacina Aspirina altri FANS Indometacina Aspirina altri FANS Prostaglandine COX-1 e COX-2 differiscono nella selettività per gli inibitori a causa del diverso amminoacido in posizione 523 che è una ISOLEUCINA nella COX-1 e una VALINA nella COX-2. SELETTIVITA’ COX-2 VALINA (COX-2) COX-2 COX-1 ISOLEUCINA (COX-1) Br N N H2NO2S SC 558 CF3 Inibitore specifico della COX-2: interazione solo con COX-2 FANS legati ai siti attivi della COX-1 rispetto alla COX-2 A. Flurbiprofen legato nel canale del sito attivo della COX-1 ovina. B. SC-588, inibitore selettivo COX-2, legato nel canale del sito attivo della COX-2 di topo. L'analisi della struttura amminoacidica delle due isoforme COX-1 e COX-2 ha evidenziato: - una sostanziale analogia per il sito catalitico. - un numero limitato di amminoacidi differenti nel canale idrofobico attraverso il quale il substrato transita per raggiungere il sito attivo dell'enzima. La presenza però di una valina nella COX-2 , al posto di una isoleucina nella struttura della COX-1, rende disponibile una tasca laterale non accessibile invece nella COX-1. GLI INIBITORI SELETTIVI COX-2 HANNO CARATTERISTICHE STRUTTURALI TALI DA POTERSI POSIZIONARE STABILMENTE NELLA TASCA LATERALE CARATTERISTICA DELLA COX-2, INIBENDONE SELETTIVAMENTE L'ATTIVITA' ENZIMATICA. NON SONO INVECE IN GRADO DI INTERAGIRE IN MODO PERSISTENTE ED EFFICACE CON IL SITO ATTIVO (PIU' RISTRETTO) DELLA COX-1. CITOCHINE MITOGENI Dexametasone COX-1 COSTITUTIVO COX-2 INDOTTO FANS TXA2 PGI2 PGE2 Piastrine Mucosa gastrica Endotelio vascolare Rene FANS: EFFETTI COLLATERALI PROSTAGLANDINE INFIAMMAZIONE DOLORE, GONFIORE EFFETTI TERAPEUTICI INIBITORI SELETTIVI COX-2 Si possono considerare inibitori COX-2 "tempo-dipendenti". Inizialmente infatti hanno uguale potenza su COX-1 e COX-2, ma la potenza contro COX-2 aumenta selettivamente dopo 10 minuti di incubazione. La rimozione del farmaco per dialisi ripristina l'attività COX-1, ma non COX-2, suggerendo l'instaurarsi di un cambiamento irreversibile nell'enzima indotto COX-2. Vengono suddivisi in due classi: - ARILSOLFONAMMIDI X N H Y O O H3C R S - DIARILETEROCICLI YO2S ANELLO ETEROCICLICO X ARILSOLFONAMMIDI Derivano dal razionale approccio di sostituzione del gruppo carbossilico degli acidi arilacetici con il gruppo isostero solfonammidico. R O NO2 O O S H3C N H NIMESULIDE (Aulin) R= NS-398 R= F F O X O O S H3C N H CGP 28238 X=O NS-398 X=S DIARILETEROCICLI Derivano dall'Indoxolo uno dei primi FANS non acidi. H3CO Indoxolo N H H3CO Studi di relazione struttura-attività hanno evidenziato che l'anello eterociclico può essere di tipo diverso e che i due gruppi arilici devono essere in posizione 1-2 dell'eterociclo che li mantiene in una corretta posizione per poter interagire con l'enzima. YO2S ANELLO ETEROCICLICO X DUP-697 Y X CH3 F ETEROCICLO Br S SC-57666 CH3 F SC-58125 CH3 F N N CF3 CELECOXIB NH2 CH3 N N CF3 ROFECOXIB CH3 H O O SELETTIVITA' COX-1/COX-2 COX-1 (IC50,PM) COX-2 (IC50,PM) INIBITORI NON SELETTIVI PREFERENZIALI SELETTIVI - Naproxene 0,11 - Diclofenac 0,4 - Indometacina 0,2 - Piroxicam <0,12 - Acido Mefenamico <0,17 - NS-398 42 - DUP-697 85 - NIMESULIDE (Aulin) 55 - MELOXICAM (Mobic) 3 - JTE-522 >156 - CELECOXIB (Celebrex) 375 - ROFECOXIB (Vioxx) 800 - VALDECOXIB (Bextra) 28000 INIBITORI PREFERENZIALI COX-2 NIMESULIDE (Aulin) 1985 O NO2 O O S H3C N H MELOXICAM (Mobic) 1996 O O S CH3 N H N S CH3 OH O N Viene utilizzato da pazienti con artrite reumatoide ed osteoartrite. Ha un'emivita di circa 20h ed un effetto terapeutico simile al Piroxicam, al Diclofenac e al Naproxene, ma possiede maggiore tollerabilità gastrointestinale probabilmente per la maggiore selettività verso la COX-2. INIBITORI SELETTIVI COX-2 INIBITORI SELETTIVI COX-2 CELECOXIB (Celebrex) O H2N O S N N CF3 H3C Appartiene alla classe degli 1,5-diarilpirazoli. In vitro ha mostrato eccellente selettività per la COX-2 (IC50 COX-2/COX-1 : 0.04/15). In vivo possiede potente attività antiinfiammatoria dopo somministrazione per os: ED50 7,1 mg/Kg per infiammazione acuta nel saggio dell'edema indotto da carragenina; ED50 0.37 mg/Kg/die per infiammazione cronica nel modello di artrite. Non produce nei topi tossicità gastrointestinale nè acuta, nè cronica. Nel saggio dell'edema indotto da carragenina nella zampa di ratto inibisce la produzione di PGE2 alla dose di 0,1-2 mg/Kg, mentre non tocca la PGE2 gastrica e renale fino alla dose di 600 mg/Kg. Presenta un buon profilo farmacocinetico con emivita di 12h. Il Celecoxib è il primo inibitore selettivo COX-2 approvato dalla FDA alla fine del 1998 ed è entrato in commercio in America nel 1999 e successivamente in altri paesi, tra cui l'Italia. Gli studi clinici hanno mostrato che non produce erosioni gastriche o ulcere, mentre hanno provato la sua efficacia come analgesico ed antiinfiammatorio in pazienti con osteoartriti ed artrite reumatoide. Rappresenta una valida opzione nel trattamento del dolore provocato dalle patologie infiammatorie delle ossa. Sintesi del Celecoxib O O NaOCH3 CH3 + H3C MeOH ' CF3 O H3C O O O O CF3 + H2N S EtOH N H H3C O H2N NH2 O S N N H3C CF3 ' ROFECOXIB (Vioxx) O O S H3C O O Ha la stessa efficacia dell'Ibuprofen sia come analgesico che come antipiretico, indicando che le prostaglandine derivate dalla COX-2 sono importanti mediatori del dolore e contribuiscono alla febbre. Studi clinici effettuati su pazienti affetti da artrite reumatoide hanno evidenziato che il Rofecoxib ha provocato infiammazioni gastriche nel 4% dei casi rispetto al 26% del Naproxene. Il Rofecoxib inoltre non ha effetto sul citocromo P450. Nel 1999 la Merck ha ottenuto dall'FDA l'approvazione del Vioxx per il trattamento dell'osteoartrite e del dolore con un'unica somministrazione al giorno. Nel 2004 il Vioxx è stato ritirato dal commercio perchè cardiotossico. Sono stati registrati numerosi casi di morte per infarto del miocardio. Sintesi del Rofecoxib H3C S CH3 Cl AlCl3 + H3C S CH3 O O O O H2O2 H3C O O S Br2 H3C S CH3 Br O O O O O-Na+ H3C S O O DMF O O O O S H3C O O (i-Pr)2NH DMF JTE-522 O O S H2N F O CH3 N Il JTE-522 è attualmente in fase II di sperimentazione clinica per il trattamento di artrite reumatoide ed osteoartrite. Inoltre questo composto ha mostrato attività antiipertensiva in uno studio condotto su ratti, indicando che le prostaglandine prodotte per azione della COX-2 possono essere coinvolte nell'ipertensione renovascolare. Il JTE-522 è stato testato in vitro e in vivo per chiarire un'eventuale relazione tra l'espressione della COX-2 e le metastasi al fegato del cancro al colon e valutare il potenziale effetto terapeutico. Gli effetti inibitori mostrati dal JTE-522 in vivo sulle metastasi al fegato ha permesso di concludere che gli inibitori COX-2 sono potenzialmente utili nel prevenire tumorogenesi colorettali ed anche metastasi ematogene del cancro al colon. VALDECOXIB (Bextra) N O CH3 H2N S O O Il Valdecoxib è un inibitore COX-2 altamente selettivo ed ha mostrato, dopo somministrazione orale, un'elevata potenza in modelli animali sia di infiammazione acuta che cronica. E' entrato in commercio nel 2004 per il trattamento di artrite e dolore. Sono stati osservati effetti collaterali: eruzioni cutanee, disturbi epatici e renali. ATTIVITA' In Vitro (IC50, PM) Enzimi ricombinanti umani COX-1 COX-2 COX-1/COX-2 Valdecoxib 140 + 19 0.005 + 0.001 28000 Celecoxib 15 + 3.4 0.04 + 0.01 375 ATTIVITA' In Vivo (EC50, mg/Kg) Edema indotto da carragenina nel ratto Artrite nel ratto Bolla d'aria nel ratto Valdecoxib 10.2 + 1.4 0.032 + 0.002 0.05 + 0.02 Celecoxib 7.13 + 0.79 0.373 + 0.163 0.33 + 0.08 PARECOXIB SODIUM N O Na H3C CH3 N CH2 O S O O E' un potente e selettivo inibitore COX-2 somministrabile per via parenterale. Si tratta infatti di un 'prodrug' che in vivo rigenera il Valdecoxib. Si è dimostrato molto efficace nelle forme di dolore acuto (ED 50 5mg/Kg) ed è in fase di sperimentazione clinica per il trattamento di queste patologie. Sintesi N O N 1. (RCO)2O, Et3N O 2. NaOH CH3 H2N O S O Na N R O O CH3 S O R = CH3 R = CH2-CH3 Parecoxib Sodium R = CH2-CH2-CH3 Profilo farmacocinetico della conversione del PARECOXIB SODIUM a VALDECOXIB Inversione dell’iperalgesia indotta da Carragenina dopo somministrazione endovena di PARECOXIB SODIUM Carragenina
Scarica