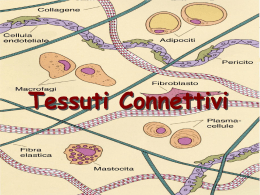
ADATTAMENTI FUNZIONALI ALL’ESERCIZIO Il rimodellamento (remodeling) dei tessuti Ogni tessuto va incontro a modificazioni: •Embriogenesi: differenziazione dei tessuti e formazione di organi e sistemi •Sviluppo corporeo: aumento armonico delle dimensioni degli organi (iperplasia: moltiplicazione cellulare; ipertrofia: aumento di volume delle cellule o del tessuto interstiziale) •Adattamenti funzionali: modificazioni indotte da fattori patologici o fisiologici sui tessuti e sugli organi – rimodellamento Meccanismi in parte comuni e in parte differenziati L’omeostasi richiede variazioni omogenee di forma e funzione Il rimodellamento spesso è morfo-funzionale ma non sempre i due elementi coincidono nel tempo e nella fenomenologia Prenderemo in considerazione: Definizione di rimodellamento tessutale Crescita e adattamento dei tessuti connettivi Tendini e tessuto adiposo Muscolo scheletrico Osso e cartilagine Rimodellamento vascolare Plasticità cardiaca N.B.: tutto il materiale presentato è tratto da articoli reperibili in internet, di cui viene sempre presentata la citazione. Annu. Rev. Biomed. Eng. 2004. 6:77–107 TISSUE GROWTH AND REMODELING Stephen C. Cowin The New York Center for Biomedical Engineering and the Departments of Biomedical and Mechanical Engineering, School of Engineering, City College and Graduate School, The City University of New York, New York 10031; email: [email protected] Un tessuto è un materiale composito i cui costituenti, che ne determinano la struttura, si modificano in continuazione a causa dell’accrescimento e in risposta all’ambiente fisico e chimico in cui si trova il tessuto. L’ambiente fisico-chimico di un tessuto è rappresentato dall’ambiente in cui si trova e dalla sua storia recente. Un tessuto è un insieme di cellule e della matrice extracellulare (ECM) che realizzano funzioni specifiche. L’ECM è fatto di fibre (es. le proteine del collagene e l’elastina) e una sostanza di base (es. proteoglicani). Rispetto ad altri tessuti, il connettivo ha relativamente poche cellule e molto materiale extracellulare; comprende: cartilagine, tendini, ligamenti, la matrice dell’osso, il tessuto adiposo (grasso), la cute, il sangue e la linfa. I tessuti maturi possono rimodellare il loro ECM per adattarne la struttura ai carichi meccanici che deve sostenere e che ha sostenuto. MYOFIBROBLASTS AND MECHANO-REGULATION OF CONNECTIVE TISSUE REMODELLING James J.Tomasek, Giulio Gabbiani, Boris Hinz , Christine Chaponnier and Robert A.Brown NATURE REVIEWS | MOLECULAR CELL BIOLOGY VOLUME 3 | MAY 2002 | 349 Quasi tutti i tessuti connettivi sono apparentemente soggetti a qualche tipo di tensione meccanica, anche in condizioni di riposo. Ad eccezione di persone molto anziane o con certi difetti genetici, i connettivi molli non si raggrinzano, nemmeno intorno a muscoli rilasciati o nel sonno. La tensione di riposo che è intrinseca nell’anatomia dei tessuti è resa evidente dal fatto che i vasi e i nervi quando vengono dissezionati assumono una lunghezza del 25-30% minore rispetto a quella che hanno in situ. Lo stabilirsi di questa situazione durante la crescita infantile si spiega se la crescita dei tessuti molli è governata da una “tensione esterna di soglia”. Ne nascono parecchi quesiti: qual è la base cellulare e molecolare di questa omeostasi tensionale dei tessuti? Come si mantiene nell’adulto? E infine come si ripristina nell’adulto durante la riparazione dei tessuti? Un altro esempio di sviluppo di tensione nel tessuto connettivo è rappresentato dalla contrazione delle ferite che si verifica durante la guarigione di una ferita aperta. Molti tessuti sono in tensione meccanica, ma questo non significa che anche le cellule siano in tensione, perché sono protette da carichi esterni relativamente grandi grazie alle proprietà meccaniche della matrice che le circonda. In termini ingegneristici queste cellule sono “schermate dalla tensione” ad opera della matrice che esse sesse producono e rimodellano. Riparazione di ferite normale e patologica La riparazione di ferite cutanee comprende due fenomeni: la riepitelizzazione, cioè la riproduzione e lo spostamento di cellule epidermiche per ricostruire la continuità del tessuto e la formazione ex novo e la contrazione del tessuto di granulazione, fatto di piccoli vasi, fibroblasti, miofibroblasti e diverse quantità di cellule infiammatorie. Quando la riepitelizzazione è completa, si verifica un’importante riduzione di elementi cellulari, soprattutto miofibroblasti, nel tessuto di granulazione, a causa di fenomeni apoptotici, e si forma una cicatrice con poche cellule. In molti casi, per cause non identificate, la cicatrizzazione non ha luogo, nonostante la riepitelizzazione e il tessuto di granulazione si trasforma in una cicatrice ipertrofica (cheloide), che contiene molti miofibroblasti e non produce abbastanza matrice extracellulare. Questo processo si chiama FIBROSI e deforma il parenchima circostante e il tessuto connettivo. La formazione della fibrosi è stata attribuita all’insufficienza di fenomeni apoptotici nella fase finale della guarigione della ferita. Questo schema generale della formazione di fibrosi vale per molti organi dopo diversi tipi di lesione (per es. rene, polmone, fegato e cuore). È ora accertato che il miofibroblasto (un fibroblasto specializzato nella contrazione) gioca un ruolo importante nello stabilire la tensione durante la riparazione di ferite e nella contrattura patologica. Il MIOFIBROBALSTO. Da molto tempo si è ritenuto che la contrazione del tessuto dipendesse da forze generate dalla retrazione del collagene. Molte osservazioni hanno però indicato che le cellule del tessuto di granulazione sono coinvolte nella generazione di forza. È stato dimostrato che molti fibroblasti contengono un’actina SM (smooth muscle), quella dei muscoli lisci vascolari, e che l’espressione di tale molecola e del collagene di tipo I è regolata dal fattore di trasformazione (transforming growth factor, TGF-ß1). Tutto questo dimostra che il miofibroblasto ha un ruolo nella sintesi dell’ECM e nella generazione di forza che riorganizza l’ECM e provoca la retrazione delle ferite. I miofibroblasti sono caratterizzati dalla presenza di un apparato contrattile che contiene fasci di microfilamenti di actina con altre proteine contrattili (miosina non muscolare). Queste fibre terminano sulla superficie cellulare nel fibrobnesso, un complesso di adesione specializzato che lega gli elementi intracellulari a quelli extracellulari. Questo costituisce un sistema di trasduzione meccanica che trasmette le forze generate nella cellula all’ECM e viceversa. I miofibroblasti, come i muscoli lisci vasali, sono direttamente collegati fra di loro attraverso gap junctions e pertanto possono formare unità contrattili multicellulari durante la retrazione del tessuto di granulazione Miofibroblasti nella membrana epiretinica. Ricostruzione tridimensionale mediante microscopia confocale laser di un miofibroblasto differenziato. Colorazione immunoistochimica dell’actina; i colori cambiano in funzione della profondità. I miofibroblasti differenziati mostrano le tipiche “fibre da stress” Ci sono due tipi di miofibroblasti, quelli che non esprimono a-SM actina, che proponiamo di chiamare protomiofibroblasti e quelli che la esprimono, che chiamiamo miofibroblasti differenziati. La differenza è particolarmente evidente in vivo, mentre in vitro sono quasi tutti del primo tipo. I segnali responsabili della formazione di protomiofibroblasti si conoscono poco, ma la tensione meccanica è certamente importante. Un altro fattore importante è il PDGF (platelet derived GF) Il modello a due stadi della differenziazione del miofibroblasto. In vivo, i fibroblasti possono contenere actina sulla membrana ma non presentano fibre da stress e non formano complessi di adesione con l’ECM. Sotto stress meccanico si differenziano in protomioblasti che formano fibre da stress contenenti actina che terminano nel fibronesso. Possono generare forza contrattile. Il TGF-ß1 aumenta l’espressione di fibronectina e in presenza di stress meccanico provoca la trasformazione in miofibroblasti differenziati che aumentano l’espressione di actina e di grossi complessi di adesione. Questo aumenta lo sviluppo di forza e organizza la fibronectina extracellulare in fibrille Non è chiaro se i miofibroblasti e le cellule muscolari lisce (SM) siano tipi cellulari distinti oppure se i primi non siano che un momento di uno spettro di differenziazione continua fra fibroblasto e SM. Tale spettro potrebbe spiegare il processo di vasculogenesi nel quale le cellule SM della media si differenziano da fibroblasti locali, come accade nell’ipertensione polmonare. REGOLAZIONE DELLA CONTRAZIONE DEI MIOFIBROBLASTI I miofibroblasti possono mantenere forza contrattile a lungo. La forza è generata da “stress fibres” contrattili – formate da fasci di microfilamenti di actina associati a miosina non muscolare – ed è regolata dalla fosforilazione della catena leggera della miosina (MLC), analogamente a quando accade nelle cellule SM. Entrano in gioco due sistemi di fosforilazione: MLCK (chinasi calcio dipendente) e il sistema della Rho chinasi. L’aumento del calcio intracellulare attiva la MLCK, provocando una contrazione rapida e breve perché la concentrazione del calcio diminuisce rapidamente e una fosfatasi disattiva la MLCK. Al contrario, l’attivazione della Rho chinasi ha due possibilità di fosforilare la MLC: in modo diretto oppure inattivando la fosfatasi della miosina. Questo provoca contrazioni sostenute Contrattura in lattice di collagene tridimensionale. Il diagramma schematico forza-tempo rappresenta tre fasi di generazione di forza. Le varie fasi si sovrappongono. L’aggiunta di citocalasina D subito dopo il raggiungimento del plateau abolisce completamente la forza, mentre l’aggiunta più tardiva lascia una forza residua, dovuta al rimodellamento (accorciamento) irreversibile della rete collagene, che è tipico della contrattura Modello della fase di rimodellamento della matrice extracellulare nella contrattura. La contrattura della matrice è mediata dai miofibroblasti: la contrazione dei miofibroblasti si trasforma in accorciamento funzionale della matrice collagene. A) i miofibroblasti sono annegati in una rete collagene e si legano alle fibrille mediante complessi di fibronectina legati ai filamenti intracellulari. B) Le fibre da stress si contraggono; l’effetto è locale e si trasmette a poche cellule circostanti. C) si aggiungono nuovi componenti della matrice che stabilizzano la nuova organizzazione del collagene. D) il ciclo si ripete fino a provocare la contrattura Modello del ruolo dei miofibroblasti nella riparazione di una ferita aperta. A) nei tessuti normali i fibroblasti sono sottoposti ad una moderata tensione grazie alla protezione dallo stress esercitata dalla matrice circostante per cui non è stimolata l’organizzazione di un citoscheletro contrattile (area rosa del derma). Quando una ferita del derma a tutto spessore è riempita da un coagulo di fibrina, fattori di crescita locali stimolano i fibroblasti del tessuto adiacente sano ad invadere la matrice provvisoria. Questi fibroblasti emigrati, insieme ai vasi, riempiono la ferita formando tessuto di granulazione. A questo punto, i fibroblasti sono già stimolati a produrre fibronectina. B) I fibroblasti esercitano forze di trazione sulla matrice collagene, che viene riorganizzata secondo linee di forza. Lo sviluppo di stress meccanico stimola i fibroblasti a sviluppare fibre di stress e così acquisiscono le caratteristiche di proto-miofibroblasti. La tensione e i fattori di crescita stimolano i proto-miofibroblasti a secernere il TGFb1 e aumenta la fibronectina. In uno schema a feedback i protomiofibroblasti diventano miofibroblasti differenziati sintetizzando actina aumentando la forza contrattile. Queste cellule differenziate depositano collagene e altri componenti dell’ECM e producono proteasi. Questo complicato processo di rimodellamento porta ad un accorciamento della matrice collagene e alla chiusura della ferita. D) Quando una ferita che guarisce normalmente si chiude i miofibroblasti vanno incontro ad apoptosi e spariscono. E) In molte situazioni patologiche invece, come nella formazione di cicatrici ipertrofiche, i miofibroblasti persistono e continuano a rimodellare l’ECM con progressiva contrattura del connettivo. In conclusione, i miofibroblasti non sono affatto cellule “cattive”, ma la loro cattiva regolazione provoca disfunzioni tissutali. Remodelling of continuously distributed collagen fibres in soft connective tissues N.J.B. Driessen, G.W.M. Peters, J.M. Huyghe, C.V.C. Bouten, F.P.T. Baaijens Journal of Biomechanics 36 (2003) 1151–1158 Stimoli biochimici e biomeccanici provocano il rimodellamento della matrice extracellulare nei tessuti connettivi molli, che modificano la morfologia e il comportamento meccanico del tessuto stimolato: questo gioca un ruolo cruciale nell’ingegneria tissutale di strutture che sopportano carichi, come le cartilagini e le valvole cardiache. Il turnover delle fibre collagene è il risultato netto di sintesi e riassorbimento, con un riallineamento della direzione delle fibre, secondo la teoria della fusione dei polimeri. La resistenza alla deformazione è adattata tramite la riorganizzazione della matrice extracellulare, nella quale sono importanti sia il riallineamento di fibre collagene preesistenti sia il turnover delle fibre. Articolo di bioingegneria troppo difficile, ma utile per alcuni concetti di base Acute exercise induced changes in rat skeletal muscle mRNAs and proteins regulating type IV collagen content S. O. A. KOSKINEN, W. WANG, A. M. AHTIKOSKI, M. KJÆR, X. Y. HAN, J. KOMULAINEN, V. KOVANEN, AND T. E. S. TAKALA Am J Physiol Regulatory Integrative Comp Physiol 280: R1292–R1300, 2001. Il collagene di tipo IV è il componente principale delle membrane basali e probabilmente svolge un ruolo critico nella sistemazione delle cellule all’interno di un tessuto, per es. assicurando stabilità meccanica nelle fibre muscolari scheletriche, benché sia soltanto una minima frazione della matrice extracellulare. È stato dimostrato nei ratti che un allenamento di endurance protratto per tutta la vita aumenta il contenuto del collagene IV nel muscolo scheletrico e che il suo mRNA aumenta rapidamente dopo un episodio acuto di esercizio strenuo. Non è noto però quali siano i meccanismi e se un singolo episodio di esercizio strenuo modifichi la degradazione e la concentrazione del collagene IV. La degradazione proteolitica di specifici componenti del’ECM che ha luogo sia in processi fisiologici sia patologici è attivata da proteasi zinco-dipendenti chiamate metallo proteinasi (MMP). Le MMP-2 e -9 distruggono il connettivo IV. L’attività delle MMP è regolata in modo complesso dalla separazione enzimatica di proMMP e dall’inibizione da parte di inibitori tissutali delle MMP, chiamati TIMPs. Esperimento: i ratti correvano su treadmill con inclinazione negativa a 17m/min per 130 min: questo modello di esercizio provoca danno muscolare. Attività glucuronidasica misurata come indice di danno muscolare Table 1. Glucuronidase activity in heavily exercised rat muscles Soleus Red MQF White MQF Control 1.72±0.16 1.91±0.14 1.66±0.11 6h 1.76±0.11 1.80±0.10 1.95±0.12 1day 1.79±0.13 2.33±0.10 1.82±0.10 2day 2.00±0.14* 3.53±0.21‡ 2.27±0.13† 4day 2.22±0.29 5.24±1.47† 2.81±0.32* 7day 2.23±0.29 4.16±0.31‡ 3.76±0.50* Values are means ± SE. Glucuronidase activity, an indicator for muscle damage, in soleus, the deep red portion of quadriceps femoris (Red MQF) and the superficial white portion of quadriceps femoris (White MQF) was determined up to 7 days after exhaustive downhill running. The activities are expressed as mol.s-1.kg-1 protein. *P ,< 0.05. †P < 0.01; ‡P < 0.001 vs. control. I risultati mostrano che la sintesi del collagene IV delle membrane basali si modifica sia a livello di mRNA si a livello delle proteine in seguito a danno muscolare indotto dall’esercizio. Il collagene fibrillare di I e III tipo è alterato solo a livello pretranslazionale. La MMP-2 che degrada il collagene IV aumenta soprattutto nella parte rossa del quadricipite, dove il danno cellulare è maggiore. Abbiamo anche dimostrato che l’espressione delle TIMP-1 e TIMP-2, le proteine che inibiscono la degradazione dell’ECM aumenta in momenti diversi del processo di degenerazione e rigenerazione del muscolo danneggiato. TRANSLATIONAL PHYSIOLOGY The history of matrix metalloproteinases: milestones, myths, and misperceptions Rugmani Padmanabhan Iyer, Nicolle L. Patterson, Gregg B. Fields, and Merry L. Lindsey Am J Physiol Heart Circ Physiol 303: H919–H930, 2012. La famiglia delle MMP comprende ora 25 membri, non tutti presenti nell’uomo. Sono stati identificati 5 sottogruppi: collagenasi, gelatinasi, matrilisine, stromolisine e MMP di membrana. Per essere classificato come MMP un enzima deve avere i seguenti requisiti: 1) proteolisi di almeno un componente dell’ECM; 2) il sito attivo dipende dallo zinco; 3) attivazione da parte di proteinasi o organomercuriali; 4) inibizione da parte dell’acido etilen diamino tetra acetico, 1,10 fenantotriolina e una TIMP (inibitore tissutale delle MMP); 5) la sequenza del cDNA omologa alla MMP-1. Substrati. Non è vero che le MMP degradano solo le proteine dell’ECM: la loro azione sulle proteine superficiali delle membrane cellulari è un meccanismo importante per la regolazione delle attività delle cellule. La proteolisi può stimolare o inattivare particolari segnali intracellulari, come quelli che provocano apoptosi o autofagia. Attivazione: non è vero che le MMP si attivino solo nell’ambiente extracellulare. L’attivazione di proenzimi MMP avviene certamente fuori dalle cellule: plasmina, eparina e ossidanti attivano MMP e molte MMP ne attivano altre. Vi sono però eccezioni e molti enzimi possono essere attivati all’interno delle cellule. Le TIMPs: non servono solo per inibire le MMP, ma attivano anche fattori di accrescimento, stimolano i fibroblasti e la loro differenziazione in miofibroblasti. Table 6. MMP and TIMP cell expression (known cardiovascular cell expression) MMP Additional Names Cell Expression -1 -2 -3 -7 -8 -9 Collagenase-1; fibroblast collagenase Gelatinase A; 72-kDa type IV collagenase Stromelysin-1 Matrilysin Collagenase-2; neutrophil collagenase Gelatinase B; 92-kDa type IV collagenase -10 -11 -12 -13 -14 -15 -16 -17 -18 -19 -20 -23 -24 -25 -26 -27 -28 TIMP-1 Stromelysin-2 Stromelysin-3 Macrophage elastase Collagenase-3 MT1-MMP MT2-MMP MT3-MMP MT4-MMP Xenopus laevis collagenase-4 RASI-1 Enamelysin CA-MMP MT5-MMP MT6-MMP Matrilysin-2 CMMP/MMP-22 Epilysin Collagenase inhibitor Endothelial, fibroblasts, macrophages Endothelial, fibroblasts, platelets, T lymphocytes Endothelial, fibroblasts, macrophages, vascular smooth muscle Macrophages Neutrophils, endothelial, fibroblasts Neutrophils, endothelial, eosinophils, macrophages, T lymphocytes Fibroblasts, T lymphocytes Fibroblasts Macrophages, stromal cells Fibroblasts Fibroblasts, macrophages Fibroblasts, macrophages Fibroblasts, macrophages, vascular smooth muscle Eosinophils, lymphocytes, monocytes Xenopus expression only Vascular smooth muscle, endothelial, monocytes Endothelial Unknown Unknown Neutrophils, monocytes B lymphocytes Fibroblasts Cardiomyocytes, macropahges, T lymphocytes Leukocytes, fibroblasts, mesenchymal stem cells, vascular smooth muscle Fibroblasts, macrophages, vascular smooth muscle Fibroblasts, pericytes Cardiomyocytes, lymphocytes, macrophages, mast cells, vascular smooth muscle TIMP-2 TIMP-3 TIMP-4 Note that the absence of a cell in the list means either that the MMP is not expressed by that cell type or MMP expression in that cell type has not been studied Eventuali usi terapeutici: l’idea che tutte le MMP abbiano funzioni negative è sbagliata e quindi non è detto che tutte le MMP debbano essere comunque bloccate se possibile. Sono state provate molte TIMP e piccole molecole sintetiche per bloccare le MMP nel cancro, nell’artrite e nelle malattie cardiovascolari, ma con scarso successo, per varie ragioni. È necessario chiarire il ruolo delle MMP nella progressione delle malattie cardiovascolari: quando e dove sono espresse MMP e TIMP, con che sequenza temporale. I diversi tipi di cellula vanno e vengono e le cellule si differenziano nel tempo e tutto questo cambia l’espressione di MMP e TIMP. Per esempio, i fibroblasti stimolati con il fattore di crescita derivato dalle piastrine (PDGF) esprimono MMP -1, -2, -3, -11, -14 e TIMP-1 e-2 ma non MMP9. Ma se il fibroblasto si differenzia in miofibroblasto, allora produce MMP-9 in risposta al PDGF. From mechanical loading to collagen synthesis, structural changes and function in human tendon M. Kjær, H. Langberg, K. Heinemeier, M. L. Bayer, M. Hansen, L. Holm, S. Doessing, M. Kongsgaard, M. R. Krogsgaard, S. P. Magnusson Scand J Med Sci Sports 2009: 19: 500–510 doi: 10.1111/j.1600-0838.2009.00986.x Dati recenti nell’uomo indicano che il tessuto tendineo risponde con variazioni del metabolismo al carico tensile. Il tessuto tendineo è soggetto a carico tensile ed è costituito soprattutto da molecole di collagene fibrillare (tipo I e III). Il collagene è prodotto dai fibroblasti tendinei, che sono sistemati in parallelo lungo la direzione principale del tendine; le cellule hanno una forma allungata, con nuclei appiattiti e allungati e protrusioni citoplasmatiche di actina. I fibroblasti tendinei interagiscono con l’ECM con accoppiamenti cellula-matrice e costituiscono una rete cellulare lungo tutto il tendine. Metodo per la quantificazione della produzione di collagene: Il procollagene appena sintetizzato è idrossilato al residuo prolinico (idrossiprolina) prima di essere assemblato nella struttura a triplice elica e questa proteina può essere marcata (con isotopi). La sua misura rispecchia fedelmente la neosintesi di collagene. Con questo metodo, si è visto che l’esercizio aumenta la sintesi di collagene nel tendine patellare da 0.05% a 0.10% in 24 ore e la sintesi è già aumentata 6 ore dopo l’esercizio. La sintesi di collagene rimane aumentata per 2-3 giorni: l’aumento è uniforme e relativamente indipendente dall’intensità dell’esercizio. Il carico meccanico induce un nuovo livello di sintesi del collagene, con una specie di interruttore (on/off) rispetto alla necessità di carico meccanico per ottimizzare la sintesi di collagene. La risposta di sintesi del collagene è generata sia da un singolo carico sia da un carico prolungato Il fibroblasto tendineo è il protagonista del mantenimento del tendine, dell’adattamento omeostatico e del rimodellamento. Dopo la nascita, il fibroblasto tendineo è la cellula meccanosensibile del tessuto. Le fibre collagene sono allineate in un ben organizzato ordine parallelo nel tendine, così pure le fibre di actina nella cellula. In campioni di tendine lesionato, i filamenti di actina perdono la distribuzione ordinata. Fibroblasti tendinei in coltura mostrano un denso citoscheletro di actina con i filamenti in parallelo, che si disorganizzano se le cellule vengono separate (trattamento con tripsina). Rimessi in coltura, i fibroblasti (arrotondati) aderiscono al fondo e ricostruiscono la loro struttura filamentosa con lunghe protrusioni citoplasmatiche di actina che interagiscono fra cellule adiacenti. Si trovano giunzioni aderenti e con fessura (gap). Giunzioni aderenti e siti di adesione mediati da caderina e catenina. Le molecole di caderina sono proteine transmembrana che si legano con la porzione extracellulare ad analoghe molecole nelle cellule adiacenti. Il Ca2+ lega le giunzioni fra cellule formando un bastoncello rigido che stabilizza il sito di adesione. Dal lato intracellulare le caderine si legano allo scheletro di actina mediante catenina –a e –b. Morfologia cellulare e localizzazione di caderina nei fibroblasti tendinei dopo il distacco. (a-c) cellule in sospensione: morfologia cellulare arrotondata con colorazione della caderina sparsa. (d-f) 1h dopo inseminazione: morfologia cellulare circolare e colorazione per la caderina perinucleare. (g-e) 2h dopo inseminazione: i fibroblasti tendinei cominciano ad appiattirsi e a formare lamellopodi. (a), (d), (g): colorazione alla falloidina; (b), (e), (h): il verde corrisponde alla caderina; (c), (f), (i): immagini fuse al computer delle due precedenti; il blu corrisponde ai nuclei Morfologia cellulare e formazione di giunzioni aderenti in fibroblasti tendinei distaccati. (a-c) 4 ore dopo inseminazione: fibroblasti tendinei con lamellipodi in espansione colorazione di caderina perinucleare e sulla membrana plasmatica. (d-f) 8 ore dopo inseminazione: fibroblasti con chiari filamenti di actina e formazione di giunzioni aderenti (formazioni a pettine). La localizzazione perinucleare è assente. (g-e) 24 ore dopo inseminazione: fibroblasti con chiari filamenti di actina e giunzioni aderenti con il tipico aspetto a pettine. Non c’è localizzazione perinucleare. (a), (d), (g): colorazione alla falloidina; (b), (e), (h): il verde corrisponde alla caderina; (c), (f), (i): immagini fuse al computer delle due precedenti; il blu corrisponde ai nuclei Al contrario delle giunzioni aderenti (e strette) quelle con fessura (gap) non sigillano le membrane di cellule adiacenti ma formano canali che permettono lo scambio di piccole molecole, rendendo possibile una comunicazione attiva nella rete intercellulare. I fibroblasti tendinei esprimono le connessine 32 e 43, che sono colocalizzate con l’actina. I tendini sono esposti a tensione meccanica ed è chiaro che la colocalizzazione actina-connessina è alterata dal carico meccanico. C’è pertanto un elevato turnover delle proteine giunzionali o un aumento delle gap junctions fra i fibroblasti tendinei sottoposti a tensione, o un aumentato fabbisogno di stabilità alle giunzioni fra cellule o tutto questo insieme. Il blocco delle gap junctions riduce la produzione di collagene II e quindi esse giocano un ruolo indispensabile nel mantenimento delle funzioni cellulari del tendine. La cellula crea un legame fra recettori cellulari e ligandi dell’ECM e il citoscheletro di actina e produce effetti adeguati attivando effettori a valle. Ruolo dei fattori di crescita negli adattamenti tendinei al carico. Un problema sull’aumento del turnover del collagene è capire come il tendine senta il carico esterno durante la contrazione muscolare e più specificamente quali fattori siano coinvolti nella regolazione. Il primo esempio è una differenza di genere perché le femmine rispondono meno dei maschi nell’aumentare la sintesi di collagene dopo l’esercizio: l’estradiolo può essere responsabile di questa differenza. Un importante fattore di regolazione della sintesi del collagene è l’asse ormone della crescita (GH) fattore della crescita simile all’insulina (insuline like growth factor IGF), il cui effetto è confermato da studi in vitro, per esempio la somministrazione di IGF nel coniglio accelera la sintesi proteica nei tendini e accelera la riparazione di lesioni tendinee. L’induzione dell’espressione di collagene in risposta ad un aumento del carico si verifica in molte cellule e tessuti e sembra dipendere dall’espressione/secrezione di fattori di crescita del collagene indotta meccanicamente: questi fattori agiscono in maniera endocrina/paracrina sulla produzione proteica dell’ECM. Molti fattori di crescita che stimolano la sintesi del collagene sono espressi in risposta al carico meccanico: transforming growth factor-b-1 (TGF-b-1), connective tissue growth factor (CTGF) e IGF-I. L’espressione di mRNA del collagene I e III segue uno schema molto simile a quello del TGFb-1 e IGF-I nel tendine e nel muscolo. Tenendo conto degli effetti del carico su tendini e muscoli è importante considerare se l’assenza di carico abbia effetti opposti. Abbiamo misurato la massa e l’espressione di mRNA per la sintesi del collagene e di fattori di crescita nel tendine di Achille e nel soleo dopo 7 e 14 giorni di sospensione di una gamba. La massa del soleo diminuiva del 50% dopo 14 giorni, mentre quella del tendine non si modificava, confermando altre osservazioni nell’uomo e in altri animali. Evidentemente gli effetti dello scarico non sono l’opposto di quelli del carico. L’espressione di collagene I e III, TGF-b-1 e CTGF non cambiava ne’ nel muscolo ne’ nel tendine, anzi in quest’ultimo aumentava il IGF-I Danni e riparazione del tendine. Danni da uso eccessivo dei tendini sono frequenti e debilitanti sia in atleti professionisti e amatoriali sia in particolari condizioni lavorative. Dolore durante l’uso, gonfiore e riduzione della forza e della mobilità caratterizzano la tendinopatia. L’iniziale attribuzione della condizione ad uno stato infiammatorio è stata smentita, mentre si descrive un’alterazione degenerativa con rimodellamento della matrice collagene, aumento delle cellule e della concentrazione di protoeglicani, senza infiltrazione di cellule infiammatorie. Le fibrille, che sopportano i carichi, hanno una forma e una distribuzione normali nella patologia da super uso e quindi il problema sta fra le fibrille; è stata dimostrata neoformazione di vasi e aumento delle terminazioni nervose. Si è dimostrato efficace il trattamento con allenamenti eccentrici ad elevato carico. I meccanismi sembrano legati alla stimolazione di neoformazione di materiale collagene. Conoscere meglio la risposta al carico del collagene tendineo nell’uomo è importante per dare le giuste raccomandazioni nei programmi di allenamento per massimizzare l’effetto senza sovraccaricare i tendini. È anche importante per comprendere gli effetti a lungo termine dell’allenamento cronico. Bisogna aggiungere lo studio di altre proteine e strutture della matrice per spiegare la conversione delle modificazioni biochimiche del tendine in adattamenti strutturali e funzionali.
Scaricare