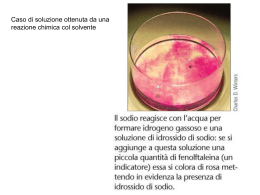
Caso di soluzione ottenuta da una reazione chimica col solvente Solubilizzazione di un composto ionico ad opera dell’acqua La variazione di energia si chiama DHdissoluzione Alcuni solidi si sciolgono in liquidi con processo endotermico altri con processo esotermico . L’etichetta su una bottiglia di acido cloridrico concentrato LE SOLUZIONI Sono miscele omogenee di due o più sostanze Sostanze che compongono la soluzione Componente presente in maggiore quantità Ogni altro componente Componenti Solvente Soluto Le proprietà delle soluzioni non dipendono dalle quantità assolute di ciascun componente quanto dai rapporti tra le quantità dei vari componenti ovvero dalle quantità relative dei vari componenti → le concentrazioni Metodi misura della concentrazione in soluzioni ideali Percentuale in massa (m%). La quantita' di soluto e' espressa in unita' di massa (ad esempio g) ed e' rapportata in percentuale alla massa della soluzione espressa nelle stesse unita' di misura: m (%) = msoluto/msoluzione x100 Quindi m(%) rappresenta grammi di soluto per 100 grammi di soluzione Metodi misura della concentrazione Percentuale in volume La quantita' di soluto e' espressa in unita' di volume (ad esempio l) ed e' rapportata in percentuale al volume della soluzione espressa nelle stesse unita' di misura V(%)=Vsoluto/Vsooluzione x100 Poco usato perché i volumi spesso non sono additivi Le percentuali Indica la composizione percentuale dei vari componenti la soluzione. Percentuale in moli : moli di soluto in 100 moli totali Percentuale in peso (% P/P) : grammi di soluto in 100 grammi totali Percentuale in peso di soluto per volume di soluzione (% P/V): grammi di soluto in 100 ml totali Percentuale in peso rispetto al solvente : grammi di soluto in 100 g di solvente puro Percentuale in volume (%V/V): volume di soluto in 100 volumi di soluzione Metodi misura della concentrazione Frazione molare (c) La quantita' di soluto e' espressa in moli ed e' rapportata alla quantita' di soluzione espressa come somma delle moli di tutti i componenti: c=nsoluto/ntotali Quindi la frazione molare c rappresenta il numero di moli di soluto che corrisponde ad 1 mole di soluzione. Metodi misura della concentrazione Molarita' (M) La quantita' di soluto e' espressa in moli ed e' rapportata alla quantita' di soluzione, espressa in litri: M= n/V(l) con n= numero di moli V= volume in l Quindi la molarita' rappresenta il numero di moli di soluto presenti in 1l di soluzione Metodi misura della concentrazione Molalita' (m ) La quantita' di soluto e' espressa in moli ed e' rapportata alla quantita' di solvente (non soluzione) espressa in kg : m= n/msolvente(kg) Quindi la molalita' rappresenta il numero di moli di soluto presenti in 1kg di solvente + utile della M quando la temperatura della soluzione varia Metodi misura della concentrazione • Parti per milione ppm= parti soluto/106parti soluzione • Parti per miliardo ppb= parti soluto/109 parti soluzione Le parti possono essere espresse in massa o in volume Metodi misura della concentrazione Normalità (N) N= neq/V (l) esprime il numero di equivalenti di soluto per litro di soluzione. Gli equivalenti sono le quantità di sostanza che hanno la stessa capacità di combinazione nelle reazioni chimiche. La normalità dipende dal tipo di reazione cui il soluto prende parte. EQUIVALENTI Peso equivalente: di una sostanza la sua quantità in grammi che reagisce completamente con 1 g di idrogeno o con 8 g di ossigeno. Si definisce equivalente o grammoequivalente di una sostanza la quantità in grammi corrispondente al peso equivalente. Gli equivalenti o sono quantità in grammi delle diverse sostanze che reagiscono completamente tra loro. Gli equivalenti reagiscono e si formano sempre in rapporto unitario (1 : 1). Un composto può entrare in reazioni diverse con rapporti stechiometrici diversi, il peso equivalente non può essere dedotto a priori ma solo considerando il composto nel contesto della reazione a cui partecipa o per la quale deve essere usato. Per un elettrolita (acido, base, sale) il numero di equivalenza z è uguale al numero di equivalenti del suo anione o del suo catione P.E. = neq (eq) = P.M. z m (g) = z (eq) • n (mol) PE (g/eq) Per un catione o un anione il numero di equivalenza z coincide con la sua carica. z è uguale al numero di elettroni ceduti o acquistati da una sostanza durante una reazione redox Esempio Calcolare il peso equivalente dei seguenti acidi o basi: a) perclorico; b) solforico; c) idrossido di zinco a) HClO4 → monovalente quindi z = 1 eq/mol P.E. = P.M./z = 100.46 (g/mol)/ 1(eq/mol) = 100.46 g/eq b) H2SO4 → divalente quindi z = 2 eq/mol P.E. = P.M./z = 98.08 (g/mol)/ 2(eq/mol) = 49.04 g/eq c) Zn(OH)2 → divalente quindi z = 2 eq/mol P.E. = P.M./z = 99.41 (g/mol)/ 2(eq/mol) = 49.71 g/eq Reazione di neutralizzazione. Il peso equivalente è il peso in grammi di sostanza che cede una mole di H+ se si tratta di un acido o acquista una mole di H+ se si tratta di una base. P.E.=P.M.\n° moli H+ scambiati Reazione di ossidoriduzione. Il peso equivalente è il peso in grammi di sostanza che acquista o cede una mole di elettroni. P.E.=P.M.\n° moli e- Esempio Calcolare il peso equivalente di KMnO4 nella semireazione di riduzione in ambiente acido. Determinare, inoltre la normalità di una soluzione che contiene 0.02 moli di KMnO4 in un litro. MnO4- + 8H+ + 5e- → Mn2+ + 4H2O PE (KMnO4) = PM / 5 = 158 /5 = 31.6 g/eq Poiché 0.02 moli su 1 l → 0.02 M N = z M = 5 • 0.02 = 0.1 tabella sali minerali disciolti nell'acqua marina elemento Cloro Sodio Magnesio Zolfo Calcio Potassio Bromo Carbonio Stronzio Boro Silicio Fluoro Argo Azoto Litio Rubidio Fosforo Iodio Bario Indio Zinco Ferro Alluminio Molibdeno Selenio Stagno Rame Arsenico Uranio mg/litro elemento mg/litro 18.980 10.540 1.350 885 400 380 65 28 8 4,6 3 1,3 0,6 0,5 0,17 0,12 0,07 0,06 0,03 0,02 0,01 0,01 0,01 0,01 0,004 0,003 0,003 0,003 0,003 Nichel Vanadio Manganese Titanio Antimonio Cobalto Cesio Cerio Ittrio Argento Lantanio Cripto Neon Cadmio Tungsteno Xeno Germanio Cromo Torio Scandio Piombo Mercurio Gallio Bismuto Niobio Tallio Elio Oro 0,002 0,002 0,002 0,001 0,0005 0,0005 0,0005 0,0004 0,0003 0,0003 0,0003 0,0003 0,0001 0,0001 0,0001 0,0001 0,00007 0,00005 0,00005 0,00004 0,00003 0,00003 0,00003 0,00002 0,00001 0,00001 0,000005 0,000004 Attività Il concetto di attività viene inteso come la concentrazione con la quale le specie prendono effettivamente parte ad un processo L'attività è in relazione con la concentrazione analitica C (per i gas la pressione parziale p) tramite l'equazione a = f*C (a = f*p, per i gas), dove a è l’attività della specie in esame a concentrazione C (o pressione parziale p) e f, detto coefficiente di attività, è un fattore correttivo adimensionale con valori compresi tra 0 e 1. Per concentrazioni < 10-3 esso tende a 1; per concentrazioni > 10-3 esso tende a zero quanto più la soluzione è concentrata: esso quindi è una misura della non idealità del componente in esame Responsabile di questo fenomeno nel caso di ioni è l’attrazione elettrostatica tra due ioni in soluzione concentrata nella quale gli ioni reagiscono elettrostaticamente in modo rilevante LE DILUIZIONI Soluzione a concentrazione nota → soluzione a concentrazione minore Soluzione1 a concentrazione M1, volume V1 → soluzione2 a concentrazione M2 (M2 < M1) e V2, tra le due soluzioni esiste la relazione: V1M1 = V2M2 La molarità M di una soluzione di densità d (g/ml) in cui m% è la percentuale in peso del generico soluto B di peso molare PMB si ricava dalla seguente relazione: M= m% • d PMB • 10 Preparazione di un litro di CuSO4 per diluizione Solubiltà = massima concentrazione di soluto ottenibile a una certa T o concentrazione della soluzione in presenza di un corpo di fondo DHsoluzione.= Eret+ DHsolvatazione Queste due energie dipendono dalla carica e dalle dimensioni degli ioni dove Eret energia che occorre fornire per allontanare gli ioni del reticolo a distanza infinita Se Eret> DHsolvatazione processo endotermico Se Eret < DHsolvatazione processo esotermico La dissoluzione di solidi contenenti ioni a carica elevata (es. AlF3, Cr2O3) è troppo endotermica (elevata Ereticolare) perché tali solidi possano essere molto solubili in acqua. Zucchero candito Effetto dell’aumento di temperatura sulla solubilità di alcuni sali Solubilità dell’ossigeno Legge di Henry Pgas= k Cgas Dove P è la pressione parziale del gas e C la concentrazione del gas disciolto nel liquido. Valida per gas che non interagiscono col solvente Tensione di vapore della solzione se il soluto è poco volatile pari a quello del solvente in soluzione Psolv.= csolvP°solv Legge di Raoult Pi= ciP°i Dimostrazione abbassamento tensione di vapore Soluzioni ideali a due componenti (volatili) P = PA + PB (legge di Dalton) PA = cA P°A; PB = cB P°B (legge di Raoult) P = cA P°A + cB P°B Soluzione ideale: le forze attrattive A-B devono essere simili alle forze attrattive A-A e B-B (es. benzene-toluene) Soluzioni non ideali con deviazioni positive Le forze attrattive A-B sono più deboli delle forze attrattive A-A e B-B (Teb più bassa; es. acqua-etanolo; etanolo-benzene) Processo endotermico Soluzioni non ideali con deviazioni negative Le forze attrattive A-B sono più forti delle forze attrattive A-A e B-B [Teb più alta; es. acqua-acido (legami idrogeno); acetonecloroformio] Processo esotermico Soluzioni reali diluite si avvicinano al comportamento ideale DISTILLAZIONE “Liquidi diversi hanno punti di ebollizione diversi” Distillazione Semplice -per liquidi con grandi ΔTeboll. Distillazione Frazionata -per liquidi con piccole ΔTeboll. Distillazioni in corrente di vapore: permettono di separare da solventi acquosi e organici liquidi a basso punto di ebollizione, che sono difficilmente isolabili in altro modo. ES. Olii essenziali di piante (essenza di menta, limone, basilico, ecc.) Distillazione (miscele ideali) l+v vapore Teb(toluene): 110,6°C Teb(benzene): 80,1°C liquido 0,45 0,73 1. La miscela o soluzione liquida è bollita per vaporizzare i componenti più volatili nella miscela. 2. Il vapore è raffreddato da acqua fredda nel condensatore in modo da liquefarlo e raccoglierlo in un recipiente. La distillazione semplice non è un procedimento efficace in quanto è necessario sottoporre una miscela a più distillazioni successive per ottenere un distillato che comunque conterrà una parte del liquido con cui era miscelato Distillazione frazionata La distillazione frazionata comprende 2 stadi principali, entrambi sono cambiamenti di stato fisico. Questa distillazione si applica a liquidi con differenti punti di ebollizione •La miscela o soluzione liquida è bollita per vaporizzare i componenti più volatili nella miscela (transizione liquido gas). I granuli solidi che sono depositati sul fondo, unitamente ad un'attenta regolazione del flusso di calore riscaldante, favoriscono un'ebollizione omogenea. Infatti, un'ebollizione tumultuosa può favorire la presenza nel "cuore" di componenti altobollenti che trascinati dai vapori caldi. •Il vapore sale attraverso una colonna di frazionamento, dove avviene la separazione. Questa colonna non è usata nella distillazione semplice descritta in precedenza. •Il vapore distillato è raffreddato da acqua fredda nel condensatore (transizione vapore liquido) e ritorna in fase liquida che gocciola nel recipiente di raccolta. Alla fine: benzene quasi puro come distillato e toluene quasi puro come residuo Principio di funzionamento di una colonna di distillazione e piatti. La miscela liquida da distillare (A + B), il cui comportamento è supposto quasi ideale, viene riscaldata alla temperatura di ebollizione ed il vapore sale passando attraverso dei piatti muniti di fori a valvola (in modo da permettere solo l'ingresso). La temperatura del vapore va diminuendo dal basso verso l'alto, ed è regolata in modo da raggiungere (all'altezza dell'ultimo piatto) un valore prossimo alla temperatura di condensazione del componente più volatile. Lungo il percorso, una parte del vapore condensa raccogliendosi nei piatti e quando in un piatto il livello del liquido raggiunge l'altezza dello sfioratore, il liquido trabocca nel piatto sottostante e così via. Nel corso del processo, quindi, si ha una corrente di vapore che sale, riscaldando i successivi strati di liquido contenuti nei piatti cha attraversa; in questo modo, il vapore si arricchisce del componente più volatile, A. Contemporaneamente, si ha un flusso di liquido che scende e diventa sempre più ricco del componente meno volatile, B. Distillazione frazionata petrolio Distillazione (miscele non ideali) Raoult: dev. negative Raoult: dev. positive Da sinistra: etanolo quasi puro come residuo e azeotropo come distillato Da destra: benzene quasi puro come residuo e azeotropo come distillato Da sinistra: cloroformio quasi puro come distillato e azeotropo come residuo Da destra: acetone quasi puro come distillato e azeotropo come residuo Nei fermentatori non si può ottenere etanolo puro da soluzioni acquose, perché l’etanolo forma con l’acqua un azeotropo minimobollente al 95% in etanolo. Le curve di riscaldamento e di raffreddamento dell’acqua pura e di una soluzione acquosa (verde) Abbassamento crioscopico e innalzamento ebullioscopico di una soluzione DTc= Kc m DTe=Ke m Pressione osmotica pV= nRT Effetto dell’osmosi sui cetrioli e le prugne Dispersioni colloidali Fase disperdente (simile a un solvente) Fase dispersa (simile a un soluto) Il colloide è la fase dispersa (= 1-1000 nm). Sistemi intermedi fra le soluzioni (omogenee) e le sospensioni (particelle separabili meccanicamente) Le particelle colloidali presentano un’elevata area superficiale e presentano, solitamente, un’elevata carica. La presenza di cariche dello stesso segno sulla superficie delle particelle fa’ si che queste si respingano fra loro e ne impedisce l’aggregazione e quindi la precipitazione. L’aggiunta di elettroliti ne facilita l’aggregazione e la precipitazione (coagulazione o flocculazione). moto browniano: osservando all'ultramicroscopio una soluzione colloidale, si nota che le particelle in essa disperse si muovono continuamente a "zig-zag". Questo movimento è dovuto alle continue collisioni con le molecole circostanti del mezzo disperdente: poiché la risultante di questi urti può essere non nulla ed orientata in una qualsiasi direzione, le particelle disperse si muovono ora da una parte ora dall'altra, del tutto a caso. Colloidi idrofili: affinità tra le particelle disperse e la fase disperdente (acqua). Presenza di gruppi polari come –OH, –NH2, =CO che possono interagire con il mezzo disperdente (es. ione-dipolo, legame idrogeno) e stabilizzare il colloide. Es. gelatine, budini, proteine, amido. Colloidi idrofobi: scarsa affinità tra le particelle disperse e la fase disperdente (acqua). Stabilità dovuta alle repulsioni tra le particelle o con la fase disperdente. Es. dispersioni di grassi in acqua (latte) o di acqua nei grassi (maionese). Il riscaldamento, aumentando la velocità e la frequenza degli urti fra le particelle, può favorire l’aggregazione. sol (es., sali poco solubili dispersi in acqua): dispersione in forma liquida gel (es., idrossidi di Fe e Al, gelatina di brodo, gel di silice): si forma una struttura rigida in cui viene catturata la fase disperdente. gel T sol (non vale per l’albume dell’uovo, irreversibile) Aumentando la concentrazione delle particelle, un sol può passare allo stato di gel: una dispersione finissima di particelle solide che ha una consistenza gelatinosa. Al contrario, diluendo un gel si può tornare ad un sol. Quindi, ciò che differenzia un sol da un gel è la sua consistenza rispettivamente fluida o gelatinosa Tecniche di separazione dalla fase disperdente: ultrafiltrazione, ultracentrifugazione Le particelle disperse hanno dimensioni simili a quella della lunghezza d’onda della luce, quindi sono in grado di diffondere la luce (effetto Tyndall) quando un raggio luminoso investe una soluzione, la attraversa direttamente: notare il puntino rosso del laser che colpisce lo schermo e la traccia del laser (per diffusione trasversale) nella soluzione. quando un raggio luminoso investe una dispersione, la luce viene diffusa in tutte le direzioni: notare che il puntino rosso del laser non colpisce lo schermo
Scarica