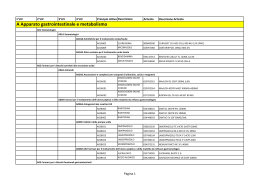
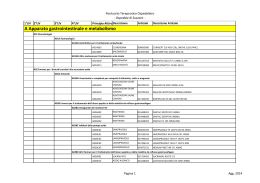
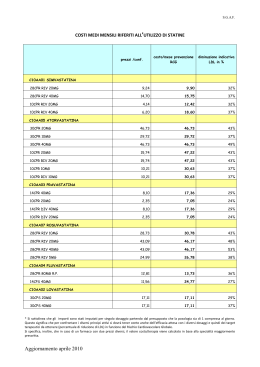
02/.45!2 )/ 4% 2!0% 54)#/ !: ) % . $%3!. )4!2 ) %02/6) .#)!$)"/,/' .! 5SOOSPEDALIEROECONTINUITÌ ASSISTENZIALEOSPEDALETERRITORIO EDIZIONE,5' ,)/ !ZIENDE 3ANITARIE DI "OLOGNA ,INTEROPRONTUARIOÒ3#!2)#!"),% DAISITIINTRANETAZIENDALI S OM M A R IO pag. Introduzione Presentazione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Composizione della CPF . . . . . . . . . . . . . . . . . . . . . . 4 Metodologia di lavoro . . . . . . . . . . . . . . . . . . . . . . . . . 5 Premessa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 Indice per ATC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 PRONTUARIO TERAPEUTICO . . . . . . . . . . . . . 23 Indice per principio attivo . . . . . . . . . . . . . . . . . . 147 Indice per nome commerciale del farmaco . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 169 Allegati al PTP Regolamento . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 187 Richiesta inserimento farmaci CPF . . . . . . . . . . . . . . 204 Procedura sulla prescrizione di farmaci. . . . . . . . . . . 207 Note AIFA 2006-2007 . . . . . . . . . . . . . . . . . . . . . . . 215 Premessa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 217 Le Note AIFA 2006 -2007 . . . . . . . . . . . . . . . . . . . . . 220 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 1 PRESENTAZIONE PRESENTAZIONE La Commisione Provinciale del Farmaco (CPF) che coinvolge le quattro Aziende Sanitarie presenti sul territorio della Provincia di Bologna (AUSL di Bologna, Azienda Ospedaliero-Univarsitaria S. Orsola- Malpighi, II.OO.RR., AUSL di Imola), è parte integrante di una strategia mirata a perseguire azioni di sviluppo della politica farmaceutica orientate all'utilizzo di farmaci di provata efficacia e alla promozione e miglioramento dell'appropriatezza della prescrizione intra ed extra ospedaliera. Obiettivo della CPF è realizzare, a mezzo di uno strumento unico, una collaborazione tra tutti i professionisti coinvolti (medici specialisti, MMG/PLS, medici di direzione sanitaria, farmacisti, coordinatori infermieristici) che permetta la massima condivisione delle decisioni su linee di comportamento concordate, al fine di un giusto equilibrio tra governo clinico e governo della spesa. Il traguardo raggiunto oggi dalla CPF è la presentazione di un Prontuario Terapeutico unico dei medicinali in uso negli Ospedali e nelle Strutture sanitarie convenzionate della provincia di Bologna (PTP). Per conseguire tale risultato sono stati utilizzati criteri guida incentrati su prove di efficacia e sicurezza derivanti da studi clinicoterapeutici a lungo termine metodologicamente qualificati, su valutazioni di equivalenza terapeutica all'interno di "categorie omogenee" di farmaci, tenuto conto dei bisogni e della realtà organizzativa locale. La presente pubblicazione rappresenta inoltre uno strumento riconosciuto di governo clinico, a disposizione di tutti i Professionisti che operano nelle Aziende Sanitarie rappresentate nella CPF, utile per la diffusione delle principali decisioni assunte, anche nella valutazione di richieste di inserimento in Prontuario di nuovi farmaci. 2 Commissione provinciale del Farmaco Bologna PRESENTAZIONE In particolare, nel Prontuario sono evidenziati: – il metodo che ha portato i clinici alla scelta dell'inserimento di un numero di molecole più ridotto rispetto alla somma dei prodotti presenti in passato nei singoli Prontuari ospedalieri; – specifiche note per segnalare particolari modalità di impiego e/o prescrittive, indicazioni di sicurezza e/o per un utilizzo appropriato, la presenza di schede monografiche elaborate dalla Commissione Regionale del Farmaco (CRF) e documenti elaborati dalla Commissione stessa; – le molecole che a fronte di una valutazione in equivalenza terapeutica sono state aggiudicate per la fornitura alle Aziende Sanitarie attraverso l'Asta pubblica realizzata nel 2006. Si segnala che il Prontuario Terapeutico, è accessibile anche attraverso l'Intranet di ogni Azienda Sanitaria rappresentata in Commissione, sia in versione pdf scaricabile, sia per ricerche mirate on line. Un ringraziamento particolare è rivolto a tutti i Professionisti delle Aziende sanitarie che con il loro contributo hanno collaborato all'aggiornamento e alla revisione del Prontuario Terapeutico Provinciale. Ci auguriamo infine, che la consultazione del Prontuario Terapeutico possa soprattuto contribuire a promuovere una prescrizione dei farmaci efficace e sicura. Il Presidente della Commisione Provinciale del Farmaco Prof. Bruno Magnani Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 3 COMPO SI ZIONE del la Commis sione Prov inci al e del Farmac o COMPOSIZIONE DELLA COMMISSIONE PROVINCIALE DEL FARMACO 2007 PRESIDENTE COMPONENTI CARDIOLOGIA DIREZIONE MEDICA FARMACOLOGIA (CeVEAS) INFERMIERE EPIDEMIOLOGO MALATTIE INFETTIVE MEDICINA INTERNA MMG/PLS NEUROLOGIA ONCOLOGIA PSICHIATRIA RIANIMAZIONEANESTESIA SERVIZIO FARMACEUTICO OSPEDALIERO E TERRITORIALE ANGIOLOGIA CHIRURGIA GENERALE EMATOLOGIA FISIATRIA GASTROENTEROLOGIA Prof. B. Magnani AUSL BO AOSP BO Dr. G. Di Pasquale Dr. G. Melandri Dr.ssa V. Solfrini Dr.ssa M. Taglioni Dr.ssa A. M. Marata e/o Dr. N. Magrini (CRF) Dott. P. Chiari Dr. L Guerra Dr. V. Pedone Dr. A. Balduzzi Dr. R. Michelucci Dr.ssa A. Brandes Dr. L. Tagliabue Dr. F. Cancellieri Dott.ssa L. Toni Dott.ssa D. Carati Dott.ssa E. Pasi AUSL IMOLA Dr.ssa M. Rolli Prof. G. Marchesini Dr. P. Iannone Dr. F. Suzzi Dr. C. Zamagni Dr. A. Masina Dr.ssa S. Taddei Dott.ssa. C. Puggioli Dott. S. Strazzari Dott. S. Nuvola Dott.ssa P. Fiacchi (CRF) Dr.ssa B. Cosmi Dr. P. Del Prete Prof. P. Zinzani (CRF) Dr.ssa L. Landi Dr. S. Macchia (CRF) GERIATRIA NEFROLOGIA ORTOPEDIA PEDIATRIA PNEUMOLOGIA SPECIALISTICA AMBULAT. II.OO.RR. Prof. D. Festi Prof. F. Bazzoli Dr. A. Salsi Dr. C. Campieri Dr. A. Santoro Dr. S. Sandri Prof. F. Bernardi Dr. F. Falcone Dr. A. Curti SEGRETERIA SCIENTIFICA PRESIDENTE Prof. B. MAGNANI VICE PRESIDENTE Prof. D. FESTI COORDINATORE Dott.ssa E. PASI Dr. C. Campieri, Dr.ssa B. Cosmi, Dott.ssa P. Fiacchi, Dr. S. Macchia, Dr.ssa AM. Marata e/o Dr. N. Magrini, Dr. G. Marchesini, Dr. F. Suzzi, Dr.ssa. M. Taglioni, Dott.ssa L. Toni. Supporto esterno alla Segreteria Scientifica: Dott.ssa L. Magnano, Dott.ssa S. Maltoni (CeVEAS) - Dott.ssa L. Alberghini (Dip. Farmaceutico AUSL Bologna) 4 Commissione provinciale del Farmaco Bologna METODOLOGIA DI LAVORO METODOLOGIA DI LAVORO La Commisione Provinciale del Farmaco con l’obiettivo di definire un processo decisionale razionale, qualificato (“evidence based”) trasparente e riproducibile, finalizzato alla stesura di un unico Prontuario Terapeutico Provinciale, ha elaborato un documento di indirizzo che esplicita la metodologia ed i criteri per la valutazione/selezione dei medicinali. Di seguito vengo riportati in sintesi i contenuti principali. • Campo di applicazione Medicinali il cui impiego sia finalizzato alla prevenzione, diagnosi, cura e riabilitazione all’interno degli Stabilimenti ospedalieri e delle strutture sanitarie (Case Protette/RSA, Residenziali Psichiatriche, ecc) afferenti alle Aziende Sanitarie della provincia di Bologna. Medicinali erogabili ai cittadini direttamente dalle Aziende Sanitarie attraverso i rispettivi Servizi Farmaceutici in ottemperanza alle disposizioni nazionali (L.405/01) e regionali (D.G. 539/02). • Strumenti Elaborati di riferimento dei Prontuari Terapeutici delle singole Aziende suddivisi per classe terapeutica dove vengono riportati i principi attivi (PA) presenti nei Prontuari delle quattro Aziende. Eventuale documentazione che riporta analisi/valutazioni/decisioni di Commissioni Terapeutiche di altre Aziende Sanitarie al fine di un confronto con altre realtà ospedaliere regionali ed extra regionali. Documenti normativi specifici nazionali e regionali. Studi clinici utilizzati per la registrazione del farmaco in esame. Documentazione proveniente da fonti secondarie di informazione indipendente quali: RIVISTA Prescrire International NOTE e indirizzi web Edizione in lingua inglese di La Revue Prescrire. Bollettino ISDB francese www.prescrire.org Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 5 METODOLOGIA DI LAVORO RIVISTA WHO Drug Information NOTE e indirizzi web Bollettino OMS www.who.int Medical Letter Bollettino ISDB american www.medletter.com Drug and Therapeutic Bullettin Bollettino ISDB inglese www.which.net Clinical Evidence www.evidence.org/index-wellcome.htm Cochrane Library www.areas.it/coclib.htm Worst Pills Best Pills Bollettino ISDB americano www.citizen.org/hrg/ Ricerca e Pratica Bollettino ISDB a cura dell’ IRFMN www.irfmn.mnegri.it Informazioni sui Farmaci Bollettino ISDB a cura del Servizio di Informazione e Documentazione FCR www.informazionisuifarmaci.it Dialogo sui Farmaci Bollettino ISDB a cura dell’Azienda ULSS n. 20 Verona e dell’ Azienda ospedaliera di Verona www.dialogosuifarmaci.it Bollettino di informazione sui farmaci Bollettino del Ministero della Salute -Dipartimento per la Valutazione dei medicinali e la Farmacovigilanza www.agenziafarmaco.it Therapeutics Letter Bollettino ISDB canadese www.tu.ubc.ca Adverse Drug Reaction Bullettin Edizione italiana. FOCUS Bollettino di farmacovigilanza AUSL Verona www.farmacovigilanza.org I criteri principali utilizzati dalla Commissione Terapeutica per la revisione ed aggiornamento del Prontuario sono i seguenti: EFFICACIA: valutata rispetto ai risultati di studi clinici di buona qualità (RCT, Revisioni sistematiche, Metanalisi) e alle raccomandazioni contenute nelle principali Linee-guida nazionali ed internazionali. SICUREZZA: valutata sulla base dei dati desunti da studi clinici e qualora disponibili da studi osservazionali di farmacosorveglianza postmarketing. 6 Commissione provinciale del Farmaco Bologna METODOLOGIA DI LAVORO GRADO DI INNOVATIVITA’: valutati in termini di maggiore efficacia o tollerabilità o compliance rispetto ai farmaci già disponibili e considerati di riferimento . EQUIVALENZA TERAPEUTICA: valutata sulla base del confronto tra i farmaci della stessa “categoria omogenea” al fine di individuare quelli che dispongono delle migliori evidenze e che possono essere considerati sovrapponibili per gli impieghi clinici prevalenti. COSTI DEL FARMACO: analisi economica di impatto sulla pratica clinica ospedaliera e sulla prescrizione e spesa farmaceutica territoriale rispetto ad eventuali analoghi ove disponibili. Associazioni La valutazione delle associazioni precostituite di principi attivi che possono essere incluse in Prontuario ha seguito i seguenti criteri: – acquisizione di specifiche proprietà farmacologiche non presenti nei singoli costituenti, – provato potenziamento d’azione, – miglioramento significativo della compliance, – semplificazione organizzativa nella gestione ospedaliera della terapia e migliore integrazione della continuità terapeutica tra ospedale e territorio limitatamente ai farmaci erogati in dimissione. Pareri La Commissione valuta le proposte di inserimento ed esprime i seguenti pareri sempre e comunque motivati: – Inserimento in Prontuario; – Non inserimento; – Inserimento con raccomandazione; – Sospensione del parere; – Erogabile in continuità assistenziale. • EQUIVALENZE TERAPEUTICHE Premessa In Europa l’immissione in commercio dei nuovi farmaci avviene prevalentemente attraverso l’Agenzia Europea per la valutazione dei Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 7 METODOLOGIA DI LAVORO prodotti medicinali (EMEA); le regole che l’EMEA applica consentono la commercializzazione anche solo sulla base di studi di efficacia e in assenza di prove di superiorità rispetto al trattamento di riferimento, in particolare vengono spesso utilizzati studi di equivalenza o di non inferiorità. Una volta che il farmaco è stato approvato dall’EMEA l’immissione in commercio nell’ambito dei paesi dell’Unione Europea è automatica; l’unica competenza dei singoli paesi riguarda il prezzo di commercializzazione e la decisione di renderlo o meno rimborsabile a carico dei sistemi sanitari. Ciò comporta inevitabilmente la possibilità che vengano immessi in commercio farmaci non realmente innovativi o con minori evidenze di efficacia rispetto a quelli già disponibili. Tale fenomeno è particolarmente evidente per patologie molto diffuse e/o di rilevante impatto economico. A partire da questi presupposti è stata sviluppata dal CeVEAS (Centro di Valutazione dell’Efficacia dell’Assistenza Sanitaria) una metodologia che nell’ambito dalle singole categorie terapeutiche omogeneeQ (definite nella riclassificazione del Prontuario terapeutico nazionale nel luglio 1999) imposta la valutazione dei farmaci secondo il principio dell’equivalenza terapeutica, allo scopo di individuare quelli in possesso delle migliori evidenze in termini di efficacia e sicurezza e/o di fare emergere eventuali differenze fra loro rilevanti per la pratica clinica. La CPF di Bologna ha condiviso tale approccio e deciso di applicare il principio dell’equivalenza terapeutica per alcune categorie omogenee. Q "La categoria terapeutica omogenea viene definita come un gruppo di farmaci (principi attivi e relative preparazioni farmaceutiche) che, in rapporto all'indicazione terapeutica principale, hanno in comune il meccanismo d'azione e sono caratterizzati da un'efficacia clinica ed un profilo di effetti indesiderati pressoché sovrapponibile, pur potendo i singoli farmaci diversificarsi per indicazioni terapeutiche aggiuntive"G.U. n. 127/99 C.U.F. "Elenco delle categorie terapeutiche omogenee" 8 Commissione provinciale del Farmaco Bologna METODOLOGIA DI LAVORO • METODOLOGIA DI VALUTAZIONE DEI FARMACI IN EQUIVALENZA TERAPEUTICA Allo scopo di favorire al massimo il coinvolgimento dei clinici il metodo prevede l’attivazione di un gruppo di lavoro multidisciplinare per ogni classe terapeutica, a cui partecipano professionisti con specifica esperienza clinica nella classe di farmaci da esaminare. Schede di equivalenza Per ogni classe di farmaci vengono predisposte schede di confronto, nelle quali per tutti i principi attivi di quella classe vengono riportate/i e analizzate/i: – le indicazioni registrate presenti in scheda tecnica mettendo in evidenza le uguaglianze e le reali differenze dei farmaci esaminati rispetto agli impieghi clinici proposti, per giungere poi ad una sintesi delle principali indicazioni d’uso da ritenere equivalenti; – le indicazioni per le quali sono disponibili studi clinici (anche al di fuori delle indicazioni registrate), dando particolare rilevanza, ove possibile, agli studi di confronto diretto tra i principi attivi in esame. Per gli studi analizzati vengono prodotte tabelle delle evidenze per consentire una valutazione critica e comparativa delle caratteristiche degli studi studio, delle popolazioni studiate, degli end-point utilizzati e dei risultati ottenuti; – i dosaggi utilizzati per le singole patologie (confrontando quelli riportati in scheda tecnica con quelli effettivamente impiegati negli studi); – il profilo di sicurezza(evidenziando eventuali differenze di rilevanza clinica fra i farmaci oggetto del confronto; – le differenze farmacocinetiche e le eventuali implicazioni cliniche; – le interazioni e/o controindicazioni; – le formulazioni disponibili; – la bibliografia di riferimento – per gli antibiotici viene prodotta una scheda sull’equivalenza microbiologica Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 9 METODOLOGIA DI LAVORO Ogni singolo punto analizzato viene completato con valutazioni riassuntive condivise dal gruppo di lavoro. Questo porta alla selezione di principi attivi con le migliori evidenze e all’esclusione di quelli meno studiati. La scheda termina con una valutazione complessiva del gruppo di lavoro che riporta per quali farmaci, per quali indicazioni cliniche e con quali dosaggi è stata definita l’equivalenza oltre che eventuali indicazioni peculiari di ogni principio attivo. Le schede approvate dal gruppo di lavoro vengono presentate alla CPF per la definitiva approvazione. 10 Commissione provinciale del Farmaco Bologna PREMESSA PREMESSA • Normativa Regionale di riferimento La Regione con DELIBERA DI GIUNTA N. 1540 del 6 novembre 2006 recante "ORGANIZZAZIONE DEL SISTEMA PREPOSTO ALLA SCELTA DEI FARMACI DA UTILIZZARE NELLE STRUTTURE DELLE AZIENDE SANITARIE E DEGLI IRCCS DELLA REGIONE EMILIA-ROMAGNA" ha disegnato un nuovo assetto nell' ambito del quale svolgere le proprie funzioni in materia di assistenza farmaceutica, "garantendo il rispetto dei criteri di appropriatezza, sicurezza ed economicità degli interventi, favorendo l' uniformità a livello regionale delle scelte attinenti l' uso dei farmaci, a tutela dell' equità del servizio reso ai cittadini". A tal fine, è stato quindi ridefinito il ruolo del Prontuario Terapeutico Regionale (PTR), dei Prontuari Terapeutici Provinciali (PTP) e delle Commissioni preposte al loro aggiornamento. In quanto strumento di governo clinico, il PTR assume natura giuridica VINCOLANTE per l' operatività delle Commissioni Provinciali del Farmaco (CPF) e la costruzione dei PTP che potranno contenere, per soddisfare le esigenze che si caratterizzano a livello locale, solo farmaci già inseriti nel PTR. Analogamente, i PTP sono VINCOLANTI per la prescrizione, somministrazione ed erogazione dei farmaci nelle strutture delle Aziende sanitarie: 1. in regime di degenza ordinaria e day hospital; 2. in ambulatorio e day service; 3. nel trattamento di pazienti soggetti a controllo ricorrente e a presa in carico assistenziale (Legge 405/2001, art. 8 comma a); 4. nel primo ciclo di trattamento dei pazienti dimessi dal ricovero ospedaliero o a seguito di visita ambulatoriale (Legge 405/2001, art. 8 comma c e DGR 539/2002). Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 11 PREMESSA Le prescrizioni di farmaci in deroga ai PTP, ed eventualmente al PTR, dovranno essere "limitate ai casi clinici eccezionali e motivati dalla indisponibilità di una alternativa farmacologia di pari efficacia, atta a garantire la continuità terapeutica, nell' ambito degli indirizzi formulati dalla CRF". In attuazione della Legge Finanziaria 2007, la Giunta regionale con delibera n. 227/200: "PIANO DI CONTENIMENTO DELLA SPESA FARMACEUTICA OSPEDALIERA" ha inoltre previsto specifici interventi per: • il controllo dei farmaci innovativi (con particolare attenzione rivolta ai farmaci oncologici); • il monitoraggio dell' uso appropriato degli stessi; • gli appalti per l' acquisto di farmaci, finalizzati a realizzare economia di spesa anche attraverso l' applicazione delle equivalenze terapeutiche. • Continuità assistenziale Ospedale-Territorio: farmaci in erogazione diretta c/o i punti di distribuzione delle U.O. di Farmacia delle Aziende sanitarie - Farmaci in PTP di: Fascia A SSN (esclusi farmaci appartenenti alle tabelle stupefacenti Legge 49/2006) Fascia H/OSP2 SSN - Farmaci compresi nell'elenco della Legge 648/96. - Farmaci per Malattie Rare [orf] in applicazione della Delibera di Giunta regionale n. 160 del 2.02.2004 "Istituzione della Rete regionale per la prevenzione, la sorveglianza, la diagnosi e la terapia delle malattie rare, ai sensi del DM 18.05.2001, n. 279". • Note di redazione - Il Prontuario deve essere considerato come uno strumento dinamico sottoposto a periodico aggiornamento da parte della CPF, al fine del suo adeguamento allo sviluppo delle nuove conoscenze farmacologiche e terapeutiche. 12 Commissione provinciale del Farmaco Bologna PREMESSA - Le richieste d'inserimento di nuovi farmaci vengono accettate dalla Commissione esclusivamente se formulate da clinici operanti in strutture ospedaliere ed extra ospedaliere convenzionate con il Servizio Sanitario della Provincia di Bologna. - L'elenco dei farmaci in Prontuario è presentato secondo la classificazione ATC = classificazione Anatomica Terapeutica Chimica (Nordic Council on Medicines-WHO). - Per ogni farmaco in elenco vengono riportati: ambiti di rimborsabilità e concedibilità SSN (classe A,H,C ed eventuale NOTA AIFA di riferimento); particolari modalità prescrittive (PT, RMP, Scheda AIFA ,MOD. STUPEFACENTE, ecc); eventuali limitazioni prescrittive e/o di destinazione d'uso; particolar i modalità di monitoraggio da parte della CPF; eventuali commenti su scelte effettuate dalla CPF e indicazioni d'uso appropriato; riferimento ad importanti segnalazioni difarmacovigilanza (DDL) e a specifici document i elaborati dalla CRF o CPF. - Ogni singola Azienda mantiene in essere il proprio format di RMP e di richiesta di Albumina. Inoltre per la Classe ATC J01-ANTIBATTERICI AD USO SISTEMICO J01 è lasciata facoltà ad ogni singola azienda di sottoporre a RMP molecole diverse, in relazione ai dati di sensibilità microbiologica e ai sistemi di monitoraggio locale esistenti. - Non compaiono in elenco i prodotti a base di Antisettici e Disinfettanti in quanto di specifica competenza dei singoli Comitati aziendali per l'Infezioni Ospedaliere (CIO). Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 13 PREMESSA • LEGENDA (abbreviazioni utilizzate nel Prontuario Terapeutico Provinciale) ATC Classe SSN A H OSP1/OSP2 C PT PHT CRF PTR CPF PTP ED NPT DDL RCP [DocCRF] [Scheda RER] Registro AIFA [Scheda AIFA] [DocCLIFF] [DocPRI-ER] [SchedaCPF] Scheda albumina RMP [orf] 14 classificazione Anatomica Terapeutica Chimica (Nordic Council on Medicines-WHO) classe di rimborsabilità del farmaco: concedibile SSN concedibile SSN solo da strutture ospedaliere non concedibile SSN Farmaco soggetto al rilascio del Piano Terapeutico da parte dei Centri autorizzati dalla Regione Emilia-Romagna ( RER Circ. 22/01) Prontuario per la continuità assistenziale H (Ospedale)-T (Territorio) Commissione Regionale del Farmaco Prontuario Terapeutico Regionale Commisione Provinciale del Farmaco Prontuario Terapeutico Provinciale Erogazione diretta da parte della Struttura sanitaria Nutrizione parenterale Totale Dear Doctor Letter (AIFA) Riassunto delle Caratteristiche del Prodotto (Scheda Tecnica) Documento approvato dalla Commissione Regionale del farmaco scaricabile all'indirizzo: http://www.saluter.it/wcm/saluter/sanitaer/servizio_sanitario_regionale/a ssistenza_farmaceutica/allegati_ commissione/commissione_farmaco/allegati/documenti_approvati.htm Scheda di monitoraggio approvata dalla Commissione Regionale del farmaco Monitoraggio AIFA all'indirizzo: http://aifa-onco.agenziafarmaco.it Monitoraggio AIFA all'indirizzo: http://monitoraggio-farmaci.agenziafarmaco.it/ Documento elaborato da Commissione interaziendale Linee-guida Indicatori -Farmaci Farmacovigilanza Documento elaborato dal Gruppo oncologico regionale nell'ambito del Progetto Ricerca e Innovazione- E.R. Scheda per la prescrizione approvata dalla Commissione Provinciale del Farmaco Richiesta personalizzata secondo raccomandazioni d'uso aziendali Farmaco soggetto a Richiesta Motivata Personalizzata (Moduli aziendali) Farmaco orfano per malattia rara Commissione provinciale del Farmaco Bologna PREMESSA Forme farmaceutiche SIR F F + SOLV FL + SOLV FIALESIRINGHE FIALE FIALE + FIALE SOLVENTE FLACONCINI + FIALE SOLVENTE FL FLACONCINI/FIALOIDI INIET PREPARAZIONE INIETTABILE CPR COMPRESSE CPS CAPSULE GTT GOCCE OS/LIQIODO OS POLV POLVERE O GRAN GRANULATO SCIR SCIROPPO SOSP SOSPENSIONE CR CREMA POM POMATA PEN PENNA UNG UNGUENTO EMULS EMULSIONE SOL SOLUZIONE POLV POLVERE U.E. COLL COLLIRIO POM OFT POMATA OFTALMICA SPR SPRAY SUP SUPPOSTE CPR VAG TAVOLETTE/COMPR. VAGINALI OV OVULI LAV VAG LAVANDE VAGINALI COLL COLLUTTORIO CONF CONFETTI LOZ LOZIONE SCHIU SCHIUMA AEROS AEROSOL CER CEROTTI CAND VAG CANDELETTE VAGINALI TBF TUBO SIRINGA Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 15 PREMESSA CARP CPR EFF UNG OFT CART POLV INAL F + SIR CPR RIV SCHIU RET SOSP RET POLYAMP AD BB 16 CARPULE CPR EFFERVESCENTI UNGUENTO OFTALMICO CARTUCCIA POLVERE PER INALAZIONE FIALA + SIRINGA COMPRESSE RIVESTITE SCHIUMA RETTALE SOSPENSIONE RETTALE AMPOLLA POLIPROPILENE ADULTI BAMBINI Commissione provinciale del Farmaco Bologna PREMESSA Vie di somministrazione ev/iv id im inal intracaver intratec ivas loc nas oft os rett sc subling td trach vag vesc endovenosa intradermica intramuscolare inalatoria intracavernosa intratecale intravasale locale nasale (sistemica) oftalmica orale rettale sottocutanea sublinguale transdermica endotracheale vaginale intravescicale Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 17 Indice per ATC ATC pag. A Apparato gastrointestinale e metabolismo . . . . . . 24 B Sangue e organi emopoietici . . . . . . . . . . . . . . . . 35 C Sistema cardiovascolare. . . . . . . . . . . . . . . . . . . . 46 D Dermatologici. . . . . . . . . . . . . . . . . . . . . . . . . . . . 56 G Sistema genito-urinario e ormoni sessuali . . . . . . 60 H Preparati ormonali sistemici, esclusi gli ormoni sessuali . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65 J Antimicrobici generali per uso sistemico . . . . . . . 70 L Farmaci antineoplastici e immunomodulatori. . . . 89 M Sistema muscolo-scheletrico . . . . . . . . . . . . . . . . 103 N Sistema nervoso. . . . . . . . . . . . . . . . . . . . . . . . . . 107 P Farmaci antiparassitari, insetticidi e repellenti . . . 125 R Sistema respiratorio . . . . . . . . . . . . . . . . . . . . . . . 128 S Organi di senso . . . . . . . . . . . . . . . . . . . . . . . . . . 132 V Vari. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 137 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 21 Prontuario terapeutico C la s s e S S N e concedibilità ATC Descrizione A Apparato gastrointestinale e metabolismo A01 Stomatologici A01A Antimicrobici orali A01AB Antimicrobici orali A01AB09 Miconazolo DAKTARIN*GEL ORALE 80G 2% Note C A02 Antiacidi, antimeteorici e antiulcera peptica A02A Antiacidi A02AD Associazioni e complessi fra composti di alluminio, calcio e magnesio A02AD01 Magnesio idrossido + Algeldrato MAALOX*40CPR MAST 800MG MAALOX*OS SOSP 200ML 6,9% A02B Antiulcera peptica A02BA Antagonisti dei recettori H2 A02BA02 Ranitidina RANITIDINA ANG*20CPR RIV 150MG RANITIDINA ANG*20CPR RIV 300MG RANITIDINA ANG*10F 5ML 50MG/5M ZANTAC*SCIR 200ML 150MG/10ML A02BB Prostaglandine A02BB01 Misoprostolo CYTOTEC*50CPR 200MCG A02BC A A A A A A 48 48 48 48 A 1 Inibitori della pompa acida - [DocCLIFF]: Raccomandazioni per l'utilizzo dei farmaci inibitori della secrezione acida A02BC03 Lansoprazolo LANSOX*14CPR ORODISP 15MG LANSOX 15*14CPS 15MG LANSOX*14CPR ORODISP 30MG 24 A A A 1/48 1/48 1/48 Commissione provinciale del Farmaco Bologna ATC Descrizione LANSOX 30*14CPS 30MG C la s s e S S N e concedibilità A Note 1/48 I principi attivi lansoprazolo, rabeprazolo, pantoprazolo, omeprazolo, esomeprazolo data la loro sostanziale sovrapponibilità clinica a dosi equipotenti sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato al principio attivo lansoprazolo per la formulazione orale ed esomeprazolo per la formulazione iniettabile. In bambini di età maggiore di 2 anni per non più di due mesi di terapia l'omeprazolo è l'unico IPP con l'indicazione terapeutica registrata. A02BC05 Esomeprazolo ESOPRAL*INIET/INFUS FL40MG A02BX A02BX02 H/OSP1 Altri antiulcera peptica Sucralfato SUCRALFATO ABC*GRAT 30BUST 2G A A03 Antispastici procinetici e anticolinergici A03A Antispastici e anticolinergici sintetici A03AX Altri anticolinergici sintetici A03AX Floroglucinolo + Meglucinolo SPASMEX*20CPR 80MG+80MG A03AX12 Floroglucinolo SPASMEX*INIETT 10F 40MG/4ML A03B C A Belladonna e derivati, non associati A03BA Alcaloidi della belladonna, amine terziarie A03BA01 Atropina ATROPINA SOLFATO*5F 0,5MG 1ML ATROPINA SOLFATO*5F 1MG 1ML A03BB A03BB01 A C Alcaloidi della belladonna semisintetici, composti ammonici quaternari Butilscopolamina BUSCOPAN*IM IV 6F 1ML 20MG BUSCOPAN*30CPR RIV 10MG A C Prontuario terapeutico della Provincia di Bologna 25 ATC Descrizione A03F Procinetici A03FA Procinetici A03FA01 Metoclopramide PLASIL*24CPR 10MG PLASIL*INET 5F 2ML 10MG/2ML PLASIL*SCIR 120ML 10MG/10ML A03FA03 C la s s e S S N e concedibilità Note C A C Domperidone MOTILIUM*30CPR RIV 10MG PERIDON*SCIR 200ML 10MG/10ML PERIDON*AD 6SUPP 60MG PERIDON*BB 6SUPP 30MG A04 Antiemetici e antinausea A04A Antiemetici e antinausea C C C C A04AA Antagonisti della serotonina (5HT3) A04AA01 Ondansetron ZOFRAN*6CPR 8MG ZOFRAN*IM IV 1F 4ML 8MG A A 57 57 I principi attivi ondansetron, granisetron e tropisetron, data la loro sostanziale sovrapponibilità clinica a dosi equipotenti sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato al principio attivo ondansetron. Nel caso di pazienti che mostrano effetti collaterali importanti a seguito di assunzione di ondansetron è possibile richiedere un prodotto alternativo nell'ambito dell' equivalenza effettuata. Evitarne l'uso nella profilassi dell'emesi post chirurgica per un rapporto costo/efficacia sfavorevole. A05 Terapia biliare ed epatica A05A Terapia biliare A05AA Preparati a base di acidi biliari A05AA02 Acido ursodesossicolico URSACOL*40CPR 50MG URSOBIL HT*20CPS 450MG R.C. URSOBIL*20CPR 300MG 26 C A A Commissione provinciale del Farmaco Bologna 2 2 ATC Descrizione A06 Lassativi A06A Lassativi A06AA Emollienti A06AA01 Paraffina liquida C la s s e S S N e concedibilità OLIO VASELINA*EMULS 200G A06AB Lassativi di contatto A06AB06 Senna foglie (glucosidi A e B) PURSENNID*40CPR RIV 12MG XPREP*SCIR TAPPOSERB 75ML150MG A06AB08 Note C C C Picosolfato sodico EUCHESSINA C.M.*OS GTT 20ML A06AD Lassativi ad azione osmotica A06AD10 Sodio fosfato acido + Disodio fosfato PHOSPHOLAX*OS 10BUST 20ML C C A06AD11 Lattulosio LAEVOLAC*SCIR 180ML LAEVOLAC EPS*SCIR 180ML LATTULAC EPS*1SACC RETT SOL20% C A H/OSP2 59 A06AD15 Macrogol 4000 NB: in attesa di aggiudicazione di gara entro il 2007 A06AD65 Macrogol+Sali di Na e K ISOCOLAN*8BUST 34,8G S/CONTENI C A06AD65 Macrogol+Simeticone+Sali di Na e K SELG ESSE*OS POLV 4BUST 70G 1L C Prontuario terapeutico della Provincia di Bologna 27 Descrizione A06AG Clismi A06AG01 sodio fosfato monobasico diidrato + disodio fosfato dibasico dodecaidrato FOSFATO SODICO AC*CLISMA 20FL A06AX Altri lassativi A06AX01 Glicerolo GLICEROLO*AD 18SUPP 2500MG GLICEROLO*BB 18SUPP 1500MG C C Antidiarroici, antinfiammatori e antimicrobici intestinali A07A Antimicrobici intestinali A07AA Antibiotici A07AA02 Nistatina A07AA06 C Colistina solfato COLIMICINA*OS GTT 4000000U 4ML A07AA11 A A Amfotericina B FUNGILIN*OS SOSP 60ML 500MG/5M A07AA10 A Paromomicina HUMATIN*16CPS 250MG HUMATIN*SCIR 60ML 2,5% A07AA07 Note C A07 MYCOSTATIN*OS SOSP FL 100ML C Rifaximina NORMIX*AD 12CPR RIV 200MG A07B Adsorbenti intestinali A07BA Preparati a base di carbone A07BA01 Carbone attivato CARBOMIX*OS GRAT SOSP FL 50G 28 C la s s e S S N e concedibilità ATC A C Commissione provinciale del Farmaco Bologna ATC Descrizione A07D Antipropulsivi A07DA Antipropulsivi A07DA03 Loperamide C la s s e S S N e concedibilità DISSENTEN*15CPR 2MG A07E Antinfiammatori intestinali A07EA Corticosteroidi per uso topico A07EA07 A07EC01 Sulfasalazina A Mesalazina (5-ASA) ASACOL SUPPOSTE*20SUPP 500MG ASACOL*24CPR GASTR 800MG ASACOL*7CLISMI SCHIUMA BOMB 2G ASACOL*7CLISMI PRONTI 2G 50ML ASACOL*7CLISMI SCHIUMA BOMB 4G ASACOL*7CLISMI PRONTI 4G 100ML ASACOL*50CPR GASTR 400MG ASAVIXIN*50CPR RIV 500MG PENTACOL 800*60CPR 800MG R.M. PENTASA*50CPR 500MG R.M. A09 A Acido aminosalicilico ed analoghi SALAZOPYRIN EN*100CPR 500MG A07EC02 C Beclometasone TOPSTER*RETT SOSP 7FL 60ML+CAN A07EC Note A A A A A A A A A A Digestivi, inclusi gli enzimi A09A Digestivi, inclusi gli enzimi A09AA Preparati a base di enzimi A09AA02 Pancrelipasi CREON 10000UI*100CPS 150MG RM CREON 25000UI*100CPS 300MG RM PANCREX*100CPS 340MG A C A Prontuario terapeutico della Provincia di Bologna 5 5 29 ATC Descrizione C la s s e S S N e concedibilità A10 Farmaci usati nel diabete A10A Insuline e analoghi A10AB Insuline e analoghi, ad azione rapida A10AB01 Insulina umana ACTRAPID*NOVOL 5CART 3ML100UI/ ACTRAPID*PENF 5CART 3ML100UI/M ACTRAPID*SC EV 1FL 10ML100UI/M A10AB04 A A A Insulina lispro HUMALOG*SC 1FL 10ML 100U/ML HUMALOG*SC 5CART 3ML 100U/ML A10AB05 Note A A Insulina aspart NOVORAPID*FLEX 5PEN 3ML 100U/M NOVORAPID PENFILL*SC 5CART 3ML A A A10AC Insuline e analoghi, ad azione intermedia A10AC01 Insulina umana isofano PROTAPHANE*NOVOL5CART 3ML100UI PROTAPHANE*PENF 5CART 3ML100UI PROTAPHANE*SC 1FL 10ML100UI/ML A A A A10AD Insuline e analoghi, ad azione intermedia e ad azione rapida associate A10AD01 Insulina umana + insulina umana isofano ACTRAPHANE 30 NOV*5CART 100UI/ ACTRAPHANE 30 PEN*5CART 3ML100 ACTRAPHANE 30*SC 10ML 100UI/ML A10AE A10AE04 A A A Insuline e analoghi, ad azione lunga Insulina glargine LANTUS*SC 5CART 3ML 100UI/ML LANTUS*SC 1FL 100UI/ML 10ML A A PHT-PT PHT-PT [DocCRF] 30 Commissione provinciale del Farmaco Bologna ATC Descrizione A10B Ipoglicemizzanti orali A10BA Biguanidi A10BA02 Metformina METFONORM*60CPR RIV 1000MG METFORMINA TEVA*30CPR 500MG OP METFORMINA TEVA*40CPR 850MG OP A10BB Sulfonamidi, derivati dell'urea A10BB01 Glibenclamide GLIBORAL*30CPR 5MG A10BB08 A A A A A Gliclazide DIAMICRON*40CPR 80MG A10BB12 Note Gliquidone GLURENOR*40CPR 30MG A10BB09 C la s s e S S N e concedibilità A Glimepiride SOLOSA*30CPR 2MG A10BD associazioni di antidiabetici orali A10BD02 Metformina + Glibenclamide GLIBOMET 5*60CPR RIV 400MG+5MG GLUCOMIDE*40CPS 500MG+2,5MG A A A A10BD03 Metformina + Rosiglitazone AVANDAMET*56CPR RIV 2MG/1000MG PT-RER A [DocCRF] A10BG Tiazolidinedioni A10BG02 Rosiglitazone AVANDIA*28CPR RIV 4MG PT-RER A Prontuario terapeutico della Provincia di Bologna 31 ATC Descrizione AVANDIA*28CPR RIV 8MG C la s s e S S N e concedibilità Note A "...Aumento dell'incidenza di fratture nelle pazienti di sesso femminile che hanno ricevuto un trattamento a lungo termine con rosiglitazone: risultati dello studio clinico ADOPT (Kahn et al.,2006.N Engl J Med, Vol. 355, No. 23:2427-2443)..."(DDL AIFA, marzo 2007). "...modesto incremento di rischio di IMA e morte cardiovascolare in pazienti con diabete di tipo 2 trattati con rosiglitazone. Analisi dei dati provenienti da 42 studi clinici su 15.550 pazienti trattati con rosiglitazone pubblicata su www.nejm.org 21 maggio 2007..."(DDL AIFA, maggio 2007). A10BG03 Pioglitazone ACTOS*28CPR 15MG ACTOS*28CPR 30MG A10BX Altri ipoglicemizzanti orali A10BX02 Repaglinide NOVONORM*90CPR 0,5MG NOVONORM*90CPR 1MG NOVONORM*90CPR 2MG A11 Vitamine A11B Polivitaminici non associati A11BA Polivitaminici non associati A11BA Complesso vitaminico CERNEVIT*INIET 10FL POLV IDROPLURIVIT*IM OS LIOF 5F+5F IDROPLURIVIT*OS GTT FL 10ML PROTOVIT RAFFORZATO*40CPR MAST A11C A A A C/OSP1 C C C RMP-Fibrosi cistica Vitamine A e D, incluse le loro associazioni A11CA Vitamina A, non associata A11CA01 Retinolo palmitato AROVIT*GTT 7,5ML 150000UI/ML A11CC Vitamina D e analoghi A11CC02 Diidrotachisterolo ATITEN*OS GTT 15ML 0,1% 32 PT-RER A A C A Commissione provinciale del Farmaco Bologna ATC Descrizione A11CC04 Calcitriolo CALCIJEX*IV 25F 1ML 1MCG/ML ROCALTROL*30CPS 0,25MCG ROCALTROL*30CPS 0,50MCG A11CC07 Note H/OSP1 A A Paracalcitolo ZEMPLAR*5F 1ML 5MCG/ML A11D C la s s e S S N e concedibilità [SchedaCPF] A PHT-PT Vitamina B1, sola o in associazione con vitamina B6 e B12 A11DA Tiamina (vitamina B1), non associata A11DA01 Tiamina BENERVA*20CPR 300MG VIT.B1 SALF*IM 3F 100MG 2ML C C A11G Acido ascorbico (vit. C), comprese le associazioni A11GA Acido ascorbico (vit. C), non associato A11GA01 Acido ascorbico VIT.C BIL*INIET 10F 500MG/5ML C A11H Altre preparazioni di vitamine, non associate A11HA Altri preparati di vitamine, non associate A11HA01 Nicotinamide VIT.PP ANGELINI*IM 6F 100MG C A11HA02 Piridossina BENADON*10CPR GASTRORES 300MG BENADON*IM IV 6F 2ML 300MG A11HA03 C C Tocoferolo EVION*20CONF 100MG RIGENTEX*30CPS MOLLI 400UI C C Prontuario terapeutico della Provincia di Bologna 33 ATC Descrizione A12 Integratori minerali A12A Calcio A12AA Calcio A12AA03 Calcio gluconato A12AA04 A Potassio A12BA Potassio A12BA01 Potassio cloruro KCL RETARD*40CPR 600MG R.P. A A16 Altri farmaci dell'apparato gastrointestinale e del metabolismo A16A Altri farmaci apparato gastrointestinale e del metabolismo A16AA Aminoacidi e derivati A16AA01 Levocarnitina CARNITENE*INIET 5F 5ML 2G/5ML A16AB Enzimi A16AB02 Imiglucerasi CEREZYME*IV 1F 200UI A16AB04 RMP C [orf] H/OSP1 Agalsidasi beta FABRAZYME*IV 1FL 35MG [orf] H/OSP1 A16AX Prodotti vari dell'apparato gastrointestinale e del metabolismo A16AX03 Sodio fenilbutirrato AMMONAPS*FL 250CPR 500MG 34 Note Calcio carbonato CALCIODIE*30CPR EFF 1000MG A12B C la s s e S S N e concedibilità [orf] H/OSP2 Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione B Sangue e organi emopoietici B01 Antitrombotici B01A Antitrombotici B01AA Antagonisti della vitamina K B01AA03 Warfarin sodico COUMADIN*30CPR 5MG B01AA07 B01AB Eparinici B01AB01 Eparina Calcica CALCIPARINA*10SIR 5000UI 0,2ML CALCIPARINA*10SIR 12500UI0,5ML H/OSP1 H/OSP1 H/OSP1 RMP H/OSP1 H/OSP1 Enoxaparina CLEXANE*6SIR 2000UI/0,2ML CLEXANE*6SIR 4000UI/0,4ML CLEXANE T*2FSIR 6000UI 0,6ML CLEXANE T*2FSIR 8000UI 0,8ML B01AB06 A A Antitrombina III umana ANBINEX*FL 1000UI+SIR 20ML+SET ANBINEX*FL 500UI+SIR 10ML+SET B01AB05 A Eparina Sodica EPSOCLAR*INF 10FL 25000UI/5ML EPSODILAVE*10F 250UI/5ML 5ML PHAREPA*EV 10F 25000UI/5ML B01AB02 A Acenocumarolo SINTROM*20CPR DIV 4MG B01AB01 Note A A A A PHT PHT PHT PHT A A PHT PHT Nadroparina FRAXIPARINA*6SIR 2850UIaXa/0,3 FRAXIPARINA*6SIR 3800UIaXa/0,4 NB:in attesa di aggiudicazione di gara entro il 2007. Prontuario terapeutico della Provincia di Bologna 35 ATC Descrizione C la s s e S S N e concedibilità B01AC Antiaggreganti piastrinici, esclusa l'eparina B01AC04 Clopidogrel PLAVIX*28CPR RIV 75MG B01AC05 uso diagnostico C/OSP1 Epoprostenolo FLOLAN*EV FL 0,5MG+FL 50ML SOL FLOLAN*EV FL 1,5MG+1FL 50ML B01AC11 A Dipiridamolo PERSANTIN*IV 10F 10MG/2ML B01AC09 A Acido acetilsalicilico + Magn. Idrossido + algedrato ASCRIPTIN*20CPR DIV 300MG B01AC07 A Acido acetilsalicilico CARDIOASPIRIN*30CPR GAST 100MG B01AC06 A Acetilsalicilato di lisina CARDIRENE*OS POLV 30BUST 75MG B01AC06 PHT-PT Ticlopidina TIKLID*30CPR RIV 250MG B01AC06 A Note RMP C/OSP1 H/OSP2 Iloprost ENDOPROST*INFUS 1F 0,050MG/ RMP C/OSP1 Limitatamente al trattamento di morbo di Raynaud secondario a sclerodermia. B01AC13 Abciximab REOPRO*EV 1F 5ML 10MG/5ML B01AC16 Eptifibatide INTEGRILIN*IV FL 10ML 2MG/ML INTEGRILIN*IV 100ML 0,75MG/ML 36 H/OSP1 H/OSP1 H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione B01AC17 Tirofiban AGGRASTAT*IV FL 50ML 0,25MG/ML B01AD Enzimi B01AD02 Alteplasi ACTILYSE*IV FL 50MG+FL 50ML C la s s e S S N e concedibilità Note H/OSP1 RMP H/OSP1 Limitatamente al trattamento trombolitico dell'embolia pomonare massiva acuta. Trattamento fibrinolitico dell'icuts ischemico acuto nei Centri autorizzati RER. B01AD04 Urokinasi UROKINASI PH&T*FL 100000UI+F B01AD10 H/OSP1 Drotrecogin alfa XIGRIS*IV FL 20MG POLV 2MG/ML XIGRIS*IV FL 5MG POLV 2MG/ML [Scheda AIFA] H/OSP1 H/OSP1 Progetto GiViTI: http://monitoraggio-farmaci.agenziafarmaco.it/ B01AD11 Tenecteplase METALYSE*IV 1FL 10000U/10ML+SI B01AD12 H/OSP1 Proteina C umana CEPROTIN*IV 1000UI B01AE Inibitori diretti della trombina B01AE02 Lepirudina REFLUDAN*EV 10F 1ML 50MG B01AX Altri antitrombotici B01AX05 Fondaparinux sodico ARIXTRA*SC 10SIR 2,5MG 0,5ML RMP H/OSP1 H/OSP1 RMP A PHT Limitatamente alla profilassi della TVP in pazienti sottoposti a chirugia ortopedica maggiore degli arti inferiori (protesi d'anca e ginocchio), 2,5mg sc. Prontuario terapeutico della Provincia di Bologna 37 ATC Descrizione B02 Antiemorragici B02A Antifibrinolitici B02AA Aminoacidi B02AA02 Acido tranexamico TRANEX*30CPS 500MG UGUROL*IM IV OS 5F 5ML 500MG C la s s e S S N e concedibilità Note A A B02AB Inibitori delle proteasi B02AB03 Proteina plasmatica umana antiangioedema estero BERINERT P 1FL 500UI B02B Vitamina K ed altri emostatici B02BA Vitamina K B02BA01 Fitomenadione KONAKION*INIET 3F 1ML 10MG/ML KONAKION*OS GTT 2,5ML 2% B02BC emostatici locali B02BC30 Colla di Fibrina TISSUCOL*ADESIVO TISS.2SIR 1ML TISSUCOL*ADESIVO TISS.2SIR 2ML A A H/OSP1 H/OSP1 B02BD Fattori della coagulazione del sangue B02BD Complesso protrombinico UMANCOMPLEX D.I.*FL 500UI+F20M A B02BD02 Fattore VIII FANHDI*INF FL1000UI+SIR SOLV+S FANHDI*INF FL 250UI+SIR SOLV+S FANHDI*INF FL 500UI+SIR SOLV+S HAEMATE P*FL 500UI+FL 20ML+SET HAEMATE P*FL 1000UI+FL30ML+SET 38 PHT-PT RMP A A A A A PHT-PT PHT-PT PHT-PT PHT-PT PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione B02BD02 Moroctocog alfa REFACTO*IV 1FL 1000UI+FL 4ML REFACTO*IV 1FL 250UI+FL 4ML REFACTO*IV 1FL 500UI+FL 4ML B02BD02 C la s s e S S N e concedibilità RMP A A A Octocog alfa ADVATE*FL 1000UI+FL SOLV 5ML ADVATE*FL 1500UI+FL SOLV 5ML ADVATE*FL 250UI+FL SOLV 5ML ADVATE*FL 500UI+FL SOLV 5ML KOGENATE BAYER*FL1000UI+SIR+1K KOGENATE BAYER*FL250UI+SIR+1KI KOGENATE BAYER*FL500UI+SIR+1KI B02BD04 PHT-PT PHT-PT PHT-PT RMP A A A A A A A B02BD03 Complesso protrombinico concentrato attivato FEIBA TIM3*IV FL 1000UI+F 20ML Note PHT-PT PHT-PT PHT-PT PHT-PT PHT-PT PHT-PT PHT-PT RMP A PHT-PT A A PHT-PT PHT-PT A PHT-PT Fattore IX MONONINE*EV F 1000UI+F10ML+KIT MONONINE*EV F 500UI+F 5ML+KIT B02BD05 Fattore VII PROVERTIN UM TIM3*IV FL 600UI B02BD08 Eptacog alfa (attivato) NOVOSEVEN*IV 1,2MG(60KUI)+2,2M B02BD09 H/OSP2 Nonacog alfa BENEFIX*IV 1FL 1000UI BENEFIX*IV 1FL 250UI BENEFIX*IV 1FL 500UI A A A PHT-PT PHT-PT PHT-PT Prontuario terapeutico della Provincia di Bologna 39 ATC Descrizione B03 Farmaci antianemici B03A Preparati a base di ferro B03AA Ferro bivalente, preparati orali B03AA07 Ferroso solfato FERROGRAD*40CPR RIV 525MG R.C. B03AB Ferro trivalente, preparati orali B03AB Ferrigluconato sodico FERLIXIT*OS IV 5F 5ML 62,5MG B03AB Note A H Ferromaltoso INTRAFER*OS GTT 30ML 50MG/ML A 76 B03B Vitamina B12 ed acido folico B03BA Vitamina B12 (cianocobalamina e derivati) B03BA01 Cianocobalamina DOBETIN*1000 5F 1ML 1000MCG DOBETIN*5000 5F 2ML 5000MCG B03BB Acido folico e derivati B03BB01 Acido folico FOLINA*IM 5F 2ML 15MG FOLINA*20CPS 5MG B03X Altri preparati antianemici B03XA Altri preparati antianemici B03XA01 Epoetina alfa EPREX*1SIR 1000UI 0,5ML EPREX*1SIR 2000UI 0,5ML EPREX*1SIR 3000UI 0,3ML EPREX*1SIR 4000UI 0,4ML EPREX*1SIR 5000UI/0,5ML EPREX*1SIR 6000UI/0,6ML EPREX*1SIR 8000UI/0,8ML 40 C la s s e S S N e concedibilità A C 10 A A 10 10 RMP-esclusa dialisi A A A A A A A 12 PHT-PT 12 PHT-PT 12 PHT-PT 12 PHT-PT 12 PHT-PT 12 PHT-PT 12 PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione EPREX*1SIR 10000UI 1ML C la s s e S S N e concedibilità A Note 12 PHT-PT I principi attivi epoetina alfa,epoetina beta e darboepoetina data la loro sostanziale sovrapponibilità clinica, a dosi equipotenti (1MCG di darbo equivalenti a 220UI di epo alfa o beta) sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato a epoetina alfa. B05 Succedanei del sangue e soluzioni perfusionali B05A Sangue e prodotti correlati B05AA Succedanei del sangue e frazioni proteiche plasmatiche B05AA01 Albumina umana UMANALBUMIN*INF FL 50ML 200G/L B05AA05 Soluzione ipertonica C/OSP1 Tetramido VOLUVEN*INFUS 15SA 500ML 6% B05B H/OSP1 Pentamido + Sodio cloruro HYPERHAES*1SACCA 250ML B05AA07 C/OSP1 H/OSP1 Poligelina EMAGEL*EV FL 500ML 35G/L B05AA07 15 Destrano PLANDER*INF 20FL 500ML 30G/500 PLANDER R*EV SOLUZ 500ML 10% B05AA06 Scheda Albumina A C/OSP1 Soluzioni endovena B05BA Soluzioni nutrizionali parenterali B05BA01 Aminoacidi ISOPURAMIN 3%*IV FL 250ML ISOPURAMIN 3%*IV FL 500ML SIFRAMIN*FL 500ML 4% SINTAMIN HEPA*FL 500ML 8% SINTAMIN*INFUS FL 500ML 10% TPH*IV FL 250ML 6% C C C C C C Prontuario terapeutico della Provincia di Bologna 41 Descrizione B05BA02 Olio di soia + Lecitina + trigliceridi saturi a media catena LIPOFUNDIN MCT*10FL 100ML 10%+ LIPOFUNDIN MCT*10FL 250ML 10%+ B05BA02 Note C/OSP1 C/OSP1 Olio di soia + Lecitina d'uovo INTRALIPID 10%*EV 500ML SACCA INTRALIPID 20%*EV 500ML SACCA B05BA03 Carboidrati B05BA10 Soluz. nutrizionali associazioni CLINIMIX N12G20E*SACCA 1LT/1LT CLINIMIX N14G30E*SACCA 1LT/1LT CLINIMIX N17G35E*SACCA 1LT/1LT CLINIMIX N9G15E*SACCA 1LT/1LT FREAMINE III 8,5%*IV FL 500ML KABIVEN*4SACCHE 1540ML KABIVEN*2SACCHE 2053ML KABIVEN*2SACCHE 2566ML KRINUVEN*2SACCHE 1970ML C/ELET KRINUVEN*4SACCHE 986ML C/ELETT NUTRIPERI LIPID*EV 5SA 1875ML NUTRIPLUS LIPID*EV 5SA 1875ML NUTRISPECIAL LIPID*5SA 1875ML NUTRISPECIAL LIPID*5SA 2500ML OLICLINOMEL*N-4-550E 1500ML4SA OLICLINOMEL*N-4-550E 2000ML4SA OLICLINOMEL*N-6-900E 2000ML4SA OLICLINOMEL*N-7-1000E2000ML4SA PERIVEN*2SACCHE 2400ML 42 C la s s e S S N e concedibilità ATC C A H/OSP2 H/OSP2 H/OSP2 H/OSP2 C C/OSP1 C/OSP1 C/OSP1 C/OSP1 C/OSP1 C C C C C C C C C/OSP1 B05BB Soluzioni che influenzano l'equilibrio elettrolitico B05BB01 Elettrolitica equilibrata enterica B05BB01 Elettrolitica equilibrata gastrica Commissione provinciale del Farmaco Bologna ATC Descrizione B05BB01 Elettrolitica reidratante I B05BB01 Elettrolitica reidratante II B05BB01 Elettrolitica reidratante III B05BB01 Ringer B05BB01 Ringer acetato B05BB01 Ringer lattato B05BB01 Sodio bicarbonato B05BB01 Sodio cloruro B05BB01 Soluzione Darrow B05BB02 Elettrolitica equilibrata pediatrica B05BB02 Glucosio + Potassio cloruro I e II B05BB02 Glucosio + Sodio cloruro I, II e III B05BB02 Ringer acetato con glucosio B05BB02 Ringer con glucosio B05BB02 Ringer lattato con glucosio B05BB03 Trometamolo THAMESOL*FLEBO FL 250ML 3,6% C la s s e S S N e concedibilità Note H/OSP2 Prontuario terapeutico della Provincia di Bologna 43 ATC Descrizione B05BC Soluzioni che favoriscono la diuresi osmotica B05BC Glicerolo + Sodio cloruro B05BC01 Mannitolo B05C Soluzioni per irrigazioni B05C Soluzioni per irrigazioni B05C Soluzioni saline B05X Soluzioni endovena additive B05XA Soluzioni elettrolitiche B05XA Potassio aspartato KFLEBO*EV OS 5F 10ML 1MEQ/ML 44 C la s s e S S N e concedibilità B05XA Sodio citrato + Acido citrico B05XA Sodio lattato B05XA01 Potassio cloruro B05XA02 Sodio bicarbonato B05XA03 Sodio cloruro B05XA04 Ammonio cloruro B05XA05 Magnesio solfato B05XA06 Potassio fosfato B05XA07 Calcio cloruro B05XA08 Sodio acetato Note C Commissione provinciale del Farmaco Bologna ATC Descrizione B05XA11 Magnesio cloruro B05XA15 Potassio lattato B05XA16 Soluzione cardioplegica B05XA30 Associazioni di elettroliti ADDAMEL N*INFUS 20F 10ML PEDITRACE*INFUS 10FL 10ML B05XB B05XB02 Note H/OSP1 H/OSP1 Aminoacidi Alanilglutamina DIPEPTIVEN*IV FL 100ML B05XC Vitamine B05XC Complesso vitaminico SOLUVIT*AD IV 10FL 10ML B05XC C la s s e S S N e concedibilità C NPT H/OSP1 Retinolo + Ergocalciferolo + Tocoferolo alfa + Fitomenadione VITALIPID*AD INFUS 10F 10ML VITALIPID*BB INFUS 10F 10ML B05Z Emodialitici ed emofiltrati B05ZA Emodialitici, concentrati B05ZA Soluzioni per emodialisi B05ZB Emofiltrati B05ZB Soluzioni per emofiltrazione NPT H/OSP1 H/OSP1 Prontuario terapeutico della Provincia di Bologna 45 ATC Descrizione C Sistema cardiovascolare C01 Terapia cardiaca C01A Glicosidi cardiaci C01AA Glicosidi digitalici C01AA05 Digossina LANOXIN*SCIR 60ML0,05MG/ML C/D LANOXIN*30CPR 0,0625MG LANOXIN*30CPR 0,125MG LANOXIN*30CPR 0,250MG LANOXIN*INIET 6F 2ML 0,5MG/2ML C01B Antiaritmici, classe IA C01BA Diidrochinidina C01BB Antiaritmici, classe IB C01BB02 Mexiletina MEXITIL*40CPS 200MG MEXITIL*IV 10F 10ML 25MG/ML C01BC Antiaritmici, classe IC C01BC03 Propafenone RYTMONORM*30CPR RIV 150MG RYTMONORM*30CPR RIV 300MG RYTMONORM*28CPS 325MG R.P. RYTMONORM*28CPS 425MG R.P. RYTMONORM*EV 5F 70MG 20ML C01BC04 Note A A A A A Antiaritmici, classe I e III C01BA IDROCHINIDINA LIRCA*40CPR150MG IDROCHINIDINA RIT.*20CPS 250MG A A A A A A A A A Flecainide ALMARYTM*20CPR 100MG ALMARYTM*IV 5F 150MG/15ML 46 C la s s e S S N e concedibilità A H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione C01BD Antiaritmici, classe III C la s s e S S N e concedibilità Note C01BD01 Amiodarone AMIODAR*20CPR 200MG AMIODARONE CL.BIO.LIM*5F 150MG A H/OSP1 C01C Stimolanti cardiaci, esclusi i glicosidi cardiaci C01CA Adrenergici e dopaminergici C01CA01 Etilefrina EFFORTIL*OS GTT 15G 0,75% EFFORTIL*IM IV 6F 1ML 10MG C01CA02 Isoprenalina C01CA03 Noradrenalina C01CA04 Dopamina REVIVAN 200*FLEBO 10F 200MG5ML C01CA07 H/OSP1 Dobutamina MIOZAC*INFUS FL20ML 250MG/20ML C01CA24 C C H/OSP1 Adrenalina ADRENALINA*10F 1MG 1ML FASTJEKT*ADULTI 1SIR 0,33MG FASTJEKT*BAMBINI 1SIR 0,165MG C H H Circ. RER-ED C01CE Inibitori della fosfodiesterasi C01CE03 Enoximone PERFAN*EV 1F 100MG 20ML H/OSP1 Prontuario terapeutico della Provincia di Bologna 47 ATC Descrizione C01CX Altri stimolanti cardiaci C01CX08 Levosimendan SIMDAX*EV 1FL 5ML 2,5MG/ML C la s s e S S N e concedibilità Note RMP C/OSP1 [DocCRF] C01D Vasodilatatori usati nelle malattie cardiache C01DA Nitrati organici C01DA02 Nitroglicerina KERITRINA*15CER 10MG/DIE KERITRINA*15CER 15MG/DIE KERITRINA*15CER 5MG/DIE NITROGLICERINA LIM*10F 5MG/1,5 PERGANIT*IV SOLUZ 1FL 50ML A A A H/OSP1 H/OSP1 C01DA08 Isosorbide dinitrato CARVASIN*50CPR 5MG SUBLINGUALI NITROSORBIDE*EV 10F 10ML A H/OSP1 C01DA14 Isosorbide mononitrato DURONITRIN*30CPR DIV 60MG R.P. MONOCINQUE RETARD*30CPS 50MG MONOCINQUE*50CPR DIV 20MG MONOCINQUE*30CPR DIV 40MG C01E Altri preparati cardiaci C01EA Prostaglandine C01EA01 Alprostadil ALPROSTAR*EV/EA 1F POLV 20MCG ALPROSTAR*EV/EA 1F POLV 60MCG PROSTIN VR*IV INF 1F 500MCG1ML C01EB C01EB07 H/OSP1 H/OSP1 H/OSP1 Altri preparati cardiaci Fruttosio difosfato ESAFOSFINA*IV 4F 500MG+4F 10ML FDP FISIOPHARMA*EV 1F 10G+100M 48 A A A A NPT C C Commissione provinciale del Farmaco Bologna ATC Descrizione FDP FISIOPHARMA*EV 1F 5G+50ML C01EB10 C la s s e S S N e concedibilità Note C Adenosina KRENOSIN*EV 6F 2ML 6MG/2ML C/OSP1 C02 Antiipertensivi C02A Sostanze antiadrenergiche ad azione centrale C02AB Agonisti dei recettori dell'imidazolina C02AB01 Metildopa ALDOMET*30CPR RIV 500MG A C02AC Agonisti dei recettori dell'imidazolina C02AC01 Clonidina CATAPRESAN TTS1*2CER 2,5M CATAPRESAN TTS2*2CER 5MG CATAPRESAN*30CPR 150MCG CATAPRESAN*5F 1ML 150MCG/ML C02C A A C A Sostanze antiadrenergiche ad azione periferica C02CA Bloccanti dei recettori alfa-adrenergici C02CA04 Doxazosina CARDURA*30CPR DIV 2MG CARDURA*20CPR DIV 4MG C02CA06 A A Urapidil EBRANTIL*IV 5F 50MG 10ML H/OSP1 C02D Sostanze ad azione sulla muscolatura liscia arteriolare C02DD Derivati nitroferricianurici C02DD01 Nitroprussiato SODIO NITROPR.MAL*EV 3F 100MG+ C/OSP1 Prontuario terapeutico della Provincia di Bologna 49 ATC Descrizione C02K Altri antiipertensivi C02KX Altri antiipertensivi C02KX01 Bosentan TRACLEER*56CPR RIV 125MG TRACLEER*56CPR RIV 62,5MG C la s s e S S N e concedibilità Note [Scheda CRF] H/OSP2 H/OSP2 [DocCRF] C03 Diuretici C03A Diuretici ad azione diuretica minore, tiazidi C03AA Tiazidi, non associate C03AA03 Idroclorotiazide ESIDREX*20CPR 25MG C03B Diuretici ad azione diuretica minore, escluse le tiazidi C03BA Sulfonamidi, non associate C03BA04 Clortalidone IGROTON 25*30CPR 25MG C03BA08 A A Diuretici ad azione diuretica maggiore C03CA Sulfonamidi, non associate C03CA01 Furosemide FUROSEMIDE*10F 20MG 2ML LASIX*INF 5F 250MG/25ML LASIX*30CPR 25MG LASIX*20CPR 500MG C03CA04 A Metolazone ZAROXOLYN*50CPR 10MG ZAROXOLYN*50CPR 5MG C03C A H/OSP1 A A A Torasemide DIUREMID*INIETT 5F 10MG/2ML RMP A Limitatamente a pazienti non responder in assenza di studi di superiorità vs il farmaco di riferimento furasemide. 50 Commissione provinciale del Farmaco Bologna ATC Descrizione C03CC Derivati dell'acido arilossiacetico C03CC01 Acido etacrinico REOMAX*20CPR 50MG REOMAX*IV F 50MG+F 20ML SOLV C la s s e S S N e concedibilità Note C C C03D Farmaci risparmiatori di potassio C03DA Antagonisti dell'aldosterone C03DA01 Spironolattone ALDACTONE*16CPS 25MG URACTONE*10CPR 100MG A A C03DA02 Canrenoato potassico KANRENOL*20CPR 100MG KANRENOL*INIET 6FL 200MG+6F2ML A H/OSP1 NB:in attesa di aggiudicazione di gara entro il 2007. C03E Diuretici e farmaci risparmiatori di potassio in associazione C03EA Diuretici ad azione diuretica minore e farmaci risparmiatori di potassio C03EA01 Amiloride + Idroclorotiazide MODURETIC*20CPR 5MG+50MG A C05 Vasoprotettori C05A Antiemorroidali per uso topico C05AA Prodotti a base di corticosteroidi C05AA08 Preparazioni antiemorroidarie + cortisonici ULTRAPROCT*UNG RETT 30G C C05B Terapia antivaricosa C05BB Sostanze sclerosanti per iniezioni locali C05BB02 Polidocanolo/Lauromacrogol 400 ATOSSISCLEROL*IV 5F 2ML 0,5% ATOSSISCLEROL*IV 5F 2ML 1% C C Prontuario terapeutico della Provincia di Bologna 51 ATC Descrizione ATOSSISCLEROL*IV 5F 2ML 2% C07 Betabloccanti C07A Betabloccanti C07AA Betabloccanti, non selettivi C07AA05 Propranololo INDERAL*28CPS 80MG R.P. INDERAL*30CPR 40MG C07AA07 C07AB02 A A A Metoprololo A H/OSP1 Atenololo ATENOLOLO TEVA*50CPR 100MG C07AB07 C Betabloccanti, selettivi SELOKEN*50CPR 100MG SELOKEN*IV 5F 5ML 5MG C07AB03 Note Sotalolo SOTALOLO TEVA*40CPR 80MG C07AB C la s s e S S N e concedibilità A Bisoprololo CARDICOR*28CPR RIV 1,25MG CARDICOR*28CPR RIV 2,5MG CARDICOR*28CPR RIV 3,75MG A A A C07AG Bloccanti dei recettori alfa- e beta-adrenergici C07AG01 Labetalolo TRANDATE*IV 1F 20ML 5MG/ML H/OSP1 C07AG02 Carvedilolo CARVEDILOLO TEVA*30CPR 25MG CARVEDILOLO TEVA*28CPR 6,25MG 52 A A Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note C08 Calcioantagonisti C08C Calcioantagonisti selettivi con prevalente effetto vascolare C08CA Derivati diidropiridinici C08CA01 Amlodipina NORVASC 10*14CPR 10MG NORVASC 5*28CPR 5MG C08CA02 Felodipina PREVEX 5*28CPR RIV 5MG R.P. C08CA05 A Nifedipina ADALAT A.R.*50CPR 20MG ADALAT CRONO*14CPR RIV 30MG ADALAT CRONO*14CPR RIV 60MG NIFEDICOR*OS FL GTT 30ML20MG/M C08CA06 A A A A A A Nimodipina NIMOTOP PER INF.*10MG/50ML+DEF NIMOTOP*OS GTT 25ML 4% RMP H/OSP1 C Limitatamente alla terapia di deficit neurologici ischemici correlati a vasospasmo cerebrale post-ESA. C08D Calcioantagonisti selettivi con effetto cardiaco diretto C08DA Derivati fenilalchilaminici C08DA01 Verapamil ISOPTIN*30CPR 240MG R.P. ISOPTIN*30CPR 120MG R.P. ISOPTIN FIALE*EV 5F 5MG 2ML VERAPAMIL ANG.*30CPR RIV 80MG C08DB A A A A Derivati benzotiazepinici C08DB01 Diltiazem ALTIAZEM*24CPR 120MG R.P. A Prontuario terapeutico della Provincia di Bologna 53 ATC Descrizione ALTIAZEM*50CPR 60MG ALTIAZEM*INIET 5FL 50MG+5F 5ML C la s s e S S N e concedibilità Note A A C09 Sostanze ad azione sul sistema renina-angiotensina C09A Inibitori dell'enzima di conversione dell'angiotensina (ACE), non associati C09AA Inibitori dell'enzima di conversione dell'angiotensina (ACE), non associati C09AA02 Enalapril NAPRILENE*14CPR 20MG NAPRILENE*28CPR 5MG C09AA03 Lisinopril ZESTRIL 20*14CPR 20MG ZESTRIL 5*14CPR 5MG C09AA05 A A A A Ramipril UNIPRIL*28CPR 2,5MG UNIPRIL*14CPR 5MG A A C09C Antagonisti dell'angiotensina II C09CA Antagonisti dell'angiotensina II, non associati C09CA04 Irbesartan KARVEA*28CPR 150MG KARVEA*28CPR 300MG A A Limitatamente alla prevenzione della nefropatia negli ipertesi diabetici C09CA06 Candesartan BLOPRESS*28CPR 16MG BLOPRESS*28CPR 32MG A A I principi attivi valsartan, candesarta e losartan sono stati ritenuti clinicamente equivalenti per le indicazioni di ipertensione arteriosa e scompensa cardiaco. NB: in attesa di aggiudicazione di gara entro il 2007. 54 Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note C10 Sostanze ipolipemizzanti C10A Ipocolesterolemizzanti ed ipotrigliceridemizzanti C10AA Inibitori della HMG CoA reduttasi - [DocCRF] C10AA01 Simvastatina SINVACOR*28CPR RIV 20MG SINVACOR*28CPR RIV 40MG C10AA03 13 13 A 13 A 13 Pravastatina SELECTIN 40*14CPR 40MG C10AA04 A A Fluvastatina LIPAXAN*28CPR 80MG R.P. Limitatamente a pazienti nefropatici e in dialisi, pazienti trapiantati. C10AA05 Atorvastatina TORVAST*30CPR 10MG TORVAST*30CPR 20MG TORVAST*30CPR 40MG C10AB C10AB04 A A A 13 13 13 A 13 Fibrati Gemfibrozil GEMFIBROZIL TEVA*20CPR RIV900M C10AC Sequestranti degli acidi biliari C10AC01 Colestiramina QUESTRAN*OS 12BUST 4G A C10AX Altri ipocolesterolemizzanti ed ipotrigliceridemizzanti C10AX06 Omega-3-trigliceridi SEACOR*20CPS 1G A Prontuario terapeutico della Provincia di Bologna 13 55 ATC Descrizione D Dermatologici C la s s e S S N e concedibilità D01 Antimicotici per uso dermatologico D01A Antimicotici per uso topico D01AC Derivati imidazolici e triazolici D01AC03 Econazolo PEVARYL*CREMA 30G 1% PEVARYL*EMULS CUT 30ML 1% PEVARYL*POLV CUT 30G 1% PEVARYL*SOL CUT 6BUST 10G 1% C C C C D01B Antimicotici per uso sistemico D01BA Antimicotici per uso sistemico D01BA01 Note Griseofulvina FULCIN 500*10CPR 500MG A D01BA02 Terbinafina TERBINAFINA TEVA*8CPR 250MG OP A D03 Preparati per il trattamento di ferite ed ulcerazioni D03A Cicatrizzanti D03AX Altri cicatrizzanti D03AX Frumento estratto + fenossietanolo FITOSTIMOLINE*10GARZE 15%+1% C D06AX09 Mupirocina BACTROBAN NASALE*POM 3G 2% C Limitatamente alla decontaminazione nei portatori di MRSA a livello nasale per l'eradicazione. D03B Enzimi D03BA Enzimi proteolitici D03BA02 Collagenasi NORUXOL*UNG 30G 56 C Commissione provinciale del Farmaco Bologna ATC Descrizione D05 Antipsoriasici D05A Antipsoriasici per uso topico D05AX Altri antipsoriasici per uso topico D05AX02 Calcipotriolo PSORCUTAN*CR IDROF 30G 0,005% PSORCUTAN*SOL CUT 30ML 50MCG/M C la s s e S S N e concedibilità Note A A D05B Antipsoriasici per uso sistemico D05BB Retinoidi per il trattamento della psoriasi D05BB02 Acitretina NEOTIGASON*30CPS 10MG NEOTIGASON*20CPS 25MG A A D06 Antibiotici e chemioterapici per uso dermatologico D06A Antibiotici per uso topico D06AX altri antibiotici per uso topico D06AX01 Acido fusidico FUCIDIN*CREMA 15G 2% C Il ricorso a terapia antibiotica topica deve essere il più possibile limitato in quanto favorisce l'insorgenza di resistenze e reazioni cutanee su base allergica. D06B Dermatologici D06BA Sulfamidici D06BA01 Sulfadiazina argentica SOFARGEN*CREMA 180G 1% SOFARGEN*CREMA 50G 1% D06BB Antivirali D06BB03 Aciclovir ZOVIRAX*CREMA 10G 5% D06BB10 H/OSP1 C C Imiquimod ALDARA*CREMA 5% 12BUST 250MG A PHT-PT Prontuario terapeutico della Provincia di Bologna 57 ATC Descrizione C la s s e S S N e concedibilità Note [DocCRF] D07 Corticosteroidi, preparati dermatologici D07A Corticosteroidi, non associati D07AB Corticosteroidi, moderatamente attivi (gruppo II) D07AB02 Idrocortisone butirrato LOCOIDON*CR IDROF 30G 0,1% D07AC D07AC01 A 88 A A A 88 88 88 A 88 Corticosteroidi, attivi (gruppo III) Betametasone ECOVAL*CREMA 30G 0,1% ECOVAL*EMULS CUT 30G 0,1% ECOVAL*UNG 30G 0,1% D07AC03 Desossimetasone FLUBASON*EMULS 15BUST 1D 2G D07AD Corticosteroidi, molto attivi (gruppo IV) D07AD01 Clobetasolo CLOBESOL*UNG DERM 30G 0,5MG/G D08 Antisettici e disinfettanti D08A Antisettici e disinfettanti D08AG Derivati dello iodio A D08AG02 Povidone-iodio BRAUNOL*10% UNG 20TUBI 20G D08AC Biguanidi e amidine D10BA01 Isotretinoina ROACCUTAN*30CPS 10MG ROACCUTAN*30CPS 20MG C/OSP1 A A [Scheda monitoraggio AIFA] 58 Commissione provinciale del Farmaco Bologna 88 ATC Descrizione C la s s e S S N e concedibilità D11 Altri preparati dermatologici D11A Altri preparati dermatologici D11AX Altri dermatologici D11AX14 Tacrolimus PROTOPIC*UNG 0,03% 30G PROTOPIC*UNG 0,1% 30G Note [SchedaCPF] H H Prontuario terapeutico della Provincia di Bologna 59 C la s s e S S N e concedibilità ATC Descrizione G Sistema genito-urinario e ormoni sessuali G01 Antimicrobici e antisettici ginecologici G01A Antimicrobici e antisettici, escluse le associazioni con corticosteroidi G01AF Derivati imidazolici G01AF01 Metronidazolo VAGILEN*10 OVULI VAG 500MG G01AF05 C Econazolo PEVARYL*15 OV VAG 50MG G01AX Altri antimicrobici e antisettici G01AX11 Iodopovidone BETADINE GINEC.P*5FL+5F+5CANN G02 Altri ginecologici G02A Oxitocici G02AB Alcaloidi della segale cornuta G02AB01 Metilergometrina METHERGIN*15CPR RIV 0,125MG METHERGIN*OS GTT 10ML 0,25MG/M METILERGOMETRINA MAL.*10F 0,2M G02AD Note C C A A A Prostaglandine G02AD02 Dinoprostone PREPIDIL*GEL 1SIR 0,5MG/3G PREPIDIL*GEL VAG 1SIR 1MG/3G PREPIDIL*GEL VAG 1SIR 2MG/3G PROPESS*5DISP VAG 10MG PROSTIN E2*INF 1F 0,75MG/0,75M H/OSP1 H/OSP1 H/OSP1 C/OSP1 H/OSP1 G02AD03 Gemeprost CERVIDIL*1 OV VAG 1MG 60 H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note G02AD05 Sulprostone NALADOR*EV 1F 0,5MG 2ML G02C Altri preparati ginecologici G02CA Simpaticomimetici, tocolitici H/OSP1 G02CA01 Ritodrina MIOLENE*20CPR 10MG MIOLENE*IV 3F 5ML 50MG G02CB G02CB01 A A Inibitori della prolattina Bromocriptina BROMOCRIPTINA DOROM*30CPR2,5MG A G02CB03 Cabergolina DOSTINEX*FL 8CPR 0,5MG G02CX A Altri ginecologici G02CX01 Atosiban acetato TRACTOCILE*EV 1FL 7,5MG/ML 0,9 TRACTOCILE*EV 1FL 7,5MG/ML 5ML RMP H/OSP1 H/OSP1 G03 Ormoni sessuali e modulatori del sistema genitale G03B Androgeni G03BA Derivati del 3-ossoandrostene (4) G03BA03 Testosterone ANDRIOL*60CPS 40MG TESTOVIS*IM 2F 2ML 100MG G03D Progestinici G03DA Derivati del pregnene (4) RMP A A 36 PHT-PT 36 PHT-PT G03DA04 Progesterone PROMETRIUM*OS VAG 30CPS 100MG PRONTOGEST*INIET 3F 1ML100MG/M A A Prontuario terapeutico della Provincia di Bologna 61 ATC Descrizione G03DB Derivati del pregnadiene C la s s e S S N e concedibilità Note G03DB01 Didrogesterone DUFASTON*10CPR RIV 10MG G03DC A Derivati dell'estrene G03DC02 Noretisterone PRIMOLUT NOR*30CPR 10MG A G03G Gonadotropine ed altri stimolanti dell ovulazione G03GA Gonadotropine G03GA02 Menotropina MENOGON*IM 10F+10F 1ML A 74 PHT-PT A 74 PHT-PT A A A A A 74 PHT-PT 74 PHT-PT 74 PHT-PT 74 PHT-PT 74 PHT-PT A A A A 74 PHT-PT 74 PHT-PT 74 PHT-PT 74 PHT-PT G03GA04 Urofollitropina FOSTIMON*1FL 75UI+1F 1ML G03GA05 Follitropina alfa GONAL F*SC 1PEN 300UI/0,5ML+5A GONAL F*SC 1PEN 450UI/0,75ML+7 GONAL F*SC FL 75UI+SIR 1ML GONAL F*SC 1PEN 900UI/1,5ML+14 GONAL F*(600UI) 1050UI/1,75ML G03GA06 Follitropina beta PUREGON*SC 1CART 300UI/0,36ML PUREGON*SC 1CART 600UI/0,72ML PUREGON*SC 1CART 900UI/1,08ML PUREGON*IM SC 5FL 100UI/0,5ML G03H Antiandrogeni G03HA Antiandrogeni, non associati G03HA01 Ciproterone ANDROCUR*30CPR 100MG ANDROCUR*IM 1F 3ML 300MG RP ANDROCUR*25CPR 50MG 62 A A A Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione Note G03X Altri ormoni sessuali e modulatori del sistema genitale G03XA Antigonadotropine e sostanze similari G03XA01 Danazolo DANATROL*30CPS 200MG A G04 Urologici G04B Altri urologici, inclusi gli antispastici G04BD Antispastici urinari G04BD04 Ossibutinina DITROPAN*30CPR 5MG C G04BE Farmaci usati nella disfunzione dell'erezione G04BE01 Alprostadil CAVERJECT*F 10MCG+SIR+2AGHI+2T CAVERJECT*F 20MCG+SIR+2AGHI+2T G04BE03 Sildenafil VIAGRA*8CPR 50MG G04BE08 PT-RER PT-RER C C Vardenafil LEVITRA*4CPR RIV 10MG LEVITRA*4CPR RIV 20MG G04BX Altri urologici G04BX Lidocaina cloridrato LUAN*POM 15G 2,5% 75 75 C Tadalafil CIALIS*4CPR RIV 10MG CIALIS*4CPR RIV 20MG G04BE09 PT-RER A C PT-RER C C C Prontuario terapeutico della Provincia di Bologna 63 C la s s e S S N e concedibilità ATC Descrizione Note G04C Farmaci usati nell'ipertrofia prostatica benigna G04CA Antagonisti dei recettori alfa-adrenergici G04CA01 Alfuzosina MITTOVAL*30CPR RIV 2,5MG A G04CA02 Tamsulosina OMNIC*20CPS 0,4MG R.M. A I principi attivi tamsulosina e alfuzosina sono farmaci di pari efficacia nel trattamento dell'IPB, sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato a tamsulosina. G04CA03 Terazosina URODIE*14CPR DIV 5MG A I principi attivi terazosina e doxazosina sono farmaci di pari efficacia nel trattamento dell'IPB, sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato a terazosina. G04CB Inibitori della testosterone-5-alfa riduttasi G04CB01 Finasteride PROSTIDE*15CPR RIV 5MG A I principi attivi finasteride e dutasteride sono farmaci di pari efficacia nel trattamento dell'IPB, sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato a finasteride. 64 Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione Note H Preparati ormonali sistemici, esclusi gli ormoni sessuali H01 Ormoni ipofisari, ipotalamici e analoghi H01A Ormoni del lobo anteriore dell'ipofisi H01AC Somatropina e agonisti della somatropina H01AC01 Somatropina GENOTROPIN MINI*7TBF 0,2MG(0,6 GENOTROPIN MINI*7TBF 0,4MG(1,2 GENOTROPIN MINI*7TBF 0,6MG(1,8 GENOTROPIN MINI*7TBF 0,8MG(2,4 GENOTROPIN MINI*4TBF 1,2MG(3,6 GENOTROPIN MINI*4TBF 1,4MG(4,2 GENOTROPIN MINI*4TBF 1,6MG(4,8 GENOTROPIN MINI*4TBF 1,8MG(5,4 GENOTROPIN MINI*7TBF 1MG(3UI)+ GENOTROPIN MINI*4TBF 2MG(6UI) HUMATROPE*1CART 12MG(36UI)+SIR HUMATROPE*1CART 6MG (18UI)+SIR NUTROPINAQ*SC 1CART 2ML10MG/2M A A A A A A A A A A C A A 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT 39 PHT-PT Per l'acquisto dell principio attivo somatropina è stata effettuata una gara regionale con l'obiettivo di metterlo a disposizione sia nella formulazione pluridose (2 specialità medicinali), sia la formulazione monodose. In base agli esiti della gara il lotto è stato aggiudicato: a NUTROPINAQ (Ipsen) per il 70% del fabbisogno del pluridose, a HUMATROPE(Eli-Lilly) per il restante 30%. Per la formulazione monodose si è proceduto alla contrattazione per l'acquisto delle quote necessarie di GENOTROPIN MINI-QUICK siringhe monodose (Pfizer). H01AX Altri ormoni del lobo anteriore dell'ipofisi e analoghi H01AX01 Pegvisomant SOMAVERT*SC 30FL 10MG+30FL 8ML SOMAVERT*SC 30FL 15MG+30FL 8ML SOMAVERT*SC 30FL 20MG+30FL 8ML RMP H/OSP2 H/OSP2 H/OSP2 Prontuario terapeutico della Provincia di Bologna 65 ATC Descrizione C la s s e S S N e concedibilità H01B Ormoni del lobo posteriore dell'ipofisi H01BA Vasopressina e analoghi Note H01BA02 Desmopressina EMOSINT*IM EV SC 10F 20MCG 1ML MINIRIN/DDAVP*30CPR 0,1MG MINIRIN/DDAVP*RIN 2,5ML 250MCG MINIRIN/DDAVP*INIET 10F 4MCG/M MINIRIN/DDAVP*SPR NAS 0,125MG A A A A A PHT-PT H01BA04 Terlipressina GLIPRESSINA*5FL+5F 5ML 1MG/1ML H/OSP1 Limitatamente al trattamento dell'emorragia da varici esofagee H01BB Oxitocina e suoi derivati H01BB02 Ossitocina OSSITOCINA*INIET 6F 1ML 5UI H/OSP1 H01C Ormoni ipotalamici H01CA Ormoni liberatori delle gonadotropine H01CA01 Gonadorelina acetato KRYPTOCUR*NAS 2FL 10G+2EROG LUTRELEF*FL 0,8MG/10ML+FL+SIR H01CB A C PHT-PT Ormone anticrescita H01CB01 Somatostatina SOMATOSTATINA PH&T*EV FL 3MG+F H/OSP1 Limitatamente al trattamento di gravi emorragie acute del tratto gastroenterico superiore. H01CB02 Octreotide SANDOSTATINA LAR*FL 10MG+SIR+2 SANDOSTATINA LAR*FL 20MG+SIR+2 SANDOSTATINA LAR*FL 30MG+SIR+2 SANDOSTATINA*INIET 5F 0,1MG/ML SANDOSTATINA*INIET 3F 0,5MG/ML 66 A A A A A 40 PHT-PT 40 PHT-PT 40 PHT-PT 40 PHT-PT 40 PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione SANDOSTATINA*IV SC FL 0,2MG/ML H01CB03 C la s s e S S N e concedibilità A 40 PHT-PT A A 40 PHT-PT 40 PHT-PT Lanreotide IPSTYL*SC 1SIR 60MG IPSTYL*IM FL30MG+F2ML+2AGH+SIR H02 Corticosteroidi sistemici H02A Corticosteroidi sistemici, non associati H02AA Mineralcorticoidi H02AA02 Note Fludrocortisone estero FLORINEF 0,1MG 56CPR H02AB Glicocorticoidi H02AB01 Betametasone [d. az. lunga] BENTELAN*10CPR EFF 0,5MG BENTELAN*INIET 6F 1,5MG/2ML BENTELAN*IM IV 3F 2ML 4MG A A A H02AB02 Desametasone [d. az. lunga] DECADRON*10CPR 0,5MG DECADRON*10CPR 0,75MG DECADRON*INIET 1F 1ML 4MG/1ML DECADRON*INIET 1F 2ML 8MG/2ML SOLDESAM*OS GTT 10ML 0,2% C A C C A H02AB04 Metilprednisolone [d. az. intermedia] DEPOMEDROL*1FL 40MG 1ML+1SIR MEDROL*20CPR DIV 16MG MEDROL*30CPR DIV 4MG SOLUMEDROL*IM IV FL 40MG 1ML SOLUMEDROL*IM IV FL 125MG 2ML SOLUMEDROL*IM IV FL 1G+F 16ML SOLUMEDROL*IM IV FL 2G+F 32ML SOLUMEDROL*IM IV FL 500MG+F8ML URBASON*IM EV 1F 250MG+1F 5ML C A C C A A A A C Prontuario terapeutico della Provincia di Bologna 67 ATC Descrizione URBASON*IM EV 3F 20MG+3F 1ML C la s s e S S N e concedibilità Note C H02AB07 Prednisone [d. az. intermedia] DELTACORTENE*10CPR 25MG DELTACORTENE*10CPR 5MG A A H02AB08 Triamcinolone [d. az. intermedia] TRIACORT*INIET 3FL 40MG/1ML A H02AB09 Idrocortisone [d. az.breve] FLEBOCORTID*EV 1FL 1G+F 10ML FLEBOCORTID*EV 1FL 500MG+F 5ML SOLUCORTEF*1FL 100MG/2ML 2ML SOLUCORTEF*1FL 250MG/2ML 2ML SOLUCORTEF*1FL 500MG/4ML 4ML H02AB10 A C C C C Cortisone [d. az.breve] CORTONE ACETATO*20CPR 25MG H03 Terapia tiroidea H03A Preparati tiroidei H03AA Ormoni tiroidei H03AA01 Levotiroxina EUTIROX*BLIST 50CPR 100MCG EUTIROX*BLISTER 50CPR 25MCG EUTIROX*BLISTER 50CPR 50MCG H03B Preparati antitiroidei H03BA Tiouracilici H03BA02 Propiltiouracile A A A A estero PROPYCIL 50 MG CPR 68 Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità H03BB Derivati imidazolici contenenti zolfo H03BB02 Tiamazolo TAPAZOLE*100CPR 5MG H03BC Note A Perclorati H03BC01 Potassio perclorato H04 Ormoni pancreatici H04A Ormoni glicogenolitici H04AA Ormoni glicogenolitici H04AA01 Glucagone GLUCAGEN*FL 1MG+FL 1ML SOLV H/OSP1 H05 Calcio-omeostatici H05A Ormoni paratiroidei e analoghi H05AA Ormoni paratiroidei e analoghi H05AA02 Teriparatide FORSTEO*SC 1PEN 3ML20MCG/80MCL [SchedaCPF] A 79 [DocCRF] H05B Ormoni antiparatiroidei H05BX Altre sostanze paratiroidee H05BX01 Cinacalcet MIMPARA*28CPR RIV 30MG MIMPARA*28CPR RIV 60MG [SchedaCPF] A A PHT-PT PHT-PT [DocCRF] Prontuario terapeutico della Provincia di Bologna 69 ATC Descrizione Note J Antimicrobici generali per uso sistemico J01 Antibatterici per uso sistemico J01A Tetracicline J01AA Tetracicline J01AA02 Doxiciclina BASSADO*10CPR 100MG J01AA08 J01B Amfenicoli J01BA01 Cloramfenicolo CLORAMFENICOLO*1FL 1G Penicilline ad ampio spettro J01CA01 Ampicillina AMPLITAL*IM EV 1FL 1G+F 4ML AMPLITAL*INIET 1F 500MG+F2,5ML A C Amoxicillina VELAMOX*12CPR DISP 1G VELAMOX*12CPS 500MG ZIMOX*OS POLVxSOSP FL 250MG/5M J01CA12 A Antibatterici beta-lattamici, penicilline J01CA J01CA04 A Amfenicoli J01BA J01C A Minociclina MINOCIN*8CPS 100MG A A A Piperacillina PIPERTEX*INIET F 2G+F 4ML SOLV PIPERTEX*INIET 10F 4G A H/OSP1 J01CE Penicilline sensibili alla beta-lattamasi J01CE01 Benzilpenicillina PENICILLINA G SQUIBB K*1/M UI 70 C la s s e S S N e concedibilità A Commissione provinciale del Farmaco Bologna 55 ATC Descrizione J01CE08 Benzilpenicillina benzatinica DIAMINOCILLINA*FL 1200000UI+F C la s s e S S N e concedibilità A J01CF Penicilline resistenti alla beta-lattamasi J01CF04 Oxacillina PENSTAPHO*IM IV 1FL+F 1G J01CR Note A Associazioni di penicilline, inclusi gli inibitori delle beta-lattamasi - Amoxi/clav. e ampicillina/sulbactam nelle formulazioni iniettabili sono stati ritenuti clinicamente equivalenti per il trattamento empirico e profilassi chirurgica. Il lotto di gara è stato aggiudicato all'associazione ampicillina/sulbactam. J01CR01 Ampicillina + Sulbactam UNASYN*EV 1FL 1G+2G UNASYN*EV 1FL 1G+500MG/3,2ML+F J01CR02 H/OSP1 H/OSP1 Amoxicillina + Acido clavulanico AUGMENTIN*12CPR RIV 875MG+125M AUGMENTIN*BB SOSP FL 70ML C/C A A La formulazione per os è in attesa di aggiudicazione di gara entro il 2007. Nei bambini di età inferiore ad 1 anno può essere utilizzata la formulazione iniettabile. J01CR05 Piperacillina + Tazobactam TAZOCIN*IM 1FL 2G+0,25G/4ML+F TAZOCIN*EV 1FL 4G+0,500G A H/OSP1 J01D Altri antibatterici beta-lattamici J01DB Cefalosporine di prima generazione J01DB01 Cefalexina CEPOREX*8CPR RIV 1G KEFORAL*OS SOSP 100ML 250MG/5M J01DB04 55 A A Cefazolina CEFAMEZIN*IV 1FL 1G+F 10ML C Prontuario terapeutico della Provincia di Bologna 71 ATC Descrizione CEFAMEZIN*IM 1FL 1G+F 4ML C la s s e S S N e concedibilità A J01DC Cefalosporine di seconda generazione J01DC01 Cefoxitina MEFOXIN*IM 1FL 1G+F 2ML MEFOXIN*IV 1FL 2G+F 20ML J01DC02 C C A Cefaclor PANACEF*GRATxSOSP 250MG/5ML PANACEF*8CPS 500MG J01DC06 55 Cefuroxima axetil ORAXIM*6CPR RIV 500MG J01DC04 A H/OSP1 Cefuroxima CUROXIM VENA 1*IV 1F 1G+F 10ML CUROXIM VENA 2*IV FL 2G J01DC02 Note A A Cefonicid RAIKOCEF*IM 1F 1G+F 2,5ML A J01DD Cefalosporine di terza generazione J01DD01 Cefotaxima TAXIME*IM EV 1FL 1G+F 4ML TAXIME*EV 1FL 2G+F 10ML 2G/10M A H/OSP1 55 55 Le cefalosporine metossiminiche non attive su pseudomonas a breve durata d'azione, cefotaxima e ceftizoxima sono state considerate terapeuticamente equivalenti nel trattamento di alcune patologie infettive di interesse ospedaliero. Sono state poste in gara in alternativa ed il lotto di gara è stato aggiudicato a cefotaxima. J01DD02 Ceftazidima GLAZIDIM VENA 2*EV 1FL 2G GLAZIDIM 1*IM 1FL 1G/3ML+F 3ML 72 H/OSP1 A Commissione provinciale del Farmaco Bologna 55 ATC Descrizione GLAZIDIM*IM 1FL 500MG/1,5ML+1F C la s s e S S N e concedibilità Note A 55 I principi attivi ceftazidima e cefepime sono stati valutati secondo il criterio di selezione dell'equivalenza terapeutica e posti in gara in alternativa. Il lotto di gara è stato aggiudicato al principio attivo ceftazidima. In caso di resistenza a ceftadizima, documentata con antibiogramma, è possibile richiedere cefepime con RMP. J01DD04 Ceftriaxone FIDATO*EV 1F 1G/10ML+F 10ML FIDATO*IM 1FL 1G/3,5ML+F 3,5ML FIDATO*INF 1FL 2G POLV FIDATO*IM 1FL 500MG/2ML+F 2ML H/OSP1 A H/OSP1 A 55 55 "...segnalazioni di gravi reazioni in bambini prematuri o neonati trattati con ceftriaxone per via endovenosa in concomitanza con gluconato di calcio..." (DDL AIFA, giugno 2007)) J01DD08 Cefixima CEFIXORAL*5CPR RIV 400MG CEFIXORAL*OS 100ML 100MG/5ML+S A A I principi attivi cefixima,ceftibuten e cefpodoxima proxetil sono stati valutati secondo il criterio di selezione dell'equivalenza terapeutica e posti in gara in alternativa Il lotto di gara è stato aggiudicato al principio attivo cefixima. J01DF Monobattami J01DF01 Aztreonam AZACTAM*IM EV FL 1G+F 3ML A 56 Spettro antibatterico limitato a batteri aerobi gram negativi. Non utilizzare da solo come trattamento iniziale aspecifico. J01DH Carbapenemi J01DH02 Meropenem MERREM*EV POLV 10FL 1000MG H 56 I principi attivi meropenem e imipenem/cilastatina sono stati ritenuti clinicamente equivalenti per il trattamento empirico e mirato delle infezioni gravi dei principali organi e apparati, causati dai batteri sensibili ai carbapenemi, compresa la neutropenia febbrile. Sono stati posti in gara in alternativa ed il lotto di gara è stato aggiudicato a meropenem. Prontuario terapeutico della Provincia di Bologna 73 ATC Descrizione J01E Sulfamidici e trimetoprim J01EC Sulfamidici ad azione intermedia J01EC02 Sulfadiazina SULFADIAZINA*20CPR 500MG C la s s e S S N e concedibilità Note A J01EE Associazioni di sulfamidici con trimetoprim, inclusi i derivati J01EE01 Sulfametoxazolo + Trimetoprim BACTRIM*SCIR 100ML 80MG+400MG BACTRIM PERFUSIONE*IV 1F 5ML BACTRIM*FTE 16CPR J01F Macrolidi e lincosamidi J01FA Macrolidi A A A - Per i principi attivi eritromicina, azitromicina e claritromicina è stato possibile stabilire un'equivalenza terapeutica solo per azitromicina e claritromicina, per le indicazioni delle infezioni delle basse vie respiratorie causate da batteri tipici e atipici, per le infezioni gravi della cute e dei tessuti molli sensibili ai macrolidi e per le infezioni da micobatteri in pazienti con HIV. Il lotto di gara è stato aggiudicato al principio attivo azitromicina per la formulazione iniettabile e alla claritromicina per la formulazione orale. L'eritromicina è l'unico macrolide ad avere l'indicazione registrata per l'uso ev in pediatria (dai lattanti fino ai bambini di 12 anni). J01FA01 Eritromicina ERITROMICINA LATTOBION*1000MG ERITROMICINA LATTOBION*500MG ERITROCINA*12CPR RIV 600MG ERITROCINA*OS GRAT 6BUST 1000M ERITROCINA*OS SOSP 100ML 10% J01FA02 Spiramicina ROVAMICINA*12CPR RIV 3000000UI J01FA09 A Claritromicina KLACID RM*7CPR RIV 500MG KLACID*BB OS GRAT 100ML 125MG/ KLACID*12CPR RIV 250MG KLACID*OS GRATxSOSP 14BUST 250 74 A A A A A A A A A Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità KLACID*BB OS GRAT 100ML 250MG/ KLACID 500*14CPR RIV 500MG J01FA10 J01FF Lincosamidi J01FF01 Clindamicina DALACIN C FOSF.*1F 4ML 600MG/4 DALACIN C*12CPS 150MG J01G Antibatterici aminoglicosidici J01GA Streptomicine J01GB Altri aminoglicosidi J01GB01 Tobramicina BRAMICIL*INIET 1F 100MG 2ML BRAMICIL*INIET 1F 150MG 2ML NEBICINA*IM IV 1F 2ML 20MG TOBI*56F MONODOSE 300MG/5ML A A A A H/OSP2 55 55 55 A C H/OSP1 55 Amikacina AMIKACINA TEVA*IM EV 5F 500MG J01GB07 A A Gentamicina GENTALYN*BB 10 IM 5F 10MG 1ML GENTALYN*BB 20 IM 1F 20MG 2ML GENTAMICINA SOLFATO*10F 80MG/2 J01GB06 H/OSP1 Streptomicina STREPTOMICINA SOLF.SQUIBB*1/MU J01GB03 A A Azitromicina ZITROMAX*EV 1FL 500MG POLV J01GA01 Note H/OSP1 Netilmicina ZETAMICIN 100*IM IV F 100MG/ML ZETAMICIN 150*IM IV F150MG/1,5 A A Prontuario terapeutico della Provincia di Bologna 55 55 75 ATC Descrizione ZETAMICIN 15*IM IV F 15MG/1,5M ZETAMICIN 300*IM IV F 300MG/3M ZETAMICIN 50*IM IV F 1ML 50MG/ J01M Antibatterici chinolonici J01MA Fluorochinoloni C la s s e S S N e concedibilità Note C A A 55 55 J01MA02 Ciprofloxacina CIPROXIN*INFUS FL 200MG 100ML CIPROXIN*10CPR RIV 250MG CIPROXIN*5% OS SOSP FL 100ML CIPROXIN*INFUS FL 400MG 200ML CIPROXIN*6CPR RIV 500MG CIPROXIN 750*12CPR RIV 750MG H/OSP1 A A H/OSP1 A A J01MA06 Norfloxacina UTICINA*14CPR RIV 400MG A J01MA12 Levofloxacina LEVOXACIN*IV FL 100ML 5MG/ML H/OSP1 J01MA14 Moxifloxacina AVALOX*5CPR RIV 400MG PP/AL A I principi attivi moxifloxacina e levofloxacina per uso orale sono stati ritenuti terapeuticamente equivalenti nel trattamento delle infezioni delle alte e basse vie respiratorie sostenute da pneumococchi e sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato al principio attivo moxifloxacina. J01MB Altri chinolonici J01MB04 Acido pipemidico PIPEMID 400*20CPS 400MG J01X Altri antibatterici J01XA Antibatterici glicopeptidici J01XA01 Vancomicina VANCOMICINA IBP P.*EV OS 1G 76 A H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione VANCOMICINA IBP P.*EV OS 500MG J01XA02 J01XB01 J01XD01 J01XE01 56 Colistina C Derivati imidazolici Metronidazolo DEFLAMON FLEBO*IV FL 500MG 100 J01XE RMP A Antibatterici glicopeptidici COLIMICINA*IM FL 1000000U4ML+F J01XD Note H/OSP1 Teicoplanina TARGOSID*IM IV 1F 200MG+F 3ML J01XB C la s s e S S N e concedibilità A Derivati nitrofuranici Nitrofurantoina NEOFURADANTIN*20CPS 50MG J01XX Altri antibatterici J01XX08 Linezolid ZYVOXID*10CPR RIV 600MG BLIST ZYVOXID*10SACCHE INF 2MG/ML C RMP H/OSP2 H/OSP1 [Scheda monitoraggio AIFA] "...Linezolid deve essere utilizzao per il trattamento delle infezioni complicate della cute e tessuti molli solo quando i test microbiologici hanno accertato che l'infezione è causata da batteri gram positivi..." (DDL AIFA, marzo 2007). J02 Antimicotici per uso sistemico J02A Antimicotici per uso sistemico J02AA Antibiotici - [DocCRF] J02AA01 Amfotericina B FUNGIZONE*IV FL POLV 50MG 15ML J02AA01 RMP H/OSP1 Amfotericina B complesso lipidico ABELCET*EV 10FL 20ML+10AGHI RMP H/OSP1 Prontuario terapeutico della Provincia di Bologna 77 ATC Descrizione J02AA01 Amfotericina B liposomiale AMBISOME*INFUS 10FL LIOF 50MG J02AC Derivati triazolici J02AC01 Fluconazolo DIFLUCAN*10CPS 100MG DIFLUCAN*INFUS FL 100MG/50ML DIFLUCAN*2CPS 150MG DIFLUCAN*INFUS FL 200MG/100ML DIFLUCAN*INFUS FL 400MG/200ML DIFLUCAN*7CPS 50MG DIFLUCAN*OS SOSP 350MG 50MG/5M J02AC02 Note RMP C/OSP1 A H/OSP1 A H/OSP1 H/OSP1 C A Itraconazolo SPORANOX*8CPS 100MG SPORANOX*F 25ML+NACL 100ML 0,9 TRIASPORIN*OS FL 150ML 10MG/ML J02AC03 C la s s e S S N e concedibilità A H/OSP1 A Voriconazolo VFEND*28CPR RIV 200MG VFEND*28CPR RIV 50MG VFEND*INF EV FL 200MG RMP H/OSP2 H/OSP2 H/OSP2 J02AX Altri antimicotici per uso sistemico J02AX04 Caspofungin CANCIDAS*EV FL 50MG 10ML CANCIDAS*EV FL 70MG 10ML RMP H/OSP1 H/OSP1 J04 Antimicobatteri J04A Farmaci per il trattamento della tubercolosi J04AB Antibiotici J04AB01 Cicloserina estero CYCLOSERINE 250 MG CPS 78 Commissione provinciale del Farmaco Bologna ATC Descrizione J04AB02 Rifampicina RIFADIN*8CPS 300MG RIFADIN*SCIR 60ML 20MG/ML RIFADIN*EV 1F 600MG+F 10ML RIFADIN*8CPR RIV 600MG RIFADIN*8CPR RIV 450MG J04AB04 J04AC Idrazidi J04AC01 Isoniazide NICOZID*50CPR 200MG NICOZID*IM 6F 2ML 100MG NICOZID*IM IV 5F 5ML 500MG J04AK01 A A A A A A A C A Pirazinamide A Etambutolo ETAPIAM*50CPR RIV 400MG ETAPIAM*50CPR RIV 500MG ETAPIAM*FLEB 10F 500MG 3ML A C C J04AM Associazioni di farmaci per il trattamento della tubercolosi J04AM Etambutolo + Isoniazide + Piridossina ETANICOZID B6*50CPR VERNIC J04B 56 Altri farmaci per il trattamento della tubercolosi PIRALDINA*50CPR 500MG J04AK02 Note Rifabutina MYCOBUTIN*30CPS 150MG J04AK C la s s e S S N e concedibilità A Farmaci per il trattamento della lebbra J04BA Farmaci per il trattamento della lebbra J04BA02 Dapsone estero DAPSONE 25 MG CPR DAPSONE 50 MG CPR Prontuario terapeutico della Provincia di Bologna 79 ATC Descrizione Note J05 Antivirali per uso sistemico J05A Antivirali ad azione diretta J05AB Nucleosidi e nucleotidi escl. inibitori della transcriptasi inversa J05AB01 Aciclovir ACICLIN*25CPR 400MG ACICLIN*35CPR 800MG ACICLOVIR ABC*OS 100ML 8% ACICLOVIR RECORDATI*EV 5F250MG ZOVIRAX*INIET 5FL 500MG J05AB04 J05AB06 H/OSP1 A 84 Cidofovir VISTIDE*IV INFUS 1F 375MG 5ML J05AB14 H/OSP2 Valaciclovir TALAVIR*21CPR RIV 1G J05AB12 84 84 84 84 Ganciclovir CYMEVENE*INFUS FL 500MG+F 10ML J05AB11 A A A A H/OSP1 Ribavirina COPEGUS*42CPR RIV 200MG H/OSP1 Valganciclovir VALCYTE*60CPR RIV 450MG J05AD Derivati dell'acido fosfonico J05AD01 Foscarnet FOSCAVIR*EV SOLxINF FL 250ML J05AE Inibitori della proteasi J05AE01 Saquinavir FORTOVASE*1FL 180CPS 200MG INVIRASE*FL 120CPR RIV 500MG 80 C la s s e S S N e concedibilità A PHT-PT H/OSP1 PHT-PT H/OSP2 H/OSP2 Commissione provinciale del Farmaco Bologna ATC Descrizione J05AE02 Indinavir CRIXIVAN*180CPS 400MG J05AE03 H/OSP2 H/OSP2 H/OSP2 Atazanavir REYATAZ*60CPS 150MG REYATAZ*60CPS 200MG J05AE09 H/OSP2 H/OSP2 Fosamprenavir TELZIR*1FL 60CPR RIV 700MG J05AE08 H/OSP2 Lopinavir + Ritonavir KALETRA*BLIST 180CPS MOLLI KALETRA*OS 5FL 60ML+5SIR J05AE07 Note Ritonavir NORVIR*4FL 84CPS MOLLI 100MG NORVIR*OS 5FL 90ML 80MG/ML J05AE06 C la s s e S S N e concedibilità H/OSP2 H/OSP2 Tipranavir APTIVUS*FL 120CPS MOLLI 250MG H/OSP2 [Scheda monitoraggio AIFA] J05AF Inibitori della transcriptasi inversa, nucleosidi J05AF01 Zidovudina RETROVIR*SCIR 200ML 100MG/ML RETROVIR*EV 5FL 20ML 200MG RETROVIR*60CPS 250MG RETROVIR*60CPR 300MG J05AF02 A A A A Didanosina VIDEX*30CPS GASTR 125MG VIDEX*30CPS GASTR 200MG VIDEX*30CPS GASTR 250MG VIDEX*30CPS GASTR 400MG H/OSP2 H/OSP2 H/OSP2 H/OSP2 Prontuario terapeutico della Provincia di Bologna 81 ATC Descrizione VIDEX*OS POLVxSOL 1FL 4G J05AF03 H/OSP2 H/OSP2 H/OSP2 A A 32 bis PHT-PT 32 bis PHT-PT H/OSP2 Tenofovir VIREAD*30CPR 245MG J05AF08 H/OSP2 H/OSP2 H/OSP2 H/OSP2 Abacavir ZIAGEN*6BLISTER 10CPR 300MG J05AF07 A Lamivudina EPIVIR*OS FL 240ML 10MG/ML EPIVIR*FL 60CPR RIV 150MG EPIVIR*FL 30CPR RIV 300MG ZEFFIX*28CPR RIV 100MG ZEFFIX*OS FL 240ML 5MG/ML J05AF06 H/OSP2 Stavudina ZERIT*56CPS 15MG ZERIT*56CPS 20MG ZERIT*56CPS 30MG ZERIT*56CPS 40MG J05AF05 Note Zalcitabina HIVID*100CPR RIV 0,750MG J05AF04 C la s s e S S N e concedibilità H/OSP2 Adefovir dipivoxil HEPSERA*1FL 30CPR 10MG H/OSP2 [Scheda monitoraggio AIFA] J05AF09 Emtricitabina EMTRIVA*1FL 30CPS 200MG J05AG Inibitori della transcriptasi inversa, non nucleosidi J05AG01 Nevirapina VIRAMUNE*60CPR 200MG 82 H/OSP2 H/OSP2 Commissione provinciale del Farmaco Bologna ATC Descrizione VIRAMUNE*OS SOSP FL240ML 50MG/ J05AG03 J05AR01 H/OSP2 Lamivudina+ Abacavir H/OSP2 Emtricitabina + Tenofovir TRUVADA*30CPR RIV 200MG/245MG J05AR04 H/OSP2 H/OSP2 H/OSP2 Lamivudina+ Zidovudina KIVEXA*BL 30CPR RIV 600MG+300M J05AR03 H/OSP2 Antivirali ad azione diretta , associazioni COMBIVIR*BLISTER 60CPR RIV J05AR02 Note Efavirenz SUSTIVA*FL 90CPS 200MG SUSTIVA*FL 30CPS 50MG SUSTIVA*30CPR RIV 600MG BLIST J05AR C la s s e S S N e concedibilità H/OSP2 Abacavir + Lamivudina + Zidovudina TRIZIVIR*BLIST 60CPR RIV J05AX Altri antivirali J05AX07 Enfuvirtide FUZEON*SC 60FL POLV+60FLSOL+60 H/OSP2 H/OSP2 [Scheda monitoraggio AIFA] J06 Sieri immuni e immunoglobuline J06A Sieri immuni J06AA Sieri immuni J06AA03 Sierimmune antivipera estero EUROP. VIPER VENUM ANTISERUM 100LD 50 di vip ammodytes + 100L D50 vip aspis + 50LD50 vip berus + 50LD50 vip ursinii J06AA04 Sierimmune antibotulinico estero Prontuario terapeutico della Provincia di Bologna 83 ATC Descrizione J06AA05 Sierimmune antigangrena gassosa J06B Immunoglobuline Immunoglobuline umane normali J06BA02 Immunoglobulina umana ad alto titolo di IgM J06BA02 J06BB Immunoglobuline specifiche J06BB01 Immunoglobulina umana anti-D Rh0 RHOPHYLAC*1SIR 300MCG/2ML J06BB02 A A H/OSP1 H/OSP1 H/OSP1 Immunoglobulina umana antiepatite B IMMUNOHBS*IM 1F 1ML 180UI IMMUNOHBS*IM 1F 3ML 540UI NEOHEPATECT*IV FL 40ML/2000UI NEOHEPATECT*IV 1F 10ML/500UI J06BB09 C Immunoglobulina umana della varicella VARITECT*IV 1F 20ML 500UI VARITECT*IV 1F 5ML 125UI VARITECT*IV 1FL 50ML 1250UI J06BB04 RMP H/OSP1 H/OSP1 Immunoglobulina umana tetanica IGANTET*IM 1SIR 1ML 250UI IGANTET*IM 1SIR 2ML 500UI J06BB03 RMP C/OSP1 C/OSP1 Immunoglobulina umana normale IGVENA*FL 100ML 5G+SET IGVENA*FL 50ML 2,5G+SET Note estero J06BA PENTAGLOBIN*EV 1F 50MG/ML 10ML PENTAGLOBIN*EV 1FL 50MG/ML100M A A H/OSP1 H/OSP1 Immunoglobulina umana citomegalovirica CYTOTECT BIOTEST*EV 10ML 500U CYTOTECT BIOTEST*EV 20ML 1000U 84 C la s s e S S N e concedibilità H/OSP1 H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione CYTOTECT BIOTEST*EV 50ML 2500U J06BB16 C la s s e S S N e concedibilità Note H/OSP1 Palivizumab SYNAGIS*IM 1F 100MG+1AMP SOLV SYNAGIS*IM 1F 50MG+1AMP SOLV H/OSP1 H/OSP1 Raccomandazioni RER J07 Vaccini J07A Vaccini batterici J07AE Vaccini colerici inattivato a cellula intera J07AE01 Vaccino colerico DUKORAL*OS 2FL 3ML C J07AG Vaccini dell'Hemophilus influenzae tipo B J07AG51 Vaccino H. influenzae coniugato al tossoide tetanico ACTHIB*IM 1FL 1D LIOF+SIR C J07AH Vaccini meningococcici J07AH04 Vaccino meningococcico polisaccaridico MENCEVAX ACWY*SC FL+SIR 0,5ML J07AH07 C Vaccino meningococcico coniugato con tossoide tetanico MENJUGATE*FL POLV+FL 0,5MLSOLV C J07AJ Vaccini pertossici J07AJ52 Vaccino difterico, tetanico e pertossico acellulare a partire dai 4 anni di età BOOSTRIX*IM SOSP 1SIR C/AGO J07AJ52 C Vaccino difterico, tetanico e pertossico acellulare a partire dal 2° mese di vita INFANRIX DTPA*IM 1SIR 0,5ML C Prontuario terapeutico della Provincia di Bologna 85 ATC Descrizione C la s s e S S N e concedibilità Note J07AL Vaccini pneumococcici J07AL01 Vaccino pneumococcico, antigene polisaccaridico purificato PNEUMO 23*INIET 1SIR 0,5ML J07AL02 Vaccino pneumococcico, antigene polisaccaridico purificato coniugato PREVENAR*INIET 1FL 0,5ML J07AM C C Vaccini tetanici J07AM01 Vaccino tetanico adsorbito IMOVAX TETANO*1SIR 0,5ML 40UI C J07AM51 Vaccino difterico e tetanico adsorbito DITANRIX*AD IM 1SIR 0,5ML 1D J07AN Vaccini della tubercolosi J07AN01 Vaccino tubercolare (BCG) liofilizzato J07AP Vaccini tifoidei J07AP01 Vaccino tifoideo vivo orale VIVOTIF*3CPS 200MG 2000MILIONI J07AP03 C Vaccini virali J07BB Vaccini influenzali J07BB02 Vaccino influenzale inattivato a base di antigeni di superficie, adiuvato INFLEXAL V*1SIR C/A 2006-2007 J07BB02 H Vaccino influenzale inattivato a base di antigeni di superficie, virosomale VAXIGRIP*1SIR 0,5ML 2006-2007 86 C Vaccino tifoideo polisaccaridico TYPHIM Vi*INIET 1SIR 0,5ML J07B C H Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione J07BB02 Vaccino influenzale subvirionico (frammentato) FLUAD*1SIR 0,5ML 2006-2007 J07BC Vaccini epatitici J07BC01 Vaccino epatitico B a Dna ric. HBVAXPRO*IM 1FL 5MCG/0,5ML HBVAXPRO*IM 1FL 10MCG/ML HBVAXPRO*IM 1FL 40MCG/ML J07BC02 J07BD52 C C C C C Vaccino apatitico A+vaccino epatitico B TWINRIX ADULTI*IM SIR 20MCG/ML TWINRIX PEDIATRICO*IM 1SIR+2AG J07BD H Vaccino epatitico A inattivato adsorbito EPAXAL*IM 1SIR 0,5ML C/AGO HAVRIX 720 PEDIAT.*1SIR 0,5ML J07BC20 Note C C Vaccini morbillosi Vaccino morbilloso parotitico e rubeolico MMR II*1FL LIOF+1SIR SOLV C J07BF Vaccini poliomielitici J07BF03 Vaccino poliomielitico trivalente inattivato parenterale a virus intero IMOVAX POLIO*IM SC 1SIR 0,5ML J07BG Vaccini rabici J07BG01 Vaccino rabico da colture cellulari RABIPUR*1FL 1D 1ML+1F C/SIR J07BK Vaccini varicellosi J07BK01 Vaccino varicelloso vivo attenuato VARILRIX*SC 1FL 1D+SIR 0,5ML C C C Prontuario terapeutico della Provincia di Bologna 87 ATC Descrizione J07BL Vaccini della febbre gialla J07BL01 Vaccino febbre gialla vivo STAMARIL PASTEUR*FL+SIR 0,5ML J07C Vaccini batterici e virali in associazione Vaccini batterici e virali in associazione J07CA01 Vaccino difterite-poliomielite-tetano J07CA09 C Vaccino difterite-epatite B-H.influenzae B-pertosse-poliomelite-tetano INFANRIX HEXA*IM 1FL+1SIR+2AGH J07CA12 Note C J07CA REVAXIS*1SIR 0,5ML C/COPRIAGO C Vaccino difterite-epatite B-pertosse-poliomelite-tetanoextra PTR INFANRIX PENTA*IM 1SIR 0,5ML+2 88 C la s s e S S N e concedibilità C Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione L Farmaci antineoplastici e immunomodulatori L01 Antineoplastici L01A Sostanze alchilanti L01AA Analoghi della mostarda azotata L01AA01 Ciclofosfamide ENDOXAN BAXTER*50CPR RIV 50MG ENDOXAN BAXTER*EV 1FL 1G ENDOXAN BAXTER*EV 1FL 500MG L01AA02 A Melfalan ALKERAN*25CPR RIV 2MG ALKERAN*1FL 50MG/10ML+FL 10ML L01AA05 A H/OSP1 H/OSP1 Clorambucile LEUKERAN*25CPR RIV 2MG L01AA03 Note A H/OSP1 Clormetina CARYOLISINE MG.10 X 6 FIALE L01AA06 Ifosfamide HOLOXAN*EV 1FL 1G L01AB Alchilsulfonati L01AB01 Busulfano MYLERAN*100CPR RIV 2MG L01AC Etilenimine L01AC01 Tiotepa THIOPLEX*INIET 1F 15MG H/OSP1 estero A H/OSP1 Prontuario terapeutico della Provincia di Bologna 89 ATC Descrizione L01AD Nitrosouree L01AD01 Carmustina C la s s e S S N e concedibilità Note estero CARMUBRIS 100MG FL L01AD04 Streptozocina estero ZANOSAR G 1 FIALE L01AD05 Fotemustina MUPHORAN*IV 1F 208MG+F SOLV L01AX L01AX03 Altre sostanze alchilanti Temozolomide TEMODAL*1FL 5CPS 100MG TEMODAL*1FL 5CPS 20MG TEMODAL*1FL 5CPS 250MG L01AX04 L01B Antimetaboliti L01BA Analoghi dell'acido folico RMP H/OSP1 Metotrexato METHOTREXATE*INIET 4SIR 10MG METHOTREXATE*INIET 4SIR 15MG/2 METHOTREXATE*25CPR 2,5MG METHOTREXATE*INIET 4SIR 20MG METHOTREXATE*INIET 4SIR 7,5MG METOTRESSATO TEVA*FL 5G 50ML METOTRESSATO TEVA*FL 500MG20ML METOTRESSATO TEVA*FL 50MG 2ML METOTREXATO MAYNE*5F 5MG 2ML L01BB Analoghi della purina L01BB02 Mercaptopurina PURINETHOL*25CPR 50MG 90 RMP H/OSP2 H/OSP2 H/OSP2 Dacarbazina DETICENE*INFUS 100MG/10ML FL+F L01BA01 RMP H/OSP1 A A A A A H/OSP1 H/OSP1 H/OSP1 A A Commissione provinciale del Farmaco Bologna ATC Descrizione L01BB03 Tioguanina THIOGUANINE*25CPR 40MG L01BB05 L01BC01 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Fluorouracile C/OSP1 H/OSP1 H/OSP1 H/OSP1 Gemcitabina GEMZAR*INF ENDOVESC 1FL 1G POL GEMZAR*INF ENDOVESC 1FL200MG P L01BC06 H/OSP2 H/OSP1 Citarabina FLUOROURACILE ICN*IV 10FL250MG FLUOROURACILE ICN*5FL20ML1G/20 FLUOROURACILE ICN*5FL10ML500MG FLUOROURACILE ICN*1FL 5G/100ML L01BC05 A Analoghi della pirimidina CITARABINA MAY*INIET 10ML1G/10 CITARABINA MAY*INIET 20ML2G/20 CITARABINA MAY*INIET 5F 100MG/ CITARABINA MAY*INIET 5F 500MG/ L01BC02 Note Fludarabina FLUDARA*20CPR RIV 10MG FLUDARA*EV 5FL 50MG L01BC C la s s e S S N e concedibilità H/OSP1 H/OSP1 Capecitabina XELODA*60CPR RIV 150MG XELODA*120CPR RIV 500MG H/OSP2 H/OSP2 L01C Alcaloidi da piante ed altri prodotti naturali L01CA Alcaloidi della vinca ed analoghi L01CA01 Vinblastina VELBE*EV 1FL 10MG H/OSP1 Prontuario terapeutico della Provincia di Bologna 91 ATC Descrizione L01CA02 Vincristina VINCRISTINA PFIZER*1FL 1MG 1ML L01CA03 L01CB Derivati della podofillotossina L01CB01 Etoposide LASTET*20CPS 50MG VEPESID*EV 1FL 100MG/5ML L01CD Taxani L01CD01 Paclitaxel ANZATAX*INF FL 100MG/16,7ML6MG ANZATAX*INF FL 30MG/5ML 6MG/ML C H/OSP1 H/OSP1 H/OSP1 H/OSP1 RMP H/OSP1 H/OSP1 Antibiotici citotossici L01DA Actinomicine L01DA01 Dactinomicina COSMEGEN*INIET 1FL 0,5MG 92 H/OSP1 H/OSP1 H/OSP2 H/OSP2 Docetaxel TAXOTERE*INFUS FL 20MG/0,5ML+F TAXOTERE*INFUS FL 80MG/2ML+F L01D H/OSP1 Teniposide VUMON*INFUS 1F 50MG/5ML L01CD02 C/OSP1 Vinorelbina NAVELBINE 10*IV 10MG 1ML NAVELBINE 50*IV 50MG 5ML NAVELBINE*1CPS 20MG NAVELBINE*1CPS 30MG L01CB02 Note Vindesina ELDISINE*EV 1FL POLV 5MG L01CA04 C la s s e S S N e concedibilità H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione L01DB Antracicline e sostanze correlate L01DB01 Doxorubicina ADRIBLASTINA*INIET 1F 10MG/5ML ADRIBLASTINA*INIET FL50MG/25ML L01DB01 C la s s e S S N e concedibilità H/OSP1 H/OSP1 Doxorubicina liposomiale CAELYX*INFUS 1FL 2MG/ML 10ML CAELYX*INFUS 1FL 2MG/ML 25ML MYOCET*INFUS 2SET 50MG Note RMP H/OSP1 H/OSP1 H/OSP1 Trattamento del carcinoma mammario metastatico in cui sia controindicato l'uso di un'antraciclina non liposomiale per elevato rischio di cardiotossicità. L01DB02 Daunorubicina DAUNOBLASTINA*EV 1FL 20MG+FL L01DB03 Epirubicina FARMORUBICINA*IV FL 10MG/5ML FARMORUBICINA*IV FL 50MG/25ML FARMORUBICINA*IV FL 10MG+F 5ML FARMORUBICINA*IV FL LIOF 50MG L01DB06 H/OSP1 H/OSP1 Mitoxantrone MITOXANTRONE EBE*EV10ML 2MG/ML ONKOTRONE*EV 1FL 10MG 5ML L01DC Altri antibiotici citotossici L01DC01 Bleomicina BLEOMICINA NIPPON K.*1FL 15MG L01DC03 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Idarubicina ZAVEDOS*EV 1FL 10MG 10ML ZAVEDOS*EV 1FL 5MG+F SOLV 5ML L01DB07 H/OSP1 RMP H/OSP1 H/OSP1 H/OSP1 Mitomicina MITOMYCIN C*INIET 1FL 10MG H/OSP1 Prontuario terapeutico della Provincia di Bologna 93 ATC Descrizione L01X Altri antineoplastici L01XA Composti del platino L01XA01 Cisplatino CISPLATINO TEVA*EV 10MG 20ML CISPLATINO TEVA*EV 50MG 100ML C la s s e S S N e concedibilità Note H/OSP1 H/OSP1 N.B. In attesa di aggiudicazione di gara entro il 2007 L01XA02 Carboplatino PARAPLATIN*IV FL 150MG/15ML PARAPLATIN*IV FL 450MG/45ML PARAPLATIN*IV FL 50MG/5ML L01XA03 H/OSP1 H/OSP1 H/OSP1 Oxaliplatino ELOXATIN*INFUS 1FL 20ML 5MG/ML ELOXATIN*INFUS 1FL 10ML 5MG/ML RMP H/OSP1 H/OSP1 Registro AIFA in adiuvante per ca colon III stadio: http://aifa-onco.agenziafarmaco.it [DocPRI-ER] L01XB L01XB01 Metilidrazine Procarbazina NATULAN*50CPS 50MG L01XC Anticorpi monoclonali L01XC02 Rituximab MABTHERA*EV 1FL 50ML 500MG MABTHERA*EV 2F 10ML 100MG L01XC03 A RMP H/OSP1 H/OSP1 Trastuzumab HERCEPTIN*EV 1FL 150MG RMP H/OSP2 Registro AIFA in adiuvante per ca mammella HER2+: http://aifa-onco.agenziafarmaco.it [DocPRI-ER] 94 Commissione provinciale del Farmaco Bologna ATC Descrizione L01XC04 Alemtuzumab MABCAMPATH*EV 3F 3ML 10MG/ML L01XC07 C la s s e S S N e concedibilità RMP H/OSP1 Bevacizumab AVASTIN*INFUS 1FL 400MG 16ML AVASTIN*INFUS 1FL 100MG 4ML Note RMP H/OSP1 H/OSP1 Registro AIFA:http://aifa-onco.agenziafarmaco.it [DocPRI-ER] L01XE L01XE01 Inibitori della proteina chinasi Imatinib GLIVEC*120CPS 100MG L01XX Altri antineoplastici L01XX02 Asparaginasi H/OSP2 estero KIDROLASE 10,000 U.I. FL EV L01XX05 Idrossicarbamide ONCOCARBIDE*20CPS 500MG L01XX08 Pentostatina NIPENT*IV FL 10MG L01XX11 A PHT-PT Topotecan HYCAMTIN*INFUS IV 5F 5ML 4MG L01XX19 A Tretinoina VESANOID*FL 100CPS 10MG L01XX17 H/OSP1 Estramustina ESTRACYT*40CPS 140MG L01XX14 A H/OSP1 Irinotecan CAMPTO*1FL 100MG/5ML H/OSP1 Prontuario terapeutico della Provincia di Bologna 95 ATC Descrizione CAMPTO*1FL 40MG 2ML L01XX23 estero H/OSP2 Bortezomib VELCADE*INIET 1FL 3,5MG 1MG/ML L02 Terapia endocrina L02A Ormoni ed agenti correlati L02AB Progestinici L02AB01 Megestrolo MEGESTIL*30CPR 160MG L02AB02 Note H/OSP1 Mitotano LYSODREN*FL 100CPR 500MG L01XX32 C la s s e S S N e concedibilità RMP H/OSP1 A 28 A 28 Medrossiprogesterone DEPOPROVERA*IM 150MG/ML 3,4ML L02AE Analoghi dell'ormone liberatore delle gonadotropine L02AE01 - I principi attivi leuprorelina e triptorelina (mensile e trimestrale), data la loro sovrapponibilità di efficacia terapeutica sono stati posti in gara in alternativa. Il lotto è stato aggiudicato a leuprorelina. Buserelin RMP SUPREFACT DEPOT 3*1SIR 9,9MG SUPREFACT DEPOT*1SIR 6,6MG A A 51 PHT-PT 51 PHT-PT Limitatamente a pazienti già in terapia laddove non è opportuna la sostituzione con leuprorelina. L02AE02 Leuprorelina ENANTONE*IM SC FL+SIR 11,25MG/ ENANTONE*IM SC FL+SIR 3,75MG/2 L02AE03 A A Goserelin ZOLADEX 10,8*SC SIR DEPOT 10,8 96 RMP 51 PHT-PT 51 PHT-PT RMP A 51 PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità ZOLADEX 3,6*SC 1SIR DEPOT 3,6M A Note 51 PHT-PT Limitatamente a pazienti già in terapia laddove non è opportuna la sostituzione con leuprorelina. L02AE04 Triptorelina DECAPEPTYL*FL 11,25MG+2ML+1SIR DECAPEPTYL*1FL 3,75MG+2ML+1SIR RMP A A 51 PHT-PT 51 PHT-PT Limitatamente a pazienti già in terapia laddove non è opportuna la sostituzione con leuprorelina. Il PT deve riportare le motivazioni della scelta di triptorelina. L02B Antagonisti ormonali ed agenti correlati L02BA Antiestrogeni L02BA01 Tamoxifene NOLVADEX*20CPR RIV 20MG L02BA03 A Fulvestrant FASLODEX*IM 1SIR 5ML+1AGO RMP H/OSP2 Registro AIFA:http://aifa-onco.agenziafarmaco.it L02BB Antiandrogeni L02BB01 Flutamide FLUTAMIDE PHT*30CPR 250MG L02BB03 PHT A A PHT PHT A PT A PT Bicalutamide CASODEX*28CPR RIV 150MG CASODEX*28CPR RIV 50MG L02BG Inibitori enzimatici L02BG03 Anastrozolo ARIMIDEX*28CPR RIV 1MG L02BG04 A Letrozolo FEMARA*30CPR RIV 2,5MG Prontuario terapeutico della Provincia di Bologna 97 ATC Descrizione L02BG06 Exemestan AROMASIN*30CPR RIV 25MG C la s s e S S N e concedibilità A L03 Immunostimolanti L03A Citochine e immunomodulatori L03AA Fattori stimolanti le colonie L03AA02 Filgrastim GRANULOKINE*1SIR 30MU 0,5ML Note PT RMP A 30 PHT-PT I principi attivi filgrastim e lenograstim, sono stati valutati secondo il criterio di selezione dell'equivalenza terapeutica e sono stati posti in gara in alternativa. In attesa di aggiudicazione del lotto entro il 2007, potranno essere utilizzati i prodotti già in uso. L03AB Interferoni L03AB01 Interferone alfa ALFAFERONE*1F 1000000UI 1ML ALFAFERONE*1F 3000000UI 1ML ALFAFERONE*1F 6000000UI 1ML L03AB03 98 H/OSP1 RMP A A A Interferone alfa-2b INTRONA*SC IV 1PEN 18MUI+12KIT INTRONA*SC IV 1PEN 30MUI+12KIT INTRONA*SC IV 1FL 10MUI INTRONA*SC IV 1FL 18MUI 3ML INTRONA*SC IV 1FL 25MUI 2,5ML 32 PHT-PT 32 PHT-PT 32 PHT-PT Lg. 648/96 Interferone alfa-2a ROFERON A*SC 1SIR 3MUI/0,5ML ROFERON A*SC 1SIR 6MUI/0,5ML ROFERON A*SC 1SIR 9MUI/0,5ML L03AB05 A A A Interferone gamma 1-b IMUKIN*6F 0,5ML 100MCG L03AB04 RMP 32 PHT-PT 32 PHT-PT 32 PHT-PT RMP A A A A A 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione L03AB07 Interferone beta -1a AVONEX*IM 4SIR 30MCG/0,5ML+4AG REBIF*SC 12SIR 6000000UI 22MCG REBIF*SC 12SIR 12000000UI44MCG L03AB08 L03AC01 L03AX03 65 PHT-PT A A A A A A A A A 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT 32 PHT-PT A A 32 PHT-PT 32 PHT-PT RMP RMP Aldesleuchina RMP H/OSP1 Altre citochine e immunomodulatori Vaccino BCG IMMUCYST*1FL POLV x SOSP 81MG L03AX13 A Interleukine PROLEUKIN*EV 1FL 18MUI 5ML L03AX 65 PHT-PT 65 PHT-PT 65 PHT-PT Peginterferon alfa-2a PEGASYS*SC SIR 0,5ML 135MCG+AG PEGASYS*SC SIR 0,5ML 180MCG+AG L03AC A A A Peginterferon alfa-2b PEGINTRON*SC 1FL 100MCG+1F PEGINTRON*SC 1FL 120MCG+1F PEGINTRON*SC 1FL 150MCG+1F PEGINTRON*SC 1FL 50MCG+1F PEGINTRON*SC 1FL 80MCG+1F PEGINTRON*SC 1PEN 50MCG+1AGO+2 PEGINTRON*SC 1PEN 80MCG+1AGO+2 PEGINTRON*SC 1PEN 100MCG+1AGO+ PEGINTRON*SC 1PEN 120MCG+1AGO+ L03AB11 Note Interferone beta -1b BETAFERON*SC 15F 0,25MG+15SIR L03AB10 C la s s e S S N e concedibilità H/OSP1 Glatiramer COPAXONE*SC 28SIR 20MG/ML A 65 PHT-PT [DocCRF] Prontuario terapeutico della Provincia di Bologna 99 Descrizione L04 Sostanze ad azione immunosoppressiva L04A Sostanze ad azione immunosoppressiva L04AA Sostanze ad azione immunosoppressiva selettiva L04AA01 L04AA02 H/OSP1 RMP A A A A PHT-PT PHT-PT PHT-PT PHT-PT Micofenolato mofetile CELLCEPT*100CPS 250MG CELLCEPT*50CPR 500MG L04AA06 estero Tacrolimus PROGRAF*30CPS 0,5MG PROGRAF*60CPS 1MG PROGRAF*30CPS 5MG PROGRAF*INFUS EV 10F 5MG/1ML L04AA06 H/OSP1 Immunoglobulina antitimocitaria ATG FRESENIUS 200 MG 10 ML F ESTERO THYMOGLOBULINE*1F 25MG+1F 5ML L04AA05 A A A A A A A A A A Muromonab CD3 ORTHOCLONE OKT3*EV 5F 5ML L04AA04 Note Ciclosporina SANDIMMUN NEORAL*50CPS 10MG SANDIMMUN NEORAL*30CPS 100MG SANDIMMUN NEORAL*50CPS 25MG SANDIMMUN NEORAL*50CPS 50MG SANDIMMUN NEORAL*50ML 100MG/ML SANDIMMUN*30CPS 100MG SANDIMMUN*OS FL 50ML 100MG/ML SANDIMMUN*50CPS 25MG SANDIMMUN*50CPS 50MG SANDIMMUN*INFUS 10F 5ML 50MG/M H/OSP2 H/OSP2 Micofenolato sodico MYFORTIC*100CPR RIV 180MG MYFORTIC*50CPR RIV 360MG 100 C la s s e S S N e concedibilità ATC H/OSP2 H/OSP2 Commissione provinciale del Farmaco Bologna ATC Descrizione L04AA08 Daclizumab ZENAPAX*IV 1FL 5ML 5MG/ML L04AA09 H/OSP1 H/OSP1 Sirolimus RAPAMUNE*100CPR RIV 1MG RAPAMUNE*OS FL 60ML+30SIR DOS+ L04AA11 Note Basiliximab SIMULECT*IV 1F 20MG+F 5ML L04AA10 C la s s e S S N e concedibilità RMP A A Etanercept ENBREL*SC 4FL 25MG+4SIR 1ML ENBREL*SC 4FL 50MG+4SIR+4AGHI+ PHT-PT PHT-PT RMP H/OSP2 H/OSP2 Progetto Nazionale PSOCARE:http://monitoraggio-farmaci.agenziafarmaco.it/ Farmaco incluso nel programma interaziendale di monitoraggio appropriatezza prescrittiva. L04AA12 Infliximab REMICADE*EV F 100MG+F 2ML RMP H/OSP2 Progetto Nazionale PSOCARE:http://monitoraggio-farmaci.agenziafarmaco.it/ Farmaco incluso nel programma interaziendale di monitoraggio appropriatezza prescrittiva. L04AA13 Leflunomide ARAVA*FL 30CPR RIV 20MG L04AA17 A Adalimumab HUMIRA*SC 2SIR+F 40MG 0,8ML+2T PHT-PT RMP H/OSP2 [DocCRF] Farmaco incluso nel programma interaziendale di monitoraggio appropriatezza prescrittiva. L04AA18 Everolimus CERTICAN*60CPR 0,25MG CERTICAN*60CPR 0,75MG RMP A A PHT-PT PHT-PT Prontuario terapeutico della Provincia di Bologna 101 ATC Descrizione L04AA21 Efalizumab RAPTIVA*SC 4FL 100MG/ML+4SIR+8 C la s s e S S N e concedibilità Note H/OSP2 Progetto Nazionale PSOCARE:http://monitoraggio-farmaci.agenziafarmaco.it/ Farmaco incluso nel programma interaziendale di monitoraggio appropriatezza prescrittiva. L04AX L04AX01 Altre sostanze ad azione immunosoppressiva Azatioprina AZATIOPRINA WELL.*50CPR 50MG 102 A Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità M Sistema muscolo-scheletrico M01 Farmaci antinfiammatori e antireumatici M01A Farmaci antinfiammatori/antireumatici, non steroidei M01AB Derivati dell'acido acetico e sostanze correlate Note M01AB01 Indometacina LIOMETACEN*IM 6F+6F 50MG A M01AB05 Diclofenac DICLOFENAC RAT.*30CPR GAST50MG DICLOREUM*INIET 6F 75MG/3ML DICLOREUM*RETARD 20CPR 100MG A A A 66 66 M01AB15 Ketorolac LIXIDOL*IM 3F 1ML 30MG A "...Evidenze epidemiologiche suggeriscono che ketorolac può essere associato a un elevato rischio di tossicità gastrointestinale, rispetto ad altri FANS, soprattutto quando usato al di fuori delle indicazioni autorizzate e/o per prolungati periodi. Si sottolinea che il ketorolac non è indicato per il trattamento del dolore oncologico;la forma iniettiva è indicata soltanto nel trattamento a breve termine (max 2 giorni) del dolore acuto post-operatorio di grado moderato-severo o del dolore da coliche renali... "(DDL AIFA, maggio 2007) M01AE Derivati dell'acido propionico M01AE01 Ibuprofene ANTALFEBAL*BB OS SOSP 100ML 2% BRUFEN*30CPR RIV400MG PVC/PVDC BRUFEN*30CPR RIV 600MG PVC/PVD C A A 66 66 A 66 M01AE02 Naproxene NAPROSYN*OS GRAT 30BUST 500MG M01AE03 Ketoprofene FLEXEN*10SUPP 100MG IBIFEN*IV 6F 100MG 5ML C H/OSP1 Prontuario terapeutico della Provincia di Bologna 103 ATC Descrizione IBIFEN*30CPS 50MG M01AX C la s s e S S N e concedibilità Note A 66 Altri farmaci antinfiammatori/ antireumatici non steroidei M01AX17 Nimesulide MESULID*OS GRAT 30BUST 100MG A M03 Miorilassanti M03A Miorilassanti ad azione periferica M03AB Derivati della colina 66 M03AB01 Suxametonio MIDARINE*IV 5F 2ML 100MG/2ML M03AC H/OSP1 Altri composti ammonici quaternari M03AC03 Vecuronio NORCURON 10*EV 10F 10MG H/OSP1 M03AC04 Atracurio ATRACURIUM HAM*EV 5F 25MG 2,5M ATRACURIUM HAM*EV 5F 50MG 5ML H/OSP1 H/OSP1 M03AC09 Rocuronio ESMERON*EV 10F 100MG/10ML C/TA H/OSP1 M03AC10 Mivacurio MIVACRON*EV 5F 5ML 2MG/ML H/OSP1 M03AC11 Cisatracurio NIMBEX 2*5F 5ML 2MG/ML NIMBEX 5*1FL 30ML 5MG/ML M03AX C/OSP1 C/OSP1 Altri miorilassanti ad azione periferica M03AX01 Tossina botulinica BOTOX*IM 1FL 100UI 104 RMP H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione DYSPORT*SC IM 2FL 500U C la s s e S S N e concedibilità Note H/OSP1 M03B Miorilassanti ad azione centrale M03BX Altri miorilassanti ad azione centrale M03BX01 Baclofene LIORESAL INTRATEC*F 0,05MG 1ML LIORESAL*50CPR 10MG LIORESAL INTRATEC*F 10MG 20ML LIORESAL INTRATEC*F 10MG 5ML LIORESAL*50CPR 25MG H/OSP1 C H/OSP1 H/OSP1 A M03C Miorilassanti ad azione diretta M03CA Dantrolene e derivati M03CA01 Dantrolene DANTRIUM*50CPS 25MG DANTRIUM*50CPS 50MG DANTRIUM*IV FL 20MG LIOF A A C/OSP1 M04 Antigottosi M04A Antigottosi M04AA Preparati inibenti la formazione di acido urico M04AA01 Allopurinolo ALLOPURINOLO MOLTENI*30CPR300M ALLOPURINOLO MOLTENI*50CPR100M M04AC A A Preparati senza effetto sul metabolismo dell'acido urico M04AC01 Colchicina COLCHICINA LIRCA*60CPR 1MG A Prontuario terapeutico della Provincia di Bologna 105 C la s s e S S N e concedibilità ATC Descrizione Note M05 Farmaci per il trattamento delle malattie delle ossa M05B Farmaci che agiscono sulla mineralizzazione M05BA Bifosfonati M05BA02 Acido clodronico DIFOSFONAL*6F 300MG 10ML A 42 M05BA03 Acido pamidronico PAMIDRONATO D.MAYNE*EV 1FL90MG PAMIDRONATO D.MAYNE*EV 5FL15MG H/OSP2 H/OSP2 M05BA04 Acido alendronico DRONAL*14CPR 10MG DRONAL*4CPR 70MG A A M05BA08 Acido zoledronico ZOMETA*IV 1FL 4MG+1F 5ML SOLV 106 H/OSP2 Commissione provinciale del Farmaco Bologna 79 79 ATC Descrizione N Sistema nervoso N01 Anestetici N01A Anestetici generali N01AB Idrocarburi alogenati N01AB06 Isoflurano AERRANE*INAL FL 100ML C la s s e S S N e concedibilità Note H/OSP1 N01AB07 Desflurano SUPRANE*LIQ INAL FL 240ML H/OSP1 N01AB08 Sevoflurano SEVORANE*INAL 250ML QUIK FIL N01AF Barbiturici, non associati N01AF03 Tiopental FARMOTAL*INFUS EV FL POLV500MG N01AH H/OSP1 H/OSP1 Anestetici oppioidi N01AH01 Fentanil FENTANEST*IM IV 5F 0,1MG 2ML H/OSP1 MOD. STUPEFACENTE H/OSP1 MOD. STUPEFACENTE N01AH03 Sufentanil SUFENTANIL HAM*EV 5F 250MCG 5M N01AH06 Remifentanil ULTIVA*IV 5FL 1MG C ULTIVA*IV 5FL 2MG C ULTIVA*IV 5FL 5MG C MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE Prontuario terapeutico della Provincia di Bologna 107 ATC Descrizione N01AX Altri anestetici generali N01AX03 Ketamina C la s s e S S N e concedibilità Note estero MOD. STUPEFACENTE KETANEST'S 25MG/ML 2 ML F N01AX10 Propofol DIPRIVAN*INFUS 50ML 20MG/ML DIPRIVAN*INFUS 1SIR 50ML 20MG/ PROPOFOL B.BRAUN 1%*10FL 50ML PROPOFOL B.BRAUN 1%*5F 20ML N01B Anestetici locali N01BB Amidi H/OSP1 C/OSP1 H/OSP1 H/OSP1 N01BB01 Bupivacaina BUPICAIN*10F 10ML 5MG/ML BUPICAIN*10F 5ML 5MG/ML BUPICAIN*10F 5ML 2,5MG/ML BUPICAIN*10F 10ML 2,5MG/ML BUPIVACAINA REC.*10F 2ML 1% IP BUPIVACAINA REC.*10F 4ML0,5% I C C C C C C N01BB02 Lidocaina ECOCAIN*FLNEBUL 60ML 10G/100ML LIDOCAINA CLORIDR*FL 20MG/ML50 LIDOCAINA CLORIDR*10F200MG10ML LIDRIAN*INIET F 5ML 2% C/BICAR N01BB03 Mepivacaina MEPICAIN*10F 2ML 3% MEPIVACAINA*1% 5F 5ML MEPIVACAINA*2% 5F 5ML MEPIVACAINA*1% 10F 10ML MEPIVACAINA*2% 10F 10ML OPTOCAIN*50CART 1,8ML 30MG/ML 108 C C/OSP1 C C C C C C C C Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note N01BB09 Ropivacaina NAROPINA 10MG/ML*5F POLYAMP10M NAROPINA 2MG/ML*5F POLYAMP10ML NAROPINA 2MG/ML*5SACCHE 100ML NAROPINA 7,5MG/ML*5F POLYAMP10 C C C C N01BB10 Levobupivacaina CHIROCAINE*10F 10ML 5MG/ML PPS CHIROCAINE*10F10ML2,5MG/ML PPS CHIROCAINE*10F10ML7,5MG/ML PPS C/OSP1 C/OSP1 C/OSP1 N01BB20 Lidocaina + Prilocaina EMLA*CREMA 5TUB 5G+10CER OCCLU C N01BB51 Bupivacaina + Adrenalina BUPIFORAN*10F 5ML 5MG/ML C/ADR BUPIFORAN*10F 10ML 5MG/ML C/AD C C N01BB53 Mepivacaina + Adrenalina MEPIVACAINA ADR.*2% 10F 10ML MEPIVACAINA ADR.*2% 5F 5ML OPTOCAIN*50CART1,8ML ADR 1:100 OPTOCAIN*50CART 1,8ML ADR 1:80 N02 Analgesici N02A Oppioidi N02AA Alcaloidi naturali dell'oppio C C C C N02AA01 Morfina MORFINA CLORIDR*1F 50MG/5ML A MORFINA CLORIDR*5F 10MG 1ML A ORAMORPH*OS 20FL 1D 5ML 10MG A ORAMORPH*OS FL 20ML 20MG/ML A MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE Prontuario terapeutico della Provincia di Bologna 109 ATC Descrizione C la s s e S S N e concedibilità TWICE*16CPS 100MG R.P. A TWICE*16CPS 10MG R.P. A TWICE*16CPS 30MG R.P. A TWICE*16CPS 60MG R.P. A Note MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE N02AA05 Ossicodone cloridrato N02AB OXYCONTIN*28CPR 20MG R.P. A OXYCONTIN*28CPR 40MG R.P. A MOD. STUPEFACENTE MOD. STUPEFACENTE C MOD. STUPEFACENTE Derivati della fenilpiperidina N02AB02 Petidina PETIDINA CLORIDR*5F 100MG 2ML N02AB03 Fentanil DUROGESIC*3CER 100MCG/ORA40CM2 A DUROGESIC*3CER 25MCG/ORA 10CM2 A DUROGESIC*3CER 50MCG/ORA 20CM2 A MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE [Scheda CRF] N02AE Derivati dell'oripavina N02AE01 Buprenorfina TEMGESIC*IM IV 5F 1ML 0,3MG A TRANSTEC*3CER 20MG 35MCG/H A TRANSTEC*3CER 30MG 52,5MCG/H A MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE [Scheda CRF] 110 Commissione provinciale del Farmaco Bologna ATC Descrizione N02AX Altri oppiodi N02AX02 Tramadolo CONTRAMAL*5F 100MG 2ML CONTRAMAL*OS GTT FL 10ML100MG/ CONTRAMAL SR 100*20CPR R.P. C la s s e S S N e concedibilità Note A A A 3 3 3 Non è consigliabile affrontare i dolori più intensi aumentando le dosi di tramadolo, considerando complessivamente il suo profilo beneficio/rischio. Il tramadolo è risultato associato al rischio, anche se basso, di crisi convulsive, e di comparsa di disturbi psichiatrici. Poiché l'insorgenza di convulsioni può verificarsi a dosi di poco superiori a quelle normalmente impiegate in terapia, la possibilità di aggiustare i dosaggi è molto limitata. N02B Altri analgesici e antipiretici N02BA Acido salicilico e derivati N02BA01 Acetilsalicilato di lisina FLECTADOL*IM EV 6FL 1G+6F 5ML FLECTADOL*IM EV 6F 500MG+6F2,5 A C N02BA01 Acido acetilsalicilico ACIDO ACETILSALIC*20CPR 500MG N02BE Anilidi N02BE01 Paracetamolo PERFALGAN*INF 12FL 100ML 10MG/ TACHIPIRINA*10SUPP 1G TACHIPIRINA*12CPR EFF 1G TACHIPIRINA*BB OS GTT 30ML 10% TACHIPIRINA*SCIR 120ML 2,4% TACHIPIRINA*10SUPP 125MG TACHIPIRINA*10SUPP 250MG TACHIPIRINA*10SUPP 500MG TACHIPIRINA*20CPR 500MG N02BE51 C C C C C C C C C C Paracetamolo + Codeina LONARID*BB 6SUPP 200MG+5MG LONARID*LATT 6SUPP 60MG+2,5MG C C Prontuario terapeutico della Provincia di Bologna 111 C la s s e S S N e concedibilità ATC Descrizione N02C Antiemicranici N02CC Agonisti selettivi dei recettori 5HT1 Note N02CC01 Sumatriptan IMIGRAN*4CPR RIV 100MG IMIGRAN*4CPR RIV 50MG IMIGRAN*SC 2SIR 6MG 0,5ML+AUTO N02CC04 A A A Rizatriptan RIZALIV RPD10*3LIOF 10MG RIZALIV 5*3CPR 5MG N03 Antiepilettici N03A Antiepilettici N03AA Barbiturici e derivati N03AA02 Fenobarbital A A FENOBARBITALE SODICO*5F 100MG C GARDENALE*20CPR 100MG A GARDENALE*30CPR 50MG A LUMINALETTE*30CPR 15MG A MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE MOD. STUPEFACENTE N03AA03 Primidone MYSOLINE*30CPR 250MG N03AB Derivati dell'idantoina N03AB02 Fenitoina AURANTIN*IM IV 5F 5ML 50MG/ML DINTOINA*30CPR 100MG N03AD A H/OSP1 A Derivati della succinimide N03AD01 Etosuccimide ZARONTIN*SCIR 200ML 250MG/5ML 112 A Commissione provinciale del Farmaco Bologna ATC Descrizione N03AE Derivati benzodiazepinici N03AE01 N03AF Derivati della carbossamide N03AF01 Carbamazepina CARBAMAZEP.RATIO.*50CPR 200MG CARBAMAZEP.RATIO*30CPR 400MG TEGRETOL CR*30CPR 200MG R.C. TEGRETOL CR*30CPR 400MG R.C. TEGRETOL*BB SCIR FL 250ML20MG/ A A A A A A A A Oxcarbazepina TOLEP*50CPR DIV 300MG TOLEP*50CPR DIV 600MG N03AG Note Clonazepam RIVOTRIL*20CPR 0,5MG RIVOTRIL*20CPR 2MG RIVOTRIL*OS GTT 10ML 2,5MG/ML N03AF02 C la s s e S S N e concedibilità A A Derivati degli acidi grassi N03AG01 Acido valproico DEPAKIN*CHRONO 30CPR 300MG R.P DEPAKIN*CHRONO 30CPR 500MG R.P DEPAKIN*40CPR GASTROR 200MG DEPAKIN*OS FL 40ML 200MG/ML DEPAKIN*4F 400MG+4F 4ML DEPAKIN*40CPR GASTROR 500MG A A A A H/OSP1 A N03AG04 Vigabatrin SABRIL*50CPR RIV 500MG A N03AG06 Tiagabina GABITRIL*50CPR RIV 10MG A Prontuario terapeutico della Provincia di Bologna 113 ATC Descrizione N03AX Altri antiepilettici C la s s e S S N e concedibilità Note N03AX09 Lamotrigina LAMICTAL*56CPR DISPERS 100MG LAMICTAL*56CPR DISPERS 200MG LAMICTAL*28CPR DISPERS 25MG LAMICTAL*56CPR DISPERS 50MG A A A A N03AX11 Topiramato TOPAMAX*60CPR RIV 100MG TOPAMAX*60CPR RIV 200MG TOPAMAX*60CPR RIV 25MG TOPAMAX*60CPR RIV 50MG N03AX12 A A A A Gabapentin GABAPENTIN FIDIA*50CPS 100MG GABAPENTIN FIDIA*50CPS 300MG GABAPENTIN FIDIA*30CPS 400MG A A A N03AX14 Levetiracetam KEPPRA*30CPR RIV 1000MG KEPPRA*60CPR RIV 500MG N04 Antiparkinsoniani N04A Sostanze anticolinergiche N04AA Amine terziarie N04AA01 Triesifenidile ARTANE*FL 50CPR 2MG A A A N04AA02 Biperidene AKINETON*60CPR 2MG AKINETON FIALE*IM EV 5F 5MG1ML 114 A A Commissione provinciale del Farmaco Bologna 4 4 4 C la s s e S S N e concedibilità ATC Descrizione N04AB Eteri chimicamente correlati agli antistaminici Note N04AB02 Orfenadrina DISIPAL*50CPR RIV 50MG N04B Sostanze dopaminergiche N04BA Dopa e suoi derivati A N04BA02 Levodopa + Benserazide MADOPAR*30CPR DISPERS 125MG MADOPAR*50CPR DIV 200MG+50MG A A N04BA02 Levodopa + Carbidopa SINEMET*50CPR 100MG+25MG R.M. SINEMET*30CPR 200MG+50MG R.M. SINEMET*50CPR 100MG+25MG SINEMET*50CPR 250MG+25MG A A A A N04BA03 Levodopa + Carbidopa + Entacapone STALEVO*100CPR 100MG/25MG/200M N04BC Agonisti della dopamina N04BC02 Pergolide NOPAR*40CPR 0,25MG NOPAR*20CPR 1MG PT-RER A PHT-PT A A PT PT N04BC04 Ropinirolo REQUIP*21CPR 0,25MG REQUIP*21CPR 1MG REQUIP*21CPR 2MG REQUIP*21CPR 5MG N04BC05 A A A A Pramipexolo MIRAPEXIN*30CPR 0,18MG MIRAPEXIN*30CPR 0,7MG A A Prontuario terapeutico della Provincia di Bologna 115 ATC Descrizione C la s s e S S N e concedibilità Note N04BC07 Apomorfina APOFIN*INFUS SC 5F 5ML 50MG/5M N04BX H/OSP2 Altri agenti dopaminergici N04BX02 Entacapone COMTAN*100CPR RIV 200MG PT-RER A PHT-PT [DocCRF] N05 N05A Psicolettici Antipsicotici - [DocCPF]:"Guida all'uso dei farmaci antipsicotici per il trattamento della schizofrenia". N05AA Fenotiazine con gruppo dimetilaminopropilico N05AA01 Clorpromazina LARGACTIL*IM 5F 2ML 50MG PROZIN*20CPR RIV 100MG PROZIN*25CPR RIV 25MG PROZIN*OS GTT 10ML 4% A C A A N05AA02 Levomepromazina NOZINAN*20CPR RIV 100MG NOZINAN*20CPR RIV 25MG N05AA03 A A Promazina TALOFEN*GTT FL 30ML 4% TALOFEN*IM IV 6F 50MG C C N05AB Fenotiazine con struttura piperazinica N05AB02 Flufenazina MODITEN DEPOT*IM 1F 25MG A N05AB03 Perfenazina TRILAFON ENANTATO*IM 1ML 100MG TRILAFON*20CPR RIV 4MG TRILAFON*20CPR RIV 8MG 116 A C C Commissione provinciale del Farmaco Bologna ATC Descrizione N05AD Derivati del butirrofenone C la s s e S S N e concedibilità Note N05AD01 Aloperidolo ALOPERIDOLO*50F 2MG 1ML HALDOL*30CPR 1MG HALDOL*30CPR 5MG HALDOL*INIET 5F 1ML 5MG/ML HALDOL*OS GTT 30ML 2MG/ML HALDOL*OS GTT 30ML 10MG/ML C A A A A A N05AD01 Aloperidolo decanoato HALDOL DECANOAS*IM F 150MG 3ML HALDOL DECANOAS*IM 3F 50MG 1ML N05AF N05AF05 A A Derivati del tioxantene Zuclopentixolo CLOPIXOL ACUPHASE*IM F 50MG1ML CLOPIXOL*30CPR 10MG CLOPIXOL*OS GTT FL 10ML 20MG/M CLOPIXOL*20CPR 25MG CLOPIXOL*10CPR 40MG CLOPIXOL DEPOT*IM 1F 200MG/ML N05AG C C C C C A Derivati della difenilbutilpiperidina N05AG02 Pimozide ORAP*20CPR 4MG N05AH A Diazepine, oxazepine e tiazepine N05AH02 Clozapina LEPONEX 100*28CPR 100MG LEPONEX 25*28CPR 25MG A A PHT-PT PHT-PT A A A PHT-PT PHT-PT PHT-PT N05AH03 Olanzapina ZYPREXA*28CPR RIV 10MG ZYPREXA*28CPR RIV 2,5MG ZYPREXA*28CPR RIV 5MG Prontuario terapeutico della Provincia di Bologna 117 ATC Descrizione ZYPREXA*IM 1FL 10MG ZYPREXA VELOTAB*28CPR 10MG ZYPREXA VELOTAB*28CPR 5MG C la s s e S S N e concedibilità Note H/OSP2 A A PHT-PT PHT-PT A A A A PHT-PT PHT-PT PHT-PT PHT-PT N05AH04 Quetiapina SEROQUEL*60CPR RIV 100MG SEROQUEL*60CPR RIV 200MG SEROQUEL*30CPR RIV 25MG SEROQUEL*60CPR RIV 300MG N05AL Benzamidi N05AL03 Tiapride SEREPRILE*INIET 10F 100MG/2ML SEREPRILE*20CPR 100MG N05AL05 Amisulpride SOLIAN*30CPR RIV 400MG N05AL07 A Levosulpiride LEVOPRAID 100*20CPR 100MG LEVOPRAID 50*20CPR 50MG LEVOPRAID 50*IM IV 6F 50MG 2ML N05AN A C C C A Litio N05AN01 Litio CARBOLITHIUM*50CPS 150MG CARBOLITHIUM*50CPS 300MG N05AX Altri antipsicotici N05AX08 Risperidone RISPERDAL*OS GTT 100ML 1MG/ML RISPERDAL*1FL 25MG+1SIR 2ML RISPERDAL*1FL 37,5MG+1SIR 2ML 118 A A RMP A H/OSP2 H/OSP2 PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note N05AX09 Clotiapina ENTUMIN*OS GTT 10ML 100MG/ML ENTUMIN*30CPR 40MG ENTUMIN*IM EV 10F 40MG 4ML A C C N05AX12 Aripiprazolo ABILIFY*28CPR 10MG ABILIFY*28CPR 15MG RMP A A PHT-PT PHT-PT "...non può essere considerato una prima scelta nei pazienti affetti da schizofrenia, sia che si tratti di fase acuta o di mantenimento..."[DocCRF] N05B Ansiolitici N05BA Derivati benzodiazepinici N05BA Delorazepam [d. az. lunga] DELORAZEPAM TEVA*OS GTT 20ML EN*IM IV 3F 1ML 2MG EN*IM IV 3F 1ML 5MG EN*20CPR 1MG EN*20CPR 2MG C C C C C N05BA01 Diazepam [d. az. lunga] DIAZEMULS*IM IV 10F 10MG 2ML DIAZEPAM*3F 2ML 10MG/2ML MICRONOAN 10*4MICROCLISMI 10MG MICRONOAN 5*4MICROCLISMI 5MG VATRAN*25CPR DIV 2MG VATRAN*25CPR DIV 5MG C C C C C C N05BA06 Lorazepam [d. az. intermedia] LORANS*OS GTT 10ML TAVOR*20CPR 1MG TAVOR*20CPR 2,5MG TAVOR*INIET 5F 1ML 4MG/ML C C C H/OSP1 Prontuario terapeutico della Provincia di Bologna 119 ATC Descrizione C la s s e S S N e concedibilità Note N05BA09 Clobazam [d. az. lunga] FRISIUM*30CPS 10MG C N05BA12 Alprazolam [d. az. intermedia] XANAX*20CPR 0,25MG XANAX*20CPR 0,50MG XANAX*OS GTT FL 20ML 0,75MG/ML XANAX*20CPR 1MG N05C Ipnotici e sedativi N05CD Derivati benzodiazepinici C C C C N05CD01 Flurazepam [d. az. lunga] FELISON*30CPS 15MG FELISON*30CPS 30MG C C N05CD07 Temazepam [d. az. intermedia] EUIPNOS*20CPS 20MG C N05CD08 Midazolam [d. az. breve] IPNOVEL*IM EV 1F 15MG 3ML IPNOVEL*IM EV 1F 5MG 1ML N05CF Analoghi delle benzodiazepine N05CF02 Zolpidem STILNOX*30CPR RIV 10MG N06 Psicoanalettici N06A Antidepressivi C/OSP1 C/OSP1 C N06AA Inibitori non selettivi della monoamino-ricaptazione N06AA02 Imipramina TOFRANIL*50CPR RIV 25MG A N06AA04 Clomipramina ANAFRANIL*50CPR RIV 10MG 120 A Commissione provinciale del Farmaco Bologna ATC Descrizione ANAFRANIL*20CPR RIV 25MG ANAFRANIL*IM IV 5F 2ML 25MG ANAFRANIL*20CPR DIV 75MG R.P. N06AA09 C la s s e S S N e concedibilità A A A Amitriptilina LAROXYL*30CPR RIV 10MG LAROXYL*25CPR RIV 25MG LAROXYL*OS GTT 20ML 4% C C A N06AB Inibitori selettivi della ricaptazione di serotonina N06AB03 Fluoxetina FLUOXEREN*OS SOL 60ML 20MG/5ML FLUOXETINA FIDIA*28CPR SOL20MG XEREDIEN*28CPR SOLUB 20MG N06AB04 A A A Citalopram FRIMAIND*28CPR RIV 20MG FRIMAIND*14CPR RIV 40MG SEROPRAM*EV 10F 1ML 40MG/ML N06AB05 Note A A H/OSP1 Paroxetina DAPAROX*28CPR RIV 20MG PVC/PE/ A La formulazione in gtt è in attesa di aggiudicazione di gara entro il 2007. N06AB06 Sertralina ZOLOFT*30CPR RIV 100MG ZOLOFT*30CPR RIV 50MG N06AX A A Altri antidepressivi N06AX03 Mianserina LANTANON*30CPR RIV 30MG LANTANON*GTT 15ML 60MG/ML A A Prontuario terapeutico della Provincia di Bologna 121 ATC Descrizione C la s s e S S N e concedibilità Note N06AX05 Trazodone TRITTICO*INIETT 3F 5ML 50MG/ML TRITTICO*20CPR DIV 150MG R.P. TRITTICO*OS GTT 30ML 2,5% TRITTICO*30CPR DIV 100MG TRITTICO*30CPR DIV 50MG TRITTICO*30CPR DIV 75MG R.P N06AX11 A A A A A A Mirtazapina MIRTAZAPINA RAT.*30CPR RIV 30M A N06AX16 Venlafaxina EFEXOR*10CPS 150MG R.P. EFEXOR*28CPR 37,5MG EFEXOR*14CPR 75MG EFEXOR*14CPS 75MG R.P. N06B A A A A Psicostimolanti e nootropi N06BA Simpaticomimetici ad azione centrale N06BA07 Modafinil PROVIGIL*30CPR 100MG N06D Farmaci anti-demenza N06DA Anticolinesterasici A PHT-PT A A 85 PHT-PT 85 PHT-PT A A A A 85 PHT-PT 85 PHT-PT 85 PHT-PT 85 PHT-PT N06DA02 Donepezil ARICEPT*28CPR RIV 10MG ARICEPT*28CPR RIV 5MG N06DA03 Rivastigmina EXELON*56CPS 1,5MG EXELON*56CPS 3MG EXELON*56CPS 4,5MG EXELON*56CPS 6MG 122 Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità Note N06DA04 Galantamina REMINYL*56CPR RIV 12MG REMINYL*56CPR RIV 4MG REMINYL*56CPR RIV 8MG N07 A A A 85 PHT-PT 85 PHT-PT 85 PHT-PT Altri farmaci del sistema nervoso N07A Parasimpaticomimetici N07AA Anticolinesterasici N07AA01 Neostigmina INTRASTIGMINA*IM 6F 1ML 0,5MG A N07AA02 Piridostigmina MESTINON*20CPR 60MG MESTINON*50CPR 180MG R.P. N07B A A Farmaci usati nei disordini da assuefazione N07BB Farmaci usati nella dipendenza da alcool N07BB Sodio oxibato ALCOVER*OS 12FL 10ML SOL 17,5% H ALCOVER*OS SOLUZ 140ML 17,5% H MOD. STUPEFACENTE MOD. STUPEFACENTE N07BB01 Disulfiram ANTABUSE DISPERG.*24CPR 400MG C N07BB04 Naltrexone ANTAXONE*10CPS 10MG ANTAXONE*OS 10FL 50MG NARCORAL*10CPR 50MG N07BC A A A Farmaci usati nella dipendenza da oppioidi N07BC01 Buprenorfina SUBUTEX*7CPR SUBLING 2MG H/OSP1 MOD. STUPEFACENTE Prontuario terapeutico della Provincia di Bologna 123 ATC Descrizione SUBUTEX*7CPR SUBLING 8MG N07BC02 C la s s e S S N e concedibilità H/OSP1 Note MOD. STUPEFACENTE Metadone METADONE CLOR.MOL*OS 1MG/ML20M A METADONE CLOR.MOL*OS 5MG/ML20M A METADONE CLOR.MOL*OS1MG/ML1000 H/OSP1 METADONE CLOR.MOL*OS5MG/ML1000 H/OSP1 N07X Altri farmaci del sistema nervoso N07XX Altri farmaci del sistema nervoso PHT -MOD. STUPEFACENTE PHT -MOD. STUPEFACENTE PHT -MOD. STUPEFACENTE PHT -MOD. STUPEFACENTE N07XX02 Riluzolo RILUTEK*56CPR RIV 50MG 124 H/OSP2 Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione P Farmaci antiparassitari, insetticidi e repellenti P01 Antiprotozoari P01A Sostanze contro l'amebiasi e altre affezioni protozoarie P01AB Derivati nitroimidazolici P01AB01 Metronidazolo VAGILEN*20CPS 250MG A P01AX Altre sostanze contro l'amebiasi e altre affezioni protozoarie P01AX06 Atovaquone WELLVONE*OS SOSP FL 240ML P01B Aminochinoline P01BA01 Clorochina CLOROCHINA*30CPR RIV 250MG A Idrossiclorochina PLAQUENIL*25CPR RIV 200MG P01BA03 H/OSP1 Antimalarici P01BA P01BA02 Note A Primachina estero PRIMAQUINE FOSFATO 7,5 MG P01BC Alcaloidi chininici P01BC01 Chinina CHININA SOLFATO*20CPR 250MG C Prontuario terapeutico della Provincia di Bologna 125 ATC Descrizione P01BD Diaminopiridine C la s s e S S N e concedibilità P01BD01 Pirimetamina Note estero DAPAPRIM 25 MG CP P01BD51 Sulfametopirazina + Pirimetamina METAKELFIN*FL 10CPR 500MG C P01C Sostanze contro la leishmaniosi e la tripanosomiasi P01CX Altre sostanze contro la leishmaniosi e la tripanosomiasi P01CX01 Pentamidina PENTACARINAT*IM EV/AEROS 300MG P02 Antielmintici P02C Antinematodi P02CA Derivati benzimidazolici P02CA01 Mebendazolo VERMOX 500*30CPR 500MG VERMOX*6CPR 100MG VERMOX*OS SOSP 20MG/ML 30ML P02CA03 A PHT-PT A A A Albendazolo ZENTEL*3CPR 400MG P02CF Avermectine P02CF01 Ivermectina A estero STROMECTOL 3MG CPR 126 Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione P03 Ectoparassiticidi,compresi gli antiscabbia,insetticidi e repellenti P03A Ectoparassiticidi,compresi gli antiscabbia P03AB Prodotti contenenti cloro P03AB51 Clofenotano + Benzile benzoato + Benzocaina ANTISCABBIA CANDIOLI*POM 100G Note C Prontuario terapeutico della Provincia di Bologna 127 ATC Descrizione R Sistema respiratorio R03 Antiasmatici R03A Adrenergici per aerosol C la s s e S S N e concedibilità Note - [DocCRF] R03AC Agonisti selettivi dei recettori beta2-adrenergici R03AC02 Salbutamolo [d. az. breve] BRONCOVALEAS*AER DOS 200INAL BRONCOVALEAS*NEBUL 15ML 500MG/ A A "Nuove importanti informazioni di sicurezza sull' associazione tra salbutamolo e ischemia cardiaca." (DDL AIFA, maggio 2007). R03AC12 Salmeterolo [d. az. lunga] SALMETEDUR SOSPxINAL*120ER 25M SALMETEDUR DISKUS*INAL 60D 50M A A R03AC13 Formoterolo [d. az. lunga] FORADIL*POLV 60CPS 12MCG+INAL FORADIL*SOLxINAL 12MCG 100D OXIS TURBOHALER 4,5*POLV 60D OXIS TURBOHALER 9*POLV 60D R03AK A A A A Adrenergici e altri farmaci per le sindromi ostruttive delle vie respiratorie R03AK06 Salmeterolo + Fluticasone ALIFLUS*INAL 120D 25/125MCG ALIFLUS*INAL 120D 25/250MCG ALIFLUS DISKUS 50/100*INAL 60D ALIFLUS DISKUS 50/250*INAL 60D ALIFLUS DISKUS 50/500*INAL 60D A A A A A R03AK07 Budesonide + Formoterolo SYMBICORT*INAL 120D 160/4,5MCG SYMBICORT*INAL 120D 160/4,5MCG 128 A A Commissione provinciale del Farmaco Bologna C la s s e S S N e concedibilità ATC Descrizione R03B Altri antiasmatici per aerosol R03BA Glicocorticoidi Note R03BA01 Beclometasone BECOTIDE*FL 250MCG 200D SOL PR BECOTIDE*FL 50MCG 200D SOL PRE CLENIL*AEROSOL 20FL MONOD 2ML CLENILEXX*SOL PRESS.100MCG+AUT A A A A R03BA02 Budesonide MIFLONIDE*POLVxINAL 120CPS 200 MIFLONIDE*POLVxINAL 60CPS 400M R03BA03 A A Flunisolide PULMIST*AD NEBUL 15MONOD2MG/2M A R03BA05 Fluticasone FLUSPIRAL 100*DISKUS 60D 100MC FLUSPIRAL 250*DISKUS 60D 250MC FLUSPIRAL 500*DISKUS 60D 500MC FLUSPIRAL*NEBULES 10D 500MCG/2 FLUSPIRAL 125*SOSPxINAL 120D FLUSPIRAL 250*SOSPxINAL 120D R03BB A A A A A A Anticolinergici R03BB01 Ipratropio bromuro ATEM*SOLxNEBUL 10FL 2ML 0,025% ATEM*AEROSOL DOSATO 200INAL13G R03BB04 A A Tiotropio bromuro SPIRIVA*30CPS 18MCG HANDIHALER A E' raccomandato l'utilizzo in pazienti con BPCO di grado grave o molto grave (stadio III Linea Guida GOLD 2003 FEV1 <50%) con frequenti riacutizzazioni della malattia. [DocCRF] Prontuario terapeutico della Provincia di Bologna 129 C la s s e S S N e concedibilità ATC Descrizione R03BC Sostanze antiallergiche, esclusi i corticosteroidi Note R03BC03 Nedocromil TILADE*SOSP PRESS INAL 2MG 112 TILADE*AEROSOL 36F 2ML 10MG A A R03D Altri antiasmatici per uso sistemico R03DA Derivati xantinici R03DA04 Teofillina RESPICUR*30CPS 200MG R.P. RESPICUR*30CPS 300MG R.P. A A R03DA05 Aminofillina TEFAMIN*IV 5F 10ML 240MG/10ML C R05 Preparati per la tosse e le malattie da raffreddam R05C Espettoranti, escluse le associazioni con antitosse R05CB Mucolitici R05CB13 Dornase alfa PULMOZYME*INAL 6F 2500U 2,5ML R05D PHT-PT Antitosse, escluse le associazioni con espettoranti R05DA Alcaloidi dell'oppio e derivati R05DA Diidrocodeina PARACODINA*OS GTT FL 15G R05DB H/OSP2 A 31 A 31 Altri sedativi della tosse R05DB27 Levodropropizina TAUTUX*OS GTT 30ML 6% 130 Commissione provinciale del Farmaco Bologna ATC Descrizione C la s s e S S N e concedibilità R06 Antiistaminici per uso sistemico R06A Antiistaminici per uso sistemico R06AB Alchilamine sostituite R06AB04 Clorfenamina TRIMETON*20CPR 4MG TRIMETON*INIET 5F 1ML 10MG R06AD Note C C Derivati fenotiazinici R06AD02 Prometazina FARGANESSE*20CONF 25MG FARGANESSE*IM 5F 2ML R06AE R06AE07 A A 89 89 A A 89 89 Derivati piperazinici Cetirizina FORMISTIN*20CPR RIV 10MG FORMISTIN*OS GTT 20ML 10MG/ML R07 Altri preparati per il sistema respiratorio R07A Altri preparati per il sistema respiratorio R07AA Surfattanti polmonari R07AA02 Surfattante alveolare suino CUROSURF*2FL 1,5ML 80MG/ML CUROSURF*1FL 3ML 80MG/ML RMP H/OSP1 H/OSP1 Prontuario terapeutico della Provincia di Bologna 131 ATC Descrizione S Organi di senso S01 Oftalmologici S01A Antimicrobici S01AA Antibiotici S01AA01 Cloramfenicolo SIFICETINA*COLL FL 5ML 0,4% SIFICETINA*UNG OFT 5G 1% S01AA02 S01AD Antivirali S01AD03 Aciclovir ZOVIRAX OFTALMICO*UNG 4,5G 3% S01AX Altri antimicrobici S01AX11 Ofloxacina EXOCIN*POM OFT 3,5G 0,3% C C C A C Ciprofloxacina OFTACILOX*OFT GTT FL 5ML 0,3% 132 C C C Netilmicina NETTACIN COLLIRIO*15FL 1D 0,3% S01AX13 C Tobramicina TOBRAL*COLL 5ML 0,3% TOBRAL*UNG OFT 0,3% S01AA23 C C Gentamicina RIBOMICIN*COLL FL 10ML 0,3% RIBOMICIN*UNG OFT 5G 0,3% RIBOMICIN*COLL 5MONOD.0,5ML S01AA12 Note Clortetraciclina AUREOMICINA*CREMA OFT 3,5G S01AA11 C la s s e S S N e concedibilità C Commissione provinciale del Farmaco Bologna ATC Descrizione S01AX18 Iodopovidone S01B Antiinfiammatori S01BA Corticosteroidi, non associati S01BA01 S01BC Antiinfiammatori non steroidei S01BC03 Diclofenac sodico VOLTAREN OFTA*COLL 30FL0,1%0,3 C C C C Antiinfiammatori e Antimicrobici in associazione S01CA Corticosteroidi e antimicrobici in associazione S01CA05 Betamesone + cloramfenicolo BETABIOPTAL*UNG OFT 5G BETABIOPTAL*COLL FL 5ML C C S01E Preparati antiglaucoma e miotici S01EA Simpaticomimetici per la terapia del glaucoma S01EA04 Clonidina ISOGLAUCON*COLL 10ML 0,125% S01EA05 S01EB01 A 78 PT Parasimpaticomimetici Pilocarpina PILOCARPINA FARM*COLL25D 0,5ML PILOCARPINA LUX*COLL 10ML 2% S01EB09 A Brimonidina ALPHAGAN*COLL FL 5ML 0,2% S01EB Note Desametasone ETACORTILEN*0,15% COLL20D 0,3M LUXAZONE*COLL FL 3ML 0,2% LUXAZONE*OFT UNG 3G 0,2% S01C C la s s e S S N e concedibilità C C Acetilcolina MIOCHOL E*SOLUZ INTRAOCUL 2ML H Prontuario terapeutico della Provincia di Bologna 133 ATC Descrizione S01EC Inibitori dell'anidrasi carbonica S01EC01 Acetazolamide DIAMOX*12CPR 250MG S01EC02 Note A Diclofenamide ANTIDRASI*IV 5F 75MG+5F 2,5ML FENAMIDE*20CPR 50MG S01EC03 C la s s e S S N e concedibilità A A Dorzolamide TRUSOPT*OFT FL 5ML 2% OCUMETER A 78 PT I principi attivi dorzolamide e brinzolamide, data la loro sostanziale sovrapponibilità clinica sono stati posti in gara in alternativa. Il lotto di gara è stato aggiudicato al principio attivo dorzolamide. S01ED Betabloccanti S01ED01 Timololo CUSIMOLOL*COLL 5ML 0,25% CUSIMOLOL*COLL 5ML 0,5% DROPTIMOL*COLL 25FL 0,5% S01ED02 Betaxololo BETOPTIC*COLL 5ML 0,5% S01ED51 A 78 PT A 78 PT A 78 PT Timololo + Latanoprost XALACOM*GTT OFT 1FL 2,5ML S01EE Analoghi delle prostaglandine S01EE01 Latanoprost XALATAN*GTT OFT 1FL 0,005% 2,5 134 A Timololo + Dorzolamide COSOPT*COLL 2%+0,5% 1FL 5ML OC S01ED51 A A A Commissione provinciale del Farmaco Bologna ATC Descrizione S01EE03 Bimatoprost LUMIGAN*COLL FL 3ML S01EE04 S01F Midriatici e cicloplegici S01FA Anticolinergici S01FA01 Atropina ATROPINA 1% FARMIGEA*5MONODOSE S01FB01 78 PT C C C C C C Simpaticomimetici, esclusi i preparati antiglaucoma Fenilefrina ISONEFRINE*COLL 5ML 36% S01H Anestetici locali S01HA Anestetici locali S01HA02 Ossibuprocaina NOVESINA*30FL 0,6ML 0,4% S01HA07 A Tropicamide + Fenilefrina VISUMIDRIATIC FENIL.*COLL 10ML S01FB 78 PT Tropicamide TROPIMIL*COLL 5ML 0,5% TROPIMIL*COLL 5MONODOSE 0,5ML VISUMIDRIATIC*COLL 10ML 1% S01FA56 A Ciclopentolato CICLOLUX*COLL 1% FL 3ML S01FA06 Note Travoprost TRAVATAN*GTT OFT 1FL 40MCG/ML S01FA04 C la s s e S S N e concedibilità C C Lidocaina LIDOCAINA CLOR 4%*COLL 100MONO C/OSP1 Prontuario terapeutico della Provincia di Bologna 135 ATC Descrizione S01J Diagnostici S01JA Sostanze coloranti S01JA01 Sodio fluoresceinato FLUORALFA*COLL FL 10ML 2% Note H S01L Sostanze contro le malattie vascolari oculari S01LA Sostanze antineovascolarizzazione S01LA01 Verteporfina VISUDYNE*INFUS 1FL 15MG 10ML S01X RMP H/OSP1 Altri oftalmologici S01XA Altri oftalmologici S01XA20 Carbomer LIPOVISC*GEL OFT 10G 2MG/G 136 C la s s e S S N e concedibilità C Commissione provinciale del Farmaco Bologna ATC Descrizione V Vari C la s s e S S N e concedibilità V03 Tutti gli altri prodotti terapeutici V03A Tutti gli altri prodotti terapeutici V03AB Antidoti V03AB Bentonite (sospensione acquosa 7%) V03AB Calcio gluconato V03AB01 Ipecacuana IPECACUANA*7% SCIR 100ML V03AB03 Note C Dicobalto edetato estero KELOCYANOR F 2,5 MG V03AB03 Edetato disodico calcico V03AB04 Pralidossima CONTRATHION*IM IV FL200MG+10ML V03AB06 Sodio tiosolfato V03AB08 Sodio nitrito V03AB09 H/OSP1 Protamina PROTAMINA ICN*IV 1F 50MG 5ML V03AB15 A Dimercaprolo BAL*IM 10F 2ML 100MG V03AB14 estero A Naloxone NARCAN NEONATAL*1F 2ML 0,04MG NARCAN*IM IV 1F 1ML 0,4MG A A Prontuario terapeutico della Provincia di Bologna 137 ATC Descrizione V03AB23 Acetilcisteina HIDONAC*EV 1FL 5G 25ML V03AB24 C la s s e S S N e concedibilità Note C/OSP1 Frammenti anticorpali specifici contro digossina estero DIGIFAB FF 40 MG V03AB25 Flumazenil ANEXATE*IV 1F 0,5MG/5ML ANEXATE*IV 1F 1MG/10ML V03AB33 H H Idroxocobalamina estero CYANOKIT G 2,5 ML 250 X 2F V03AC Sostanze chelanti del ferro V03AC01 Deferoxamina DESFERAL*1FL 2G/20ML+1F SOLV DESFERAL*10FL 500MG/5ML+10F5ML V03AC02 H/OSP2 V03AE Farmaci per il trattamento dell'iperkaliemia e dell'iperfosfatemia V03AE01 Polistirensolfonato KAYEXALATE*OS SOSP 100MG/G 454 V03AE02 PHT-PT Deferiprone FERRIPROX*100CPR RIV 500MG A Sevelamer RENAGEL*FL 180CPR 800MG A PHT-PT V03AF Sostanze disintossicanti per trattamenti antineoplastici V03AF01 Mesna UROMITEXAN*IV 15F 4ML 400MG/4M 138 A A A PHT-PT Commissione provinciale del Farmaco Bologna ATC Descrizione V03AF02 Dexrazoxano CARDIOXANE*EV FL 500MG V03AF03 C C H/OSP1 H/OSP1 Rasburicase FASTURTEC*EV 1F 7,5MG+1F 5ML V03AH H/OSP1 Calcio levofolinato CALCIO LEVOF.FIDIA*1FL 100MG CALCIO LEVOF.FIDIA*1FL 175MG V03AF07 Note Calcio folinato CALFOLEX*10CPR 15MG CALFOLEX*IM EV FL 50MG V03AF04 C la s s e S S N e concedibilità RMP C Farmaci per il trattamento della ipoglicemia V03AH01 Diazossido PROGLICEM*100CPS 100MG V03AZ Deprimenti del sistema nervoso V03AZ01 Etanolo (soluzione 50%) V04 Diagnostici V04C Altri diagnostici V04CA Test per il diabete V04CA02 Glucosio monoidrato GLUCOSIO*OS 50% 1FL 150ML V04CD A C Test di funzionalita' ipofisaria V04CD03 Sermorelina GEREF*EV 1F 50MCG+F 1ML V04CD05 H/OSP1 Somatorelina GHRH FERRING*1F 50MCG+F 1ML H/OSP1 Prontuario terapeutico della Provincia di Bologna 139 ATC Descrizione V04CF Test per la tubercolosi V04CF01 Tubercolina BIOCINETEST PPD*LIOF 2D 10UI/D BIOCINETEST PPD*LIOF 2D 5UI/D V04CG C la s s e S S N e concedibilità Note C C Test per la secrezione gastrica V04CG04 Pentogastrina estero PENTAGASTRIN 500 MCG 2 ML 5 FIALE V04CJ Test per la funzionalità tiroidea V04CJ01 Tireotropina alfa THYROGEN*IM 2F 0,9MG V04CJ02 RMP H/OSP1 Protirelina estero TRH UBC 200 MCG F V04CX Altri diagnostici V04CX Bleu di Evans V04CX Dimeticone attivato METEOSIM*50CPR MAST 40MG METEOSIM*OS GTT 30ML 6,66% V04CX Fluoresceina FLUORESCEINA SODICA MON*IV 10F H/OSP1 V04CX Rosso Congo V04CX Sodio bicarbonato + acido citrico anidro DUOGAS*GRAT 10BUST 3,5G V04CX 140 C C C/OSP1 Somatostatina Commissione provinciale del Farmaco Bologna ATC Descrizione V04CX Urea c tredici CITREDICI UBT KIT*FL75MG+1BUST V04CX C la s s e S S N e concedibilità Note H Xilosio V07 Tutti gli altri prodotti non terapeutici V07A Tutti gli altri prodotti non terapeutici V07AB Solventi e diluenti, comprese le soluzioni detergenti V07AB Acqua per preparazioni iniettabili FU V07AC Prodotti ausiliari per la trasfusione del sangue V07AC Anticoagulante ACD V07AC Anticoagulante CDP V07AC Sodio citrato V07AY Altri prodotti ausiliari non terapeutici V07AY Soluzione di Eurocollins V08 Mezzi di contrasto V08A Mezzi di contrasto radiologici, iodati V08AA Mezzi di contrasto radiologici idrosolubili, nefrotropici, ad alta osmolarita' V08AA01 Acido diatrizoico GASTROGRAFIN*OS RETT FL 100ML V08AA03 H/OSP1 Iodamide ISTEROPAC E.R.*1F 10ML OPACIST E.R.*FL 200ML H/OSP1 H/OSP1 Prontuario terapeutico della Provincia di Bologna 141 Descrizione V08AB Mezzi di contrasto radiologici idrosolubili, nefrotropici, a bassa osmolarita' V08AB03 Acido ioxaglico HEXABRIX 320*INIET 1FL 100ML HEXABRIX*FL 200ML 320MG/ML HEXABRIX 320*INIET 1FL 50ML V08AB04 V08AB09 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Iodixanolo VISIPAQUE*270MG I/ML FL 20ML VISIPAQUE*270MG I/ML FL 100ML VISIPAQUE*270MG I/ML FL 200ML VISIPAQUE*270MG I/ML FL 50ML VISIPAQUE*270MG I/ML FL 500ML V08AB10 Note Iopamidolo GASTROMIRO*FL 20ML 12,25G GASTROMIRO*FL 50ML 30,62G GASTROMIRO*FL 100ML 61,24G IOPAMIRO 150*FL 50ML IOPAMIRO 150*FL 100ML IOPAMIRO 150*FL 250ML IOPAMIRO 300*1F 10ML IOPAMIRO 300*FL 30ML IOPAMIRO 300*FL 50ML IOPAMIRO 300*FL 100ML IOPAMIRO 300*FL 200ML IOPAMIRO 370*1F 10ML IOPAMIRO 370*FL 30ML IOPAMIRO 370*FL 50ML IOPAMIRO 370*FL 100ML IOPAMIRO 370*FL 200ML H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Iomeprolo IOMERON 300*IV FL 50ML IOMERON 300*IV FL 75ML IOMERON 300*IV FL 100ML 142 C la s s e S S N e concedibilità ATC H/OSP1 H/OSP1 H/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione IOMERON 300*IV FL 150ML IOMERON 300*IV FL 200ML IOMERON 300*IV FL 500ML IOMERON 350*IV FL 50ML IOMERON 350*IV FL 100ML IOMERON 350*IV FL 150ML IOMERON 350*IV FL 200ML IOMERON 350*IV FL 250ML IOMERON 350*IV FL 500ML IOMERON 400*IV FL 50ML IOMERON 400*IV FL 75ML IOMERON 400*IV FL 100ML IOMERON 400*IV FL 150ML IOMERON 400*IV FL 200ML IOMERON 400*IV FL 250ML V08AB11 C la s s e S S N e concedibilità Note H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Iobitridolo XENETIX 350*FL 100ML 350MG/ML XENETIX 350*FL 150ML 350MG/ML XENETIX 350*FL 200ML 350MG/ML XENETIX 350*FL 50ML 350MG/ML XENETIX 350*FL 500ML 350MG/ML XENETIX*FL 60ML300MG/ML+SIR+CA C/OSP1 C/OSP1 C/OSP1 C/OSP1 C/OSP1 C/OSP1 V08AC Mezzi di contrasto radiologici idrosolubili, epatotropici V08AC06 Acido iopanoico CISTOBIL*6CPR 500MG V08AD V08AD01 H Mezzi di contrasto radiologici non idrosolubili Olio etiodato LIPIODOL ULTRAFLUIDO*F 10ML H/OSP1 Prontuario terapeutico della Provincia di Bologna 143 ATC Descrizione Note V08B Mezzi di contrasto radiologici, non iodati V08BA Bario solfato contenente mezzi di contrasto radiologici V08BA02 Bario solfato PRONTOBARIO HD*OS POLV 340G PRONTOBARIO ESOFAGO*CR 250ML PRONTOBARIO TAC*SOSP FL 225ML V08C V08CA Mezzi di contrasto paramagnetici V08CA01 Acido gadopentetico V08CA04 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 H/OSP1 Gadoteridolo PROHANCE*EV 1FL 5ML 279,3MG/ML PROHANCE*EV 1FL 10ML 279,3MG/M PROHANCE*EV 1FL 15ML 279,3MG/M PROHANCE*EV 1FL 20ML 279,3MG/M PROHANCE*EV SIR 10ML 279,3MG PROHANCE*EV 1SIR 15ML 279,3MG PROHANCE*EV 1SIR 17ML 279,3MG V08CA08 H/OSP1 H/OSP1 H/OSP1 Mezzi di contrasto per risonanza magnetica MAGNEVIST*EV 1FL 5ML 469MG/ML MAGNEVIST*EV 1FL 10ML 469MG/ML MAGNEVIST*EV 1FL 15ML 469MG/ML MAGNEVIST*EV 1FL 20ML 469MG/ML MAGNEVIST*EV 1FL 30ML 469MG/ML MAGNEVIST*EV 1FL 100ML 469MG/M MAGNEVIST*EV 1SIR 10ML 469MG/M MAGNEVIST*EV 1SIR 15ML 469MG/M MAGNEVIST*EV 1SIR 20ML 469MG/M H/OSP1 H/OSP1 H/OSP1 H/OSP1 C/OSP1 C/OSP1 C/OSP1 Acido Gadobenico MULTIHANCE*EV 1F 5ML MULTIHANCE*EV 1F 10ML MULTIHANCE*EV 1F 15ML MULTIHANCE*EV 1F 20ML 144 C la s s e S S N e concedibilità C/OSP1 C/OSP1 C/OSP1 C/OSP1 Commissione provinciale del Farmaco Bologna ATC Descrizione V08CA09 Gadobutrolo C la s s e S S N e concedibilità GADOVIST*FL 15ML 1,0MMOL/ML Note H/OSP1 Mezzi di contrasto per risonanza magnetica contenenti gadolinio: "...In seguito a segnalazioni di fibrosi sistemica nefrogenica associata all'impiego di mezzi di contrasto contenenti gadolinio, l'uso del farmaco è controindicato nei pz con grave insufficienza renale (GFR<30 ml/min/1,73m2)..." (DDL AIFA, febbraio 2007). V08CB Mezzi di contrasto superparamagnetici V08CB01 Ferumoxsil LUMIREM*SOSP 3FL 52,5MG/300ML V08CB03 C Ferro ossido nanoparticelle ENDOREM*1F 8ML+SIR RESOVIST*INIET 1SIR 0,9ML RMP C/OSP1 C/OSP1 V08D Mezzi di contrasto per ultrasonologia V08DA Mezzi di contrasto per ultrasonologia V08DA02 Galattosio + Acido palmitico LEVOVIST*1FL 4G+FL 20ML+SIR H/OSP1 V08DA05 Zolfo esafluoruro SONOVUE*1FL 8MCG+1SIR 5ML+ADAT V10 Radiofarmaci terapeutici V10B Radiofarmaci terapeutici vari V10XX Altri radiofarmaci terapeutici V10XX02 Ibritumomab tiuxetano ZEVALIN*INFUS 1F 3ML 1,6MG/ML C/OSP1 H/OSP1 Registro AIFA:http://aifa-onco.agenziafarmaco.it Prontuario terapeutico della Provincia di Bologna 145 Indice per principio attivo P ri n c i p i o at t i v o Abacavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Abacavir + Lamivudina + Zidovudina . . . . . . . . . . . . . . . . . . . . Abciximab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acenocumarolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acetazolamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acetilcisteina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acetilcolina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acetilsalicilato di lisina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acetilsalicilato di lisina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido acetilsalicilico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido acetilsalicilico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido acetilsalicilico + Magn. Idrossido + algedrato . . . . . . . . . Acido alendronico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido ascorbico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido clodronico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido diatrizoico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido etacrinico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido folico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido fusidico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido Gadobenico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido gadopentetico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido iopanoico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido ioxaglico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido pamidronico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido pipemidico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido tranexamico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido ursodesossicolico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido valproico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acido zoledronico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acitretina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Acqua per preparazioni iniettabili FU . . . . . . . . . . . . . . . . . . . . . Adalimumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Adefovir dipivoxil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Adenosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Adrenalina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Agalsidasi beta . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alanilglutamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 148 pag. 82 83 36 35 134 138 133 111 36 132 57 80 111 36 36 106 33 106 141 51 40 57 144 144 143 142 106 76 38 26 113 106 57 141 101 82 49 47 34 45 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Albendazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Albumina umana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aldesleuchina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alemtuzumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alfuzosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Allopurinolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aloperidolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aloperidolo decanoato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alprazolam [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . . . . . . Alprostadil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alprostadil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alteplasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amfotericina B . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amfotericina B . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amfotericina B complesso lipidico . . . . . . . . . . . . . . . . . . . . . . . Amfotericina B liposomiale . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amikacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amiloride + Idroclorotiazide . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aminoacidi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aminofillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amiodarone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amisulpride . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amitriptilina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amlodipina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ammonio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amoxicillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Amoxicillina + Acido clavulanico . . . . . . . . . . . . . . . . . . . . . . . . Ampicillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ampicillina + Sulbactam . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Anastrozolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Anticoagulante ACD . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Anticoagulante CDP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Antitrombina III umana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Apomorfina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aripiprazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Asparaginasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Associazioni di elettroliti . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atazanavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atenololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atorvastatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 126 41 99 95 64 105 117 117 120 48 63 37 28 77 77 78 75 51 41 130 47 118 121 53 44 70 71 70 71 97 141 141 35 116 119 95 45 81 52 55 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 149 P ri n c i p i o at t i v o Atosiban acetato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atovaquone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atracurio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atropina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Atropina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Azatioprina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Azitromicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Aztreonam . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Baclofene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bario solfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Basiliximab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Beclometasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Beclometasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bentonite (sospensione acquosa 7%) . . . . . . . . . . . . . . . . . . . . Benzilpenicillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Benzilpenicillina benzatinica . . . . . . . . . . . . . . . . . . . . . . . . . . . Betamesone + cloramfenicolo . . . . . . . . . . . . . . . . . . . . . . . . . . Betametasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Betametasone [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . Betaxololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bevacizumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bicalutamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bimatoprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Biperidene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bisoprololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bleomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bleu di Evans . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bortezomib . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bosentan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Brimonidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bromocriptina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Budesonide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Budesonide + Formoterolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bupivacaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Bupivacaina + Adrenalina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Buprenorfina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Buprenorfina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Buserelin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Busulfano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Butilscopolamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 150 pag. 61 125 104 135 25 102 75 73 105 144 101 129 29 137 70 71 133 58 67 134 95 97 135 114 52 93 140 96 50 133 61 129 128 108 109 110 123 96 89 25 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Cabergolina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio carbonato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio folinato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio gluconato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio gluconato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcio levofolinato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcipotriolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Calcitriolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Candesartan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Canrenoato potassico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Capecitabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carbamazepina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carboidrati . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carbomer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carbone attivato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carboplatino . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carmustina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Carvedilolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Caspofungin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefaclor . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefalexina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefazolina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefixima . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefonicid . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefotaxima . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefoxitina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ceftazidima . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ceftriaxone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefuroxima . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cefuroxima axetil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cetirizina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Chinina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cianocobalamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ciclofosfamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ciclopentolato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cicloserina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ciclosporina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cidofovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cinacalcet . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 61 34 44 139 137 34 139 57 33 54 51 91 113 42 136 28 94 90 52 78 72 71 71 73 72 72 72 72 73 72 72 131 125 40 89 135 78 100 80 69 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 151 P ri n c i p i o at t i v o Ciprofloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ciprofloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ciproterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cisatracurio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cisplatino . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Citalopram . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Citarabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Claritromicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clindamicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clobazam [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clobetasolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clofenotano + Benzile benzoato + Benzocaina . . . . . . . . . . . . . Clomipramina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clonazepam . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clonidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clonidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clopidogrel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clorambucile . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cloramfenicolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cloramfenicolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clorfenamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clormetina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clorochina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clorpromazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clortalidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clortetraciclina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clotiapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Clozapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Colchicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Colestiramina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Colistina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Colistina solfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Colla di Fibrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Collagenasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Complesso protrombinico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Complesso protrombinico concentrato attivato . . . . . . . . . . . . . Complesso vitaminico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Complesso vitaminico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Cortisone [d. az.breve] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dacarbazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 152 pag. 132 76 62 104 94 121 91 74 75 120 58 127 120 113 133 49 36 89 132 70 131 89 125 116 50 132 119 117 105 55 77 28 38 56 38 39 32 45 68 90 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Daclizumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dactinomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Danazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dantrolene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dapsone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Daunorubicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Deferiprone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Deferoxamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Delorazepam [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . Desametasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Desametasone [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . Desflurano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Desmopressina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Desossimetasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Destrano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dexrazoxano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diazepam [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diazossido . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diclofenac . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diclofenac sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diclofenamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dicobalto edetato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Didanosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Didrogesterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Digossina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diidrochinidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diidrocodeina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diidrotachisterolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Diltiazem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dimercaprolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dimeticone attivato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dinoprostone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dipiridamolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Disulfiram . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dobutamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Docetaxel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Domperidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Donepezil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dopamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Dornase alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 101 92 63 105 79 93 138 138 119 133 67 107 66 58 41 139 119 139 103 133 134 137 81 62 46 46 130 32 53 137 140 60 36 123 47 92 26 122 47 130 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 153 P ri n c i p i o at t i v o Dorzolamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Doxazosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Doxiciclina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Doxorubicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Doxorubicina liposomiale . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Drotrecogin alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Econazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Econazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Edetato disodico calcico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Efalizumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Efavirenz . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica equilibrata enterica . . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica equilibrata gastrica . . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica equilibrata pediatrica . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica reidratante I . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica reidratante II . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Elettrolitica reidratante III . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Emtricitabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Emtricitabina + Tenofovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Enalapril . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Enfuvirtide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Enoxaparina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Enoximone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Entacapone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Eparina Calcica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Eparina Sodica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Epirubicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Epoetina alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Epoprostenolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Eptacog alfa (attivato) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Eptifibatide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Eritromicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Esomeprazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Estramustina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Etambutolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Etambutolo + Isoniazide + Piridossina . . . . . . . . . . . . . . . . . . . . Etanercept . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Etanolo (soluzione 50%) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Etilefrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Etoposide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 154 pag. 134 49 70 93 93 37 56 60 137 102 83 42 42 43 43 43 43 82 83 54 83 35 47 116 35 35 93 40 36 39 36 74 25 95 79 79 101 139 47 92 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Etosuccimide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Everolimus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Exemestan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fattore IX . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fattore VII . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fattore VIII . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Felodipina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fenilefrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fenitoina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fenobarbital . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fentanil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fentanil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ferrigluconato sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ferro ossido nanoparticelle . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ferromaltoso . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ferroso solfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ferumoxsil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Filgrastim . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Finasteride . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fitomenadione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flecainide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Floroglucinolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Floroglucinolo + Meglucinolo . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluconazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fludarabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fludrocortisone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flufenazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flumazenil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flunisolide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluoresceina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluorouracile . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluoxetina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flurazepam [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Flutamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluticasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fluvastatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Follitropina alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Follitropina beta . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fondaparinux sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Formoterolo [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 112 101 98 39 39 38 53 135 112 112 107 110 40 145 40 40 145 98 64 38 46 25 25 78 91 67 116 138 129 140 91 121 120 97 129 55 62 62 37 128 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 155 P ri n c i p i o at t i v o Fosamprenavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Foscarnet . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fotemustina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Frammenti anticorpali specifici contro digossina . . . . . . . . . . . . Frumento estratto + fenossietanolo . . . . . . . . . . . . . . . . . . . . . . Fruttosio difosfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Fulvestrant . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Furosemide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gabapentin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gadobutrolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gadoteridolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Galantamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Galattosio + Acido palmitico . . . . . . . . . . . . . . . . . . . . . . . . . . . Ganciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gemcitabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gemeprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gemfibrozil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gentamicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gentamicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glatiramer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glibenclamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glicerolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glicerolo + Sodio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gliclazide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glimepiride . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gliquidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glucagone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Glucosio + Potassio cloruro I e II . . . . . . . . . . . . . . . . . . . . . . . . Glucosio + Sodio cloruro I, II e III . . . . . . . . . . . . . . . . . . . . . . . . Glucosio monoidrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Gonadorelina acetato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Goserelin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Griseofulvina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ibritumomab tiuxetano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ibuprofene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idarubicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idroclorotiazide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idrocortisone [d. az.breve] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idrocortisone butirrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idrossicarbamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 156 pag. 81 80 90 138 56 48 97 50 114 145 144 123 145 80 91 60 55 132 75 99 31 28 44 31 31 31 69 43 43 139 66 96 56 145 103 93 50 68 58 95 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Idrossiclorochina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Idroxocobalamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ifosfamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iloprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Imatinib . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Imiglucerasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Imipramina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Imiquimod . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Immunoglobulina antitimocitaria . . . . . . . . . . . . . . . . . . . . . . . . Immunoglobulina umana ad alto titolo di IgM . . . . . . . . . . . . . . Immunoglobulina umana anti-D Rh0 . . . . . . . . . . . . . . . . . . . . . Immunoglobulina umana antiepatite B . . . . . . . . . . . . . . . . . . . . Immunoglobulina umana citomegalovirica . . . . . . . . . . . . . . . . Immunoglobulina umana della varicella . . . . . . . . . . . . . . . . . . . Immunoglobulina umana normale . . . . . . . . . . . . . . . . . . . . . . . Immunoglobulina umana tetanica . . . . . . . . . . . . . . . . . . . . . . . Indinavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Indometacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Infliximab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Insulina aspart . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Insulina glargine . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Insulina lispro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Insulina umana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Insulina umana + insulina umana isofano . . . . . . . . . . . . . . . . . Insulina umana isofano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone alfa-2a . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone alfa-2b . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone beta -1a . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone beta -1b . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interferone gamma 1-b . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iobitridolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iodamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iodixanolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iodopovidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iodopovidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iomeprolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Iopamidolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ipecacuana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ipratropio bromuro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 125 138 89 36 95 34 120 57 100 84 84 84 84 84 84 84 81 103 101 30 30 30 30 30 30 98 98 98 99 99 98 143 141 142 133 60 142 142 137 129 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 157 P ri n c i p i o at t i v o Irbesartan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Irinotecan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isoflurano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isoniazide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isoprenalina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isosorbide dinitrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isosorbide mononitrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Isotretinoina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Itraconazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ivermectina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ketamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ketoprofene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ketorolac . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Labetalolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lamivudina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lamivudina+ Abacavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lamivudina+ Zidovudina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lamotrigina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lanreotide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lansoprazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Latanoprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lattulosio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Leflunomide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lepirudina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Letrozolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Leuprorelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levetiracetam . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levobupivacaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levocarnitina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levodopa + Benserazide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levodopa + Carbidopa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levodopa + Carbidopa + Entacapone . . . . . . . . . . . . . . . . . . . Levodropropizina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levofloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levomepromazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levosimendan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levosulpiride . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Levotiroxina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lidocaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lidocaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158 pag. 54 95 107 79 47 48 48 58 78 126 108 103 103 52 82 83 83 114 67 24 134 27 101 37 97 96 114 109 34 115 115 115 130 76 116 48 118 68 108 135 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Lidocaina + Prilocaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lidocaina cloridrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Linezolid . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lisinopril . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Litio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Loperamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lopinavir + Ritonavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lorazepam [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . . . . . . Macrogol 4000 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Macrogol+Sali di Na e K . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Macrogol+Simeticone+Sali di Na e K . . . . . . . . . . . . . . . . . . . . Magnesio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Magnesio idrossido + Algeldrato . . . . . . . . . . . . . . . . . . . . . . . . Magnesio solfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mannitolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mebendazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Medrossiprogesterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Megestrolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Melfalan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Menotropina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mepivacaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mepivacaina + Adrenalina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mercaptopurina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Meropenem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mesalazina (5-ASA) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mesna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metadone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metformina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metformina + Glibenclamide . . . . . . . . . . . . . . . . . . . . . . . . . . . Metformina + Rosiglitazone . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metildopa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metilergometrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metilprednisolone [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . Metoclopramide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metolazone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metoprololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metotrexato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metronidazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metronidazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metronidazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 109 63 77 54 118 29 81 119 27 27 27 45 24 44 44 126 96 96 89 62 108 109 90 73 29 138 124 31 31 31 49 60 67 26 50 52 90 125 60 77 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 159 P ri n c i p i o at t i v o Mexiletina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mianserina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Micofenolato mofetile . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Micofenolato sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Miconazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Midazolam [d. az. breve] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Minociclina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mirtazapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Misoprostolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mitomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mitotano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mitoxantrone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mivacurio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Modafinil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Morfina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Moroctocog alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Moxifloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Mupirocina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Muromonab CD3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nadroparina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Naloxone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Naltrexone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Naproxene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nedocromil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Neostigmina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Netilmicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Netilmicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nevirapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nicotinamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nifedipina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nimesulide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nimodipina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nistatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nitrofurantoina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nitroglicerina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nitroprussiato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nonacog alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Noradrenalina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Noretisterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Norfloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 160 pag. 46 121 100 100 24 120 70 122 24 93 96 93 104 122 109 39 76 56 100 35 137 123 103 130 123 132 75 82 33 53 104 53 28 77 48 49 39 47 62 76 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Octocog alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Octreotide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ofloxacina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Olanzapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Olio di soia + Lecitina + trigliceridi saturi a media catena . . . . . Olio di soia + Lecitina d'uovo . . . . . . . . . . . . . . . . . . . . . . . . . . . Olio etiodato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Omega-3-trigliceridi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ondansetron . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Orfenadrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ossibuprocaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ossibutinina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ossicodone cloridrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ossitocina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Oxacillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Oxaliplatino . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Oxcarbazepina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paclitaxel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Palivizumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pancrelipasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paracalcitolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paracetamolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paracetamolo + Codeina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paraffina liquida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paromomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Paroxetina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Peginterferon alfa-2a . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Peginterferon alfa-2b . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pegvisomant . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pentamidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pentamido + Sodio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pentogastrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pentostatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Perfenazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pergolide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Petidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Picosolfato sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pilocarpina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pimozide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pioglitazone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 39 66 132 117 42 42 143 55 26 115 135 63 110 66 71 94 113 92 85 29 33 111 111 27 28 121 99 99 65 126 41 140 95 116 115 110 27 133 117 32 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 161 P ri n c i p i o at t i v o Piperacillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Piperacillina + Tazobactam . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pirazinamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Piridossina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Piridostigmina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pirimetamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Polidocanolo/Lauromacrogol 400 . . . . . . . . . . . . . . . . . . . . . . . . Poligelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Polistirensolfonato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio aspartato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio fosfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio lattato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Potassio perclorato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Povidone-iodio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pralidossima . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pramipexolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Pravastatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Prednisone [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . . . . . . Preparazioni antiemorroidarie + cortisonici . . . . . . . . . . . . . . . . Primachina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Primidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Procarbazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Progesterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Promazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Prometazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Propafenone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Propiltiouracile . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Propofol . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Propranololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Protamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Proteina C umana . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Proteina plasmatica umana antiangioedema . . . . . . . . . . . . . . . Protirelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Quetiapina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ramipril . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ranitidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rasburicase . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Remifentanil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 162 pag. 70 71 79 33 123 126 51 41 138 44 34 44 44 45 69 58 137 115 55 68 51 125 112 94 61 116 131 46 68 108 52 137 37 38 140 118 54 24 139 107 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Repaglinide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Retinolo + Ergocalciferolo + Tocoferolo alfa + Fitomenadione . Retinolo palmitato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ribavirina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rifabutina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rifampicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rifaximina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Riluzolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer acetato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer acetato con glucosio . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer con glucosio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer lattato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ringer lattato con glucosio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Risperidone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ritodrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ritonavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rituximab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rivastigmina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rizatriptan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rocuronio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ropinirolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ropivacaina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rosiglitazone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Rosso Congo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Salbutamolo [d. az. breve] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Salmeterolo + Fluticasone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Salmeterolo [d. az. lunga] . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Saquinavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Senna foglie (glucosidi A e B) . . . . . . . . . . . . . . . . . . . . . . . . . . Sermorelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sertralina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sevelamer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sevoflurano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sierimmune antibotulinico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sierimmune antigangrena gassosa . . . . . . . . . . . . . . . . . . . . . . Sierimmune antivipera . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sildenafil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Simvastatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sirolimus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 32 45 32 80 79 79 28 124 43 43 43 43 43 43 118 61 81 94 122 112 104 115 109 31 140 128 128 128 80 27 139 121 138 107 83 84 83 63 55 101 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 163 P ri n c i p i o at t i v o Sodio acetato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio bicarbonato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio bicarbonato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio bicarbonato + acido citrico anidro . . . . . . . . . . . . . . . . . . Sodio citrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio citrato + Acido citrico . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio cloruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio fenilbutirrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio fluoresceinato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio fosfato acido + Disodio fosfato . . . . . . . . . . . . . . . . . . . . . sodio fosfato monobasico diidrato + disodio fosfato dibasico dodecaidrato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio lattato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio nitrito . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio oxibato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sodio tiosolfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluz. nutrizionali associazioni . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzione cardioplegica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzione Darrow . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzione di Eurocollins . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzioni per emodialisi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzioni per emofiltrazione . . . . . . . . . . . . . . . . . . . . . . . . . . . . Soluzioni saline . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Somatorelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Somatostatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Somatostatina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Somatropina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sotalolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Spiramicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Spironolattone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Stavudina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Streptomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Streptozocina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sucralfato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sufentanil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sulfadiazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sulfadiazina argentica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sulfametopirazina + Pirimetamina . . . . . . . . . . . . . . . . . . . . . . . Sulfametoxazolo + Trimetoprim . . . . . . . . . . . . . . . . . . . . . . . . . 164 pag. 44 43 44 140 141 44 43 44 34 136 27 28 44 137 123 137 42 45 43 141 45 45 44 139 140 66 65 52 74 51 82 75 90 25 107 74 57 126 74 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Sulfasalazina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sulprostone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Sumatriptan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Surfattante alveolare suino . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Suxametonio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tacrolimus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tacrolimus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tadalafil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tamoxifene . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tamsulosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Teicoplanina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Temazepam [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . . . . . Temozolomide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tenecteplase . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Teniposide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tenofovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Teofillina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Terazosina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Terbinafina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Teriparatide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Terlipressina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Testosterone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tetramido . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiagabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiamazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiamina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiapride . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Ticlopidina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Timololo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Timololo + Dorzolamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Timololo + Latanoprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tioguanina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiopental . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiotepa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tiotropio bromuro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tipranavir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tireotropina alfa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tirofiban . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tobramicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Tobramicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 29 61 112 131 104 100 59 63 97 64 77 120 90 37 92 82 130 64 56 69 66 61 41 113 69 33 118 36 134 134 134 91 107 89 129 81 140 37 132 75 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 165 P ri n c i p i o at t i v o pag. Tocoferolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33 Topiramato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 114 Topotecan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 95 Torasemide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50 Tossina botulinica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 104 Tramadolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 111 Trastuzumab . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 94 Travoprost . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135 Trazodone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 122 Tretinoina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 95 Triamcinolone [d. az. intermedia] . . . . . . . . . . . . . . . . . . . . . . . . 68 Triesifenidile . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 114 Triptorelina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 97 Trometamolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43 Tropicamide . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135 Tropicamide + Fenilefrina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135 Tubercolina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 140 Urapidil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49 Urea c tredici . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 141 Urofollitropina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62 Urokinasi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 Vaccino apatitico A+vaccino epatitico B . . . . . . . . . . . . . . . . . . 87 Vaccino BCG . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 99 Vaccino colerico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85 Vaccino difterico e tetanico adsorbito . . . . . . . . . . . . . . . . . . . . 86 Vaccino difterico, tetanico e pertossico acellulare a partire dai 4 anni di età . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85 Vaccino difterico, tetanico e pertossico acellulare a partire dal 2° mese di vita . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85 Vaccino difterite-epatite B-H.influenzae B-pertosse-poliomelitetetano . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 88 Vaccino difterite-epatite B-pertosse-poliomelite-tetano . . . . . . . 88 Vaccino difterite-poliomielite-tetano . . . . . . . . . . . . . . . . . . . . . . 88 Vaccino epatitico A inattivato adsorbito . . . . . . . . . . . . . . . . . . . 87 Vaccino epatitico B a Dna ric. . . . . . . . . . . . . . . . . . . . . . . . . . . 87 Vaccino febbre gialla vivo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 88 Vaccino H. influenzae coniugato al tossoide tetanico . . . . . . . . 85 Vaccino influenzale inattivato a base di antigeni di superficie, adiuvato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86 Vaccino influenzale inattivato a base di antigeni di superficie, virosomale . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86 166 Commissione provinciale del Farmaco Bologna P ri n c i p i o a t t i v o Vaccino influenzale subvirionico (frammentato) . . . . . . . . . . . . Vaccino meningococcico coniugato con tossoide tetanico . . . Vaccino meningococcico polisaccaridico . . . . . . . . . . . . . . . . . Vaccino morbilloso parotitico e rubeolico . . . . . . . . . . . . . . . . . Vaccino pneumococcico, antigene polisaccaridico purificato . Vaccino pneumococcico, antigene polisaccaridico purificato coniugato . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vaccino poliomielitico trivalente inattivato parenterale a virus intero . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vaccino rabico da colture cellulari . . . . . . . . . . . . . . . . . . . . . . . Vaccino tetanico adsorbito . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vaccino tifoideo polisaccaridico . . . . . . . . . . . . . . . . . . . . . . . . Vaccino tifoideo vivo orale . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vaccino tubercolare (BCG) liofilizzato . . . . . . . . . . . . . . . . . . . . Vaccino varicelloso vivo attenuato . . . . . . . . . . . . . . . . . . . . . . . Valaciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Valganciclovir . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vancomicina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vardenafil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vecuronio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Venlafaxina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Verapamil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Verteporfina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vigabatrin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vinblastina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vincristina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vindesina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Vinorelbina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Voriconazolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Warfarin sodico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Xilosio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Zalcitabina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Zidovudina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Zolfo esafluoruro . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Zolpidem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Zuclopentixolo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . pag. 87 85 85 87 86 86 87 87 86 86 86 86 87 80 80 76 63 104 122 53 136 113 91 92 92 92 78 35 141 82 81 145 120 117 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 167 Indice per nome commerciale del farmaco Nome commerciale pag ABELCET*EV 10FL 20ML+10AGHI . . . . . . . 77 ABILIFY*28CPR 10MG . . . . . . . . . . . . . . . . 119 ABILIFY*28CPR 15MG . . . . . . . . . . . . . . . . 119 ACICLIN*25CPR 400MG. . . . . . . . . . . . . . . 80 ACICLIN*35CPR 800MG. . . . . . . . . . . . . . . 80 ACICLOVIR ABC*OS 100ML 8% . . . . . . . . 80 ACICLOVIR RECORDATI*EV 5F250MG. . . . 80 ACIDO ACETILSALIC*20CPR 500MG. . . . . 111 ACTHIB*IM 1FL 1D LIOF+SIR. . . . . . . . . . . 85 ACTILYSE*IV FL 50MG+FL 50ML. . . . . . . . 37 ACTOS*28CPR 15MG. . . . . . . . . . . . . . . . . 32 ACTOS*28CPR 30MG. . . . . . . . . . . . . . . . . 32 ACTRAPHANE 30 NOV*5CART 100UI/ . . . . 30 ACTRAPHANE 30 PEN*5CART 3ML100 . . . 30 ACTRAPHANE 30*SC 10ML 100UI/ML . . . 30 ACTRAPID*NOVOL 5CART 3ML100UI/ . . . 30 ACTRAPID*PENF 5CART 3ML100UI/M . . . 30 ACTRAPID*SC EV 1FL 10ML100UI/M . . . . 30 ADALAT A.R.*50CPR 20MG . . . . . . . . . . . . 53 ADALAT CRONO*14CPR RIV 30MG . . . . . . 53 ADALAT CRONO*14CPR RIV 60MG . . . . . . 53 ADDAMEL N*INFUS 20F 10ML . . . . . . . . . 45 ADRENALINA*10F 1MG 1ML . . . . . . . . . . . 47 ADRIBLASTINA*INIET 1F 10MG/5ML. . . . . 93 ADRIBLASTINA*INIET FL50MG/25ML . . . . 93 ADVATE*FL 1000UI+FL SOLV 5ML . . . . . . 39 ADVATE*FL 1500UI+FL SOLV 5ML . . . . . . 39 ADVATE*FL 250UI+FL SOLV 5ML . . . . . . . 39 ADVATE*FL 500UI+FL SOLV 5ML . . . . . . . 39 AERRANE*INAL FL 100ML . . . . . . . . . . . . . 107 AGGRASTAT*IV FL 50ML 0,25MG/ML . . . . 37 AKINETON FIALE*IM EV 5F 5MG1ML . . . . 114 AKINETON*60CPR 2MG . . . . . . . . . . . . . . . 114 ALCOVER*OS 12FL 10ML SOL 17,5% . . . . 123 ALCOVER*OS SOLUZ 140ML 17,5% . . . . . 123 ALDACTONE*16CPS 25MG . . . . . . . . . . . . 51 ALDARA*CREMA 5% 12BUST 250MG . . . . 57 ALDOMET*30CPR RIV 500MG . . . . . . . . . . 49 ALFAFERONE*1F 1000000UI 1ML . . . . . . . 98 ALFAFERONE*1F 3000000UI 1ML . . . . . . . 98 ALFAFERONE*1F 6000000UI 1ML . . . . . . . 98 ALIFLUS DISKUS 50/100*INAL 60D. . . . . . 128 ALIFLUS DISKUS 50/250*INAL 60D. . . . . . 128 ALIFLUS DISKUS 50/500*INAL 60D. . . . . . 128 170 Nome commerciale ALIFLUS*INAL 120D 25/125MCG . . . . . . ALIFLUS*INAL 120D 25/250MCG . . . . . . ALKERAN*1FL 50MG/10ML+FL 10ML . . . ALKERAN*25CPR RIV 2MG . . . . . . . . . . . ALLOPURINOLO MOLTENI*30CPR300M . ALLOPURINOLO MOLTENI*50CPR100M . ALMARYTM*20CPR 100MG . . . . . . . . . . . ALMARYTM*IV 5F 150MG/15ML . . . . . . . ALOPERIDOLO*50F 2MG 1ML . . . . . . . . . ALPHAGAN*COLL FL 5ML 0,2% . . . . . . . ALPROSTAR*EV/EA 1F POLV 20MCG . . . ALPROSTAR*EV/EA 1F POLV 60MCG . . . ALTIAZEM*24CPR 120MG R.P. . . . . . . . . ALTIAZEM*50CPR 60MG . . . . . . . . . . . . . ALTIAZEM*INIET 5FL 50MG+5F 5ML . . . . AMBISOME*INFUS 10FL LIOF 50MG . . . . AMIKACINA TEVA*IM EV 5F 500MG . . . . AMIODAR*20CPR 200MG . . . . . . . . . . . . AMIODARONE CL.BIO.LIM*5F 150MG . . . AMMONAPS*FL 250CPR 500MG . . . . . . . AMPLITAL*IM EV 1FL 1G+F 4ML . . . . . . . AMPLITAL*INIET 1F 500MG+F2,5ML. . . . ANAFRANIL*20CPR DIV 75MG R.P. . . . . . ANAFRANIL*20CPR RIV 25MG . . . . . . . . . ANAFRANIL*50CPR RIV 10MG . . . . . . . . . ANAFRANIL*IM IV 5F 2ML 25MG. . . . . . . ANBINEX*FL 1000UI+SIR 20ML+SET . . . . ANBINEX*FL 500UI+SIR 10ML+SET . . . . . ANDRIOL*60CPS 40MG . . . . . . . . . . . . . . ANDROCUR*25CPR 50MG . . . . . . . . . . . . ANDROCUR*30CPR 100MG . . . . . . . . . . . ANDROCUR*IM 1F 3ML 300MG RP . . . . . ANEXATE*IV 1F 0,5MG/5ML . . . . . . . . . . ANEXATE*IV 1F 1MG/10ML . . . . . . . . . . . ANTABUSE DISPERG.*24CPR 400MG . . . ANTALFEBAL*BB OS SOSP 100ML 2% . . ANTAXONE*10CPS 10MG . . . . . . . . . . . . ANTAXONE*OS 10FL 50MG . . . . . . . . . . . ANTIDRASI*IV 5F 75MG+5F 2,5ML . . . . . ANTISCABBIA CANDIOLI*POM 100G. . . . ANZATAX*INF FL 100MG/16,7ML6MG . . ANZATAX*INF FL 30MG/5ML 6MG/ML . . APOFIN*INFUS SC 5F 5ML 50MG/5M . . . APTIVUS*FL 120CPS MOLLI 250MG . . . . pag 128 128 89 89 105 105 46 46 117 133 48 48 53 54 54 78 75 47 47 34 70 70 121 121 120 121 35 35 61 62 62 62 138 138 123 103 123 123 134 127 92 92 116 81 Commissione provinciale del Farmaco Bologna Nome commerciale pag ARAVA*FL 30CPR RIV 20MG . . . . . . . . . . . 101 ARICEPT*28CPR RIV 10MG . . . . . . . . . . . . 122 ARICEPT*28CPR RIV 5MG . . . . . . . . . . . . . 122 ARIMIDEX*28CPR RIV 1MG. . . . . . . . . . . . 97 ARIXTRA*SC 10SIR 2,5MG 0,5ML . . . . . . . 37 AROMASIN*30CPR RIV 25MG . . . . . . . . . . 98 AROVIT*GTT 7,5ML 150000UI/ML. . . . . . . 32 ARTANE*FL 50CPR 2MG . . . . . . . . . . . . . . 114 ASACOL SUPPOSTE*20SUPP 500MG. . . . 29 ASACOL*24CPR GASTR 800MG . . . . . . . . 29 ASACOL*50CPR GASTR 400MG . . . . . . . . 29 ASACOL*7CLISMI PRONTI 2G 50ML. . . . . 29 ASACOL*7CLISMI PRONTI 4G 100ML. . . . 29 ASACOL*7CLISMI SCHIUMA BOMB 2G . . 29 ASACOL*7CLISMI SCHIUMA BOMB 4G . . 29 ASAVIXIN*50CPR RIV 500MG . . . . . . . . . . 29 ASCRIPTIN*20CPR DIV 300MG . . . . . . . . . 36 ATEM*AEROSOL DOSATO 200INAL13G . . 129 ATEM*SOLxNEBUL 10FL 2ML 0,025% . . . 129 ATENOLOLO TEVA*50CPR 100MG . . . . . . 52 ATG FRESENIUS 200 MG 10 ML F ESTERO100 ATITEN*OS GTT 15ML 0,1% . . . . . . . . . . . 32 ATOSSISCLEROL*IV 5F 2ML 0,5% . . . . . . 51 ATOSSISCLEROL*IV 5F 2ML 1%. . . . . . . . 51 ATOSSISCLEROL*IV 5F 2ML 2%. . . . . . . . 52 ATRACURIUM HAM*EV 5F 25MG 2,5M. . . 104 ATRACURIUM HAM*EV 5F 50MG 5ML . . . 104 ATROPINA 1% FARMIGEA*5MONODOSE . 135 ATROPINA SOLFATO*5F 0,5MG 1ML . . . . 25 ATROPINA SOLFATO*5F 1MG 1ML . . . . . . 25 AUGMENTIN*12CPR RIV 875MG+125M . . 71 AUGMENTIN*BB SOSP FL 70ML C/C . . . . 71 AURANTIN*IM IV 5F 5ML 50MG/ML . . . . . 112 AUREOMICINA*CREMA OFT 3,5G . . . . . . . 132 AVALOX*5CPR RIV 400MG PP/AL. . . . . . . 76 AVANDAMET*56CPR RIV 2MG/1000MG . . 31 AVANDIA*28CPR RIV 4MG . . . . . . . . . . . . 31 AVANDIA*28CPR RIV 8MG . . . . . . . . . . . . 32 AVASTIN*INFUS 1FL 100MG 4ML. . . . . . . 95 AVASTIN*INFUS 1FL 400MG 16ML. . . . . . 95 AVONEX*IM 4SIR 30MCG/0,5ML+4AG . . . 99 AZACTAM*IM EV FL 1G+F 3ML. . . . . . . . . 73 AZATIOPRINA WELL.*50CPR 50MG . . . . . 102 BACTRIM PERFUSIONE*IV 1F 5ML . . . . . . 74 Nome commerciale pag BACTRIM*FTE 16CPR . . . . . . . . . . . . . . . . 74 BACTRIM*SCIR 100ML 80MG+400MG . . . 74 BACTROBAN NASALE*POM 3G 2%. . . . . . 56 BAL*IM 10F 2ML 100MG . . . . . . . . . . . . . . 137 BASSADO*10CPR 100MG . . . . . . . . . . . . . 70 BECOTIDE*FL 250MCG 200D SOL PR . . . . 129 BECOTIDE*FL 50MCG 200D SOL PRE . . . . 129 BENADON*10CPR GASTRORES 300MG . . 33 BENADON*IM IV 6F 2ML 300MG. . . . . . . . 33 BENEFIX*IV 1FL 1000UI . . . . . . . . . . . . . . . 39 BENEFIX*IV 1FL 250UI . . . . . . . . . . . . . . . . 39 BENEFIX*IV 1FL 500UI . . . . . . . . . . . . . . . . 39 BENERVA*20CPR 300MG. . . . . . . . . . . . . . 33 BENTELAN*10CPR EFF 0,5MG. . . . . . . . . . 67 BENTELAN*IM IV 3F 2ML 4MG . . . . . . . . . 67 BENTELAN*INIET 6F 1,5MG/2ML. . . . . . . . 67 BERINERT P 1FL 500UI. . . . . . . . . . . . . . . . 38 BETABIOPTAL*COLL FL 5ML. . . . . . . . . . . 133 BETABIOPTAL*UNG OFT 5G. . . . . . . . . . . . 133 BETADINE GINEC.P*5FL+5F+5CANN. . . . . 60 BETAFERON*SC 15F 0,25MG+15SIR . . . . . 99 BETOPTIC*COLL 5ML 0,5%. . . . . . . . . . . . 134 BIOCINETEST PPD*LIOF 2D 10UI/D. . . . . . 140 BIOCINETEST PPD*LIOF 2D 5UI/D. . . . . . . 140 BLEOMICINA NIPPON K.*1FL 15MG . . . . . 93 BLOPRESS*28CPR 16MG . . . . . . . . . . . . . 54 BLOPRESS*28CPR 32MG . . . . . . . . . . . . . 54 BOOSTRIX*IM SOSP 1SIR C/AGO . . . . . . . 85 BOTOX*IM 1FL 100UI. . . . . . . . . . . . . . . . . 104 BRAMICIL*INIET 1F 100MG 2ML. . . . . . . . 75 BRAMICIL*INIET 1F 150MG 2ML. . . . . . . . 75 BRAUNOL*10% UNG 20TUBI 20G . . . . . . . 58 BROMOCRIPTINA DOROM*30CPR2,5MG . 61 BRONCOVALEAS*AER DOS 200INAL. . . . . 128 BRONCOVALEAS*NEBUL 15ML 500MG/. . 128 BRUFEN*30CPR RIV 600MG PVC/PVD . . . 103 BRUFEN*30CPR RIV400MG PVC/PVDC . . 103 BUPICAIN*10F 10ML 2,5MG/ML . . . . . . . . 108 BUPICAIN*10F 10ML 5MG/ML . . . . . . . . . 108 BUPICAIN*10F 5ML 2,5MG/ML . . . . . . . . . 108 BUPICAIN*10F 5ML 5MG/ML . . . . . . . . . . 108 BUPIFORAN*10F 10ML 5MG/ML C/AD . . . 109 BUPIFORAN*10F 5ML 5MG/ML C/ADR . . . 109 BUPIVACAINA REC.*10F 2ML 1% IP . . . . . 108 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 171 Nome commerciale pag BUPIVACAINA REC.*10F 4ML0,5% I . . . . . 108 BUSCOPAN*30CPR RIV 10MG. . . . . . . . . . 25 BUSCOPAN*IM IV 6F 1ML 20MG. . . . . . . . 25 CAELYX*INFUS 1FL 2MG/ML 10ML . . . . . 93 CAELYX*INFUS 1FL 2MG/ML 25ML . . . . . 93 CALCIJEX*IV 25F 1ML 1MCG/ML . . . . . . . 33 CALCIO LEVOF.FIDIA*1FL 100MG . . . . . . . 139 CALCIO LEVOF.FIDIA*1FL 175MG . . . . . . . 139 CALCIODIE*30CPR EFF 1000MG . . . . . . . . 34 CALCIPARINA*10SIR 12500UI0,5ML . . . . . 35 CALCIPARINA*10SIR 5000UI 0,2ML . . . . . 35 CALFOLEX*10CPR 15MG. . . . . . . . . . . . . . 139 CALFOLEX*IM EV FL 50MG . . . . . . . . . . . . 139 CAMPTO*1FL 100MG/5ML . . . . . . . . . . . . 95 CAMPTO*1FL 40MG 2ML . . . . . . . . . . . . . 96 CANCIDAS*EV FL 50MG 10ML . . . . . . . . . 78 CANCIDAS*EV FL 70MG 10ML . . . . . . . . . 78 CARBAMAZEP.RATIO*30CPR 400MG . . . . 113 CARBAMAZEP.RATIO.*50CPR 200MG . . . . 113 CARBOLITHIUM*50CPS 150MG . . . . . . . . 118 CARBOLITHIUM*50CPS 300MG . . . . . . . . 118 CARBOMIX*OS GRAT SOSP FL 50G . . . . . 28 CARDICOR*28CPR RIV 1,25MG . . . . . . . . . 52 CARDICOR*28CPR RIV 2,5MG . . . . . . . . . . 52 CARDICOR*28CPR RIV 3,75MG . . . . . . . . . 52 CARDIOASPIRIN*30CPR GAST 100MG . . . 36 CARDIOXANE*EV FL 500MG . . . . . . . . . . . 139 CARDIRENE*OS POLV 30BUST 75MG . . . . 36 CARDURA*20CPR DIV 4MG . . . . . . . . . . . . 49 CARDURA*30CPR DIV 2MG . . . . . . . . . . . . 49 CARMUBRIS 100MG FL . . . . . . . . . . . . . . . 90 CARNITENE*INIET 5F 5ML 2G/5ML . . . . . . 34 CARVASIN*50CPR 5MG SUBLINGUALI . . . 48 CARVEDILOLO TEVA*28CPR 6,25MG . . . . 52 CARVEDILOLO TEVA*30CPR 25MG . . . . . . 52 CARYOLISINE MG.10 X 6 FIALE . . . . . . . . . 89 CASODEX*28CPR RIV 150MG . . . . . . . . . . 97 CASODEX*28CPR RIV 50MG . . . . . . . . . . . 97 CATAPRESAN TTS1*2CER 2,5M . . . . . . . . 49 CATAPRESAN TTS2*2CER 5MG. . . . . . . . . 49 CATAPRESAN*30CPR 150MCG . . . . . . . . . 49 CATAPRESAN*5F 1ML 150MCG/ML . . . . . 49 CAVERJECT*F 10MCG+SIR+2AGHI+2T . . . 63 CAVERJECT*F 20MCG+SIR+2AGHI+2T . . . 63 172 Nome commerciale CEFAMEZIN*IM 1FL 1G+F 4ML . . . . . . . . CEFAMEZIN*IV 1FL 1G+F 10ML. . . . . . . . CEFIXORAL*5CPR RIV 400MG . . . . . . . . . CEFIXORAL*OS 100ML 100MG/5ML+S . . CELLCEPT*100CPS 250MG . . . . . . . . . . . CELLCEPT*50CPR 500MG . . . . . . . . . . . . CEPOREX*8CPR RIV 1G . . . . . . . . . . . . . . CEPROTIN*IV 1000UI . . . . . . . . . . . . . . . . CEREZYME*IV 1F 200UI . . . . . . . . . . . . . . CERNEVIT*INIET 10FL POLV . . . . . . . . . . CERTICAN*60CPR 0,25MG . . . . . . . . . . . CERTICAN*60CPR 0,75MG . . . . . . . . . . . CERVIDIL*1 OV VAG 1MG . . . . . . . . . . . . CHININA SOLFATO*20CPR 250MG . . . . . CHIROCAINE*10F 10ML 5MG/ML PPS . . CHIROCAINE*10F10ML2,5MG/ML PPS . . CHIROCAINE*10F10ML7,5MG/ML PPS . . CIALIS*4CPR RIV 10MG . . . . . . . . . . . . . . CIALIS*4CPR RIV 20MG . . . . . . . . . . . . . . CICLOLUX*COLL 1% FL 3ML . . . . . . . . . CIPROXIN 750*12CPR RIV 750MG. . . . . . CIPROXIN*10CPR RIV 250MG . . . . . . . . . CIPROXIN*5% OS SOSP FL 100ML . . . . . CIPROXIN*6CPR RIV 500MG . . . . . . . . . . CIPROXIN*INFUS FL 200MG 100ML . . . . CIPROXIN*INFUS FL 400MG 200ML . . . . CISPLATINO TEVA*EV 10MG 20ML . . . . . CISPLATINO TEVA*EV 50MG 100ML . . . . CISTOBIL*6CPR 500MG . . . . . . . . . . . . . . CITARABINA MAY*INIET 10ML1G/10. . . . CITARABINA MAY*INIET 20ML2G/20. . . . CITARABINA MAY*INIET 5F 100MG/ . . . . CITARABINA MAY*INIET 5F 500MG/ . . . . CITREDICI UBT KIT*FL75MG+1BUST. . . . CLENIL*AEROSOL 20FL MONOD 2ML . . . CLENILEXX*SOL PRESS.100MCG+AUT . . CLEXANE T*2FSIR 6000UI 0,6ML . . . . . . CLEXANE T*2FSIR 8000UI 0,8ML . . . . . . CLEXANE*6SIR 2000UI/0,2ML . . . . . . . . . CLEXANE*6SIR 4000UI/0,4ML . . . . . . . . . CLINIMIX N12G20E*SACCA 1LT/1LT. . . . CLINIMIX N14G30E*SACCA 1LT/1LT. . . . CLINIMIX N17G35E*SACCA 1LT/1LT. . . . CLINIMIX N9G15E*SACCA 1LT/1LT. . . . . pag 72 71 73 73 100 100 71 37 34 32 101 101 60 125 109 109 109 63 63 135 76 76 76 76 76 76 94 94 143 91 91 91 91 141 129 129 35 35 35 35 42 42 42 42 Commissione provinciale del Farmaco Bologna Nome commerciale pag CLOBESOL*UNG DERM 30G 0,5MG/G . . . 58 CLOPIXOL ACUPHASE*IM F 50MG1ML . . 117 CLOPIXOL DEPOT*IM 1F 200MG/ML . . . . 117 CLOPIXOL*10CPR 40MG. . . . . . . . . . . . . . 117 CLOPIXOL*20CPR 25MG. . . . . . . . . . . . . . 117 CLOPIXOL*30CPR 10MG. . . . . . . . . . . . . . 117 CLOPIXOL*OS GTT FL 10ML 20MG/M . . . 117 CLORAMFENICOLO*1FL 1G . . . . . . . . . . . 70 CLOROCHINA*30CPR RIV 250MG. . . . . . . 125 COLCHICINA LIRCA*60CPR 1MG . . . . . . . 105 COLIMICINA*IM FL 1000000U4ML+F . . . . 77 COLIMICINA*OS GTT 4000000U 4ML . . . . 28 COMBIVIR*BLISTER 60CPR RIV . . . . . . . . 83 COMTAN*100CPR RIV 200MG . . . . . . . . . 116 CONTRAMAL SR 100*20CPR R.P. . . . . . . . 111 CONTRAMAL*5F 100MG 2ML . . . . . . . . . . 111 CONTRAMAL*OS GTT FL 10ML100MG/ . . 111 CONTRATHION*IM IV FL200MG+10ML. . . 137 COPAXONE*SC 28SIR 20MG/ML . . . . . . . 99 COPEGUS*42CPR RIV 200MG. . . . . . . . . . 80 CORTONE ACETATO*20CPR 25MG . . . . . . 68 COSMEGEN*INIET 1FL 0,5MG. . . . . . . . . . 92 COSOPT*COLL 2%+0,5% 1FL 5ML OC . . 134 COUMADIN*30CPR 5MG. . . . . . . . . . . . . . 35 CREON 10000UI*100CPS 150MG RM . . . . 29 CREON 25000UI*100CPS 300MG RM . . . . 29 CRIXIVAN*180CPS 400MG . . . . . . . . . . . . 81 CUROSURF*1FL 3ML 80MG/ML . . . . . . . . 131 CUROSURF*2FL 1,5ML 80MG/ML . . . . . . 131 CUROXIM VENA 1*IV 1F 1G+F 10ML . . . . 72 CUROXIM VENA 2*IV FL 2G. . . . . . . . . . . . 72 CUSIMOLOL*COLL 5ML 0,25% . . . . . . . . 134 CUSIMOLOL*COLL 5ML 0,5% . . . . . . . . . 134 CYANOKIT G 2,5 ML 250 X 2F . . . . . . . . . . 138 CYCLOSERINE 250 MG CPS . . . . . . . . . . . 78 CYMEVENE*INFUS FL 500MG+F 10ML. . . 80 CYTOTEC*50CPR 200MCG . . . . . . . . . . . . 24 CYTOTECT BIOTEST*EV 10ML 500U. . . . . 84 CYTOTECT BIOTEST*EV 20ML 1000U. . . . 84 CYTOTECT BIOTEST*EV 50ML 2500U. . . . 85 DAKTARIN*GEL ORALE 80G 2% . . . . . . . . 24 DALACIN C FOSF.*1F 4ML 600MG/4 . . . . 75 DALACIN C*12CPS 150MG . . . . . . . . . . . . 75 DANATROL*30CPS 200MG . . . . . . . . . . . . 63 Nome commerciale pag DANTRIUM*50CPS 25MG . . . . . . . . . . . . . 105 DANTRIUM*50CPS 50MG . . . . . . . . . . . . . 105 DANTRIUM*IV FL 20MG LIOF . . . . . . . . . . 105 DAPAPRIM 25 MG CP . . . . . . . . . . . . . . . . 126 DAPAROX*28CPR RIV 20MG PVC/PE/. . . . 121 DAPSONE 25 MG CPR . . . . . . . . . . . . . . . . 79 DAPSONE 50 MG CPR . . . . . . . . . . . . . . . . 79 DAUNOBLASTINA*EV 1FL 20MG+FL . . . . . 93 DECADRON*10CPR 0,5MG . . . . . . . . . . . . 67 DECADRON*10CPR 0,75MG . . . . . . . . . . . 67 DECADRON*INIET 1F 1ML 4MG/1ML . . . . 67 DECADRON*INIET 1F 2ML 8MG/2ML . . . . 67 DECAPEPTYL*1FL 3,75MG+2ML+1SIR . . . 97 DECAPEPTYL*FL 11,25MG+2ML+1SIR . . . 97 DEFLAMON FLEBO*IV FL 500MG 100 . . . . 77 DELORAZEPAM TEVA*OS GTT 20ML. . . . . 119 DELTACORTENE*10CPR 25MG . . . . . . . . . 68 DELTACORTENE*10CPR 5MG . . . . . . . . . . 68 DEPAKIN*40CPR GASTROR 200MG . . . . . 113 DEPAKIN*40CPR GASTROR 500MG . . . . . 113 DEPAKIN*4F 400MG+4F 4ML . . . . . . . . . . 113 DEPAKIN*CHRONO 30CPR 300MG R.P . . . 113 DEPAKIN*CHRONO 30CPR 500MG R.P . . . 113 DEPAKIN*OS FL 40ML 200MG/ML . . . . . . 113 DEPOMEDROL*1FL 40MG 1ML+1SIR . . . . 67 DEPOPROVERA*IM 150MG/ML 3,4ML . . . 96 DESFERAL*10FL 500MG/5ML+10F5ML . . 138 DESFERAL*1FL 2G/20ML+1F SOLV. . . . . . 138 DETICENE*INFUS 100MG/10ML FL+F. . . . 90 DIAMICRON*40CPR 80MG . . . . . . . . . . . . 31 DIAMINOCILLINA*FL 1200000UI+F . . . . . . 71 DIAMOX*12CPR 250MG . . . . . . . . . . . . . . 134 DIAZEMULS*IM IV 10F 10MG 2ML . . . . . . 119 DIAZEPAM*3F 2ML 10MG/2ML. . . . . . . . . 119 DICLOFENAC RAT.*30CPR GAST50MG. . . 103 DICLOREUM*INIET 6F 75MG/3ML. . . . . . . 103 DICLOREUM*RETARD 20CPR 100MG . . . . 103 DIFLUCAN*10CPS 100MG. . . . . . . . . . . . . 78 DIFLUCAN*2CPS 150MG. . . . . . . . . . . . . . 78 DIFLUCAN*7CPS 50MG. . . . . . . . . . . . . . . 78 DIFLUCAN*INFUS FL 100MG/50ML . . . . . 78 DIFLUCAN*INFUS FL 200MG/100ML . . . . 78 DIFLUCAN*INFUS FL 400MG/200ML . . . . 78 DIFLUCAN*OS SOSP 350MG 50MG/5M . . 78 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 173 Nome commerciale pag DIFOSFONAL*6F 300MG 10ML . . . . . . . . . 106 DIGIFAB FF 40 MG . . . . . . . . . . . . . . . . . . . 138 DINTOINA*30CPR 100MG . . . . . . . . . . . . . 112 DIPEPTIVEN*IV FL 100ML . . . . . . . . . . . . . 45 DIPRIVAN*INFUS 1SIR 50ML 20MG/ . . . . . 108 DIPRIVAN*INFUS 50ML 20MG/ML . . . . . . 108 DISIPAL*50CPR RIV 50MG. . . . . . . . . . . . . 115 DISSENTEN*15CPR 2MG . . . . . . . . . . . . . . 29 DITANRIX*AD IM 1SIR 0,5ML 1D . . . . . . . . 86 DITROPAN*30CPR 5MG . . . . . . . . . . . . . . . 63 DIUREMID*INIETT 5F 10MG/2ML . . . . . . . 50 DOBETIN*1000 5F 1ML 1000MCG. . . . . . . 40 DOBETIN*5000 5F 2ML 5000MCG. . . . . . . 40 DOSTINEX*FL 8CPR 0,5MG . . . . . . . . . . . . 61 DRONAL*14CPR 10MG . . . . . . . . . . . . . . . 106 DRONAL*4CPR 70MG . . . . . . . . . . . . . . . . 106 DROPTIMOL*COLL 25FL 0,5% . . . . . . . . . 134 DUFASTON*10CPR RIV 10MG . . . . . . . . . . 62 DUKORAL*OS 2FL 3ML . . . . . . . . . . . . . . . 85 DUOGAS*GRAT 10BUST 3,5G . . . . . . . . . . 140 DUROGESIC*3CER 100MCG/ORA40CM2 . 110 DUROGESIC*3CER 25MCG/ORA 10CM2 . . 110 DUROGESIC*3CER 50MCG/ORA 20CM2 . . 110 DURONITRIN*30CPR DIV 60MG R.P. . . . . . 48 DYSPORT*SC IM 2FL 500U . . . . . . . . . . . . 105 EBRANTIL*IV 5F 50MG 10ML. . . . . . . . . . . 49 ECOCAIN*FLNEBUL 60ML 10G/100ML . . . 108 ECOVAL*CREMA 30G 0,1% . . . . . . . . . . . . 58 ECOVAL*EMULS CUT 30G 0,1% . . . . . . . . 58 ECOVAL*UNG 30G 0,1% . . . . . . . . . . . . . . 58 EFEXOR*10CPS 150MG R.P. . . . . . . . . . . . 122 EFEXOR*14CPR 75MG . . . . . . . . . . . . . . . . 122 EFEXOR*14CPS 75MG R.P. . . . . . . . . . . . . 122 EFEXOR*28CPR 37,5MG . . . . . . . . . . . . . . 122 EFFORTIL*IM IV 6F 1ML 10MG . . . . . . . . . 47 EFFORTIL*OS GTT 15G 0,75% . . . . . . . . . . 47 ELDISINE*EV 1FL POLV 5MG. . . . . . . . . . . 92 ELOXATIN*INFUS 1FL 10ML 5MG/ML. . . . 94 ELOXATIN*INFUS 1FL 20ML 5MG/ML. . . . 94 EMAGEL*EV FL 500ML 35G/L . . . . . . . . . . 41 EMLA*CREMA 5TUB 5G+10CER OCCLU . . 109 EMOSINT*IM EV SC 10F 20MCG 1ML. . . . 66 EMTRIVA*1FL 30CPS 200MG . . . . . . . . . . 82 EN*20CPR 1MG . . . . . . . . . . . . . . . . . . . . . 119 174 Nome commerciale EN*20CPR 2MG . . . . . . . . . . . . . . . . . . . . EN*IM IV 3F 1ML 2MG . . . . . . . . . . . . . . . EN*IM IV 3F 1ML 5MG . . . . . . . . . . . . . . . ENANTONE*IM SC FL+SIR 11,25MG/ . . . ENANTONE*IM SC FL+SIR 3,75MG/2 . . . ENBREL*SC 4FL 25MG+4SIR 1ML . . . . . . ENBREL*SC 4FL 50MG+4SIR+4AGHI+ . . . ENDOPROST*INFUS 1F 0,050MG/ . . . . . . ENDOREM*1F 8ML+SIR . . . . . . . . . . . . . . ENDOXAN BAXTER*50CPR RIV 50MG . . . ENDOXAN BAXTER*EV 1FL 1G . . . . . . . . . ENDOXAN BAXTER*EV 1FL 500MG . . . . . ENTUMIN*30CPR 40MG. . . . . . . . . . . . . . ENTUMIN*IM EV 10F 40MG 4ML . . . . . . . ENTUMIN*OS GTT 10ML 100MG/ML. . . . EPAXAL*IM 1SIR 0,5ML C/AGO . . . . . . . . EPIVIR*FL 30CPR RIV 300MG . . . . . . . . . EPIVIR*FL 60CPR RIV 150MG . . . . . . . . . EPIVIR*OS FL 240ML 10MG/ML . . . . . . . EPREX*1SIR 10000UI 1ML . . . . . . . . . . . . EPREX*1SIR 1000UI 0,5ML . . . . . . . . . . . EPREX*1SIR 2000UI 0,5ML . . . . . . . . . . . EPREX*1SIR 3000UI 0,3ML . . . . . . . . . . . EPREX*1SIR 4000UI 0,4ML . . . . . . . . . . . EPREX*1SIR 5000UI/0,5ML . . . . . . . . . . . EPREX*1SIR 6000UI/0,6ML . . . . . . . . . . . EPREX*1SIR 8000UI/0,8ML . . . . . . . . . . . EPSOCLAR*INF 10FL 25000UI/5ML. . . . . EPSODILAVE*10F 250UI/5ML 5ML . . . . . ERITROCINA*12CPR RIV 600MG . . . . . . . ERITROCINA*OS GRAT 6BUST 1000M . . . ERITROCINA*OS SOSP 100ML 10% . . . . ERITROMICINA LATTOBION*1000MG . . . ERITROMICINA LATTOBION*500MG . . . . ESAFOSFINA*IV 4F 500MG+4F 10ML . . . ESIDREX*20CPR 25MG . . . . . . . . . . . . . . ESMERON*EV 10F 100MG/10ML C/TA . . ESOPRAL*INIET/INFUS FL40MG . . . . . . . ESTRACYT*40CPS 140MG . . . . . . . . . . . . ETACORTILEN*0,15% COLL20D 0,3M . . . ETANICOZID B6*50CPR VERNIC . . . . . . . ETAPIAM*50CPR RIV 400MG . . . . . . . . . . ETAPIAM*50CPR RIV 500MG . . . . . . . . . . ETAPIAM*FLEB 10F 500MG 3ML . . . . . . . pag 119 119 119 96 96 101 101 36 145 89 89 89 119 119 119 87 82 82 82 41 40 40 40 40 40 40 40 35 35 74 74 74 74 74 48 50 104 25 95 133 79 79 79 79 Commissione provinciale del Farmaco Bologna Nome commerciale pag EUCHESSINA C.M.*OS GTT 20ML. . . . . . . 27 EUIPNOS*20CPS 20MG. . . . . . . . . . . . . . . 120 EUROP. VIPER VENUM ANTISERUM 100LD 50 di vip ammodytes + 100L D50 vip aspis + 50LD50 vip berus + 50LD50 vip ursinii 83 EUTIROX*BLIST 50CPR 100MCG . . . . . . . 68 EUTIROX*BLISTER 50CPR 25MCG . . . . . . 68 EUTIROX*BLISTER 50CPR 50MCG . . . . . . 68 EVION*20CONF 100MG . . . . . . . . . . . . . . . 33 EXELON*56CPS 1,5MG . . . . . . . . . . . . . . . 122 EXELON*56CPS 3MG. . . . . . . . . . . . . . . . . 122 EXELON*56CPS 4,5MG . . . . . . . . . . . . . . . 122 EXELON*56CPS 6MG. . . . . . . . . . . . . . . . . 122 EXOCIN*POM OFT 3,5G 0,3% . . . . . . . . . . 132 FABRAZYME*IV 1FL 35MG . . . . . . . . . . . . 34 FANHDI*INF FL 250UI+SIR SOLV+S . . . . . 38 FANHDI*INF FL 500UI+SIR SOLV+S . . . . . 38 FANHDI*INF FL1000UI+SIR SOLV+S . . . . . 38 FARGANESSE*20CONF 25MG . . . . . . . . . . 131 FARGANESSE*IM 5F 2ML . . . . . . . . . . . . . 131 FARMORUBICINA*IV FL 10MG+F 5ML . . . 93 FARMORUBICINA*IV FL 10MG/5ML . . . . . 93 FARMORUBICINA*IV FL 50MG/25ML . . . . 93 FARMORUBICINA*IV FL LIOF 50MG . . . . . 93 FARMOTAL*INFUS EV FL POLV500MG. . . 107 FASLODEX*IM 1SIR 5ML+1AGO . . . . . . . . 97 FASTJEKT*ADULTI 1SIR 0,33MG. . . . . . . . 47 FASTJEKT*BAMBINI 1SIR 0,165MG . . . . . 47 FASTURTEC*EV 1F 7,5MG+1F 5ML. . . . . . 139 FDP FISIOPHARMA*EV 1F 10G+100M . . . 48 FDP FISIOPHARMA*EV 1F 5G+50ML . . . . 49 FEIBA TIM3*IV FL 1000UI+F 20ML . . . . . . 39 FELISON*30CPS 15MG . . . . . . . . . . . . . . . 120 FELISON*30CPS 30MG . . . . . . . . . . . . . . . 120 FEMARA*30CPR RIV 2,5MG . . . . . . . . . . . 97 FENAMIDE*20CPR 50MG . . . . . . . . . . . . . 134 FENOBARBITALE SODICO*5F 100MG . . . . 112 FENTANEST*IM IV 5F 0,1MG 2ML. . . . . . . 107 FERLIXIT*OS IV 5F 5ML 62,5MG . . . . . . . . 40 FERRIPROX*100CPR RIV 500MG. . . . . . . . 138 FERROGRAD*40CPR RIV 525MG R.C. . . . . 40 FIDATO*EV 1F 1G/10ML+F 10ML . . . . . . . 73 FIDATO*IM 1FL 1G/3,5ML+F 3,5ML . . . . . 73 FIDATO*IM 1FL 500MG/2ML+F 2ML. . . . . 73 Nome commerciale pag FIDATO*INF 1FL 2G POLV . . . . . . . . . . . . . 73 FITOSTIMOLINE*10GARZE 15%+1%. . . . . 56 FLEBOCORTID*EV 1FL 1G+F 10ML . . . . . . 68 FLEBOCORTID*EV 1FL 500MG+F 5ML . . . 68 FLECTADOL*IM EV 6F 500MG+6F2,5 . . . . 111 FLECTADOL*IM EV 6FL 1G+6F 5ML . . . . . 111 FLEXEN*10SUPP 100MG . . . . . . . . . . . . . . 103 FLOLAN*EV FL 0,5MG+FL 50ML SOL . . . . 36 FLOLAN*EV FL 1,5MG+1FL 50ML . . . . . . . 36 FLORINEF 0,1MG 56CPR . . . . . . . . . . . . . . 67 FLUAD*1SIR 0,5ML 2006-2007 . . . . . . . . . 87 FLUBASON*EMULS 15BUST 1D 2G. . . . . . 58 FLUDARA*20CPR RIV 10MG . . . . . . . . . . . 91 FLUDARA*EV 5FL 50MG . . . . . . . . . . . . . . 91 FLUORALFA*COLL FL 10ML 2% . . . . . . . . 136 FLUORESCEINA SODICA MON*IV 10F. . . . 140 FLUOROURACILE ICN*1FL 5G/100ML. . . . 91 FLUOROURACILE ICN*5FL10ML500MG . . 91 FLUOROURACILE ICN*5FL20ML1G/20 . . . 91 FLUOROURACILE ICN*IV 10FL250MG. . . . 91 FLUOXEREN*OS SOL 60ML 20MG/5ML . . 121 FLUOXETINA FIDIA*28CPR SOL20MG. . . . 121 FLUSPIRAL 100*DISKUS 60D 100MC . . . . 129 FLUSPIRAL 125*SOSPxINAL 120D . . . . . . 129 FLUSPIRAL 250*DISKUS 60D 250MC . . . . 129 FLUSPIRAL 250*SOSPxINAL 120D . . . . . . 129 FLUSPIRAL 500*DISKUS 60D 500MC . . . . 129 FLUSPIRAL*NEBULES 10D 500MCG/2 . . . 129 FLUTAMIDE PHT*30CPR 250MG. . . . . . . . 97 FOLINA*20CPS 5MG . . . . . . . . . . . . . . . . . 40 FOLINA*IM 5F 2ML 15MG . . . . . . . . . . . . . 40 FORADIL*POLV 60CPS 12MCG+INAL . . . . 128 FORADIL*SOLxINAL 12MCG 100D . . . . . . 128 FORMISTIN*20CPR RIV 10MG. . . . . . . . . . 131 FORMISTIN*OS GTT 20ML 10MG/ML . . . . 131 FORSTEO*SC 1PEN 3ML20MCG/80MCL . 69 FORTOVASE*1FL 180CPS 200MG . . . . . . . 80 FOSCAVIR*EV SOLxINF FL 250ML . . . . . . 80 FOSFATO SODICO AC*CLISMA 20FL . . . . 28 FOSTIMON*1FL 75UI+1F 1ML . . . . . . . . . . 62 FRAXIPARINA*6SIR 2850UIaXa/0,3 . . . . . . 35 FRAXIPARINA*6SIR 3800UIaXa/0,4 . . . . . . 35 FREAMINE III 8,5%*IV FL 500ML. . . . . . . . 42 FRIMAIND*14CPR RIV 40MG. . . . . . . . . . . 121 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 175 Nome commerciale pag FRIMAIND*28CPR RIV 20MG . . . . . . . . . . . 121 FRISIUM*30CPS 10MG . . . . . . . . . . . . . . . 120 FUCIDIN*CREMA 15G 2% . . . . . . . . . . . . . 57 FULCIN 500*10CPR 500MG. . . . . . . . . . . . 56 FUNGILIN*OS SOSP 60ML 500MG/5M . . . 28 FUNGIZONE*IV FL POLV 50MG 15ML . . . . 77 FUROSEMIDE*10F 20MG 2ML. . . . . . . . . . 50 FUZEON*SC 60FL POLV+60FLSOL+60 . . . 83 GABAPENTIN FIDIA*30CPS 400MG . . . . . . 114 GABAPENTIN FIDIA*50CPS 100MG . . . . . . 114 GABAPENTIN FIDIA*50CPS 300MG . . . . . . 114 GABITRIL*50CPR RIV 10MG. . . . . . . . . . . . 113 GADOVIST*FL 15ML 1,0MMOL/ML . . . . . . 145 GARDENALE*20CPR 100MG . . . . . . . . . . . 112 GARDENALE*30CPR 50MG . . . . . . . . . . . . 112 GASTROGRAFIN*OS RETT FL 100ML. . . . . 141 GASTROMIRO*FL 100ML 61,24G. . . . . . . . 142 GASTROMIRO*FL 20ML 12,25G. . . . . . . . . 142 GASTROMIRO*FL 50ML 30,62G. . . . . . . . . 142 GEMFIBROZIL TEVA*20CPR RIV900M . . . . 55 GEMZAR*INF ENDOVESC 1FL 1G POL. . . . 91 GEMZAR*INF ENDOVESC 1FL200MG P. . . 91 GENOTROPIN MINI*4TBF 1,2MG(3,6 . . . . . 65 GENOTROPIN MINI*4TBF 1,4MG(4,2 . . . . . 65 GENOTROPIN MINI*4TBF 1,6MG(4,8 . . . . . 65 GENOTROPIN MINI*4TBF 1,8MG(5,4 . . . . . 65 GENOTROPIN MINI*4TBF 2MG(6UI) . . . . . 65 GENOTROPIN MINI*7TBF 0,2MG(0,6 . . . . . 65 GENOTROPIN MINI*7TBF 0,4MG(1,2 . . . . . 65 GENOTROPIN MINI*7TBF 0,6MG(1,8 . . . . . 65 GENOTROPIN MINI*7TBF 0,8MG(2,4 . . . . . 65 GENOTROPIN MINI*7TBF 1MG(3UI)+ . . . . 65 GENTALYN*BB 10 IM 5F 10MG 1ML . . . . . 75 GENTALYN*BB 20 IM 1F 20MG 2ML . . . . . 75 GENTAMICINA SOLFATO*10F 80MG/2 . . . 75 GEREF*EV 1F 50MCG+F 1ML. . . . . . . . . . . 139 GHRH FERRING*1F 50MCG+F 1ML . . . . . . 139 GLAZIDIM 1*IM 1FL 1G/3ML+F 3ML . . . . . 72 GLAZIDIM VENA 2*EV 1FL 2G . . . . . . . . . . 72 GLAZIDIM*IM 1FL 500MG/1,5ML+1F . . . . 73 GLIBOMET 5*60CPR RIV 400MG+5MG . . . 31 GLIBORAL*30CPR 5MG . . . . . . . . . . . . . . . 31 GLICEROLO*AD 18SUPP 2500MG . . . . . . . 28 GLICEROLO*BB 18SUPP 1500MG . . . . . . . 28 176 Nome commerciale GLIPRESSINA*5FL+5F 5ML 1MG/1ML . . GLIVEC*120CPS 100MG . . . . . . . . . . . . . GLUCAGEN*FL 1MG+FL 1ML SOLV . . . . GLUCOMIDE*40CPS 500MG+2,5MG. . . . GLUCOSIO*OS 50% 1FL 150ML . . . . . . . GLURENOR*40CPR 30MG . . . . . . . . . . . . GONAL F*(600UI) 1050UI/1,75ML . . . . . . GONAL F*SC 1PEN 300UI/0,5ML+5A. . . . GONAL F*SC 1PEN 450UI/0,75ML+7 . . . . GONAL F*SC 1PEN 900UI/1,5ML+14 . . . . GONAL F*SC FL 75UI+SIR 1ML . . . . . . . . GRANULOKINE*1SIR 30MU 0,5ML . . . . . HAEMATE P*FL 1000UI+FL30ML+SET. . . HAEMATE P*FL 500UI+FL 20ML+SET . . . HALDOL DECANOAS*IM 3F 50MG 1ML . HALDOL DECANOAS*IM F 150MG 3ML . HALDOL*30CPR 1MG. . . . . . . . . . . . . . . . HALDOL*30CPR 5MG. . . . . . . . . . . . . . . . HALDOL*INIET 5F 1ML 5MG/ML . . . . . . . HALDOL*OS GTT 30ML 10MG/ML. . . . . . HALDOL*OS GTT 30ML 2MG/ML. . . . . . . HAVRIX 720 PEDIAT.*1SIR 0,5ML . . . . . . HBVAXPRO*IM 1FL 10MCG/ML. . . . . . . . HBVAXPRO*IM 1FL 40MCG/ML. . . . . . . . HBVAXPRO*IM 1FL 5MCG/0,5ML . . . . . . HEPSERA*1FL 30CPR 10MG . . . . . . . . . . HERCEPTIN*EV 1FL 150MG . . . . . . . . . . . HEXABRIX 320*INIET 1FL 100ML. . . . . . . HEXABRIX 320*INIET 1FL 50ML. . . . . . . . HEXABRIX*FL 200ML 320MG/ML . . . . . . HIDONAC*EV 1FL 5G 25ML . . . . . . . . . . . HIVID*100CPR RIV 0,750MG . . . . . . . . . . HOLOXAN*EV 1FL 1G . . . . . . . . . . . . . . . . HUMALOG*SC 1FL 10ML 100U/ML. . . . . HUMALOG*SC 5CART 3ML 100U/ML . . . HUMATIN*16CPS 250MG . . . . . . . . . . . . HUMATIN*SCIR 60ML 2,5% . . . . . . . . . . HUMATROPE*1CART 12MG(36UI)+SIR . . HUMATROPE*1CART 6MG (18UI)+SIR . . HUMIRA*SC 2SIR+F 40MG 0,8ML+2T . . . HYCAMTIN*INFUS IV 5F 5ML 4MG . . . . . HYPERHAES*1SACCA 250ML . . . . . . . . . IBIFEN*30CPS 50MG . . . . . . . . . . . . . . . . IBIFEN*IV 6F 100MG 5ML . . . . . . . . . . . . pag 66 95 69 31 139 31 62 62 62 62 62 98 38 38 117 117 117 117 117 117 117 87 87 87 87 82 94 142 142 142 138 82 89 30 30 28 28 65 65 101 95 41 104 103 Commissione provinciale del Farmaco Bologna Nome commerciale pag IDROCHINIDINA LIRCA*40CPR150MG . . . 46 IDROCHINIDINA RIT.*20CPS 250MG. . . . . 46 IDROPLURIVIT*IM OS LIOF 5F+5F. . . . . . . 32 IDROPLURIVIT*OS GTT FL 10ML. . . . . . . . 32 IGANTET*IM 1SIR 1ML 250UI . . . . . . . . . . 84 IGANTET*IM 1SIR 2ML 500UI . . . . . . . . . . 84 IGROTON 25*30CPR 25MG . . . . . . . . . . . . 50 IGVENA*FL 100ML 5G+SET . . . . . . . . . . . . 84 IGVENA*FL 50ML 2,5G+SET . . . . . . . . . . . 84 IMIGRAN*4CPR RIV 100MG. . . . . . . . . . . . 112 IMIGRAN*4CPR RIV 50MG. . . . . . . . . . . . . 112 IMIGRAN*SC 2SIR 6MG 0,5ML+AUTO . . . 112 IMMUCYST*1FL POLV x SOSP 81MG. . . . 99 IMMUNOHBS*IM 1F 1ML 180UI . . . . . . . . 84 IMMUNOHBS*IM 1F 3ML 540UI . . . . . . . . 84 IMOVAX POLIO*IM SC 1SIR 0,5ML . . . . . . 87 IMOVAX TETANO*1SIR 0,5ML 40UI. . . . . . 86 IMUKIN*6F 0,5ML 100MCG. . . . . . . . . . . . 98 INDERAL*28CPS 80MG R.P. . . . . . . . . . . . 52 INDERAL*30CPR 40MG . . . . . . . . . . . . . . . 52 INFANRIX DTPA*IM 1SIR 0,5ML . . . . . . . . 85 INFANRIX HEXA*IM 1FL+1SIR+2AGH . . . . 88 INFANRIX PENTA*IM 1SIR 0,5ML+2 . . . . . 88 INFLEXAL V*1SIR C/A 2006-2007 . . . . . . . 86 INTEGRILIN*IV 100ML 0,75MG/ML . . . . . . 36 INTEGRILIN*IV FL 10ML 2MG/ML . . . . . . . 36 INTRAFER*OS GTT 30ML 50MG/ML . . . . . 40 INTRALIPID 10%*EV 500ML SACCA . . . . . 42 INTRALIPID 20%*EV 500ML SACCA . . . . . 42 INTRASTIGMINA*IM 6F 1ML 0,5MG . . . . . 123 INTRONA*SC IV 1FL 10MUI. . . . . . . . . . . . 98 INTRONA*SC IV 1FL 18MUI 3ML. . . . . . . . 98 INTRONA*SC IV 1FL 25MUI 2,5ML . . . . . . 98 INTRONA*SC IV 1PEN 18MUI+12KIT. . . . . 98 INTRONA*SC IV 1PEN 30MUI+12KIT. . . . . 98 INVIRASE*FL 120CPR RIV 500MG. . . . . . . 80 IOMERON 300*IV FL 100ML . . . . . . . . . . . 142 IOMERON 300*IV FL 150ML . . . . . . . . . . . 143 IOMERON 300*IV FL 200ML . . . . . . . . . . . 143 IOMERON 300*IV FL 500ML . . . . . . . . . . . 143 IOMERON 300*IV FL 50ML . . . . . . . . . . . . 142 IOMERON 300*IV FL 75ML . . . . . . . . . . . . 142 IOMERON 350*IV FL 100ML . . . . . . . . . . . 143 IOMERON 350*IV FL 150ML . . . . . . . . . . . 143 Nome commerciale pag IOMERON 350*IV FL 200ML . . . . . . . . . . . 143 IOMERON 350*IV FL 250ML . . . . . . . . . . . 143 IOMERON 350*IV FL 500ML . . . . . . . . . . . 143 IOMERON 350*IV FL 50ML . . . . . . . . . . . . 143 IOMERON 400*IV FL 100ML . . . . . . . . . . . 143 IOMERON 400*IV FL 150ML . . . . . . . . . . . 143 IOMERON 400*IV FL 200ML . . . . . . . . . . . 143 IOMERON 400*IV FL 250ML . . . . . . . . . . . 143 IOMERON 400*IV FL 50ML . . . . . . . . . . . . 143 IOMERON 400*IV FL 75ML . . . . . . . . . . . . 143 IOPAMIRO 150*FL 100ML . . . . . . . . . . . . . 142 IOPAMIRO 150*FL 250ML . . . . . . . . . . . . . 142 IOPAMIRO 150*FL 50ML . . . . . . . . . . . . . . 142 IOPAMIRO 300*1F 10ML . . . . . . . . . . . . . . 142 IOPAMIRO 300*FL 100ML . . . . . . . . . . . . . 142 IOPAMIRO 300*FL 200ML . . . . . . . . . . . . . 142 IOPAMIRO 300*FL 30ML . . . . . . . . . . . . . . 142 IOPAMIRO 300*FL 50ML . . . . . . . . . . . . . . 142 IOPAMIRO 370*1F 10ML . . . . . . . . . . . . . . 142 IOPAMIRO 370*FL 100ML . . . . . . . . . . . . . 142 IOPAMIRO 370*FL 200ML . . . . . . . . . . . . . 142 IOPAMIRO 370*FL 30ML . . . . . . . . . . . . . . 142 IOPAMIRO 370*FL 50ML . . . . . . . . . . . . . . 142 IPECACUANA*7% SCIR 100ML . . . . . . . . . 137 IPNOVEL*IM EV 1F 15MG 3ML . . . . . . . . . 120 IPNOVEL*IM EV 1F 5MG 1ML . . . . . . . . . . 120 IPSTYL*IM FL30MG+F2ML+2AGH+SIR . . . 67 IPSTYL*SC 1SIR 60MG . . . . . . . . . . . . . . . 67 ISOCOLAN*8BUST 34,8G S/CONTENI . . . . 27 ISOGLAUCON*COLL 10ML 0,125%. . . . . . 133 ISONEFRINE*COLL 5ML 36% . . . . . . . . . . 135 ISOPTIN FIALE*EV 5F 5MG 2ML . . . . . . . . 53 ISOPTIN*30CPR 120MG R.P. . . . . . . . . . . . 53 ISOPTIN*30CPR 240MG R.P. . . . . . . . . . . . 53 ISOPURAMIN 3%*IV FL 250ML . . . . . . . . . 41 ISOPURAMIN 3%*IV FL 500ML . . . . . . . . . 41 ISTEROPAC E.R.*1F 10ML . . . . . . . . . . . . . 141 KABIVEN*2SACCHE 2053ML . . . . . . . . . . . 42 KABIVEN*2SACCHE 2566ML . . . . . . . . . . . 42 KABIVEN*4SACCHE 1540ML . . . . . . . . . . . 42 KALETRA*BLIST 180CPS MOLLI . . . . . . . . 81 KALETRA*OS 5FL 60ML+5SIR . . . . . . . . . . 81 KANRENOL*20CPR 100MG . . . . . . . . . . . . 51 KANRENOL*INIET 6FL 200MG+6F2ML . . . 51 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 177 Nome commerciale pag KARVEA*28CPR 150MG . . . . . . . . . . . . . . . 54 KARVEA*28CPR 300MG . . . . . . . . . . . . . . . 54 KAYEXALATE*OS SOSP 100MG/G 454 . . . 138 KCL RETARD*40CPR 600MG R.P. . . . . . . . 34 KEFORAL*OS SOSP 100ML 250MG/5M . . 71 KELOCYANOR F 2,5 MG . . . . . . . . . . . . . . . 137 KEPPRA*30CPR RIV 1000MG. . . . . . . . . . . 114 KEPPRA*60CPR RIV 500MG. . . . . . . . . . . . 114 KERITRINA*15CER 10MG/DIE . . . . . . . . . . 48 KERITRINA*15CER 15MG/DIE . . . . . . . . . . 48 KERITRINA*15CER 5MG/DIE . . . . . . . . . . . 48 KETANEST'S 25MG/ML 2 ML F . . . . . . . . . 108 KFLEBO*EV OS 5F 10ML 1MEQ/ML. . . . . . 44 KIDROLASE 10,000 U.I. FL EV . . . . . . . . . . 95 KIVEXA*BL 30CPR RIV 600MG+300M . . . . 83 KLACID 500*14CPR RIV 500MG . . . . . . . . 75 KLACID RM*7CPR RIV 500MG. . . . . . . . . . 74 KLACID*12CPR RIV 250MG . . . . . . . . . . . . 74 KLACID*BB OS GRAT 100ML 125MG/ . . . . 74 KLACID*BB OS GRAT 100ML 250MG/ . . . . 75 KLACID*OS GRATxSOSP 14BUST 250. . . . 74 KOGENATE BAYER*FL1000UI+SIR+1K. . . . 39 KOGENATE BAYER*FL250UI+SIR+1KI . . . . 39 KOGENATE BAYER*FL500UI+SIR+1KI . . . . 39 KONAKION*INIET 3F 1ML 10MG/ML . . . . . 38 KONAKION*OS GTT 2,5ML 2% . . . . . . . . . 38 KRENOSIN*EV 6F 2ML 6MG/2ML . . . . . . . 49 KRINUVEN*2SACCHE 1970ML C/ELET . . . 42 KRINUVEN*4SACCHE 986ML C/ELETT . . . 42 KRYPTOCUR*NAS 2FL 10G+2EROG. . . . . . 66 LAEVOLAC EPS*SCIR 180ML. . . . . . . . . . . 27 LAEVOLAC*SCIR 180ML . . . . . . . . . . . . . . 27 LAMICTAL*28CPR DISPERS 25MG . . . . . . 114 LAMICTAL*56CPR DISPERS 100MG . . . . . 114 LAMICTAL*56CPR DISPERS 200MG . . . . . 114 LAMICTAL*56CPR DISPERS 50MG . . . . . . 114 LANOXIN*30CPR 0,0625MG . . . . . . . . . . . 46 LANOXIN*30CPR 0,125MG . . . . . . . . . . . . 46 LANOXIN*30CPR 0,250MG . . . . . . . . . . . . 46 LANOXIN*INIET 6F 2ML 0,5MG/2ML . . . . . 46 LANOXIN*SCIR 60ML0,05MG/ML C/D . . . 46 LANSOX 15*14CPS 15MG . . . . . . . . . . . . . 24 LANSOX 30*14CPS 30MG . . . . . . . . . . . . . 25 LANSOX*14CPR ORODISP 15MG . . . . . . . 24 178 Nome commerciale LANSOX*14CPR ORODISP 30MG . . . . . . LANTANON*30CPR RIV 30MG . . . . . . . . . LANTANON*GTT 15ML 60MG/ML . . . . . . LANTUS*SC 1FL 100UI/ML 10ML . . . . . . LANTUS*SC 5CART 3ML 100UI/ML. . . . . LARGACTIL*IM 5F 2ML 50MG . . . . . . . . . LAROXYL*25CPR RIV 25MG . . . . . . . . . . LAROXYL*30CPR RIV 10MG . . . . . . . . . . LAROXYL*OS GTT 20ML 4% . . . . . . . . . . LASIX*20CPR 500MG. . . . . . . . . . . . . . . . LASIX*30CPR 25MG. . . . . . . . . . . . . . . . . LASIX*INF 5F 250MG/25ML. . . . . . . . . . . LASTET*20CPS 50MG . . . . . . . . . . . . . . . LATTULAC EPS*1SACC RETT SOL20% . . LEPONEX 100*28CPR 100MG . . . . . . . . . LEPONEX 25*28CPR 25MG . . . . . . . . . . . LEUKERAN*25CPR RIV 2MG . . . . . . . . . . LEVITRA*4CPR RIV 10MG . . . . . . . . . . . . LEVITRA*4CPR RIV 20MG . . . . . . . . . . . . LEVOPRAID 100*20CPR 100MG . . . . . . . LEVOPRAID 50*20CPR 50MG . . . . . . . . . LEVOPRAID 50*IM IV 6F 50MG 2ML . . . . LEVOVIST*1FL 4G+FL 20ML+SIR. . . . . . . LEVOXACIN*IV FL 100ML 5MG/ML . . . . . LIDOCAINA CLOR 4%*COLL 100MONO . LIDOCAINA CLORIDR*10F200MG10ML. . LIDOCAINA CLORIDR*FL 20MG/ML50 . . LIDRIAN*INIET F 5ML 2% C/BICAR . . . . . LIOMETACEN*IM 6F+6F 50MG . . . . . . . . LIORESAL INTRATEC*F 0,05MG 1ML . . . LIORESAL INTRATEC*F 10MG 20ML . . . . LIORESAL INTRATEC*F 10MG 5ML . . . . . LIORESAL*50CPR 10MG . . . . . . . . . . . . . LIORESAL*50CPR 25MG . . . . . . . . . . . . . LIPAXAN*28CPR 80MG R.P. . . . . . . . . . . LIPIODOL ULTRAFLUIDO*F 10ML . . . . . . LIPOFUNDIN MCT*10FL 100ML 10%+ . . LIPOFUNDIN MCT*10FL 250ML 10%+ . . LIPOVISC*GEL OFT 10G 2MG/G . . . . . . . LIXIDOL*IM 3F 1ML 30MG. . . . . . . . . . . . LOCOIDON*CR IDROF 30G 0,1% . . . . . . . LONARID*BB 6SUPP 200MG+5MG . . . . . LONARID*LATT 6SUPP 60MG+2,5MG . . . LORANS*OS GTT 10ML . . . . . . . . . . . . . . pag 24 121 121 30 30 116 121 121 121 50 50 50 92 27 117 117 89 63 63 118 118 118 145 76 135 108 108 108 103 105 105 105 105 105 55 143 42 42 136 103 58 111 111 119 Commissione provinciale del Farmaco Bologna Nome commerciale pag LUAN*POM 15G 2,5% . . . . . . . . . . . . . . . . 63 LUMIGAN*COLL FL 3ML . . . . . . . . . . . . . . 135 LUMINALETTE*30CPR 15MG . . . . . . . . . . 112 LUMIREM*SOSP 3FL 52,5MG/300ML. . . . 145 LUTRELEF*FL 0,8MG/10ML+FL+SIR . . . . . 66 LUXAZONE*COLL FL 3ML 0,2% . . . . . . . . 133 LUXAZONE*OFT UNG 3G 0,2% . . . . . . . . . 133 LYSODREN*FL 100CPR 500MG. . . . . . . . . 96 MAALOX*40CPR MAST 800MG. . . . . . . . . 24 MAALOX*OS SOSP 200ML 6,9% . . . . . . . 24 MABCAMPATH*EV 3F 3ML 10MG/ML . . . 95 MABTHERA*EV 1FL 50ML 500MG. . . . . . . 94 MABTHERA*EV 2F 10ML 100MG. . . . . . . . 94 MADOPAR*30CPR DISPERS 125MG . . . . . 115 MADOPAR*50CPR DIV 200MG+50MG . . . 115 MAGNEVIST*EV 1FL 100ML 469MG/M. . . 144 MAGNEVIST*EV 1FL 10ML 469MG/ML. . . 144 MAGNEVIST*EV 1FL 15ML 469MG/ML. . . 144 MAGNEVIST*EV 1FL 20ML 469MG/ML. . . 144 MAGNEVIST*EV 1FL 30ML 469MG/ML. . . 144 MAGNEVIST*EV 1FL 5ML 469MG/ML. . . . 144 MAGNEVIST*EV 1SIR 10ML 469MG/M . . . 144 MAGNEVIST*EV 1SIR 15ML 469MG/M . . . 144 MAGNEVIST*EV 1SIR 20ML 469MG/M . . . 144 MEDROL*20CPR DIV 16MG. . . . . . . . . . . . 67 MEDROL*30CPR DIV 4MG. . . . . . . . . . . . . 67 MEFOXIN*IM 1FL 1G+F 2ML . . . . . . . . . . . 72 MEFOXIN*IV 1FL 2G+F 20ML . . . . . . . . . . 72 MEGESTIL*30CPR 160MG. . . . . . . . . . . . . 96 MENCEVAX ACWY*SC FL+SIR 0,5ML. . . . 85 MENJUGATE*FL POLV+FL 0,5MLSOLV. . . 85 MENOGON*IM 10F+10F 1ML . . . . . . . . . . 62 MEPICAIN*10F 2ML 3% . . . . . . . . . . . . . . 108 MEPIVACAINA ADR.*2% 10F 10ML . . . . . 109 MEPIVACAINA ADR.*2% 5F 5ML . . . . . . . 109 MEPIVACAINA*1% 10F 10ML . . . . . . . . . . 108 MEPIVACAINA*1% 5F 5ML . . . . . . . . . . . . 108 MEPIVACAINA*2% 10F 10ML . . . . . . . . . . 108 MEPIVACAINA*2% 5F 5ML . . . . . . . . . . . . 108 MERREM*EV POLV 10FL 1000MG. . . . . . . 73 MESTINON*20CPR 60MG . . . . . . . . . . . . . 123 MESTINON*50CPR 180MG R.P. . . . . . . . . 123 MESULID*OS GRAT 30BUST 100MG. . . . . 104 METADONE CLOR.MOL*OS 1MG/ML20M 124 Nome commerciale pag METADONE CLOR.MOL*OS 5MG/ML20M. 124 METADONE CLOR.MOL*OS1MG/ML1000. 124 METADONE CLOR.MOL*OS5MG/ML1000. 124 METAKELFIN*FL 10CPR 500MG . . . . . . . . 126 METALYSE*IV 1FL 10000U/10ML+SI . . . . 37 METEOSIM*50CPR MAST 40MG . . . . . . . . 140 METEOSIM*OS GTT 30ML 6,66% . . . . . . . 140 METFONORM*60CPR RIV 1000MG . . . . . . 31 METFORMINA TEVA*30CPR 500MG OP . . 31 METFORMINA TEVA*40CPR 850MG OP . . 31 METHERGIN*15CPR RIV 0,125MG. . . . . . . 60 METHERGIN*OS GTT 10ML 0,25MG/M . . . 60 METHOTREXATE*25CPR 2,5MG . . . . . . . . 90 METHOTREXATE*INIET 4SIR 10MG . . . . . . 90 METHOTREXATE*INIET 4SIR 15MG/2 . . . . 90 METHOTREXATE*INIET 4SIR 20MG . . . . . . 90 METHOTREXATE*INIET 4SIR 7,5MG . . . . . 90 METILERGOMETRINA MAL.*10F 0,2M . . . 60 METOTRESSATO TEVA*FL 500MG20ML . . 90 METOTRESSATO TEVA*FL 50MG 2ML . . . 90 METOTRESSATO TEVA*FL 5G 50ML . . . . . 90 METOTREXATO MAYNE*5F 5MG 2ML. . . . 90 MEXITIL*40CPS 200MG. . . . . . . . . . . . . . . 46 MEXITIL*IV 10F 10ML 25MG/ML. . . . . . . . 46 MICRONOAN 10*4MICROCLISMI 10MG . . 119 MICRONOAN 5*4MICROCLISMI 5MG . . . . 119 MIDARINE*IV 5F 2ML 100MG/2ML . . . . . . 104 MIFLONIDE*POLVxINAL 120CPS 200 . . . . 129 MIFLONIDE*POLVxINAL 60CPS 400M . . . 129 MIMPARA*28CPR RIV 30MG . . . . . . . . . . . 69 MIMPARA*28CPR RIV 60MG . . . . . . . . . . . 69 MINIRIN/DDAVP*30CPR 0,1MG. . . . . . . . . 66 MINIRIN/DDAVP*INIET 10F 4MCG/M . . . . 66 MINIRIN/DDAVP*RIN 2,5ML 250MCG . . . . 66 MINIRIN/DDAVP*SPR NAS 0,125MG. . . . . 66 MINOCIN*8CPS 100MG. . . . . . . . . . . . . . . 70 MIOCHOL E*SOLUZ INTRAOCUL 2ML. . . . 133 MIOLENE*20CPR 10MG. . . . . . . . . . . . . . . 61 MIOLENE*IV 3F 5ML 50MG . . . . . . . . . . . . 61 MIOZAC*INFUS FL20ML 250MG/20ML. . . 47 MIRAPEXIN*30CPR 0,18MG . . . . . . . . . . . 115 MIRAPEXIN*30CPR 0,7MG . . . . . . . . . . . . 115 MIRTAZAPINA RAT.*30CPR RIV 30M. . . . . 122 MITOMYCIN C*INIET 1FL 10MG . . . . . . . . 93 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 179 Nome commerciale pag MITOXANTRONE EBE*EV10ML 2MG/ML . . 93 MITTOVAL*30CPR RIV 2,5MG . . . . . . . . . . 64 MIVACRON*EV 5F 5ML 2MG/ML. . . . . . . . 104 MMR II*1FL LIOF+1SIR SOLV . . . . . . . . . . 87 MODITEN DEPOT*IM 1F 25MG . . . . . . . . . 116 MODURETIC*20CPR 5MG+50MG . . . . . . . 51 MONOCINQUE RETARD*30CPS 50MG . . . 48 MONOCINQUE*30CPR DIV 40MG . . . . . . . 48 MONOCINQUE*50CPR DIV 20MG . . . . . . . 48 MONONINE*EV F 1000UI+F10ML+KIT . . . . 39 MONONINE*EV F 500UI+F 5ML+KIT . . . . . 39 MORFINA CLORIDR*1F 50MG/5ML . . . . . . 109 MORFINA CLORIDR*5F 10MG 1ML . . . . . . 109 MOTILIUM*30CPR RIV 10MG . . . . . . . . . . 26 MULTIHANCE*EV 1F 10ML . . . . . . . . . . . . 144 MULTIHANCE*EV 1F 15ML . . . . . . . . . . . . 144 MULTIHANCE*EV 1F 20ML . . . . . . . . . . . . 144 MULTIHANCE*EV 1F 5ML . . . . . . . . . . . . . 144 MUPHORAN*IV 1F 208MG+F SOLV . . . . . . 90 MYCOBUTIN*30CPS 150MG . . . . . . . . . . . 79 MYCOSTATIN*OS SOSP FL 100ML . . . . . . 28 MYFORTIC*100CPR RIV 180MG . . . . . . . . 100 MYFORTIC*50CPR RIV 360MG . . . . . . . . . 100 MYLERAN*100CPR RIV 2MG . . . . . . . . . . . 89 MYOCET*INFUS 2SET 50MG . . . . . . . . . . . 93 MYSOLINE*30CPR 250MG. . . . . . . . . . . . . 112 NALADOR*EV 1F 0,5MG 2ML. . . . . . . . . . . 61 NAPRILENE*14CPR 20MG . . . . . . . . . . . . . 54 NAPRILENE*28CPR 5MG . . . . . . . . . . . . . . 54 NAPROSYN*OS GRAT 30BUST 500MG . . . 103 NARCAN NEONATAL*1F 2ML 0,04MG. . . . 137 NARCAN*IM IV 1F 1ML 0,4MG . . . . . . . . . 137 NARCORAL*10CPR 50MG . . . . . . . . . . . . . 123 NAROPINA 10MG/ML*5F POLYAMP10M . 109 NAROPINA 2MG/ML*5F POLYAMP10ML . 109 NAROPINA 2MG/ML*5SACCHE 100ML . . . 109 NAROPINA 7,5MG/ML*5F POLYAMP10. . . 109 NATULAN*50CPS 50MG . . . . . . . . . . . . . . 94 NAVELBINE 10*IV 10MG 1ML . . . . . . . . . . 92 NAVELBINE 50*IV 50MG 5ML . . . . . . . . . . 92 NAVELBINE*1CPS 20MG . . . . . . . . . . . . . . 92 NAVELBINE*1CPS 30MG . . . . . . . . . . . . . . 92 NEBICINA*IM IV 1F 2ML 20MG . . . . . . . . . 75 NEOFURADANTIN*20CPS 50MG . . . . . . . . 77 180 Nome commerciale NEOHEPATECT*IV 1F 10ML/500UI . . . . . NEOHEPATECT*IV FL 40ML/2000UI . . . . NEOTIGASON*20CPS 25MG . . . . . . . . . . NEOTIGASON*30CPS 10MG . . . . . . . . . . NETTACIN COLLIRIO*15FL 1D 0,3% . . . . NICOZID*50CPR 200MG . . . . . . . . . . . . . NICOZID*IM 6F 2ML 100MG . . . . . . . . . . NICOZID*IM IV 5F 5ML 500MG . . . . . . . . NIFEDICOR*OS FL GTT 30ML20MG/M . . NIMBEX 2*5F 5ML 2MG/ML . . . . . . . . . . NIMBEX 5*1FL 30ML 5MG/ML . . . . . . . . NIMOTOP PER INF.*10MG/50ML+DEF . . NIMOTOP*OS GTT 25ML 4% . . . . . . . . . . NIPENT*IV FL 10MG . . . . . . . . . . . . . . . . . NITROGLICERINA LIM*10F 5MG/1,5 . . . . NITROSORBIDE*EV 10F 10ML . . . . . . . . . NOLVADEX*20CPR RIV 20MG . . . . . . . . . NOPAR*20CPR 1MG. . . . . . . . . . . . . . . . . NOPAR*40CPR 0,25MG . . . . . . . . . . . . . . NORCURON 10*EV 10F 10MG . . . . . . . . . NORMIX*AD 12CPR RIV 200MG . . . . . . . NORUXOL*UNG 30G. . . . . . . . . . . . . . . . . NORVASC 10*14CPR 10MG . . . . . . . . . . . NORVASC 5*28CPR 5MG . . . . . . . . . . . . . NORVIR*4FL 84CPS MOLLI 100MG . . . . . NORVIR*OS 5FL 90ML 80MG/ML . . . . . . NOVESINA*30FL 0,6ML 0,4% . . . . . . . . . NOVONORM*90CPR 0,5MG . . . . . . . . . . . NOVONORM*90CPR 1MG . . . . . . . . . . . . NOVONORM*90CPR 2MG . . . . . . . . . . . . NOVORAPID PENFILL*SC 5CART 3ML . . NOVORAPID*FLEX 5PEN 3ML 100U/M . . NOVOSEVEN*IV 1,2MG(60KUI)+2,2M . . . NOZINAN*20CPR RIV 100MG. . . . . . . . . . NOZINAN*20CPR RIV 25MG. . . . . . . . . . . NUTRIPERI LIPID*EV 5SA 1875ML. . . . . . NUTRIPLUS LIPID*EV 5SA 1875ML . . . . . NUTRISPECIAL LIPID*5SA 1875ML . . . . . NUTRISPECIAL LIPID*5SA 2500ML . . . . . NUTROPINAQ*SC 1CART 2ML10MG/2M. OFTACILOX*OFT GTT FL 5ML 0,3% . . . . OLICLINOMEL*N-4-550E 1500ML4SA. . . OLICLINOMEL*N-4-550E 2000ML4SA. . . OLICLINOMEL*N-6-900E 2000ML4SA. . . pag 84 84 57 57 132 79 79 79 53 104 104 53 53 95 48 48 97 115 115 104 28 56 53 53 81 81 135 32 32 32 30 30 39 116 116 42 42 42 42 65 132 42 42 42 Commissione provinciale del Farmaco Bologna Nome commerciale pag OLICLINOMEL*N-7-1000E2000ML4SA . . . 42 OLIO VASELINA*EMULS 200G. . . . . . . . . . 27 OMNIC*20CPS 0,4MG R.M.. . . . . . . . . . . . 64 ONCOCARBIDE*20CPS 500MG . . . . . . . . . 95 ONKOTRONE*EV 1FL 10MG 5ML . . . . . . . 93 OPACIST E.R.*FL 200ML . . . . . . . . . . . . . . 141 OPTOCAIN*50CART 1,8ML 30MG/ML. . . . 108 OPTOCAIN*50CART 1,8ML ADR 1:80 . . . . 109 OPTOCAIN*50CART1,8ML ADR 1:100. . . . 109 ORAMORPH*OS 20FL 1D 5ML 10MG . . . . 109 ORAMORPH*OS FL 20ML 20MG/ML. . . . . 109 ORAP*20CPR 4MG. . . . . . . . . . . . . . . . . . . 117 ORAXIM*6CPR RIV 500MG . . . . . . . . . . . . 72 ORTHOCLONE OKT3*EV 5F 5ML . . . . . . . . 100 OSSITOCINA*INIET 6F 1ML 5UI. . . . . . . . . 66 OXIS TURBOHALER 4,5*POLV 60D . . . . . . 128 OXIS TURBOHALER 9*POLV 60D. . . . . . . . 128 OXYCONTIN*28CPR 20MG R.P. . . . . . . . . 110 OXYCONTIN*28CPR 40MG R.P. . . . . . . . . 110 PAMIDRONATO D.MAYNE*EV 1FL90MG. . 106 PAMIDRONATO D.MAYNE*EV 5FL15MG. . 106 PANACEF*8CPS 500MG . . . . . . . . . . . . . . 72 PANACEF*GRATxSOSP 250MG/5ML. . . . . 72 PANCREX*100CPS 340MG . . . . . . . . . . . . 29 PARACODINA*OS GTT FL 15G. . . . . . . . . . 130 PARAPLATIN*IV FL 150MG/15ML . . . . . . . 94 PARAPLATIN*IV FL 450MG/45ML . . . . . . . 94 PARAPLATIN*IV FL 50MG/5ML . . . . . . . . . 94 PEDITRACE*INFUS 10FL 10ML . . . . . . . . . 45 PEGASYS*SC SIR 0,5ML 135MCG+AG . . . 99 PEGASYS*SC SIR 0,5ML 180MCG+AG . . . 99 PEGINTRON*SC 1FL 100MCG+1F . . . . . . . 99 PEGINTRON*SC 1FL 120MCG+1F . . . . . . . 99 PEGINTRON*SC 1FL 150MCG+1F . . . . . . . 99 PEGINTRON*SC 1FL 50MCG+1F . . . . . . . . 99 PEGINTRON*SC 1FL 80MCG+1F . . . . . . . . 99 PEGINTRON*SC 1PEN 100MCG+1AGO+ . . 99 PEGINTRON*SC 1PEN 120MCG+1AGO+ . . 99 PEGINTRON*SC 1PEN 50MCG+1AGO+2 . . 99 PEGINTRON*SC 1PEN 80MCG+1AGO+2 . . 99 PENICILLINA G SQUIBB K*1/M UI . . . . . . . 70 PENSTAPHO*IM IV 1FL+F 1G . . . . . . . . . . 71 PENTACARINAT*IM EV/AEROS 300MG . . . 126 PENTACOL 800*60CPR 800MG R.M. . . . . 29 Nome commerciale pag PENTAGASTRIN 500 MCG 2 ML 5 FIALE . . 140 PENTAGLOBIN*EV 1F 50MG/ML 10ML . . . 84 PENTAGLOBIN*EV 1FL 50MG/ML100M . . 84 PENTASA*50CPR 500MG R.M. . . . . . . . . . 29 PERFALGAN*INF 12FL 100ML 10MG/ . . . . 111 PERFAN*EV 1F 100MG 20ML . . . . . . . . . . 47 PERGANIT*IV SOLUZ 1FL 50ML . . . . . . . . 48 PERIDON*AD 6SUPP 60MG . . . . . . . . . . . . 26 PERIDON*BB 6SUPP 30MG . . . . . . . . . . . . 26 PERIDON*SCIR 200ML 10MG/10ML . . . . . 26 PERIVEN*2SACCHE 2400ML . . . . . . . . . . . 42 PERSANTIN*IV 10F 10MG/2ML . . . . . . . . . 36 PETIDINA CLORIDR*5F 100MG 2ML . . . . . 110 PEVARYL*15 OV VAG 50MG . . . . . . . . . . . 60 PEVARYL*CREMA 30G 1% . . . . . . . . . . . . 56 PEVARYL*EMULS CUT 30ML 1% . . . . . . . 56 PEVARYL*POLV CUT 30G 1% . . . . . . . . . . 56 PEVARYL*SOL CUT 6BUST 10G 1% . . . . . 56 PHAREPA*EV 10F 25000UI/5ML . . . . . . . . 35 PHOSPHOLAX*OS 10BUST 20ML . . . . . . . 27 PILOCARPINA FARM*COLL25D 0,5ML . . . 133 PILOCARPINA LUX*COLL 10ML 2% . . . . . 133 PIPEMID 400*20CPS 400MG. . . . . . . . . . . 76 PIPERTEX*INIET 10F 4G. . . . . . . . . . . . . . . 70 PIPERTEX*INIET F 2G+F 4ML SOLV. . . . . . 70 PIRALDINA*50CPR 500MG . . . . . . . . . . . . 79 PLANDER R*EV SOLUZ 500ML 10% . . . . . 41 PLANDER*INF 20FL 500ML 30G/500. . . . . 41 PLAQUENIL*25CPR RIV 200MG. . . . . . . . . 125 PLASIL*24CPR 10MG . . . . . . . . . . . . . . . . 26 PLASIL*INET 5F 2ML 10MG/2ML . . . . . . . 26 PLASIL*SCIR 120ML 10MG/10ML. . . . . . . 26 PLAVIX*28CPR RIV 75MG . . . . . . . . . . . . . 36 PNEUMO 23*INIET 1SIR 0,5ML . . . . . . . . . 86 PREPIDIL*GEL 1SIR 0,5MG/3G . . . . . . . . . 60 PREPIDIL*GEL VAG 1SIR 1MG/3G . . . . . . . 60 PREPIDIL*GEL VAG 1SIR 2MG/3G . . . . . . . 60 PREVENAR*INIET 1FL 0,5ML . . . . . . . . . . . 86 PREVEX 5*28CPR RIV 5MG R.P. . . . . . . . . 53 PRIMAQUINE FOSFATO 7,5 MG. . . . . . . . . 125 PRIMOLUT NOR*30CPR 10MG . . . . . . . . . 62 PROGLICEM*100CPS 100MG . . . . . . . . . . 139 PROGRAF*30CPS 0,5MG . . . . . . . . . . . . . . 100 PROGRAF*30CPS 5MG . . . . . . . . . . . . . . . 100 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 181 Nome commerciale pag PROGRAF*60CPS 1MG . . . . . . . . . . . . . . . 100 PROGRAF*INFUS EV 10F 5MG/1ML . . . . . 100 PROHANCE*EV 1FL 10ML 279,3MG/M . . . 144 PROHANCE*EV 1FL 15ML 279,3MG/M . . . 144 PROHANCE*EV 1FL 20ML 279,3MG/M . . . 144 PROHANCE*EV 1FL 5ML 279,3MG/ML . . . 144 PROHANCE*EV 1SIR 15ML 279,3MG. . . . . 144 PROHANCE*EV 1SIR 17ML 279,3MG. . . . . 144 PROHANCE*EV SIR 10ML 279,3MG. . . . . . 144 PROLEUKIN*EV 1FL 18MUI 5ML . . . . . . . . 99 PROMETRIUM*OS VAG 30CPS 100MG . . . 61 PRONTOBARIO ESOFAGO*CR 250ML . . . . 144 PRONTOBARIO HD*OS POLV 340G . . . . . . 144 PRONTOBARIO TAC*SOSP FL 225ML . . . . 144 PRONTOGEST*INIET 3F 1ML100MG/M . . . 61 PROPESS*5DISP VAG 10MG . . . . . . . . . . . 60 PROPOFOL B.BRAUN 1%*10FL 50ML . . . . 108 PROPOFOL B.BRAUN 1%*5F 20ML . . . . . . 108 PROPYCIL 50 MG CPR . . . . . . . . . . . . . . . . 68 PROSTIDE*15CPR RIV 5MG . . . . . . . . . . . . 64 PROSTIN E2*INF 1F 0,75MG/0,75M. . . . . . 60 PROSTIN VR*IV INF 1F 500MCG1ML. . . . . 48 PROTAMINA ICN*IV 1F 50MG 5ML . . . . . . 137 PROTAPHANE*NOVOL5CART 3ML100UI. . 30 PROTAPHANE*PENF 5CART 3ML100UI. . . 30 PROTAPHANE*SC 1FL 10ML100UI/ML . . . 30 PROTOPIC*UNG 0,03% 30G . . . . . . . . . . . 59 PROTOPIC*UNG 0,1% 30G . . . . . . . . . . . . 59 PROTOVIT RAFFORZATO*40CPR MAST. . . 32 PROVERTIN UM TIM3*IV FL 600UI . . . . . . 39 PROVIGIL*30CPR 100MG. . . . . . . . . . . . . . 122 PROZIN*20CPR RIV 100MG . . . . . . . . . . . . 116 PROZIN*25CPR RIV 25MG . . . . . . . . . . . . . 116 PROZIN*OS GTT 10ML 4%. . . . . . . . . . . . . 116 PSORCUTAN*CR IDROF 30G 0,005% . . . . 57 PSORCUTAN*SOL CUT 30ML 50MCG/M . 57 PULMIST*AD NEBUL 15MONOD2MG/2M . 129 PULMOZYME*INAL 6F 2500U 2,5ML. . . . . 130 PUREGON*IM SC 5FL 100UI/0,5ML. . . . . . 62 PUREGON*SC 1CART 300UI/0,36ML. . . . . 62 PUREGON*SC 1CART 600UI/0,72ML. . . . . 62 PUREGON*SC 1CART 900UI/1,08ML. . . . . 62 PURINETHOL*25CPR 50MG. . . . . . . . . . . . 90 PURSENNID*40CPR RIV 12MG . . . . . . . . . 27 182 Nome commerciale QUESTRAN*OS 12BUST 4G . . . . . . . . . . . RABIPUR*1FL 1D 1ML+1F C/SIR . . . . . . . RAIKOCEF*IM 1F 1G+F 2,5ML . . . . . . . . . RANITIDINA ANG*10F 5ML 50MG/5M . . . RANITIDINA ANG*20CPR RIV 150MG . . . RANITIDINA ANG*20CPR RIV 300MG . . . RAPAMUNE*100CPR RIV 1MG. . . . . . . . . RAPAMUNE*OS FL 60ML+30SIR DOS+ . . RAPTIVA*SC 4FL 100MG/ML+4SIR+8 . . . REBIF*SC 12SIR 12000000UI44MCG. . . . REBIF*SC 12SIR 6000000UI 22MCG . . . . REFACTO*IV 1FL 1000UI+FL 4ML . . . . . . REFACTO*IV 1FL 250UI+FL 4ML . . . . . . . REFACTO*IV 1FL 500UI+FL 4ML . . . . . . . REFLUDAN*EV 10F 1ML 50MG . . . . . . . . REMICADE*EV F 100MG+F 2ML . . . . . . . REMINYL*56CPR RIV 12MG. . . . . . . . . . . REMINYL*56CPR RIV 4MG. . . . . . . . . . . . REMINYL*56CPR RIV 8MG. . . . . . . . . . . . RENAGEL*FL 180CPR 800MG . . . . . . . . . REOMAX*20CPR 50MG . . . . . . . . . . . . . . REOMAX*IV F 50MG+F 20ML SOLV . . . . REOPRO*EV 1F 5ML 10MG/5ML . . . . . . . REQUIP*21CPR 0,25MG . . . . . . . . . . . . . . REQUIP*21CPR 1MG . . . . . . . . . . . . . . . . REQUIP*21CPR 2MG . . . . . . . . . . . . . . . . REQUIP*21CPR 5MG . . . . . . . . . . . . . . . . RESOVIST*INIET 1SIR 0,9ML . . . . . . . . . . RESPICUR*30CPS 200MG R.P. . . . . . . . . RESPICUR*30CPS 300MG R.P. . . . . . . . . RETROVIR*60CPR 300MG . . . . . . . . . . . . RETROVIR*60CPS 250MG . . . . . . . . . . . . RETROVIR*EV 5FL 20ML 200MG . . . . . . . RETROVIR*SCIR 200ML 100MG/ML . . . . REVAXIS*1SIR 0,5ML C/COPRIAGO. . . . . REVIVAN 200*FLEBO 10F 200MG5ML . . . REYATAZ*60CPS 150MG . . . . . . . . . . . . . REYATAZ*60CPS 200MG . . . . . . . . . . . . . RHOPHYLAC*1SIR 300MCG/2ML . . . . . . RIBOMICIN*COLL 5MONOD.0,5ML . . . . . RIBOMICIN*COLL FL 10ML 0,3% . . . . . . RIBOMICIN*UNG OFT 5G 0,3% . . . . . . . . RIFADIN*8CPR RIV 450MG . . . . . . . . . . . RIFADIN*8CPR RIV 600MG . . . . . . . . . . . pag 55 87 72 24 24 24 101 101 102 99 99 39 39 39 37 101 123 123 123 138 51 51 36 115 115 115 115 145 130 130 81 81 81 81 88 47 81 81 84 132 132 132 79 79 Commissione provinciale del Farmaco Bologna Nome commerciale pag RIFADIN*8CPS 300MG . . . . . . . . . . . . . . . 79 RIFADIN*EV 1F 600MG+F 10ML . . . . . . . . 79 RIFADIN*SCIR 60ML 20MG/ML. . . . . . . . . 79 RIGENTEX*30CPS MOLLI 400UI . . . . . . . . 33 RILUTEK*56CPR RIV 50MG . . . . . . . . . . . . 124 RISPERDAL*1FL 25MG+1SIR 2ML . . . . . . 118 RISPERDAL*1FL 37,5MG+1SIR 2ML . . . . . 118 RISPERDAL*OS GTT 100ML 1MG/ML . . . . 118 RIVOTRIL*20CPR 0,5MG . . . . . . . . . . . . . . 113 RIVOTRIL*20CPR 2MG. . . . . . . . . . . . . . . . 113 RIVOTRIL*OS GTT 10ML 2,5MG/ML . . . . . 113 RIZALIV 5*3CPR 5MG . . . . . . . . . . . . . . . . 112 RIZALIV RPD10*3LIOF 10MG. . . . . . . . . . . 112 ROACCUTAN*30CPS 10MG. . . . . . . . . . . . 58 ROACCUTAN*30CPS 20MG. . . . . . . . . . . . 58 ROCALTROL*30CPS 0,25MCG . . . . . . . . . 33 ROCALTROL*30CPS 0,50MCG . . . . . . . . . 33 ROFERON A*SC 1SIR 3MUI/0,5ML . . . . . . 98 ROFERON A*SC 1SIR 6MUI/0,5ML . . . . . . 98 ROFERON A*SC 1SIR 9MUI/0,5ML . . . . . . 98 ROVAMICINA*12CPR RIV 3000000UI . . . . 74 RYTMONORM*28CPS 325MG R.P. . . . . . . 46 RYTMONORM*28CPS 425MG R.P. . . . . . . 46 RYTMONORM*30CPR RIV 150MG. . . . . . . 46 RYTMONORM*30CPR RIV 300MG. . . . . . . 46 RYTMONORM*EV 5F 70MG 20ML. . . . . . . 46 SABRIL*50CPR RIV 500MG . . . . . . . . . . . . 113 SALAZOPYRIN EN*100CPR 500MG. . . . . . 29 SALMETEDUR DISKUS*INAL 60D 50M . . . 128 SALMETEDUR SOSPxINAL*120ER 25M . . 128 SANDIMMUN NEORAL*30CPS 100MG . . . 100 SANDIMMUN NEORAL*50CPS 10MG . . . . 100 SANDIMMUN NEORAL*50CPS 25MG . . . . 100 SANDIMMUN NEORAL*50CPS 50MG . . . . 100 SANDIMMUN NEORAL*50ML 100MG/ML. 100 SANDIMMUN*30CPS 100MG . . . . . . . . . . 100 SANDIMMUN*50CPS 25MG . . . . . . . . . . . 100 SANDIMMUN*50CPS 50MG . . . . . . . . . . . 100 SANDIMMUN*INFUS 10F 5ML 50MG/M. . 100 SANDIMMUN*OS FL 50ML 100MG/ML . . 100 SANDOSTATINA LAR*FL 10MG+SIR+2 . . . 66 SANDOSTATINA LAR*FL 20MG+SIR+2 . . . 66 SANDOSTATINA LAR*FL 30MG+SIR+2 . . . 66 SANDOSTATINA*INIET 3F 0,5MG/ML . . . . 66 Nome commerciale pag SANDOSTATINA*INIET 5F 0,1MG/ML . . . . 66 SANDOSTATINA*IV SC FL 0,2MG/ML . . . . 67 SEACOR*20CPS 1G . . . . . . . . . . . . . . . . . . 55 SELECTIN 40*14CPR 40MG. . . . . . . . . . . . 55 SELG ESSE*OS POLV 4BUST 70G 1L . . . . 27 SELOKEN*50CPR 100MG. . . . . . . . . . . . . . 52 SELOKEN*IV 5F 5ML 5MG . . . . . . . . . . . . . 52 SEREPRILE*20CPR 100MG . . . . . . . . . . . . 118 SEREPRILE*INIET 10F 100MG/2ML . . . . . . 118 SEROPRAM*EV 10F 1ML 40MG/ML . . . . . 121 SEROQUEL*30CPR RIV 25MG . . . . . . . . . . 118 SEROQUEL*60CPR RIV 100MG . . . . . . . . . 118 SEROQUEL*60CPR RIV 200MG . . . . . . . . . 118 SEROQUEL*60CPR RIV 300MG . . . . . . . . . 118 SEVORANE*INAL 250ML QUIK FIL. . . . . . . 107 SIFICETINA*COLL FL 5ML 0,4% . . . . . . . . 132 SIFICETINA*UNG OFT 5G 1% . . . . . . . . . . 132 SIFRAMIN*FL 500ML 4%. . . . . . . . . . . . . . 41 SIMDAX*EV 1FL 5ML 2,5MG/ML. . . . . . . . 48 SIMULECT*IV 1F 20MG+F 5ML . . . . . . . . . 101 SINEMET*30CPR 200MG+50MG R.M.. . . . 115 SINEMET*50CPR 100MG+25MG R.M.. . . . 115 SINEMET*50CPR 100MG+25MG . . . . . . . . 115 SINEMET*50CPR 250MG+25MG . . . . . . . . 115 SINTAMIN HEPA*FL 500ML 8% . . . . . . . . 41 SINTAMIN*INFUS FL 500ML 10% . . . . . . . 41 SINTROM*20CPR DIV 4MG . . . . . . . . . . . . 35 SINVACOR*28CPR RIV 20MG . . . . . . . . . . 55 SINVACOR*28CPR RIV 40MG . . . . . . . . . . 55 SODIO NITROPR.MAL*EV 3F 100MG+. . . . 49 SOFARGEN*CREMA 180G 1% . . . . . . . . . . 57 SOFARGEN*CREMA 50G 1% . . . . . . . . . . . 57 SOLDESAM*OS GTT 10ML 0,2%. . . . . . . . 67 SOLIAN*30CPR RIV 400MG . . . . . . . . . . . . 118 SOLOSA*30CPR 2MG . . . . . . . . . . . . . . . . 31 SOLUCORTEF*1FL 100MG/2ML 2ML . . . . 68 SOLUCORTEF*1FL 250MG/2ML 2ML . . . . 68 SOLUCORTEF*1FL 500MG/4ML 4ML . . . . 68 SOLUMEDROL*IM IV FL 125MG 2ML . . . . 67 SOLUMEDROL*IM IV FL 1G+F 16ML. . . . . 67 SOLUMEDROL*IM IV FL 2G+F 32ML. . . . . 67 SOLUMEDROL*IM IV FL 40MG 1ML . . . . . 67 SOLUMEDROL*IM IV FL 500MG+F8ML. . . 67 SOLUVIT*AD IV 10FL 10ML . . . . . . . . . . . . 45 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 183 Nome commerciale pag SOMATOSTATINA PH&T*EV FL 3MG+F. . . 66 SOMAVERT*SC 30FL 10MG+30FL 8ML. . . 65 SOMAVERT*SC 30FL 15MG+30FL 8ML. . . 65 SOMAVERT*SC 30FL 20MG+30FL 8ML. . . 65 SONOVUE*1FL 8MCG+1SIR 5ML+ADAT . . 145 SOTALOLO TEVA*40CPR 80MG. . . . . . . . . 52 SPASMEX*20CPR 80MG+80MG . . . . . . . . 25 SPASMEX*INIETT 10F 40MG/4ML. . . . . . . 25 SPIRIVA*30CPS 18MCG HANDIHALER . . . 129 SPORANOX*8CPS 100MG . . . . . . . . . . . . . 78 SPORANOX*F 25ML+NACL 100ML 0,9 . . . 78 STALEVO*100CPR 100MG/25MG/200M . . 115 STAMARIL PASTEUR*FL+SIR 0,5ML . . . . . 88 STILNOX*30CPR RIV 10MG . . . . . . . . . . . . 120 STREPTOMICINA SOLF.SQUIBB*1/MU . . . 75 STROMECTOL 3MG CPR . . . . . . . . . . . . . . 126 SUBUTEX*7CPR SUBLING 2MG. . . . . . . . . 123 SUBUTEX*7CPR SUBLING 8MG. . . . . . . . . 124 SUCRALFATO ABC*GRAT 30BUST 2G . . . . 25 SUFENTANIL HAM*EV 5F 250MCG 5M . . . 107 SULFADIAZINA*20CPR 500MG . . . . . . . . . 74 SUPRANE*LIQ INAL FL 240ML. . . . . . . . . . 107 SUPREFACT DEPOT 3*1SIR 9,9MG . . . . . . 96 SUPREFACT DEPOT*1SIR 6,6MG. . . . . . . . 96 SUSTIVA*30CPR RIV 600MG BLIST. . . . . . 83 SUSTIVA*FL 30CPS 50MG. . . . . . . . . . . . . 83 SUSTIVA*FL 90CPS 200MG. . . . . . . . . . . . 83 SYMBICORT*INAL 120D 160/4,5MCG . . . . 128 SYMBICORT*INAL 120D 160/4,5MCG . . . . 128 SYNAGIS*IM 1F 100MG+1AMP SOLV . . . . 85 SYNAGIS*IM 1F 50MG+1AMP SOLV . . . . . 85 TACHIPIRINA*10SUPP 125MG. . . . . . . . . . 111 TACHIPIRINA*10SUPP 1G . . . . . . . . . . . . . 111 TACHIPIRINA*10SUPP 250MG. . . . . . . . . . 111 TACHIPIRINA*10SUPP 500MG. . . . . . . . . . 111 TACHIPIRINA*12CPR EFF 1G . . . . . . . . . . . 111 TACHIPIRINA*20CPR 500MG. . . . . . . . . . . 111 TACHIPIRINA*BB OS GTT 30ML 10% . . . . 111 TACHIPIRINA*SCIR 120ML 2,4%. . . . . . . . 111 TALAVIR*21CPR RIV 1G . . . . . . . . . . . . . . . 80 TALOFEN*GTT FL 30ML 4%. . . . . . . . . . . . 116 TALOFEN*IM IV 6F 50MG. . . . . . . . . . . . . . 116 TAPAZOLE*100CPR 5MG . . . . . . . . . . . . . . 69 TARGOSID*IM IV 1F 200MG+F 3ML . . . . . 77 184 Nome commerciale TAUTUX*OS GTT 30ML 6% . . . . . . . . . . . TAVOR*20CPR 1MG . . . . . . . . . . . . . . . . . TAVOR*20CPR 2,5MG . . . . . . . . . . . . . . . TAVOR*INIET 5F 1ML 4MG/ML . . . . . . . . TAXIME*EV 1FL 2G+F 10ML 2G/10M . . . TAXIME*IM EV 1FL 1G+F 4ML . . . . . . . . . TAXOTERE*INFUS FL 20MG/0,5ML+F . . . TAXOTERE*INFUS FL 80MG/2ML+F . . . . TAZOCIN*EV 1FL 4G+0,500G . . . . . . . . . . TAZOCIN*IM 1FL 2G+0,25G/4ML+F. . . . . TEFAMIN*IV 5F 10ML 240MG/10ML . . . . TEGRETOL CR*30CPR 200MG R.C. . . . . . TEGRETOL CR*30CPR 400MG R.C. . . . . . TEGRETOL*BB SCIR FL 250ML20MG/ . . . TELZIR*1FL 60CPR RIV 700MG . . . . . . . . TEMGESIC*IM IV 5F 1ML 0,3MG . . . . . . . TEMODAL*1FL 5CPS 100MG . . . . . . . . . . TEMODAL*1FL 5CPS 20MG . . . . . . . . . . . TEMODAL*1FL 5CPS 250MG . . . . . . . . . . TERBINAFINA TEVA*8CPR 250MG OP . . . TESTOVIS*IM 2F 2ML 100MG . . . . . . . . . THAMESOL*FLEBO FL 250ML 3,6% . . . . THIOGUANINE*25CPR 40MG . . . . . . . . . . THIOPLEX*INIET 1F 15MG . . . . . . . . . . . . THYMOGLOBULINE*1F 25MG+1F 5ML . . THYROGEN*IM 2F 0,9MG. . . . . . . . . . . . . TIKLID*30CPR RIV 250MG . . . . . . . . . . . . TILADE*AEROSOL 36F 2ML 10MG. . . . . . TILADE*SOSP PRESS INAL 2MG 112. . . . TISSUCOL*ADESIVO TISS.2SIR 1ML . . . . TISSUCOL*ADESIVO TISS.2SIR 2ML . . . . TOBI*56F MONODOSE 300MG/5ML . . . . TOBRAL*COLL 5ML 0,3% . . . . . . . . . . . . TOBRAL*UNG OFT 0,3% . . . . . . . . . . . . . TOFRANIL*50CPR RIV 25MG . . . . . . . . . . TOLEP*50CPR DIV 300MG . . . . . . . . . . . . TOLEP*50CPR DIV 600MG . . . . . . . . . . . . TOPAMAX*60CPR RIV 100MG . . . . . . . . . TOPAMAX*60CPR RIV 200MG . . . . . . . . . TOPAMAX*60CPR RIV 25MG . . . . . . . . . . TOPAMAX*60CPR RIV 50MG . . . . . . . . . . TOPSTER*RETT SOSP 7FL 60ML+CAN . . TORVAST*30CPR 10MG . . . . . . . . . . . . . . TORVAST*30CPR 20MG . . . . . . . . . . . . . . pag 130 119 119 119 72 72 92 92 71 71 130 113 113 113 81 110 90 90 90 56 61 43 91 89 100 140 36 130 130 38 38 75 132 132 120 113 113 114 114 114 114 29 55 55 Commissione provinciale del Farmaco Bologna Nome commerciale pag TORVAST*30CPR 40MG . . . . . . . . . . . . . . 55 TPH*IV FL 250ML 6% . . . . . . . . . . . . . . . . 41 TRACLEER*56CPR RIV 125MG . . . . . . . . . 50 TRACLEER*56CPR RIV 62,5MG . . . . . . . . . 50 TRACTOCILE*EV 1FL 7,5MG/ML 0,9 . . . . . 61 TRACTOCILE*EV 1FL 7,5MG/ML 5ML. . . . 61 TRANDATE*IV 1F 20ML 5MG/ML . . . . . . . 52 TRANEX*30CPS 500MG. . . . . . . . . . . . . . . 38 TRANSTEC*3CER 20MG 35MCG/H . . . . . . 110 TRANSTEC*3CER 30MG 52,5MCG/H . . . . 110 TRAVATAN*GTT OFT 1FL 40MCG/ML . . . . 135 TRH UBC 200 MCG F . . . . . . . . . . . . . . . . . 140 TRIACORT*INIET 3FL 40MG/1ML . . . . . . . 68 TRIASPORIN*OS FL 150ML 10MG/ML . . . 78 TRILAFON ENANTATO*IM 1ML 100MG. . . 116 TRILAFON*20CPR RIV 4MG. . . . . . . . . . . . 116 TRILAFON*20CPR RIV 8MG. . . . . . . . . . . . 116 TRIMETON*20CPR 4MG . . . . . . . . . . . . . . 131 TRIMETON*INIET 5F 1ML 10MG . . . . . . . . 131 TRITTICO*20CPR DIV 150MG R.P. . . . . . . 122 TRITTICO*30CPR DIV 100MG . . . . . . . . . . 122 TRITTICO*30CPR DIV 50MG . . . . . . . . . . . 122 TRITTICO*30CPR DIV 75MG R.P . . . . . . . . 122 TRITTICO*INIETT 3F 5ML 50MG/ML . . . . . 122 TRITTICO*OS GTT 30ML 2,5% . . . . . . . . . 122 TRIZIVIR*BLIST 60CPR RIV . . . . . . . . . . . . 83 TROPIMIL*COLL 5ML 0,5%. . . . . . . . . . . . 135 TROPIMIL*COLL 5MONODOSE 0,5ML . . . 135 TRUSOPT*OFT FL 5ML 2% OCUMETER . . 134 TRUVADA*30CPR RIV 200MG/245MG . . . 83 TWICE*16CPS 100MG R.P. . . . . . . . . . . . . 110 TWICE*16CPS 10MG R.P. . . . . . . . . . . . . . 110 TWICE*16CPS 30MG R.P. . . . . . . . . . . . . . 110 TWICE*16CPS 60MG R.P. . . . . . . . . . . . . . 110 TWINRIX ADULTI*IM SIR 20MCG/ML . . . . 87 TWINRIX PEDIATRICO*IM 1SIR+2AG. . . . . 87 TYPHIM Vi*INIET 1SIR 0,5ML . . . . . . . . . . 86 UGUROL*IM IV OS 5F 5ML 500MG . . . . . . 38 ULTIVA*IV 5FL 1MG. . . . . . . . . . . . . . . . . . 107 ULTIVA*IV 5FL 2MG. . . . . . . . . . . . . . . . . . 107 ULTIVA*IV 5FL 5MG. . . . . . . . . . . . . . . . . . 107 ULTRAPROCT*UNG RETT 30G. . . . . . . . . . 51 UMANALBUMIN*INF FL 50ML 200G/L . . . 41 UMANCOMPLEX D.I.*FL 500UI+F20M . . . 38 Nome commerciale pag UNASYN*EV 1FL 1G+2G . . . . . . . . . . . . . . 71 UNASYN*EV 1FL 1G+500MG/3,2ML+F . . . 71 UNIPRIL*14CPR 5MG. . . . . . . . . . . . . . . . . 54 UNIPRIL*28CPR 2,5MG . . . . . . . . . . . . . . . 54 URACTONE*10CPR 100MG . . . . . . . . . . . . 51 URBASON*IM EV 1F 250MG+1F 5ML . . . . 67 URBASON*IM EV 3F 20MG+3F 1ML . . . . . 68 URODIE*14CPR DIV 5MG. . . . . . . . . . . . . . 64 UROKINASI PH&T*FL 100000UI+F . . . . . . 37 UROMITEXAN*IV 15F 4ML 400MG/4M . . . 138 URSACOL*40CPR 50MG . . . . . . . . . . . . . . 26 URSOBIL HT*20CPS 450MG R.C. . . . . . . . 26 URSOBIL*20CPR 300MG . . . . . . . . . . . . . . 26 UTICINA*14CPR RIV 400MG . . . . . . . . . . . 76 VAGILEN*10 OVULI VAG 500MG . . . . . . . . 60 VAGILEN*20CPS 250MG . . . . . . . . . . . . . . 125 VALCYTE*60CPR RIV 450MG . . . . . . . . . . 80 VANCOMICINA IBP P.*EV OS 1G . . . . . . . . 76 VANCOMICINA IBP P.*EV OS 500MG . . . . 77 VARILRIX*SC 1FL 1D+SIR 0,5ML. . . . . . . . 87 VARITECT*IV 1F 20ML 500UI. . . . . . . . . . . 84 VARITECT*IV 1F 5ML 125UI. . . . . . . . . . . . 84 VARITECT*IV 1FL 50ML 1250UI. . . . . . . . . 84 VATRAN*25CPR DIV 2MG . . . . . . . . . . . . . 119 VATRAN*25CPR DIV 5MG . . . . . . . . . . . . . 119 VAXIGRIP*1SIR 0,5ML 2006-2007. . . . . . . 86 VELAMOX*12CPR DISP 1G . . . . . . . . . . . . 70 VELAMOX*12CPS 500MG . . . . . . . . . . . . . 70 VELBE*EV 1FL 10MG . . . . . . . . . . . . . . . . . 91 VELCADE*INIET 1FL 3,5MG 1MG/ML . . . . 96 VEPESID*EV 1FL 100MG/5ML . . . . . . . . . . 92 VERAPAMIL ANG.*30CPR RIV 80MG. . . . . 53 VERMOX 500*30CPR 500MG. . . . . . . . . . . 126 VERMOX*6CPR 100MG . . . . . . . . . . . . . . . 126 VERMOX*OS SOSP 20MG/ML 30ML. . . . . 126 VESANOID*FL 100CPS 10MG . . . . . . . . . . 95 VFEND*28CPR RIV 200MG . . . . . . . . . . . . 78 VFEND*28CPR RIV 50MG . . . . . . . . . . . . . 78 VFEND*INF EV FL 200MG . . . . . . . . . . . . . 78 VIAGRA*8CPR 50MG . . . . . . . . . . . . . . . . . 63 VIDEX*30CPS GASTR 125MG . . . . . . . . . . 81 VIDEX*30CPS GASTR 200MG . . . . . . . . . . 81 VIDEX*30CPS GASTR 250MG . . . . . . . . . . 81 VIDEX*30CPS GASTR 400MG . . . . . . . . . . 81 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 185 Nome commerciale pag VIDEX*OS POLVxSOL 1FL 4G . . . . . . . . . . 82 VINCRISTINA PFIZER*1FL 1MG 1ML . . . . . 92 VIRAMUNE*60CPR 200MG . . . . . . . . . . . . 82 VIRAMUNE*OS SOSP FL240ML 50MG/. . . 83 VIREAD*30CPR 245MG . . . . . . . . . . . . . . . 82 VISIPAQUE*270MG I/ML FL 100ML. . . . . . 142 VISIPAQUE*270MG I/ML FL 200ML. . . . . . 142 VISIPAQUE*270MG I/ML FL 20ML. . . . . . . 142 VISIPAQUE*270MG I/ML FL 500ML. . . . . . 142 VISIPAQUE*270MG I/ML FL 50ML. . . . . . . 142 VISTIDE*IV INFUS 1F 375MG 5ML. . . . . . . 80 VISUDYNE*INFUS 1FL 15MG 10ML. . . . . . 136 VISUMIDRIATIC FENIL.*COLL 10ML . . . . . 135 VISUMIDRIATIC*COLL 10ML 1%. . . . . . . . 135 VIT.B1 SALF*IM 3F 100MG 2ML . . . . . . . . 33 VIT.C BIL*INIET 10F 500MG/5ML . . . . . . . 33 VIT.PP ANGELINI*IM 6F 100MG. . . . . . . . . 33 VITALIPID*AD INFUS 10F 10ML. . . . . . . . . 45 VITALIPID*BB INFUS 10F 10ML. . . . . . . . . 45 VIVOTIF*3CPS 200MG 2000MILIONI . . . . . 86 VOLTAREN OFTA*COLL 30FL0,1%0,3 . . . . 133 VOLUVEN*INFUS 15SA 500ML 6% . . . . . . 41 VUMON*INFUS 1F 50MG/5ML. . . . . . . . . . 92 WELLVONE*OS SOSP FL 240ML . . . . . . . . 125 XALACOM*GTT OFT 1FL 2,5ML. . . . . . . . . 134 XALATAN*GTT OFT 1FL 0,005% 2,5 . . . . . 134 XANAX*20CPR 0,25MG . . . . . . . . . . . . . . . 120 XANAX*20CPR 0,50MG . . . . . . . . . . . . . . . 120 XANAX*20CPR 1MG. . . . . . . . . . . . . . . . . . 120 XANAX*OS GTT FL 20ML 0,75MG/ML. . . . 120 XELODA*120CPR RIV 500MG . . . . . . . . . . 91 XELODA*60CPR RIV 150MG . . . . . . . . . . . 91 XENETIX 350*FL 100ML 350MG/ML . . . . . 143 XENETIX 350*FL 150ML 350MG/ML . . . . . 143 XENETIX 350*FL 200ML 350MG/ML . . . . . 143 XENETIX 350*FL 500ML 350MG/ML . . . . . 143 XENETIX 350*FL 50ML 350MG/ML . . . . . . 143 XENETIX*FL 60ML300MG/ML+SIR+CA . . . 143 XEREDIEN*28CPR SOLUB 20MG . . . . . . . . 121 XIGRIS*IV FL 20MG POLV 2MG/ML. . . . . . 37 XIGRIS*IV FL 5MG POLV 2MG/ML. . . . . . . 37 XPREP*SCIR TAPPOSERB 75ML150MG . . 27 ZANOSAR G 1 FIALE . . . . . . . . . . . . . . . . . . 90 ZANTAC*SCIR 200ML 150MG/10ML . . . . . 24 186 Nome commerciale ZARONTIN*SCIR 200ML 250MG/5ML . . . ZAROXOLYN*50CPR 10MG . . . . . . . . . . . ZAROXOLYN*50CPR 5MG . . . . . . . . . . . . ZAVEDOS*EV 1FL 10MG 10ML . . . . . . . . ZAVEDOS*EV 1FL 5MG+F SOLV 5ML . . . ZEFFIX*28CPR RIV 100MG. . . . . . . . . . . . ZEFFIX*OS FL 240ML 5MG/ML . . . . . . . . ZEMPLAR*5F 1ML 5MCG/ML . . . . . . . . . ZENAPAX*IV 1FL 5ML 5MG/ML . . . . . . . . ZENTEL*3CPR 400MG . . . . . . . . . . . . . . . ZERIT*56CPS 15MG . . . . . . . . . . . . . . . . . ZERIT*56CPS 20MG . . . . . . . . . . . . . . . . . ZERIT*56CPS 30MG . . . . . . . . . . . . . . . . . ZERIT*56CPS 40MG . . . . . . . . . . . . . . . . . ZESTRIL 20*14CPR 20MG . . . . . . . . . . . . ZESTRIL 5*14CPR 5MG . . . . . . . . . . . . . . ZETAMICIN 100*IM IV F 100MG/ML . . . . ZETAMICIN 15*IM IV F 15MG/1,5M . . . . . ZETAMICIN 150*IM IV F150MG/1,5 . . . . . ZETAMICIN 300*IM IV F 300MG/3M . . . . ZETAMICIN 50*IM IV F 1ML 50MG/ . . . . . ZEVALIN*INFUS 1F 3ML 1,6MG/ML . . . . ZIAGEN*6BLISTER 10CPR 300MG . . . . . . ZIMOX*OS POLVxSOSP FL 250MG/5M . . ZITROMAX*EV 1FL 500MG POLV. . . . . . . ZOFRAN*6CPR 8MG . . . . . . . . . . . . . . . . . ZOFRAN*IM IV 1F 4ML 8MG . . . . . . . . . . ZOLADEX 10,8*SC SIR DEPOT 10,8 . . . . . ZOLADEX 3,6*SC 1SIR DEPOT 3,6M . . . . ZOLOFT*30CPR RIV 100MG . . . . . . . . . . . ZOLOFT*30CPR RIV 50MG . . . . . . . . . . . . ZOMETA*IV 1FL 4MG+1F 5ML SOLV . . . . ZOVIRAX OFTALMICO*UNG 4,5G 3% . . . ZOVIRAX*CREMA 10G 5% . . . . . . . . . . . . ZOVIRAX*INIET 5FL 500MG . . . . . . . . . . . ZYPREXA VELOTAB*28CPR 10MG . . . . . . ZYPREXA VELOTAB*28CPR 5MG . . . . . . . ZYPREXA*28CPR RIV 10MG. . . . . . . . . . . ZYPREXA*28CPR RIV 2,5MG . . . . . . . . . . ZYPREXA*28CPR RIV 5MG. . . . . . . . . . . . ZYPREXA*IM 1FL 10MG . . . . . . . . . . . . . . ZYVOXID*10CPR RIV 600MG BLIST. . . . . ZYVOXID*10SACCHE INF 2MG/ML . . . . . pag 112 50 50 93 93 82 82 33 101 126 82 82 82 82 54 54 75 76 75 76 76 145 82 70 75 26 26 96 97 121 121 106 132 57 80 118 118 117 117 117 118 77 77 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – REGOLAMENTO DELLA COMMISSIONE PROVINCIALE DEL FARMACO 1. PREMESSA Le Aziende Sanitarie del territorio della provincia di Bologna intendono perseguire le potenzialità di buon uso delle risorse in ambito farmaceutico e terapeutico implementando sia la promozione dell’appropriatezza, sia l’adozione di modalità organizzative efficienti ed efficaci anche da un punto di vista economico-finanziario. L’istituzione di una Commissione di ambito provinciale ha consentito la condivisione di metodi, strumenti per la valutazione dei farmaci e la elaborazione di un unico Prontuario Terapeutico Provinciale (PTP) attualmente in uso nelle Strutture delle AUSL di Bologna e Imola, dell’Azienda ospedaliero-universitaria S. Orsola - Malpighi e dell’Istituto di ricovero e cura a carattere scientifico Rizzoli. Inoltre la continua promozione di un uso appropriato dei farmaci facilita il potenziale risparmio di risorse, realizzabile anche attraverso le unioni d’acquisto e la gestione centralizzata della distribuzione/approvvigionamento di beni sanitari. La Regione Emilia-Romagna, con Delibera di Giunta n. 1540 del 06.11. 2006 riconosce la necessità di innovare il sistema esistente e disegnare un nuovo assetto favorendo l’uniformità a livello regionale delle scelte attinenti l’uso dei farmaci, a tutela dell’equità del servizio reso ai cittadini. In particolare viene ridefinito il ruolo del Prontuario Terapeutico Regionale (PTR), dei Prontuari Terapeutici Provinciali ed i compiti affidati alle Commissioni preposte al loro aggiornamento. Il presente regolamento che disciplina il funzionamento della Commissione Provinciale del Farmaco (CPF), formalizza obiettivi, funzioni e procedure operative per lo svolgimento delle proprie attività, è approvato dalla (CPF) nella seduta del 15 febbraio 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 187 REGOLAMENTO OBIETTIVI GENERALI E SPECIFICI Obiettivo generale della Commissione è quello di assicurare l’applicazione di quanto indicato nel documento condiviso dalle Direzioni Generali e Sanitarie delle Aziende sanitarie della provincia. Il documento assunto con delibera dalle Aziende Sanitarie stesse definisce ruolo, mandato, struttura, regole di funzionamento e relazioni della Commissione Provinciale del Farmaco delle Aziende Sanitarie di Bologna alla luce del nuovo quadro normativo regionale (DG n. 1540) coerentemente a quanto indicato nei provvedimenti normativi nazionali in tema di governo clinico ed economico finanziario (L. Finanziaria 2007), secondo i principi guida dell’appropriatezza, efficacia e sicurezza d’uso dei farmaci introdotti con la legge 502/92 e riproposti nei PSN 2006-2008 e PSR vigente. È altresì obiettivo strategico e generale della Commissione, definire modalità e tempi per garantire la massima diffusione delle informazioni e delle decisioni assunte dalla Commissione presso i professionisti sanitari. L’ambito di competenza riguarda: – farmaci registrati in Italia e relative indicazioni; – farmaci non registrati in Italia, ma registrati all’estero; – farmaci richiesti per indicazioni terapeutiche non autorizzate né in Italia né all’estero, il cui impiego è disciplinato da normativa nazionale, regionale e da procedure condivise in ambito provinciale. Le funzioni della Commissione possono essere suddivise nei seguenti capitoli di attività. • PRONTUARIO TERAPEUTICO ELABORAZIONE E COSTANTE AGGIORNAMENTO DEL PRONTUARIO TERAPEUTICO PROVINCIALE (PTP) RISPETTO A QUELLO REGIONALE (PTR). La CPF provvede alla formulazione e all’aggiornamento del PTP, espressione delle esigenze e delle scelte aziendali effettuate all’interno e nei limiti dei farmaci contenuti nel PTR. 188 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – Il Prontuario terapeutico provinciale (PTP) è costituito da: – un elenco di principi attivi selezionati a partire dal PTR – informazioni, indicazioni, limitazioni già presenti nel PTR – eventuali documenti o limitazioni aggiuntive elaborati a livello locale. La scelta dei farmaci nella costruzione ed aggiornamento del Prontuario deve essere effettuata nel rispetto dei seguenti criteri e principi fondamentali: a. valutazione delle esigenze locali, b. selezione di un più ristretto numero dei farmaci tra quelli proposti in equivalenza sulla base degli studi clinici disponibili, con particolare riguardo a quelli di confronto diretto, e con end-point clinicamente rilevanti c. collocazione in terapia del farmaco in esame rispetto al trattamento di riferimento per le indicazioni in uso. d. valutazione dell’impatto economico dell’inserimento di nuovi farmaci in PTP, rispetto alle patologie da trattare ed ai volumi di impiego previsti, L’aggiornamento può prevedere l’esclusione o sostituzione di principi attivi già presenti in Prontuario, in ottemperanza a normative cogenti, raccomandazioni sulla sicurezza, significativa riduzione dell’uso nella pratica clinica. VALUTAZIONE DELLE RICHIESTE ESTEMPORANEE DI PRINCIPI ATTIVI NON INCLUSI IN PRONTUARIO PROVINCIALE E/O NON INCLUSI NEL PRONTUARIO REGIONALE, PER I QUALI LA CRF NON SI È ANCORA ESPRESSA AI FINI DELLA LORO EVENTUALE EROGAZIONE Si precisa al riguardo che: • gli usi dei medicinali in deroga al PTP e/o al PTR, devono essere limitati a casi clinici eccezionali e motivati dalla indisponibilità di una alternativa farmacologica di pari efficacia atta a garantire la continuità terapeutica, nell’ambito degli indirizzi formulati dalla CRF, con particolare riferimento alle terapie già in corso al momento del ricovero con farmaci giudicati non sostituibili e/o non Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 189 REGOLAMENTO sospendibili con analoghi presenti in Prontuario, secondo le valutazioni del Medico che formula la richiesta,. • in caso di richiesta alla farmacia di un medicinale non inserito in PTR per il quale la CRF non si è ancora espressa, se la richiesta è giudicata urgente, irrinunciabile e non dilazionabile dal clinico prescrittore la farmacia fornirà il farmaco e ne informerà la CPF; in tutti gli altri casi la farmacia inoltrerà la richiesta alla CPF che provvederà a valutarla e in caso di differimento del parere da parte della CRF, formulerà un pre-parere che inoltrerà alla Commissione Regionale. Le richieste di farmaci non inclusi in PTP e/o in PTR dovranno essere formulate su apposito modulo e l’andamento di tali prescrizioni sarà periodicamente monitorato. VALUTAZIONE DELLE RICHIESTE DI INSERIMENTO DI MEDICINALI NEL PTP RISPETTO AI QUALI LA CRF SI È ESPRESSA NEGATIVAMENTE La CPF può provvedere, su richiesta di uno o più clinici, alla valutazione di richieste di farmaci rispetto ai quali la CRF si è espressa negativamente. Se la Commissione riterrà che la richiesta sia supportata da prove di efficacia che ne individuano un ruolo in terapia rispetto al trattamento di riferimento potrà decidere di inviare una richiesta motivata di inserimento nel Prontuario Terapeutico Regionale alla CRF. PRESCRIZIONE DI FARMACI “OFF-LABEL” Compete alla CPF anche la valutazione di prescrizioni al di fuori delle indicazioni terapeutiche e/o della posologia e/o del dosaggio e/ o della via di somministrazione indicate in scheda tecnica, da effettuarsi in conformità alle disposizioni emanate in materia dalla RER. VALUTAZIONE RICHIESTE DI FARMACI DI FASCIA C (SSN) La CPF può esprimere un parere tecnico circa l’opportunità/necessità di procedere all’erogazione gratuita di farmaci in classe C in caso di istanza da parte di assistiti non ricoverati nelle strutture ospe- 190 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – daliere laddove venga presentata adeguata documentazione che ne supporti l’uso in specifiche situazioni cliniche. • METODOLOGIA La presentazione delle richieste di inserimento in Prontuario (sia provinciale sia regionale) deve essere effettuata esclusivamente dai clinici su apposita modulistica, unica a livello provinciale (ALL. 3), corredata di idonea documentazione di supporto . La CPF valuterà la richiesta secondo i criteri di seguito specificati: a. ANALISI DELLA LETTERATURA SCIENTIFICA relativamente a prove di efficacia clinica e sicurezza, attraverso la selezione dei principali studi disponibili di buona qualità metodologica e di numerosità adeguata; b. OPPORTUNITÀ DI UNA VALUTAZIONE IN EQUIVALENZA TERAPEUTICA nell’ambito di categorie terapeutiche omogenee, da effettuate attraverso l’attivazione di appositi gruppi di lavoro. La richiesta di inserimento in prontuario di un farmaco appartenente alla stessa classe omogenea per la quale è già stata fatta una equivalenza terapeutica dovrà tenere conto dell’equivalenza terapeutica esistente; c. VALUTAZIONE DI NUOVE MOLECOLE APPARTENENTI A CATEGORIE TERAPEUTICHE GIÀ RAPPRESENTATE IN PRONTUARIO dovrà essere motivata alla CPF sulla base di studi che dimostrino vantaggi significativi in termini di: – maggiore efficacia/sicurezza rispetto ai farmaci già presenti in PTP o – siano stati studiati in particolari tipologie di pazienti, o – presentino documentata innovatività terapeutica. L’uso clinico potrà di conseguenza essere limitato, anche attraverso RMP, ad indicazioni specifiche o a particolari categorie di pazienti; d. VALUTAZIONI ECONOMICHE: a parità di i efficacia clinica e di sicurezza si terra conto del minor costo per ciclo terapeutico. La Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 191 REGOLAMENTO valutazione economica per l’inserimento in prontuario di un medicinale che interessa patologie croniche dovrà considerare oltre agli elementi citati anche l’impatto che tale scelta potrebbe avere sulla prescrizione/spesa territoriale e. ASPETTI NORMATIVI relativamente a classe di rimborsabilità SSN, vincoli prescrittivi (note AIFA, Piano Terapeutico, normativa stupefacenti), restrizioni/indicazioni particolari impartite dalla Commissione Regionale del Farmaco; MONITORAGGIO DELL’ANDAMENTO DEI CONSUMI, VIGILANZA SUL RISPETTO DEL PTP IN AMBITO PROVINCIALE La CPF svolge attività di vigilanza sul rispetto del PTP in ambito provinciale attraverso l’analisi dei consumi di farmaci extra-prontuario oltre ad un periodico monitoraggio della prescrizione sia Ospedaliera sia Territoriale rispetto ai nuovi farmaci inseriti in PTP. Inoltre, avvalendosi della collaborazione degli specialisti operanti presso le diverse Aziende, definisce i criteri per l’uso appropriato di alcuni farmaci/categorie di farmaci cui si correlano particolari livelli di criticità di impiego in termini di sicurezza, elevato costo, rischio di inappropriatezza, formulando anche una stima del numero di pazienti candidati al trattamento. In relazione all’applicazione dei criteri di selezione della casistica da trattare e delle stime formulati, la CPF esegue un costante monitoraggio dell’impiego dei farmaci citati attraverso la produzione periodica di rapporti che pongano in evidenza i locali ambiti di utilizzo ed il confronto con raccomandazioni e/o indirizzi regionali laddove esistenti. DIALOGO CON LE DIREZIONI AZIENDALI E CON LA CRF SUI RISULTATI DELLE ATTIVITÀ Per favorire l’esame e il confronto sull’andamento dei consumi dei farmaci nel rispetto delle scelte operate, la CPF elabora periodicamente una relazione sull’uso dei farmaci in ambito provinciale, da trasmettere alle Direzioni Aziendali e alla CRF. 192 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – Le analisi contenute devono consentire confronti e valutazioni non solo in termini di spesa ma anche di intensità d’uso dei gruppi terapeutici e/o delle singole sostanze, permettendo altresì di evidenziare i principali fattori che determinano la eventuale variabilità nella prescrizione sia tra le Aziende Sanitarie della provincia rispetto al PTP sia tra queste e le Aziende regionali, rispetto al PTR. DIFFUSIONE DELLE INFORMAZIONI SUI TEMI DI PERTINENZA Il PTP viene pubblicato e reso consultabile in formato cartaceo e/ o informatico in tutte le Aziende sanitarie della Provincia di Bologna. Nell’ottica del rispetto della trasparenza, i documenti che riportano le decisioni assunte dalla CPF (verbali ed altra documentazione) sono resi disponibili per la consultazione a tutto il personale delle Aziende Sanitarie rappresentate in Commissione. La CPF può inoltre favorire la diffusione delle informazioni attraverso seminari di approfondimento da lei stessa organizzati o attraverso la partecipazione ad eventi aziendali. • INDIVIDUAZIONE DEL RUOLO IN TERAPIA DEI NUOVI FARMACI RISPETTO ALL’INTERA CLASSE TERAPEUTICA, DEFINIZIONE DI EVENTUALI RACCOMANDAZIONI D’USO La CPF definisce un piano di lavoro annuale allo scopo di individuare gli argomenti di terapia che in seguito alla disponibilità di nuovi principi attivi necessitano di una rivalutazione del ruolo che ogni farmaco può assumere nell’ambito della classe; a tale scopo la CPF deciderà se procedere alla elaborazione di una vera e propria linea guida piuttosto che a raccomandazioni d’uso o a semplici schede di monitoraggio . Le priorità di lavoro saranno definite sulla base delle caratteristiche innovative dei nuovi principi attivi introdotti in prontuario, e delle criticità d’uso previste. Una volta definiti gli argomenti su cui lavorare alla Commissione Provinciale del Farmaco compete la nomina del gruppo di lavoro in- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 193 REGOLAMENTO terdisciplinare che produrrà il documento e la validazione delle eventuali raccomandazioni prodotte. Le decisioni assunte e le relative valutazioni d’impatto clinico ed organizzativo saranno periodicamente presentate ai collegi di direzione delle Aziende Sanitarie. La CPF garantisce il supporto metodologico ed organizzativo necessario allo svolgimento delle attività e programma un monitoraggio periodico dell’aderenza alle schede di monitoraggio proposte dalla CRF, alle eventuali raccomandazioni/linee guida adottate, la CPF adotta specifici standard di analisi della prescrizione di farmaci sia in ambito ospedaliero che in ambito territoriale. • FARMACOVIGILANZA E GESTIONE DEL RISCHIO CLINICO La CPF sviluppa attività in tema di Farmacovigilanza, attraverso la raccolta e diffusione di informazioni utili all’aggiornamento relativo al beneficio/rischio degli interventi farmacologici. Con particolare riferimento al rischio di determinate aree terapeutiche, i responsabili aziendali di farmacovigilanza provvedono a trasmettere alla CPF informazioni utili per raccogliere, codificare e interpretare i segnali e gli eventi avversi legati all’utilizzo dei medicinali 194 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – 2. COMPOSIZIONE La Commissione è composta da farmacisti, medici referenti di varie discipline e un rappresentante del Servizio assistenziale tecnico e riabilitativo, con competenze nell’ambito della Medicina Basata sulle Evidenze scientifiche, e rappresenta in maniera equilibrata tutte le Aziende Sanitarie per le quali opera, tenuto conto del contesto assistenziale specifico di ognuna. La Commissione si avvale di un Ufficio di Segreteria dotato di adeguate risorse di personale, strutture e strumenti informatici anche per effettuare le opportune ricerche bibliografiche e per l’archiviazione degli atti. L ’Ufficio di Segreteria ha sede presso: Dipartimento Assistenza Farmaceutica AUSL di Bologna Via Gramsci, 12 – Bologna Referente: Dott. ssa Elisabetta Pasi. Tel.: 051/6079919 - Fax: 051/6079628 e-mail: [email protected] • PROCEDURA DI NOMINA E COMPITI Il Presidente è nominato dai Direttori Generali delle Aziende sanitarie rappresentate in Commissione. Il Vicepresidente è scelto dal Presidente nell’ambito dei Componenti la Segreteria Scientifica I Componenti della Commissione sono proposti dai Direttori Sanitari delle singole Aziende. La nomina a Componente non prevede possibilità di sostituzione con delega ad altri colleghi in caso di impossibilità a partecipare alle riunioni della Commissione. Le assenze devono essere giustificate in forma scritta (fax, mail, posta), comunicate alla Segreteria almeno tre giorni prima della riunione. Nel caso in cui lo stesso Componente sia designato a relazionare su di uno specifico tema, deve comunque, negli stessi tempi, inol- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 195 REGOLAMENTO trare alla Segreteria una propria relazione scritta, per consentire alla Segreteria di presentarla nella seduta plenaria. In caso di assenze non giustificate reiterate o di dimissione spontanea di un Componente viene inviata formale comunicazione al Direttore Sanitario dell’Azienda di appartenenza al fine di una eventuale sostituzione. La Segreteria Scientifica è composta da: • Presidente (Prof. B. Magnani) • Vicepresidente (Prof. D. Festi) • 1 farmacologo CeVEAS • 4 medici ospedalieri • 1 medico di medicina generale • 1 medico di direzione sanitaria • 3 farmacisti La composizione della Segreteria è proposta dai Direttori Sanitari e si avvale di un supporto esterno per la ricerca documentale necessaria alla predisposizione dell’istruttoria. Qualora se ne ravveda la necessità la Segreteria può avvalersi della consulenza di esperti su argomenti specifici. Compiti del Presidente: • Convoca le sedute secondo il calendario stabilito, ne definisce l’ordine del giorno e le presiede; • Convoca eventuali sedute straordinarie; • Coordina i lavori della Segreteria Scientifica; • Richiede di concerto con la Segreteria Scientifica il parere di esperti su argomenti specifici da trattare. Compiti del vicepresidente • Sostituisce il Presidente in tutte le funzioni in caso di suo impedimento. Compiti della segreteria scientifica: • Si riunisce almeno 10-20 gg prima della data di convocazione; 196 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – • Riceve ed esamina le richieste di inserimento di nuovi farmaci e/o le richieste di parere su altri medicinali pervenute alla Commissione; • Pianifica e valuta le priorità degli argomenti da trattare; • Programma e suddivide gli argomenti tra i componenti della Segreteria; • Analizza le richieste di inserimento di nuovi farmaci e/o le richieste di parere su altri medicinali attraverso una ricerca sistematica, ed una valutazione degli studi clinici (pubblicati e non pubblicati) in chiave di medicina basata sulle prove di efficacia, delle quantità delle informazioni disponibili in letteratura; • Predispone le relazioni sugli argomenti da discutere in riunione plenaria condividendone i contenuti nella riunione che precede la plenaria; • Può supportare le attività dei gruppi di lavoro nominati dalla commissione per la definizione di linee-guida, raccomandazioni e schede di monitoraggio; • Redige i verbali degli incontri e recepisce eventuali modifiche al fine della loro formale approvazione; • Invia ai Componenti i verbali e la documentazione relativa all’o.d.g. in anticipo di una settimana rispetto alla riunione successiva; • Invia a nome della Commissione ai richiedenti e per conoscenza ai Servizi Farmaceutici delle Aziende Sanitarie di riferimento, le risposte in merito ai quesiti pervenuti; • Provvede alla diffusione e/o pubblicazione dei documenti approvati dalla Commissione; • Predispone per sottoporle alla approvazione della Commissione le Istruzioni Operative, la modulistica e qualsiasi altra documentazione al fine di ottemperare a tutte le funzioni affidate alla Commissione stessa. • Coordina le attività di monitoraggio sull’andamento dei consumi e di analisi dei consumi extra-prontuario, di vigilanza sul rispetto del PTP e di adesione a Linee-guida, raccomandazioni, protocolli e quant’altro adottato in ambito provinciale. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 197 REGOLAMENTO • Elabora periodicamente una relazione sull’uso dei farmaci in ambito provinciale, da trasmettere alle Direzioni Aziendali e alla CRF. • Assicura l’aggiornamento del sito Intranet/Internet dedicato alla CPF. • Protocolla, archivia e conserva per almeno due anni, tutta la documentazione in arrivo alla Segreteria Scientifica nonché quella prodotta per l’emissione di un parere. Dichiarazione di insussistenza di cause ostative alla nomina e di situazioni di incompatibilità Tutti i Componenti della Commissione, al momento dell’accettazione dell’incarico, devono rilasciare una dichiarazione scritta riguardo all’eventuale presenza di condizioni di conflitto di interesse e/o per le quali possa sussistere una cointeressenza di tipo economico con aziende del settore farmaceutico. Tale dichiarazione dovrà essere presentata anche in caso di condizioni che si realizzino successivamente alla nomina. • FUNZIONAMENTO La Commissione si riunisce di norma una volta al mese (tranne il mese di agosto) secondo un calendario definito annualmente. Il Presidente ha facoltà di convocare incontri straordinari qualora ne ravvisi la necessità. Affinchè le riunioni siano ritenute valide, devono essere presenti la metà più uno dei Componenti includendo nel computo del numero legale gli assenti giustificati. Le decisioni sono assunte dai presenti con votazione a maggioranza assoluta (50%+1). In caso di parità, il voto del Presidente vale il doppio. Nel caso in cui la decisione riguardi una disciplina pluri-rappresentata in CTP (Direzione Medica, Cardiologia, Medicina interna, Medicina Generale, Oncologia, Rianimazione-Anestesia, Servizio Farmaceutico, Gastroenterologia, Nefrologia), ai fini della discussione e di un’eventuale votazione, è necessaria, la presenza di almeno un componente della disciplina interessata. In caso contrario la discussione potrà essere affrontata senza però addivenire alla decisione finale. 198 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – Le richieste di inserimento di nuovi farmaci e/o eventuali pareri su altri medicinali sono formulate dal personale medico delle Aziende Sanitarie, su apposita modulistica (ALL. 3). Tali richieste sono inviate alla Segreteria Scientifica e per conoscenza ai singoli Servizi/U.O. di Farmacia dell’Azienda Sanitaria di riferimento. Il Coordinatore della Segreteria Scientifica ne valuta la completezza ed in caso siano necessarie integrazioni/modifiche si fà carico di acquisire dal richiedente le informazioni mancanti e di predisporre la documentazione completa per l’incontro di Segreteria Scientifica. Durante gli incontri di Segreteria si procede ad una pianificazione e valutazione delle priorità degli argomenti da trattare, ad una loro programmazione e ad una suddivisone del lavoro. Al singolo componente viene assegnato un argomento e affidato l’incarico di presentare una relazione in corso di riunione plenaria. Per l’elaborazione di linee-guida, raccomandazioni e protocolli terapeutici, si costituiscono gruppi di lavoro multidisciplinari, la cui composizione viene decisa di volta in volta dalla Commissione in base all’argomento da affrontare. I gruppi possono comprendere professionisti esterni alla Commissione, sono da considerare a termine e per ciascun gruppo va definito un Coordinatore tra i componenti della Commissione. Pareri La Commissione, in sede di riunione plenaria, valuta le proposte di inserimento ed esprime i seguenti pareri che devono essere sempre e comunque motivati: – Inserimento in Prontuario; – Non inserimento; – Inserimento con limitazioni; – Sospensione del parere; – Consenso all’approvvigionamento temporaneo in attesa di acquisire ulteriori elementi di valutazione (deve essere specificato il periodo consentito). – La Commissione discute e approva documenti di indirizzo prescrittivo ( linee guida/ raccomandazioni d’uso/ schede di monito- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 199 REGOLAMENTO raggio) o progetti di valutazione e verifica dell’appropriatezza prescrittivi Norme di incompatibilità I Clinici devono assentarsi al momento della votazione su decisioni relative a farmaci per i quali essi stessi abbiano fatto richiesta di inserimento in Prontuario e/o per i quali possono sussistere altre condizioni di conflitto di interesse diretto o indiretto. 200 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – 3. RAPPORTI DI COLLABORAZIONE E CONDIVISIONE DELLE SCELTE FRA CRF E CPF La CPF mantiene rapporti con la CRF improntati al dialogo ed alla collaborazione in modo tale da permettere la costituzione di un’efficace rete di ambito regionale, all’interno della quale sia ottimizzato l’uso delle risorse disponibili. Tale rete ha lo scopo di evitare la conduzione di valutazioni ed approfondimenti paralleli su tematiche analoghe, e di favorire un sistema all’interno del quale i lavori prodotti dalla CPF possano ricevere il contributo degli altri soggetti della rete ed essere condivisi. In particolare, la CPF si confronta con la CRF in modo tale da concordare i piani di attività che devono essere rispettivamente adottati a cadenza annuale. Per meglio garantire la collaborazione e la condivisione delle scelte con la CRF, il coordinatore della Segreteria della CPF partecipa agli incontri stabiliti dal Coordinamento delle segreterie delle CPF con la CRF anche per la presentazione delle relazioni sulle attività svolte dalla CPF stessa. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 201 REGOLAMENTO 4. RAPPORTI CON ISTITUZIONI, ASSOCIAZIONI IN RAPPRESENTANZA DI CITTADINI, INDUSTRIA FARMACEUTICA Al fine di raggiungere gli obiettivi generali e specifici, la Commissione auspica di intraprendere rapporti di collaborazione sia con altre Commissioni e/o con Uffici Regionali con competenze e obiettivi affini, sia con le Associazioni riconosciute di cittadini-pazienti nel rispetto delle finalità scientifiche e civico-sociali della stessa. I rapporti con l’Industria Farmaceutica sono improntati alla trasparenza e indipendenza scientifica e finalizzati esclusivamente ad ottenere/produrre eventuali informazioni scientifiche integrative rispetto a quanto disponibile e rilevabile in letteratura. I rapporti con le istituzioni, associazioni in rappresentanza di cittadini, industria farmaceutica si realizzano attraverso comunicazioni scritte indirizzate alla Segreteria Scientifica. I Componenti della Commissione sono tenuti a mantenere il riserbo sulle decisioni assunte e sullo stato di avanzamento dei lavori della Commissione fino alla loro diffusione ufficiale. 202 Commissione provinciale del Farmaco Bologna – AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA – 5. NORME FINALI Eventuali modifiche o aggiornamenti potranno essere proposte dal Presidente della Commissione o su richiesta di almeno un terzo (14) dei componenti e dovranno essere approvate a maggioranza. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 203 Richiesta inserimento farmac i CPF Richiesta inserimento farmaci CPF Inviare a: SEGRETERIA SCIENTIFICA DELLA COMMISSIONE PROVINCIALE DEL FARMACO – c/o Dipartimento Assistenza Farmaceutica AUSL di Bologna – Via Gramsci, 12 – Bologna TEL 051/6079919; FAX 051/6079628 SERVIZIO FARMACEUTICO AZIENDA SANITARIA DI RIFERIMENTO AZIENDA SANITARIA _____________________________________________________________ STABILIMENTO OSPEDALIERO____________________________________________________ UNITÀ OPERATIVA___________________ DIPARTIMENTO_____________________________ E-mail________________________________________ Tel.____________________________ o Inserimento nuovo farmaco o Allargamento di indicazione terapeutica registrata/nuova formulazione o Richiesta NON URGENTE per singolo paziente (allegare relazione clinica) FARMACO RICHIESTO (PRINCIPIO ATTIVO) _______________________________________________________ Forma farmaceutica _______________________________________________________ o Dosaggio giornaliero _______________________________________________________ o per ciclo _______________________________________________________ o per singolo trattamento _______________________________________________________ FARMACI ALTERNATIVI PRESENTI IN PRONTUARIO (PRINCIPIO ATTIVO) ______________________________________________ Il farmaco viene somministrato in regime di: o ricovero ordinario – o day-hospital – o ambulatoriale Numero di pazienti/anno elegibili al trattamento: Diagnosi primaria (ICD9) ______________________________________ _________________________________________________________ E' già stato acquistato estemporaneamente dalla Farmacia ospedaliera di riferimento: o SI – o NO Data ______________ 204 IL MEDICO RICHIEDENTE IL DIRETTORE DI UNITA' OPERATIVA ______________________ _________________________________ Commissione provinciale del Farmaco Bologna Richi est a inseri ment o f armac i CPF SCHEMA DI RIFERIMENTO PER LA RELAZIONE DA ALLEGARE ALLA RICHIESTA La Commissione Provinciale del Farmaco ha individuato alcuni aspetti fondamentali ed utili per una appropriata valutazione del farmaco. Il Medico richiedente, in allegato al modulo di richiesta, è invitato a presentare alla Segreteria Scientifica una breve relazione dove vengono approfonditi ed esplicitati i seguenti punti: • Inquadramento sintetico della patologia. • Standard terapeutico di riferimento e protocolli di trattamento in uso nelle Unità Operative/Servizi interessati, nella patologia correlata al farmaco richiesto. • Descrizione sintetica degli studi clinici a supporto della richiesta: specificare l'indicazione e la popolazione studiate (quest'ultima deve essere il più possibile sovrapponibile a quella per la quale si prevede il trattamento richiesto), eventuali gruppi di controllo, gli end-points, la durata e i risultati • Motivazioni cliniche generali per l'uso del farmaco e descrizione dei benefici attesi (vantaggi rispetto alle terapie di riferimento disponibili in Prontuario Terapeutico). • Modalità di uso previste, con indicazione dei criteri di inclusione dei pazienti e della durata del trattamento. • Potenziali rischi associati al trattamento. DOCUMENTAZIONE SCIENTIFICA: Si prega di riportare le referenze bibliografiche di eventuali linee-guida nazionali e/o internazionali di riferimento e studi clinici controllati condotti secondo validi criteri metodologici. (in totale non più di 5 referenze). Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 205 Richiesta inserimento farmac i CPF 206 Commissione provinciale del Farmaco Bologna Procedura sulla prescrizione di farmaci per indicazioni non autorizzate dal Ministero della Salute PROCEDURA SULLA PRESCRIZIONE DI FARMACI PER INDICAZIONI NON AUTORIZZATE DAL MINISTERO DELLA SALUTE REDAZIONE, RESPONSABILE PROCEDURA,VERIFICA, APPROVAZIONE, AUTORIZZAZIONE REDAZIONE RESPONSABILE PROCEDURA VERIFICA APPROVAZIONE AUTORIZZAZIONE Commissione Terapeutica della Provincia di Bologna STATO DELLE REVISIONI REV. N. SEZIONI REVISIONATE 1 2 MOTIVAZIONE DELLA REVISIONE Integrazione e condivisione in ambito provinciale Aggiornamento normativa DATA LUGLIO 2006 MAGGIO 2007 ELENCO ALLEGATI ALL. N. Codice 1 MODP029AUSLBO DESCRIZIONE ALLEGATO Modello di richiesta utilizzo farmaco "off-label" in urgenza REV. N. 0 SOMMARIO 1. 2. 3. 4. 5. 6. 7. 8. 9. SCOPO/OBIETTIVO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 208 CAMPO DI APPLICAZIONE . . . . . . . . . . . . . . . . . . . . . . . . . 208 LUOGO DI APPLICAZIONE . . . . . . . . . . . . . . . . . . . . . . . . . 208 RIFERIMENTI NORMATIVI E DOCUMENTALI . . . . . . . . . . 208 ABBREVIAZIONI, DEFINIZIONI E TERMINOLOGIA . . . . . 209 MATRICE DELLE RESPONSABILITÀ . . . . . . . . . . . . . . . . . 209 PROCESSO/MODALITÀ OPERATIVE . . . . . . . . . . . . . . . . 209 DIAGRAMMA DI FLUSSO . . . . . . . . . . . . . . . . . . . . . . . . . . 212 INDICATORI E PARAMETRI DI CONTROLLO. . . . . . . . . . 213 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 207 Proc edura sull a presc ri zi one di farmaci per indicazioni non autorizzate dal Mi nistero della Salute 1. SCOPO/OBIETTIVO Informare il Personale Medico dell' Aziende Sanitarie della Provincia di Bologna ed uniformare i comportamenti rispetto a: - modalità a cui attenersi in ottemperanza alla normativa vigente per la prescrizione ed eventuale erogazione di un farmaco per indicazioni non autorizzate dal Ministero della Salute, 2. CAMPO DI APPLICAZIONE Prescrizione ed erogazione di farmaci per indicazioni non autorizzate dal Ministero della Salute. 3. LUOGO DI APPLICAZIONE AZIENDE SANITARIE DELLA PROVINCIA DI BOLOGNA 4. RIFERIMENTI NORMATIVI E DOCUMENTALI Autore Titolo Ministero della Salute Legge 648: “Conversione decreto-legge 21 ottobre 1996, n. 536, relativo alle misure per il contenimento della spesa farmaceutica…” Ministero della Salute Testo coordinato: “Ripubblicazione del decretolegge 17 febbraio 1998, n. 23, coordinato con la legge di conversione 8 aprile 1998, n. 94, recante: Disposizioni urgenti in materia di sperimentazioni cliniche e altre misure in materia sanitaria”. CUF Provvedimento: “Istituzione dell'elenco delle specialità medicinali erogabili a totale carico del SSN ai sensi della legge 648/96” Ministero della Salute D.M. 279: “Regolamento di istituzione della rete nazionale delle malattie rare…” Ministero della Salute Comunicato concernente l'ambito di applicazione della L. 648/96 Ministero della Salute D.M. “Uso terapeutico di medicinale sottoposto a sperimentazione clinica.” Regione Emilia Circolare n. 18: “Note esplicative riguardo l'applicazione della Delibera di Giunta regionale Romagna n. 160 del 02.02.2004” (Malattie rare) Parlamento Legge Finanziaria 2007: art.1,comma 796, Repubblica italiana puntoz. 208 Data 23 dicembre 1996 G.U. n. 05 8 maggio 1998 20 luglio 2000 18 maggio 2001 26 giugno 2002 8 maggio 2003 24 novembre 2004 27 dicembre 2006 Commissione provinciale del Farmaco Bologna Procedura sulla prescrizione di farmaci per indicazioni non autorizzate dal Ministero della Salute 5. ABBREVIAZIONI, DEFINIZIONI E TERMINOLOGIA ABBREVIAZIONI CE Comitato Etico aziendale CPF Commissione Provinciale del Farmaco AIFA Agenzia Italiana del Farmaco R.E.R Regione Emilia Romagna DS Direzione Sanitaria Cdp Centro di prelievo DEFINIZIONI E TERMINOLOGIA Richieste in Richiesta di medicinali non gestiti a scorta dalla Farmacia ospedaliera di emergenza riferimento che prevede l'acquisizione e la consegna del farmaco nei tempi concordati con il richiedente. 6. MATRICE DELLE RESPONSABILITÀ Attività Funzione Medico Farmacista Valutazione assenza di valida alternativa terapeutica. R Valutazione per sperimentazioni cliniche in corso R Valutazione/autorizzazione richiesta - DM 8 maggio 2003 Valutazione/espressione di parere tecnico richiesta -L. 94/98 Predisposizione della documentazione richiesta/ prescrizione del farmaco e inoltro alla Commissione di competenza. R C Valutazione compatibilità spesa con risorse assegnate al Cdp richiedente. C Valutazione/autorizzazione richiesta -L. 648/96 Adempimenti conseguenti l'autorizzazione. R Erogazione del farmaco. R DS CE CPF AIFA R R R C R R= responsabile, C= coinvolto 7. PROCESSO/MODALITÀ OPERATIVE La normativa di riferimento riportata al punto 4. della presente procedura, pone limiti precisi riguardo l'utilizzo di farmaci per indicazioni terapeutiche non registrate dal Ministero della Salute: Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 209 Proc edura sull a presc ri zi one di farmaci per indicazioni non autorizzate dal Mi nistero della Salute • impone al Medico un'attenta valutazione sulla presenza di valida alternativa terapeutica e un utilizzo ponderato sulla base di documentazione scientifica che ne attesti l'efficacia e la sicurezza; • impone l'acquisizione del consenso informato; • pone in capo al Medico e non all'Azienda Sanitaria eventuali conseguenze negative derivanti dall'utilizzo del farmaco; • ribadisce che l'utilizzo dei farmaci al di fuori delle indicazioni di registrazione si configura come uso sperimentale. • al di fuori dell'ambito di applicazione della legge 648/96, non ammette che il costo del farmaco possa essere posto a carico del SSN. In regime di ricovero in una struttura pubblica o privata o accreditata, il costo del trattamento farmacologico praticato non può comunque essere in carico al paziente. Il medico che intende richiedere l'erogazione di un farmaco per un uso fuori dalle indicazioni registrate dal Ministero della Salute, valutata l'assenza di valida alternativa terapeutica, in caso si tratti di patologia rara inclusa nell' Allegato 1 del D.M. 279/2001, deve inoltrare la richiesta secondo il percorso definito dalla R.E.R. con Circ. 18 del 24/11/2004. Se non si tratta di patologia rara, e sono in corso sperimentazioni cliniche presso Aziende sanitarie della provincia di Bologna valuta la possibilità di indirizzare il paziente presso il centro dove è in corso lo studio clinico. Se non si tratta di patologia rara, e non è possibile accedere ad una sperimentazione clinica valuta l'incidenza della patologia sulla popolazione AUSL e se vi sono studi di fase III in corso o già conclusi, oppure in caso di pericolo di vita per il paziente anche solo di fase II già conclusi, predispone la documentazione descritta nel diagramma di flusso di seguito riportato (decreto 8 maggio 2003) e provvede all'inoltro al CE aziendale per la valutazione del protocollo, l'eventuale autorizzazione all'uso e la notifica al Ministero della Salute. Il farmaco è fornito gratuitamente dalla ditta produttrice ed erogato tramite la Farmacia ospedaliera di riferimento. 210 Commissione provinciale del Farmaco Bologna Procedura sulla prescrizione di farmaci per indicazioni non autorizzate dal Ministero della Salute In assenza degli studi clinici sopra citati sempre che l'impiego del medicinale sia noto e conforme a lavori apparsi su pubblicazioni scientifiche, predispone una relazione scientifica secondo quanto indicato nel diagramma di flusso (L.94/98) e provvede all'inoltro della documentazione alla CPF. In caso di parere positivo la CPF lo notifica alla DS per la valutazione della compatibilità della relativa spesa con le risorse economiche assegnate al Cdp richiedente. Completate tutte le valutazioni la CPF inoltra la risposta al medico richiedente. Il farmaco è erogato tramite la Farmacia ospedaliera di riferimento e la spesa ricade sul Cdp richiedente. In caso di richieste in emergenza, il Medico provvede all'invio della documentazione /prescrizione relativa al farmaco alla Farmacia ospedaliera di riferimento oltre che alla Segreteria della CPF. Il Farmacista di guardia in collaborazione con il prescrittore, verifica: • l'assenza di una valida alternativa terapeutica tra i farmaci presenti in Prontuario Terapeutico, • la presenza del consenso informato e dell'assunzione di responsabilità e si attiva per rendere disponibile il medicinale nei tempi concordati con il prescrittore. Nel caso in cui, valutata l'incidenza della patologia, ritiene che la terapia con quel farmaco sia di tipo cronico e possa interessare più pazienti, predispone una relazione scientifica sulla base di quanto previsto dalla legge 648/96 (vedi diagramma di flusso). I documenti devono essere inoltrati alla CPF, per una preliminare valutazione e successiva trasmissione all'AIFA. Il farmaco è erogato tramite la Farmacia ospedaliera di riferimento e la spesa ricade sul Cdp richiedente, solo successivamente alla emanazione dello specifico provvedimento AIFA d' inclusione nell' elenco di cui alla 648/96. Il Medico può utilizzare il farmaco richiesto esclusivamente a seguito dell'autorizzazione rilasciata e deve attenersi agli adempimenti ed eventuali limiti generali posti dalle normative vigenti in materia, nonché a quelli specifici stabiliti da CE o CPF o AIFA. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 211 Proc edura sull a presc ri zi one di farmaci per indicazioni non autorizzate dal Mi nistero della Salute 8. DIAGRAMMA DI FLUSSO Richiesta medicinale per indicazione non registrata dal Ministero della Salute Assenza di valida alternativa terapeutica Percorso RER (Circ. 18 del 24.11.04) Patologia rara ? SI NO Centro presso il quale si svolge lo studio clinico SI Paziente arruolabile in studio clinico in corso? SI Singolo caso? NO NO Presenza di studi di fase III in corso o già conclusi o in caso di pericolo di vita, di fase II conclusi NO SI Decreto 8 maggio 2003 L. 94/98 L. 648/96 Protocollo in cui siano documentate: Relazione scientifica sulla patologia che attesti anche gravità, riportante la terapia già effettuata, con scarso o nullo risultato, e l’ assenza di alternativa terapeutica. Relazione scientifica sulla patologia che attesti anche gravità e assenza di alternativa terapeutica; 1.motivazione clinica della richiesta; 2.dati su efficacia e tollerabilità; Predisporre la documentazione elencata. 3.comparabilità dei pz. compresi nel campione di sperimentazione e di coloro per cui si fa la richiesta; Piano terapeutico proposto. Stato autorizzativo del medicinale in Italia e all'estero; Assunzione di responsabilità e consenso informato; Dati indicativi sul costo del trattamento; assunzione di responsabilità del medico richiedente. Documentazione che attesti che tale impiego è noto e conforme a pubblicazioni scientifiche accreditate. Documentazione quale: pubblicazioni scientifiche, risultati di studi clinici di fase I e II, informazioni su sperimentazioni cliniche in corso. Indirizzare la richiesta: Al CE, anche con procedura d'urgenza. Alla CTP, anche con procedura d'urgenza. Alla CTP, per una preliminare valutazione e successiva trasmissione all’AIFA. Autorizzazione: Il CE, valutato il protocollo, lo notifica al Ministero della Salute. La CTP, valutata la documentazione, notifica il proprio parere alla Direzione Sanitaria e p.c. al Medico richiedente Il medico che ha ottenuto l'autorizzazione: Il Medico deve attenersi agli adempimenti e limiti stabiliti nell'autorizzazione. 4.modalità d'informazione del pz; 5.modalità di raccolta dati, secondo i criteri degli studi osservazionali Parere positivo della Direzione Sanitaria SI Il Medico deve attenersi alle indicazioni ed eventuali limiti stabiliti nella nota della CTP. Fornitura del medicinale e attribuzione della spesa: 212 Piano terapeutico proposto; Il medicinale è fornito gratuitamente dalla ditta produttrice tramite la Farmacia ospedaliera di riferimento Il medicinale è fornito dalla Farmacia ospedaliera di riferimento e la spesa ricade sul Cdp richiedente L' AIFA rilascia l'autorizzazione tramite uno specifico provvedimento d'inserimento nell'elenco dei medicinali erogabili ai sensi della L. 648/96. Il Medico deve attenersi ai criteri di impiego indicati nei singoli provvedimenti e a quelli generali indicati nella normativa (consenso informato, PT, ecc.) Il medicinale è a carico del SSN (fornito dalla Farmacia ospedaliera di riferimento e la spesa ricade sul Cdp richiedente) Commissione provinciale del Farmaco Bologna Procedura sulla prescrizione di farmaci per indicazioni non autorizzate dal Ministero della Salute 9. INDICATORI E PARAMETRI DI CONTROLLO Monitoraggio annuale delle richieste di farmaci prescritte per indicazioni non registrate dal Ministero della Salute pervenute alle Farmacie ospedaliere di riferimento: N. richieste autorizzate/totale richieste pervenute. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 213 Le note AIFA 2006-2007 per l'uso appropriato dei farmaci I n di c e n o t e A I F A Nota 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 8 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 9 - 9 bis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 10 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 11 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 12 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 13 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 15 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 28 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 30 e 30 BIS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 31 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 32 e 32 BIS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 36 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 39 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 40 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 41 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 42 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 48 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 51 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 55 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 56 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 57 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 59 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 65 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 66 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 74 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 75 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 76 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 78 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 79 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 82 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 83 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 84 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 85 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 87 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 88 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Nota 89 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 216 pag. 220 224 226 228 231 233 235 238 239 240 241 248 252 254 255 257 258 259 263 264 265 266 269 272 275 277 278 280 282 287 289 291 292 295 301 303 304 307 314 315 318 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Premessa Le note per l'appropriatezza rappresentano ancora oggi uno dei terreni dove è stato maggiormente sperimentato il tentativo di far incontrare le scelte regolatorie con le prove di efficacia presenti in letteratura. L'introduzione di questo strumento regolatorio risale al 1994 e coincide con un'importante ridefinizione dei medicinali ritenuti essenziali, e quindi rimborsabili, per il Servizio Sanitario nazionale. L'obbiettivo originario era quello di definire, quando opportuno, alcuni ambiti di rimborsabilità nella medicina generale, senza per questo interferire con la libertà prescrittiva del singolo medico. La necessità di uno strumento regolatorio di questo tipo risiede soprattutto nel cercare di rispondere ad una doppia esigenza: da una parte garantire l'accesso a tutti i farmaci ritenuti essenziali ed efficienti per le malattie croniche ed epidemiologicamente rilevanti e dall'altra governare le nuove indicazioni dei medicinali registrati per il mercato nazionale ed europeo ma che non sempre garantiscono un vantaggio terapeutico rispetto alle scelte di cura esistenti. Nel corso del tempo le note hanno subito una evoluzione nei contenuti, nella forma e nelle finalità pur mantenendo sempre il principale obiettivo di riassumere e documentare un percorso di valutazione critica della Commissione Tecnico Scientifica (CTS) dell'AIFA. Ogni aggiornamento delle note si arricchisce di tutti i commenti raccolti nel corso delle passate edizioni e tiene conto dei nuovi dati presenti nell'ambito della letteratura scientifica. Il processo continuo di revisione delle note AIFA viene portato avanti in un'ottica di condivisione scientifica e culturale del sistema note e con la finalità prima di recepire tutti i suggerimenti necessari ad evitare un ostacolo all'accesso alle terapie efficaci ed essenziali. In questo contesto le nuove note per l'appropriatezza hanno raccolto molte delle indicazioni provenienti dalla medicina generale; in ogni caso le note AIFA devono essere tenute in considerazione e osservate anche dai medici ospedalieri e specialisti. Il metodo ed il percorso Sulla base dell'esperienza sviluppata nel corso delle precedenti tre edizioni delle note, il metodo è stato ulteriormente arricchito inserendo alcuni passaggi che hanno l'obiettivo di rendere, per quanto possibile, ancora più trasparente il percorso utilizzato. La sottocommissione della CTS delegata all'aggiornamento delle note per l'appropriatezza è stata affiancata da un gruppo di lavoro che ha permesso di analizzare tutti gli aspetti critici posti dall'applicazione delle note. L'analisi delle criticità ha consentito di raccogliere in modo sistematico tutte le proposte di soluzioni e modifiche possibili e di fornire alla CTS un documento con la ricognizione di tutti i commenti legati ad ogni singola nota. Tale gruppo di lavoro è stato costituito da rappresentati della medicina generale e della medicina ospedaliera oltre che da professionisti dei settori farmaceutici delle Regioni. I lavori di tale gruppo sono stati sintetizzati in un documento pubblicato sul Bollettino di Informazione sui Farmaci distribuito a tutti i medici e farmacisti italiani. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 217 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Sulla base di questo primo passaggio è stata elaborata una proposta di revisione delle note nella sua parte "normativa" (executive summary), che è stata presentata ufficialmente ai rappresentati delle diverse categorie coinvolte (medici, farmacisti, produttori, distributori, servizi farmaceutici territoriali e regionali). I rilievi ed i commenti raccolti da quest'ultimo passaggio sono serviti per la stesura definitiva della parte normativa delle note. A questo punto gli uffici hanno raccolto in un formato unico le motivazioni ed i criteri applicativi di ogni nota. Quest'ultimo elaborato ha tenuto conto anche dei diversi aggiornamenti bibliografici necessari per l'aggiornamento finale del documento. Nel testo viene riportata, in ordine alfabetico, la bibliografia di riferimento utilizzata dalla CTS nell'ambito della stesura delle note. Il documento integrale, ratificato in via definitiva dalla CTS, è stato discusso ed approvato sulla base anche di una valutazione generale di impatto del nuovo provvedimento nell'ambito del generale utilizzo dei medicinali. Le novità Le principali novità che riguardano le nuove note per l'appropriatezza possono essere riassunte secondo i seguenti punti: • sono stati semplificati diversi percorsi prescrittivi soprattutto per quanto riguarda la prescrizione che origina in ambito specialistico e prosegue in un contesto di medicina generale; • sono state riviste le indicazioni terapeutiche secondo uno schema più fedele a quanto riportato in scheda tecnica; • le motivazioni ed i criteri applicativi sono stati organizzati secondo uno schema strutturato e unico che dovrebbe aiutare a seguire il ragionamento e la documentazione utilizzata per la stesura della nota stessa. Uno dei maggiori contrasti provocati fino ad oggi dalle note risiedeva nel fatto che queste venivano intese soprattutto come dei vincoli prescrittivi per la medicina generale e non per quella specialistica ed ospedaliera. Molte aree terapeutiche sono invece fortemente condizionate dall'induzione prescrittiva di tipo specialistico, ossia da una scelta del farmaco che nasce da una prescrizione specialistica e viene poi proseguita dal medico di medicina generale. Le nuove note per l'appropriatezza hanno eliminato per alcuni farmaci l'obbligo di un passaggio specialistico (diagnosi e piano terapeutico), assicurando una gestione più complessiva del paziente. Rimangono comunque valide le avvertenze per un uso attento di farmaci che per i dosaggi più elevati possono esporre a particolari rischi. Le note AIFA 2006-2007 I criteri che hanno guidato la stesura delle Note si riferiscono in particolare ai seguenti casi: a. quando un farmaco è autorizzato per diverse indicazioni cliniche, di cui solo alcune per patologie rilevanti; b. quando il farmaco è finalizzato a prevenire un rischio che è significativo solo per uno o più gruppi di popolazione; 218 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i c. quando il farmaco si presta non solo a usi di efficacia documentata, ma anche a usi impropri. In ogni caso il contenuto delle note AIFA non modifica, né può modificare, le informazioni contenute nella scheda tecnica delle singole specialità medicinali. Inoltre, le note AIFA non hanno valore retroattivo e quindi non incidono sui trattamenti iniziati precedentemente e fino al successivo controllo da parte del medico o della struttura specialistica. Ove viene specificato che la rimborsabilità dei medicinali inclusi nella nota è soggetta alla definizione di una diagnosi e di un piano terapeutico, si intende che quest'ultimo viene trasmesso in copia al medico di medicina generale e al settore farmaceutico della ASL di appartenenza del paziente. Ogni nota è composta da una parte regolatoria (executive summary) che indica le limitazioni di prescrivibilità all'interno delle indicazioni registrate dei diversi farmaci coinvolti. A ciò si aggiunge una sezione che motiva le decisioni regolatorie commentando il contesto (background) e le prove di efficacia. E' stata introdotta una sezione per le particolari avvertenze che dovrebbero guidare l'applicazione della prescrizione appropriata di questi farmaci. Per ogni nota vi è una selezione delle più importanti referenze che hanno guidato il processo decisionale in ambito CTS. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 219 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Le Note AIFA 2006 -2007 per l'uso appropriato dei farmaci Nota 1 Gastroprotettori: – misoprostolo – esomeprazolo – lansoprazolo – omeprazolo – pantoprazolo – rabeprazolo – misoprostolo + diclofenac* La prescrizione a carico del SSN è limitata: alla prevenzione delle complicanze gravi del tratto gastrointestinale superiore: – in trattamento cronico con farmaci antiifiammatori non steroidei – in terapia antiaggregante con ASA a basse dosi purché sussista una delle seguenti condizioni di rischio: – storia di pregresse emorragie digestive o di ulcera peptica non guarita con terapia eradicante – concomitante terapia con anticoagulanti o cortisonici – età avanzata Background È noto come il trattamento cronico con i FANS possa determinare un aumentato rischio di ulcera peptica e delle sue complicanze gravi (emorragia, perforazione, ostruzione). Il rischio di ospedalizzazione per una complicanza grave è stimato fra l'1 e il 2% per anno, ed aumenta fino a 4-5 volte nelle categorie a rischio specificate nella nota limitativa. Sulla base di studi clinici randomizzati e osservazionali anche l'uso di anticoagulanti e l'età avanzata (65-75 anni) sono risultate essere condizioni predisponenti al rischio di complicanze gravi del tratto gastrointestinale superiore. Pertanto tali condizioni devono essere considerate fattori suggestivi di popolazioni a maggior rischio ma non raccomandazioni tassative per trattare, ad esempio, tutti gli anziani o tutti coloro che assumono anticoagulanti. Gli inibitori di pompa, fatte salve le indicazioni della nota 48, ed il misoprostolo non sono rimborsati quando prescritti in associazione con i COXIB. Non ci sono dati a supporto di un beneficio nell'impiego dei PPI nei pazienti trattati con i COXIB. Data la rilevanza clinica della tossicità gastroduodenale indotta dai FANS, numerosi sono stati inoltre gli studi che hanno valutato l'efficacia di una "gastroprotezione" utilizzando accanto agli inibitori di pompa anche gli analoghi delle prostaglandine (misoprostolo) e gli anti secretivi (H2 antagonisti). Evidenze disponibili Misoprostolo Risulta ancor oggi l'unico farmaco per il quale esistono dati convincenti che ne dimostrano l'efficacia nel ridurre l'incidenza delle complicanze gravi (emorragie, perforazioni e ostruzione pilorica) della gastropatia da FANS. Lo studio (MUCOSA) di grandi dimensioni (8.853 pazienti) ha infatti documentato una riduzione del 40% di dette complicanze rispetto al placebo. Una metanalisi di 24 studi che ha valutato 220 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i l'efficacia del misoprostolo non in base alla riduzione delle complicanze ma solo in base alla riduzione dell'incidenza di ulcere gastriche o duodenali diagnosticate endoscopicamente ha confermato detta efficacia: (NNT = 8) per prevenire un'ulcera gastrica e (NNT = 30) per prevenire un'ulcera duodenale. Il misoprostolo somministrato alla dose di 800 μg ha però una tollerabilità scarsa (dispepsia, dolore addominale, diarrea) e nello studio MUCOSA i pazienti che sospendevano il trattamento per disturbi gastrointestinali erano più numerosi fra quelli trattati con misoprostolo più FANS (27,4%) che fra quelli trattati con FANS più placebo (20,1% p<0,001). Inibitori della pompa protonica Numerosi studi hanno dimostrato che nei soggetti trattati con FANS, dosi standard di inibitori della pompa protonica riducono significativamente l'incidenza di ulcere gastriche e duodenali diagnosticate all'endoscopia rispetto al placebo. Due di essi meritano particolare attenzione. Nel primo l'omeprazolo è stato confrontato con ranitidina e, nel secondo, con misoprostolo in due trial con uguale disegno sperimentale. In tutti e due gli studi (ASTRONAUT e OMNIUM) venivano valutati soggetti che a seguito della terapia con FANS presentavano una ulcera peptica o almeno 10 erosioni gastriche o duodenali. Ciascuno dei due trial esaminava due fasi: a) la guarigione delle lesioni da FANS già presenti; e b) la prevenzione della ricomparsa delle lesioni durante ritrattamento con i FANS. In entrambe le fasi la terapia con omeprazolo si è dimostrata più efficace del farmaco di confronto (rispettivamente, ranitidina e misoprostolo) sia nel guarire le ulcere sia nel prevenire le recidive. Detti risultati vanno però valutati con prudenza in quanto entrambi gli studi presentano limiti metodologici rilevanti quali: 1) la dimostrazione di maggiore efficacia è basata su parametri surrogati, infatti gli studi hanno utilizzato come "end-point" terapeutico la riduzione del numero di ulcere endoscopiche e dei sintomi dispeptici e non delle complicanze gravi che sono il parametro clinico più rilevante cui mira la profilassi farmacologica: non è cioè la stessa cosa prevenire un'ulcera visibile alla endoscopia routinaria in uno studio clinico e prevenire una complicanza grave (emorragia, perforazione, ostruzione); 2) le dosi utilizzate con i farmaci di riferimento (400 μg/d per il misoprostolo e 300 mg/d per la ranitidina) sono probabilmente inadeguate; infine, 3) è mancata soprattutto una attenta considerazione alla presenza o meno nei pazienti trattati di una infezione da H. pylori. Lo stato di portatore o meno di una tale infezione può, infatti, avere grande rilevanza. Una recente metanalisi condotta su 16 studi dimostra, infatti, in modo convincente come sia l'infezione da H. pylori sia l'impiego di FANS tradizionali possano aumentare il rischio di causare un'ulcera peptica o un sanguinamento gastrico in modo indipendente, avendo un effetto sinergico nell'aggravare il rischio di ulcera peptica e sanguinamento quando entrambi i fattori di rischio sono presenti nello stesso paziente. La superiore efficacia dell'inibitore di pompa rispetto a misoprostolo e a dosi usuali di H2 bloccanti nel prevenire le ulcere da FANS potrebbe cioè essere in parte solo apparente e dovuta a una diversa distribuzione dei pazienti con infezione nella popolazione studiata. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 221 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Particolari avvertenze L'importanza dell'infezione da H. pylori nella strategia di prevenzione del sanguinamento gastrico causato dai FANS tradizionali e dall'ASA a basso dosaggio è dimostrato da uno studio recente che ha rilevato come nei pazienti con infezione da H. pylori e una storia di sanguinamento gastrico, l'eradicazione dell'infezione da Helicobacter pylori risulti equivalente all'omeprazolo nel prevenire una recidiva del sanguinamento gastrico nei pazienti che assumono ASA a basse dosi (probabilità di recidiva del sanguinamento a sei mesi 1,9% con eradicazione e 0,9% con omeprazolo). Mentre nei pazienti che assumono naprossene al posto dell'ASA a basse dosi l'inibitore di pompa risulta più efficace della semplice eradicazione (probabilità di recidiva del sanguinamento a 6 mesi 18,8% con l'eradicazione e 4,4% con omeprazolo). Nei pazienti con storia di sanguinamento gastrico e che devono continuare una profilassi secondaria con ASA a basse dosi l'eradicazione dell'infezione probabilmente si pone perciò come strategia profilattica più conveniente della somministrazione di un inibitore di pompa. Non è chiaro se l'eradicazione vada comunque eseguita in tutti i pazienti infetti che fanno uso cronico di FANS tradizionali. Una metanalisi recente ha dimostrato che il rischio emorragico da ASA impiegato come antiaggregante è assai basso (una emorragia ogni 117 pazienti trattati con 50-162 mg/die di ASA per una durata media di 28 mesi). Pertanto, una gastroprotezione farmacologica generalizzata non è giustificata. I trial considerati nella metanalisi escludevano però i pazienti ad alto rischio emorragico. In mancanza di dati relativi a questi pazienti, se si estrapola ad essi l'aumento di emorragie o ulcere da FANS nei soggetti a rischio (4-5 volte quello di base), la gastroprotezione nei soggetti a rischio emorragico trattati "long-term" con ASA potrebbe essere giustificata specie in presenza dei fattori di rischio più rilevanti (emorragia pregressa e pazienti in trattamento con anticoagulanti e cortisonici). Nei pazienti con infezione da Helicobacter pylori risulta indicata l'eradicazione. Non è invece appropriato l'uso di preparazioni "gastroprotette" o tamponate di ASA, che hanno un rischio emorragico non differente da quello dell'ASA standard. Gli H2-inibitori non sono stati inclusi tra i farmaci indicati per la prevenzione e il trattamento del danno gastrointestinale da FANS perché in dosi standard non riducono significativamente l'incidenza delle ulcere gastriche, che sono le più frequenti fra quelle da FANS anche se hanno efficacia pressochè uguale a quella del misoprostolo sulle ulcere duodenali. Una revisione non sistematica del danno gastrointestinale da FANS non raccomanda gli H2 - inibitori per la prevenzione dei danni gastrointestinali da FANS; li ammette per la terapia delle ulcere previa sospensione dei FANS, ma non se si seguitano i FANS. I dati clinici citati non possono essere applicati ai COXIB. Va segnalato come in uno studio in pazienti con storia di sanguinamento gastrico recente, il trattamento per sei mesi con omeprazolo più diclofenac si sia dimostrato egualmente efficace rispetto al celecoxib nel prevenire la ricorrenza del sanguinamento gastrico. Al momento non vi sono ulteriori dati sulla letteratura scientifica internazionale che documentino un'efficacia nella gastroprotezione con misoprostolo e/o inibitori della pompa protonica nei confronti del danno gastrointestinale da COXIB. 222 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i La prescrizione dell'associazione misoprostolo + diclofenac* è rimborsata alle condizioni previste dalla nota 66. Bibliografia 1. Chan FKL, et al. Celecoxib versus diclofenac and omeprazole in reducing the risk of recurrent ulcer bleeding in patients with arthritis. N Engl J Med 2002; 347: 2104-2110. 2. Chan FKL, et al. Preventing recurrent upper gastrointestinal bleending in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen. N Engl J Med 2001; 344: 967-973. 3. Cullen D, et al. Primary gastroduodenal prophylaxis with Omeprazolo for Nonsteroidal Antiinflammatory Drug users. Aliment Pharmacol Ther 1998; 12: 135-140. 4. Daneshmend TK, et al. Abolition by Omeprazole of Aspirin-induced gastric mucosal injury in man. Gut 1990; 31: 514-7. 5. Derry S, et al. Risk of gastrointestinal hemorrhage with long term use of aspirin: metaanalysis. BMJ 2000; 321: 1183-7. 6. Ekstrom P, et al. Prevention of peptic ulcer and dyspeptic symptoms with Omeprazolo in patients receiving Nonsteroidal Anti-inflammatory Drug continuous therapy. A nordic multicentre study. Scand J Gastroenterol 1996; 31: 753-8. 7. Feldman M. Peptic ulcer disease. In: Dale DC, Federman DD eds. Scientific American Medicine, Section 4, Gastroenterology II, 2000: 2-3. 8. Graham DY, et al. Ulcer prevention in long-term users of Nonsteroidal Antinflammatory Drugs. Arch Intern Med 2002; 162: 169 - 175. 9. Graham DY. Critical effect of Helicobacter pylori infection on the effectiveness of omeprazole for prevention of gastric or duodenal ulcers among chronic NSAID users. Helicobacter 2002; 7: 1-8. 10.Graham DY. NSAIDS, Helicobacter pylori and Pandora Box. N Engl. J. Med. 2002; 347: 2162-2164. 11.Hawkey CJ, et al. Omeprazole compared with Misoprostol for ulcers associated either Nonsteroidal Anti-inflammatory Drugs. N Engl J Med 1998; 338: 727-34. 12.Jia-Qing, et al. Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic ulcer disease : a meta-analysis. Lancet 2002; 359:14-22. 13.Kelly YP, et al. Risk of aspirin - associated major upper gastrointestinal bleending with enteric-coated or buffered products. Lancet 1996; 384: 1413-6. 14.Koch M, et al. Prevention of Nonsteroidal Anti-inflammatory drugs-induced gastrointestinal mucosal injury. A meta-analysis of randomised controlled clinical trial. Arch Intern Med 1996; 156: 2321-32. 15.Lanza FL. A guideline for the treatment and prevention of NSAID-induced ulcers. Am J Gastroenterol 1998; 93: 2037-46. 16.Silverstein, et al. Misorpostol reduces serious gastrointestinal complications in patients with rheumatoid arthritis receiving Nonsteroidal Anti-inflammatory gruds. A. randomised, double-blind, placebo-controlled trial. Ann Intern Med 1995; 123: 241-9. 17.Wolfe MM, et al. Gastrointestinal toxicity of Non-steroidal Anti-inflammatoru Drugs. N Engl J Med 1999; 340: 1888-99. 18.Yeomans ND, et al. A comparison of Omeprazole with Ranitidine for ulcers associated with Nonsteroidal Anti-inflammatory Drugs. N Engl J Med 1998; 338:719-26. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 223 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 2 Acidi biliari: – chenourso-desossicolico – taurourso-desossicolico – urso-desossicolico La prescrizione a carico del SSN è limitata ai pazienti affetti da: – cirrosi biliare primitiva – colangite sclerosante primitiva – colestasi associata alla fibrosi cistica o intraepatica familiare – calcolosi colesterinica Background La presente nota nasce per il fatto che alcuni prodotti a base di acidi biliari riportano "indicazioni minori" quali le "dispepsie biliari". Tali indicazioni, per il carattere indefinito del disturbo, per la sua limitata rilevanza clinica se isolatamente considerato, oltre che per l'assenza di studi adeguati a supporto di tali indicazioni, non possono essere poste a carico del Servizio Sanitario Nazionale. Pertanto, sono rimborsate solo le prescrizioni riferite alle situazioni cliniche indicate nella presente nota. Evidenze disponibili Le prime tre indicazioni si riferiscono a epatopatie croniche nelle quali modificazioni quali quantitative della funzione biligenetica hanno un ruolo patogenetico molto importante, determinando alterazioni anatomiche e funzionali del fegato (epatopatie colestatiche). L'impiego degli acidi urso- e taurourso desossicolico nelle epatopatie croniche colestatiche è limitato a quelle per le quali si trovano in letteratura evidenze di efficacia terapeutica in termini di miglioramenti anatomici, clinici e di sopravvivenza significativi o, nel caso di malattie prive di altre terapie utili, anche marginali. Tali evidenze, non univoche ma nettamente prevalenti per la cirrosi biliare primitiva (l'acido ursodesossicolico è stato recentemente approvato per la terapia di questa malattia dalla Food and Drug Administration), sono meno chiare ma non inesistenti per le altre epatopatie colestatiche in nota. Le sperimentazioni controllate e randomizzate hanno invece dimostrato che l'acido ursodesossicolico non è efficace nelle epatiti croniche virali, nelle quali non favorisce l'eliminazione dell'RNA del virus C e non migliora le lesioni istologiche. Particolari avvertenze La calcolosi colesterinica potenzialmente trattabile con acidi biliari è caratterizzata da calcoli singoli o multipli (diametro uguale o inferiore a 1 cm), radiotrasparenti, con colecisti funzionante, pazienti non obesi con sintomatologia modesta (coliche non molto frequenti o severe). Altra indicazione è la presenza in colecisti di frammenti di calcoli post-litotripsia. Nella colelitiasi, la terapia con sali biliari ottiene la dissoluzione dei calcoli solo in una parte dei pazienti, variabile in relazione a fattori diversi (dimensioni dei calcoli, funzionalità della colecisti, ecc.); è seguita frequentemente dalla formazione di nuovi calcoli (50-60% a 5 anni); non trova indicazione nei pazienti con coliche ravvicinate o severe, per i quali è necessaria la colecistectomia. Bisogna anche considera- 224 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i re che l'alternativa chirurgica, laparoscopica o con minilaparotomia, è risolutiva e a basso rischio. Si ritiene opportuno limitare l'uso dei sali biliari ai pazienti con caratteristiche definite "ottimali" per la dissoluzione dei calcoli, che raggiunge in questi casi percentuali fra il 48% e il 60%. Le caratteristiche sopra ricordate sono presenti in circa il 15% dei pazienti. La prescrizione di acidi biliari non è rimborsata dal SSN per il trattamento della semplice dispepsia. Il trattamento con acidi biliari non è rimborsato nei pazienti con epatite cronica virale ed in quelli con coliche ravvicinate o gravi per i quali è indicata la colecistectomia. Bibliografia 1. Angelico M, et al. Recombinant interferon-alpha and ursodeoxycholic acid versus interferon alpha alone in the treatment of chronic hepatitis C: a randomized clinical trial with long-term follow up. Am J Gastroenterol 1995;90:263-9. 2. Bellentani S, et al. Ursodiol in the long-term treatment of chronic hepatitis: a double-blind multicenter trial. J Hepatol 1993;19:459-64. 3. Beuers U, et al. Ursodeoxycholic acid in cholestasis: potential mechanisms of action and therapeutic applications. Hepatology 1998;28:1449-53. 4. Boucher E, et al. Interferon and ursodeoxycholic acid combined therapy in the treatment of chronic viral C hepatitis: results from a controlled clinical trial in 8 patients. Hepatology 1995;21:322-7. 5. Colombo C, et al. Ursodeoxycholic acid for liver disease associated with cystic fibrosis : a double-blind, multicenter trial. Hepatology 1996;23:1484-90. 6. Combes B, et al. The effect of ursodeoxycholic acid on the florid duct lesion of primary biliary cirrhosis. Hepatology 1999;30:602-5. 7. Goulis J, et al. Randomised controlled trial of ursodeoxycholic acid therapy in primary biliary cirrhosis: a meta-analysis. Lancet 1999;354:1053-60. 8. Lindor KD, Dickson ER. Management of primary biliary cirrhosis. In: Schiff's diseases of the liver. 8th ed. Lippincott Williamds et Wilkins, 1999: Ch. 25. 9. Lindor KD, et al. Ursodiol for primary sclerosing cholangitis. N Engl J Med 1997;336:691-5. 10.May GR, et al. Efficacy of bile acid therapy for gallstone dissolution: a meta-analysis of randomized trial. Aliment Pharmacol Ther 1993;7:139-48. 11.Poupon R, et al. Combined analysis of randomized controlled trial of Ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology 1997;113:884-90. 12.Strasberg SM, et al. Cholecystolithiasis: lithotherapy for the 90s. Hepatology 1992;16:82039. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 225 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 3 La prescrizione a carico del SSN è limitata ai pazienti afFarmaci per la terapia fetti da: – dolore lieve e moderato in corso di patologia neoplastidel dolore: ca o degenerativa e sulla base di eventuali disposizioni – tramadolo delle Regioni e delle Provincie Autonome Background I prodotti a base di tramadolo sono approvati con l'indicazione generica di "stati dolorosi acuti e cronici di diverso tipo e causa e di media e grave intensità, come pure in dolori indotti da interventi diagnostici e chirurgici". Alcune di queste condizioni patologiche associate a dolore non possono essere poste a carico del Servizio sanitario nazionale a causa del loro carattere episodico. Infatti, questa nota è stata dettata dall'intento di limitare la rimborsabilità del tramadolo al trattamento del dolore cronico di natura neoplastica o degenerativa, in aggiunta agli analgesici già disponibili in fascia A. Mentre la prescrizione di oppiacei utilizzabili in queste situazioni è regolamentata dalla Legge 49/2006, quella del tramadolo non avrebbe trovato alcuna limitazione della rimobrsabilità, stante l'esclusione (Decreto del Ministero della Salute del 19 giugno 2006) del medesimo principio attivo (considerato a basso potere d'abuso) dalla Tabella II, sezione B e D, di cui alla Legge 49/2006. Attualmente, il tramadolo, per le indicazioni non a carico del Ssn, è prescrivibile su ricetta bianca (RNR). Evidenze disponibili Il tramadolo è un analgesico con un doppio meccanismo d'azione: è agonista oppioide dei recettori μ ed è responsabile dell'inibizione della ricaptazione della noradrenalina e serotonina. E' un farmaco non appartenente ad una classe specifica ed ha apparentemente un basso potenziale d'abuso e di euforia. La sua efficacia sembra essere simile a quella di dosi equianalgesiche di codeina e idrocodone, così come la potenziale sedazione e nausea. Particolari avvertenze Benché il tramadolo sia indicato "per stati dolorosi acuti e cronici di diverso tipo e causa e di media e grave intensità", in caso condizioni neoplastiche e degenerative, il tramadolo si colloca ai gradini più bassi dell'approccio farmacoterapeutico al dolore, potendo disporre degli oppiacei per i gradini superiori. Non è consigliabile affropntare i dolori più intensi aumentando le dosi di tramadolo, considerando complessivamente il suo profilo beneficio/rischio. Infatti, il tramadolo è risultato associato al rischio, anche se basso, di crisi convulsive, e di comparsa di disturbi psichiatrici. Poiché l'insorgenza di convulsioni può verificarsi a dosi di poco superiori a quelle normalmente impiegate in terapia, la possibilità di aggiustare i dosaggi è molto limitata. Pertanto, nel caso di risposta analgesica inadeguata, anziché aumentare le dosi, è opportuno scegliere un altro farmaco, possibilmente nella fascia superiore (III, oppioidi) della scala OMS. Naturalmente, il tramadolo do- 226 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i vrebbe essere usato con estrema cautela nei pazienti con un passato di crisi convulsive o nei pazienti che assumono altri farmaci che abbassano la soglia convulsiva. Bibliografia 1. Scottish Intercollegiate Guidelines Network (SIGN). Control of pain in patients with cancer. A national clincal guideline. n°44. June 2000. http://www.sign.ac.uk/index.html 2. AGS Panel on Persistent Pain in Older Persons. The Management of Persistent Pain in Older Persons. Journal of Association of Geriatric Society 2002;50:S205-S224. 3. Judith Jacobi, PharmD, FCCM, BCPS; Clinical practice guidelines for the sustained use of sedatives and analgesics in the critically ill adult. Crit Care Med 2002 Vol. 30, No. 1 4. http://www.who.int/cancer/palliative/painladder/en/ Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 227 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 4 La prescrizione a carico del SSN è limitata ai pazienti con dolore grave e persistente dovuto a: – nevralgia post-erpetica correlabile clinicamente e topograficamente ad infezione da herpes zoster – neuropatia associata a malattia neoplastica documentata dal – gabapentin quadro clinico o strumentale gabapentin, pregabalin – pregabalin – neuropatia diabetica documentata dal quadro clinico e strumentale – duloxetina duloxetina, gabapentin, pregabalin L'impiego di questi farmaci non è assoggettato a nota limitativa ed è a carico del SSN per le seguenti restanti indicazioni autorizzate: trattamento della depressione per duloxetina e della epilessia per gabapentin e pregabalin. Background Il dolore neuropatico (o neurogeno) viene definito dall'International Asssociation for the Study of Pain (IASP) come "dolore associato a lesione primaria o disfunzione del sistema nervoso". Tale sindrome è stata progressivamente identificata a partire da denominatori comuni essenzialmente clinici, rappresentati sia dalla modalità di presentazione dei sintomi (coesistenza di disturbi di sensibilità, assenza di stimolazione nocicettiva), sia dalla durata (la cronicità del dolore neuropatico è legata a persistenza per settimane, mesi o anni), sia dalla risposta ai trattamenti farmacologici (scarsa agli oppioidi ed anti-infiammatori non sterodei; significativa ai farmaci anticonvulsivanti, antidepressivi e antiaritmici). Le condizioni cliniche responsabili del dolore neuropatico sono identificabili in molteplici quadri morbosi associabili sia a compromissione del sistema nervoso centrale che periferico. La valutazione dell'effetto dei farmaci sul dolore è basata sull'impiego di scale analogiche o numeriche strutturate per quantificarne l'entità o la ricaduta su altri aspetti più generali del quadro clinico (ad es. la qualità di vita). Evidenze disponibili Nessuno dei farmaci attualmente impiegati nella terapia del dolore neuropatico è in grado di agire sulle cause del dolore stesso. L'approccio terapeutico alla sintomatologia algica è dunque solo sintomatico e non causale. La relazione tra eziologia, patogenesi e sintomi del dolore neuropatico è complessa: in pazienti diversi lo stesso sintomo può essere provocato da meccanismi diversi, e nello stesso paziente il dolore può essere causato da più meccanismi contemporaneamente, soggetti a variazioni nel tempo. La scelta del farmaco in una specifica situazione morbosa deve quindi essere fatta privilegiando gli agenti la cui efficacia è stata dimostrata nell'ambito di sperimentazioni cliniche controllate. 228 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Particolari avvertenze La duloxetina è autorizzata soltanto per il trattamento della neuropatia diabetica negli adulti, mentre gabapentin e pregabalin hanno indicazioni meno selettive (dolore neuropatico in generale). Nonostante ciò le condizioni cliniche più studiate per questi due ultimi principi attivi sono quelle riportate nella presente nota. L'impiego di questi farmaci per le restanti indicazioni autorizzate (trattamento della depressione per la duloxetina e della epilessia per gabapentin e pregabalin) non è assoggettato a nota limitativa. Bibliografia 1. Bone M, Critchley P, Buggy DJ. Gabapentin postamputation phantom limb pain: A randomized, double-blind, placebo-controlled, cross-over study. Reg Anesth Pain Med 2002;27:481-486. 2. Caraceni A, Zecca E, Bonezzi C, Arcuri E, Yaya Tur R, Maltoni M, Visentin M, Gorni G, Martini C, Tirelli W, Barbieri M, De Conno F. Gabapentin for neuropathic cancer pain: a randomized controlled trial from the Gabapentin Cancer Pain Study Group. J Clin Oncol 2004; 22:2909-17 3. Dworkin RH, Backonja M, Rowbotham MC, et al. Advances in neuropathic pain. Diagnosis, mechanisms, and treatment recommendations. Arch Neurol 2003;60:1524-1534. 4. Dworkin RH, Corbin AE, Young Jr JP, et al. Pregabalin for the treatment of postherpetic neuralgia. Neurology 2003;60:1274-83. 5. Freynhagen R., Krzysztof Strojekb, Teresa Griesingc, Ed Whalenc, Michael Balkenohl. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain 2005;115:254-263 6. Gilron, I. et al. Morphine, gabapentin, or their combination for neuropathic pain. N Engl J Med 2005;352:1324-1334. 7. Goldstein DJ, Lu Y, Detke MJ, Lee TC, Iyengar S. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109-18. 8. Hahn K, Arendt G, Braun JS, von Giesen HJ, Husstedt IW, Maschke M, Straube E, Schielke E.A placebo controlled trial of gabapentin for painful HIV-associated sensory neuropathies. J Neurol 2004;251:1260-1266. 9. Harden R.N., Chronic Neuropathic Pain. Mechanisms, Diagnosis, and Treatment. The Neurologist 2005;11:111-22. 10.Lesser, H. et al. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized controlled trial. Neurology 2004:63: 2104-2110. 11.Levendoglu F, Ogun CO, Ozerbil O, Ogun TC, Ugurlu H. Gabapentin is a first line drug for the treatment of neuropathic pain in spinal cord injury. Spine 2004:29:743-751. 12.Morello CM, Leckband SG, Stoner CP, Moorhouse DF, Sahagian GA. Randomized doubleblind study comparing the efficacy of gabapentin with amitriptyline on diabetic peripheral neuropathy pain. Arch Intern Med 1999 159:1931-1937. 13.Raskin J, Pritchett YL, Wang F, D'Souza DN, Waninger AL, Iyengar S, Wernicke JF. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med. 2005;5:346-56. 14.Rice AS, Maton S. Postherpetic Neuralgia Study Group. Gabapentin in postherpetic neuralgia: a randomized, double-blind, placebo-controlled study. Pain 2001;94:215-24. 15.Richter, R. W. et al. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebocontrolled trial. J. Pain 2005;6:253-260. 16.Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo controlled trial. Pain 2004;110:628-638 17.Rowbotham M, Harden N, Stacey B, Bernstein P, Magnus-Miller L. Gabapentin for the treatment of postherpetic neuralgia: a randomized controlled trial. JAMA 1998; 80:1837-42. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 229 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 18.Sabatowski, R. et al. Pregabalin reduces pain and improves sleep and mood disturbances in patients with post-herpetic neuralgia: results of a randomised, placebo controlled clinical trial. Pain 2004;109: 26-35. 19.Serpell MG, for the Neuropathic Pare Study Group. Gabapentin in neuropathic pain syndromes: a randomised, double-blind, placebo-controlled trial. Pain. 2002;99:557-566. 20.Simpson DA.Gabapentin and venlafaxine for the treatment of painful diabetic neuropathy. J Clin Neuromusc disease 2001;3:53-62. 21.Woolf CJ, Mannion RJ. Neuropathic pain: aetiology symtpoms, mechanisms, and management. Lancet 1999;353:1959-64 Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 230 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 5 Enzimi pancreatici: – pancrelipasi La prescrizione a carico del SSN è consentita nei pazienti in una delle seguenti condizioni comportanti maldigestione e malassorbimento di grassi e proteine: – insufficienza pancreatica esocrina conseguente a pancreatite cronica – pancreasectomia – neoplasie del pancreas – fibrosi cistica Background La pancreatite cronica, la fibrosi cistica e le neoplasie del pancreas possono causare una perdita della funzionalità pancreatica con conseguente riduzione della produzione degli enzimi. Evidenze disponibili La supplementazione orale con enzimi pancreatici si rende necessaria per compensare la ridotta o assente secrezione causata da varie malattie del pancreas con maldigestione e malassorbimento di grassi e proteine. Particolari avvertenze Attualmente tutte le preparazioni disponibili sono "gastroprotette" per cui non serve associare alla supplementazione di enzimi pancreatici anche inibitori della secrezione acida gastrica o antiacidi. La posologia è regolata sulla base del numero di scariche alvine, la consistenza e la quantità delle feci riferite dal paziente che assume la terapia sostitutiva con gli enzimi pancreatici. Gli enzimi pancreatici possono provocare irritazione perianale, se assunti in dosaggio eccessivo e periorale e se trattenuti in cavità orale. Possono anche causare nausea, vomito, gonfiore addominale e, raramente, iperuricemia ed iperuricosuria La prescrizione di enzimi pancreatici non è rimborsata dal SSN per il trattamento della semplice dispepsia. Bibliografia 1. Andren-Sandberg, A. Theory and practice in the individualization of oral pancreatic enzyme administration for chronic pancreatitis. Int J Pancreatol 1989; 5:51. 2. De Boeck K, Weren M, Proesmans M, Kerem E. Pancreatitis among patients with cystic fibrosis: correlation with pancreatic status and genotype. Pediatrics 2005; 115:463-9. 3. Dobrilla G. Management of chronic pancreatitis. Focus on enzyme replacement therapy. Int J Pancreatol 1989; 5:17-29 4. Perez MM, Newcomer AD, Moertel CG, Go VL, Dimagno EP. Assessment of weight loss, food intake, fat metabolism, malabsorption, and treatment of pancreatic insufficiency in pancreatic cancer. Cancer 1983;52:346-52. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 231 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 5. Slaff J, Jacobson D, Tillman CR, Curington C, Toskes P. Protease-specific suppression of pancreatic exocrine secretion. Gastroenterology 1984; 87:44-52. 6. Steer ML, Waxman I, Freedman S. Chronic pancreatitis. N Engl J Med 1995;332:1482-90. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 232 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 8 – levocarnitina La prescrizione a carico del SSN, su diagnosi e piano terapeutico di strutture specialistiche, secondo modalità adottate dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: – carenza primaria di carnitina – carenza di carnitina secondaria a trattamento dialitico Background La carnitina è un costituente essenziale dell'organismo e svolge un ruolo di rilievo nel metabolismo energetico a livello mitocondriale; il SSN garantisce pertanto la gratuità dell'erogazione per coloro che hanno carenza primaria di carnitina, evidenziata mediante dosaggio della carnitina nel plasma o in biopsie muscolari. I valori normali di carnitina nel plasma sono di circa 25 mol/L nell'infanzia e di 54 mol/L nell'età adulta; nella pratica clinica viene posta diagnosi di carenza primaria per livelli ematici inferiori a 2 mol/L o per concentrazioni tissutali minori del 10-20% rispetto ai valori normali. Evidenze disponibili Una carenza secondaria può verificarsi durante trattamento dialitico. Sono state pubblicate 3 ricerche (anche se condotte su un numero limitato di pazienti), in cui è stata dimostrata la possibilità di ridurre la posologia dell'eritropoietina in circa il 50% dei casi trattati con 1 grammo di levocarnitina per via endovenosa a fine dialisi. La levocarnitina può pertanto essere usata in regime ospedaliero anche domiciliare, quando sia stato ottimizzato l'apporto di ferro, per ridurre la posologia dell'eritropoietina e per migliorare l'insufficiente risposta alla terapia con eritropoietina che si verifica in alcuni pazienti. Secondo la Società Italiana di Nefrologia per i pazienti in trattamento emodialitico cronico sarebbe preferibile la somministrazione della L-carnitina per via endovenosa alla dose di 20 mg/kg a fine dialisi. Infatti solo il 15% di una dose orale di L-carnitina è assorbita; la rimanente dose viene degradata dai batteri intestinali in trimetilamina (TMA) e trimetilamina-N-ossido (TMAO), sostanze che vengono escrete dal rene nel soggetto normale, ma non nei pazienti in trattamento dialitico. Particolari avvertenze L'accumulo di queste sostanze nei pazienti in dialisi può determinare disturbi cognitivi e alitosi. Il trattamento con levocarnitina dovrebbe essere sospeso se, dopo 4 mesi di terapia, non sia stato possibile dimostrare una riduzione della posologia dell'eritropoietina. Attualmente le sole specialità incluse nella nota sono a base di formulazioni utilizzabili per via orale mentre le evidenze disponibili si riferiscono a studi effettuati con formulazioni utilizzate per via endovenosa. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 233 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Bibliografia 1. Bremer J. The role of carnitine in intracellular metabolism. J Clin Chem Clin Biochem 1990;28:297-301. 2. Caruso U, et al. Effects of L-Carnitine on anemia in aged hemodialysis patients treated with recombinant human erythropoietin: a pilot study. Dial Transplant 1999;27:498-506. 3. Eknoyan G, et al. Practice recommandations for the use of L-carnitine in dialysis-related disorders. National Kidney Foudation. Carnitene Consensus Conference. Am J Kidney Dis 2003;41:868-876. 4. Famularo G, et al. Carnitine deficency: primary and secondary syndromes. In: De Simone C, Famularo G, eds. Carnitine today. Hidelberg: Springer-Verlag, 1997:119-61. 5. Kletzmayr J, et al. Anemia and carnitine supplementation in hemodialyzed patients. Kid Intern 1999;55:S93-106. 6. Labonia WD, et al. L-Carnitine effects on anemia in hemodialyzed patients treated with erythropoietin. Am J Kidney Dis 1995;26:757-64. 7. Pons R, et al. Primary and secondary carnitine deficency syndromes. J Clin Neurol 1995;10:S8-21. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 234 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 9 - 9 bis – ticlopidina – clopidogrel Le note 9 - 9 bis sono abolite e la prescrizione del clopidogrel a carico del SSN è vincolata all'adozione del Piano Terapeutico AIFA riportato in allegato (vedi Allegato 3). Background La nota 9, che limitava la rimborsabilità della ticlopidina a determinate situazioni cliniche, è da ritenersi superata in base all'esperienza e alle conoscenze ormai acquisite su questo farmaco. La limitazione del suo impiego ai soggetti intolleranti all'ASA dovrebbe essere considerata un'acquisizione medica dettata direttamente dal suo limitato profilo di sicurezza, piuttosto che proposta mediante una nota riguardante la sua rimborsabilità. Pertanto, la ticlopidina può essere prescritta a carico del Servizio sanitario nazionale senza le limitazioni delle precedente nota 9 (ora abolita), ma con una particolare attenzione al rischio di reazioni avverse gravi a livello della crasi ematica (leucopenia e/o piastrinopenia). La raccomandazione di sorvegliare tale rischio rimane tuttora valida. Al tempo stesso, le evidenze a sostegno dell'impiego del clopidogrel pubblicate in questi ultimi anni hanno suggerito un superamento delle limitazioni dettate dalla nota 9bis mediante l'adozione di un piano terapeutico AIFA (PT-AIFA), di tipo vincolante, nel quale sono previste le situazioni cliniche per le quali la prescrizione di clopidogrel è a carico del Servizio sanitario nazionale. Evidenze disponibili In base alla metanalisi del Antithrombotic Trialists' Collaboration la ticlopidina si è dimostrata efficace al pari di altri antiaggreganti nella prevenzione degli eventi vascolari gravi in pazienti ad alto rischio. Inoltre, da una metanalisi sull'impiego a breve termine di antiaggreganti in aggiunta all'ASA dopo intervento di stent coronarico non sono emerse differenze significative tra ticlopidina e clopidogrel. Per quanto riguarda il clopidogrel, le principali evidenze a sostegno delle situazioni cliniche ammesse alla rimborsabilità nel piano terapeutico AIFA (vincolante) sono le seguenti. – Sindrome coronarica acuta senza innalzamento del tratto ST in associazione con ASA: si veda lo studio di Yusuf et al., 2001. – Angioplastica percutanea (PTCA) con applicazione di stent: si veda lo studio PCICURE di Metha et al, 2001, nonché le linee guida American College of Cardiology/American Heart Association del 2005. – Terapia antiaggregante a breve termine per la prevenzione secondaria dell'infarto in associazione con ASA: si vedano gli studi COMMIT e CLARITY-TIMI. – Terapia antiaggregante a lungo termine per la prevenzione secondaria dell'infarto e dell'ictus: si vedano lo studio CAPRIE e l'analisi post-hoc dello studio stesso, pubblicata nel 2004 su Stroke. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 235 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Particolari avvertenze Per la ticlopidina, una grave leucopenia, spesso reversibile all'interruzione del trattamento, è la complicanza principale (circa dell'1% dei pazienti). Si può presentare un fenomeno ancora più grave quale la porpora trombotica trombocitopenica. Sono stati documentati anche casi di anemia aplastica. Il rischio di alterazioni ematologiche anche gravi, leucopenia e/o piastrinopenia rende indispensabile nei pazienti trattati con ticlopidina un monitoraggio mediante l'esecuzione periodica dell'esame emocromocitometrico Anche per il clopidogrel sono stati documentati casi di porpora trombocitopenica. Va inoltre tenuto presente il rischio di sanguinamento nei pazienti trattati. Tale rischio di base aumenta con l'associazione con ASA. Bibliografia 1. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996;348:1329-39. 2. ACC/AHA/SCAI 2005 Guideline Update for Percutaneous Coronary Intervention--summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2006;113:156-75 3. Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002;324:71-86. Erratum in: BMJ 2002;3247:141. 4. Bennett CL, Davidson CJ, Raisch DW, Weinberg PD, Bennett RH, Feldman MD. Thrombotic thrombocytopenic purpura associated with ticlopidine in the setting of coronary artery stents and stroke prevention. Arch Intern Med 1999;159:2524-8. 5. Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, Collins R, Liu LS; COMMIT (Clopidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet 2005;366:1607-21. 6. Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, Andersen M, Lassen AT. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ 2006;333:726. 7. Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, Malmberg K, Rupprecht H, Zhao F, Chrolavicius S, Copland I, Fox KA; Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE) Investigators. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet 2001;358:527-33. 8. Page, Y, Tardy, B, Zeni, F, et al. Thrombotic thrombocytopenic purpura related to ticlopidine. Lancet 1991; 337:774-776. 9. Paradiso-Hardy FL, Angelo CM, Lanctot KL, Cohen EA. Hematologic dyscrasia associated with ticlopidine therapy: evidence for causality. CMAJ 2000;163:1441-8. 10.Ringleb et al. Benefit of Clopidogrel Over Aspirin Is Amplified in Patients With a History of Ischemic Events. Stroke 2004;35:528-532. 11.Sabatine MS, Cannon CP, Gibson CM, Lopez-Sendon JL, Montalescot G, Theroux P, Claeys MJ, Cools F, Hill KA, Skene AM, McCabe CH, Braunwald E; CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with STsegment elevation. N Engl J Med 2005;352:1179-89. 12.Schleinitz MD, Olkin I, Heidenreich PA. Cilostazol, clopidogrel or ticlopidine to prevent subacute stent thrombosis: a meta-analysis of randomized trials. Am Heart J 2004;6:990-7. 236 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 13.Symeonidis A, Kouraklis-Symeonidis A, Seimeni U, Galani A, Giannakoulas N, Fragopanagou E, Tiniakou M, Matsouka P, Zoumbos N. Ticlopidine-induced aplastic anemia: two new case reports, review, and meta-analysis of 55 additional cases. Am J Hematol 2002;71:24-32. 14.Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK; Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001;7:494-502. 15.Zakarija A, Bandarenko N, Pandey DK, Auerbach A, Raisch DW, Kim B, Kwaan HC, McKoy JM, Schmitt BP, Davidson CJ, Yarnold PR, Gorelick PB, Bennett CL. Clopidogrel-associated TTP: an update of pharmacovigilance efforts conducted by independent researchers, pharmaceutical suppliers, and the Food and Drug Administration. Stroke 2004;35:533-7. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 237 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 10 La prescrizione a carico del SSN è limitata ai pazienti con: – acido folico – anemie megaloblastiche dovute a carenza di vitamina – cianocobalamina B12 e/o di folati – idrossicobalamina Background La cianocobalamina e l'acido folico hanno un ruolo fondamentale per la crescita e la replicazione cellulare. Il sistema emopoietico risulta particolarmente sensibile alla loro carenza in quanto presenta un elevato turn-over cellulare. Il deficit di cobalamina e/o acido folico rappresenta la causa della maggior parte delle anemie megaloblastiche. In questi casi, l'approccio terapeutico è rappresentato dalla terapia sostitutiva. Evidenze disponibili Il deficit di cobalamina può essere dovuto a malassorbimento causato ad esempio da un'insufficiente produzione di fattore intrinseco o da malattie dell'ileo terminale. L'anemia perniciosa è considerata la causa più comune di deficit di cobalamina ed è dovuta all'assenza del fattore intrinseco provocata da atrofia della mucosa gastrica o da distruzione autoimmunitaria delle cellule parietali. Il deficit di acido folico può essere dovuto ad un apporto insufficiente, ad aumentato fabbisogno e a malassorbimento. Particolari avvertenze Le formulazioni di acido folico, al dosaggio di 400 mcg, autorizzate per la profilassi primaria dei difetti dello sviluppo del tubo neurale in donne in età fertile che stanno pianificando una gravidanza, sono rimborsate dal SSN e non sono soggette a nota limitativa. Bibliografia 1. Bender D.A. Megaloblastic anaemia in vitamin B12 deficiency. Br J Nutr 2003;89:439-41 2. Chanarin I, R Deacon, M Lumb, J Perry. Cobalamin and folate:recent developments. JClin Pathol 1992;45:277-283. 3. Kuzminski AM, DelGiacco EJ, Allen RH, Stabler SP, Lindenbaum J.Effective treatment of cobalamin deficiency with oral cobalamin. Blood 1998;92:1191-8. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 238 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 11 La prescrizione a carico del SSN è limitata alle seguenti condizioni: – acido folinico e – recupero (rescue) dopo terapia con antagonisti dell'acido suoi analoghi diidrofolico Background I farmaci antagonisti dell'acido folico agiscono inibendo la deidrofolato reduttasi enzima coinvolto nel metabolismo dei folati, per questo motivo possono provocare effetti tossici a carico di cellule a divisione rapida quali il midollo osseo e l'epitelio gastro-intestinale. Evidenze disponibili La somministrazione di acido folinico risolve la deplezione provocata dalla somministrazione di antagonisti dell'acido folico e in particolare: a) nelle forme orali e nelle forme iniettabili per uso ospedaliero, per contrastare la tossicità a livello del midollo emopoietico, della mucosa gastrointestinale e della cute dopo somministrazione a scopo antitumorale del metotrexato, antagonista della diidrofolato reduttasi; b) nelle forme iniettabili per uso ospedaliero, in associazione a 5FU, per modularne l'efficacia terapeutica. Particolari avvertenze L'utilizzo del farmaco per altre indicazioni non ha motivazioni ai fini dell'ammissione alla rimborsabilità. Bibliografia 1. Comella P, Massidda B, Filippelli G, Natale D, Farris A, Buzzi F, Tafuto S, Maiorino L, Palmeri S, De Lucia L, Mancarella S, Leo S, Roselli M, Lorusso V, De Cataldis G. Safety and efficacy of irinotecan plus high-dose leucovorin and intravenous bolus 5-fluorouracil for metastatic colorectal cancer: pooled analysis of two consecutive southern Italy cooperative oncology group trials. Clin Colorectal Cancer 2005;5:203-10. 2. Ferguson WS, Goorin AM.Current treatment of osteosarcoma. Cancer Invest 2001;19:292-315. 3. Goorin A, Strother D, Poplack D, Letvak LA, George M, Link M. Safety and efficacy of lleucovorin rescue following high-dose methotrexate for osteosarcoma. Med Pediatr Oncol 1995;24:362-7. 4. Jahnke K, Korfel A, Martus P, Weller M, Herrlinger U, Schmittel A, Fischer L, Thiel E; on the behalf of the German Primary Central Nervous System Lymphoma Study Group (G-PCNSLSG). High-dose methotrexate toxicity in elderly patients with primary central nervous system lymphoma. Ann Oncol 2005;16:445-9. 5. Sobrero A, Frassineti G, Falcone A, Dogliotti L, Rosso R, Di Costanzo F, Bruzzi P; INTACC. Adjuvant sequential methotrexate 5-fluorouracil vs 5-fluorouracil plus leucovorin in radically resected stage III and high-risk stage II colon cancer. Br J Cancer 2005;92:24-9. Erratum in: Br J Cancer 2005;93:733. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 239 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 12 Eritropoietina e nuove preparazioni: La nota 12 rimane in vigore fino alla pubblicazione del – darbepoetina D Piano Terapeutico AIFA, adottato con atto separato. – epoetina D – epoetina E 240 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 13 La prescrizione a carico del SSN è limitata ai pazienti affetti da: Ipolipemizzanti: Fibrati: – bezafibrato – fenofibrato – gemfibrozil Statine: – atorvastatina – fluvastatina – lovastatina – pravastatina – rosuvastatina – simvastatina – simvastatina + ezetimibe Altri: – omega 3 etilesteri – dislipidemie familiari bezafibrato, fenofibrato, gemfibrozil atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina, simvastatina, simvastatina + ezetimibe omega 3 etilesteri – ipercolesterolemia non corretta dalla sola dieta: • in soggetti a rischio elevato di un primo evento cardiovascolare maggiore (rischio a 10 anni > 20% in base alle Carte di Rischio del Progetto Cuore dell'Istituto Superiore di Sanità) (prevenzione primaria) • in soggetti con coronaropatia documentata o pregresso ictus o arteriopatia obliterante periferica o pregresso infarto o diabete (prevenzione secondaria) atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina, simvastatina, simvastatina + ezetimibe – in soggetti con pregresso infarto del miocardio (prevenzione secondaria) omega 3 etilesteri – iperlipidemie non corrette dalla sola dieta: • indotte da farmaci (immunosoppressori, antiretrovirali e inibitori della aromatasi) • in pazienti con insufficienza renale cronica atorvastatina, fluvastatina, lovastatina, pravastatina, rosuvastatina, simvastatina, simvastatina + ezetimibe bezafibrato, fenofibrato, gemfibrozil, omega 3 etilesteri Background La corretta alimentazione rappresenta, assieme all'aumento dell'attività fisica ed alla sospensione del fumo, il primo provvedimento da attuare nel controllo del rischio cardiovascolare. Solo dopo tre mesi di dieta adeguatamente proposta al paziente ed eseguita in modo corretto, dopo aver escluso le cause di dislipidemia familiare o dovute ad altre patologie (ad esempio l'ipotiroidismo oppure patologie HIV correlate) si può valutare il Rischio Cardiovascolare Globale Assoluto (RCGA) e, se superiore al 20% a 10 anni, iniziare una terapia ipolipemizzante. Le correzioni delle abitudini alimentari, l'aumento dell'attività fisica insieme con la sospensione del fumo devono essere significativi, permanenti e mantenuti anche quando viene iniziata la terapia farmacologica. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 241 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i L'ultima revisione della nota 13 è stata caratterizzata dall'introduzione delle carte di rischio italiane prodotte dall'Istituto Superiore di Sanità all'interno del Progetto Cuore (www.cuore.iss.it). Nelle carte di rischio italiane si fa riferimento al RCGA stimato a 10 anni sia per gli uomini che per le donne per eventi fatali e non fatali riferibili a malattia cardiovascolare maggiore (in particolare infarto del miocardio sicuro e possibile, morte coronarica, morte improvvisa, ictus e interventi di rivascolarizzazione). A questo proposito è importante ricordare che il calcolo del RCGA per la rimborsabilità delle statine in prevenzione primaria si è basato fino al 2004 su differenti carte di rischio sviluppate su popolazioni statunitensi, carte che tendevano a sovrastimare il RCGA nella nostra popolazione. Dislipidemie familiari Le dislipidemie familiari sono malattie su base genetica a carattere autosomico (recessivo, dominante o co-dominante a seconda della malattia) caratterizzate da elevati livelli di alcune frazioni lipidiche del sangue e da una grave e precoce insorgenza di malattia coronarica. Le dislipidemie sono state finora distinte secondo la classificazione di Frederickson, basata sull'individuazione delle frazioni lipoproteiche aumentate. Questa classificazione è stata superata da una genotipica. Ad oggi non sono presenti criteri internazionali consolidati per la diagnosi molecolare di alcune delle forme familiari, pertanto vengono utilizzati algoritmi diagnostici che si basano sulla combinazione di criteri biochimici, clinici ed anamnestici. Tra le forme familiari quelle che più frequentemente si associano a cardiopatia ischemica prematura sono l'ipercolesterolemia familiare, l'iperlipidemia familiare combinata e la disbetalipoproteinemia. Ipercolesterolemia familiare monogenica (prevalenza 1:500) Malattia genetica in genere dovuta a mutazioni del gene che codifica il recettore delle LDL. Per la diagnosi di queste forme, le metodiche di biologia molecolare sono specifiche intorno all'80%, per cui ai fini diagnostici esiste consenso internazionale sull'utilizzo di criteri biochimici, clinici ed anamnestici I cardini di questi criteri, sostanzialmente condivisi da tutti gli algoritmi diagnostici proposti, includono: • Colesterolemia LDL superiore a 200 mg/dl più • Trasmissione verticale della malattia, documentata dalla presenza di tale alterazione biochimica nei familiari del probando (in questo caso l'indagine biomolecolare praticamente sempre conferma la diagnosi) In assenza di informazioni sul profilo lipidico dei familiari il sospetto è molto forte se insieme alla colesterolemia LDL superiore a 200 mg/dl ci sono: • Presenza di xantomatosi tendinea nel brobando oppure • un'anamnesi positiva nei familiari di I grado per cardiopatia ischemica precoce (prima dei 55 anni negli uomini, prima dei 60 nelle donne) o anche se presente grave ipercolesterolemia in bambini prepuberi 242 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Iperlipidemia combinata familiare (prevalenza 1:100) Espressione fenotipica collegata a molte variazioni genetiche (nello studio EUFAM se ne sono contate per 27 geni) con meccanismi fisiopatologici legati al metabolismo delle VLDL. Eziologia non è stata ancora chiarita e i criteri diagnostici sui quali è presente un consenso sono: • Colesterolemia LDL superiore a 160 mg/dl e/o trigliceridemia superiore a 200 mg/dl più • Documentazione nella stessa famiglia (I grado) di più casi di ipercolesterolemia e/o ipertrigliceridemia (fenotipi multipli) Oppure in assenza di documentazione sui familiari, la dislipidemia è fortemente sospetta in presenza anamnestica o clinica o strumentale di arteriosclerosi precoce. E' indispensabile per la validità della diagnosi di iperlipidemia combinata familiare: – Escludere le famiglie in cui siano presenti unicamente ipercolesterolemia o ipertrigliceridemia – Escludere tutte le forme di iperlipidemie secondarie (da malattie endocrine, epato-biliari, renali, da farmaci) Disbetalipoproteinemia familiare Patologia molto rara che si manifesta nei soggetti portatori dell'isoforma apoE2 in modo omozigote <1:10.000. I criteri diagnostici includono: • Valori di colesterolemia e trigliceridemia intorno ai 400 mg/dl per entrambi più • Presenza di banda larga (broad E alla elettroforesi) La presenza di uno di questi fattori aumenta la validità della diagnosi: • xantomi tuberosi, • xantomi striati palmari (strie giallastre nelle pieghe interdigitali o sulla superficie palmare delle mani, da considerare molto specifici). Avvertenza I centri specialisti, già identificati per le certificazioni, per le iperlipidemie possono fungere da supporto per la decisione diagnostica e per la soluzione di eventuali quesiti terapeutici. Ipercolesterolemia non corretta dalla sola dieta Nelle malattie cardiovascolari non è individuabile una causa unica. Sono noti diversi fattori che aumentano nella persona il rischio di sviluppare la malattia e predispongono l'organismo ad ammalarsi. I più importanti sono: abitudine al fumo di sigaretta, diabete, valori elevati della colesterolemia, valori elevati della pressione arteriosa, età e sesso e, inoltre, la scarsa attività fisica, l'obesità e la familiarità alla malattia. L'entità del rischio che ogni persona ha di sviluppare la malattia dipende dalla combinazione dei fattori di rischio o meglio dalla combinazione dei loro livelli; il fattore Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 243 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i più importante è l'età, pertanto il rischio aumenta con l'avanzare dell'età, ma, attraverso un sano stile di vita, è possibile mantenerlo a un livello favorevole. La nuova nota 13 stabilisce per il trattamento ipocolesterolemizzante non un valore soglia verticale ma un valore decisionale basato sul RCGA. Per convenzione internazionale è considerato a rischio elevato un paziente con rischio 20% a 10 anni. Le carte del Progetto Cuore non consentono la valutazione del rischio cardiovascolare per la popolazione con età superiore a 70 anni. Ciò anche in assenza di una serie di studi specificatamente dedicati a questa fascia di età. Per tale motivo si ritiene che in questi casi la valutazione del rischio debba essere lasciata alla valutazione del singolo medico che terrà conto delle comorbidità. Iperlipidemie non corrette dalla sola dieta Le malattie cardiovascolari sono la principale causa di morte dei pazienti con insufficienza renale cronica (IRC). La National Kidney Foundation, nello stabilire le Linee Guida per il trattamento dell'IRC, ritiene che l'incidenza di danno aterosclerotico in pazienti con IRC sia superiore a quella della popolazione generale. Per tale motivo richiede un accurato controllo dei fattori di rischio, tra cui la dislipidemia. Per pazienti adulti con IRC in stadio 5 (GRF<15ml/min o trattamento sostitutivo della funzione renale) il trattamento farmacologico delle dislipidemie è indicato, nel caso di insuccesso di dieta e cambiamento di abitudini di vita, per livelli di trigliceridi 500 mg/dL con fibrati, per livelli di LDL-C 130 mg/dL con statine a basse dosi e per livelli di LDL-C<100 mg/dL, trigliceridi 200 mg/dL e colesterolo non HDL (tot C meno HDL-C) 130 mg/dL. Le statine sembrano efficaci nella prevenzione di eventi vascolari in pazienti vasculopatici e con moderata IRC e sono in grado di rallentare la progressione della malattia renale. Viene raccomandata la riduzione del dosaggio in funzione del filtrato glomerulare. Nei pazienti con infezione da HIV, a seguito dell'introduzione della HAART (terapia antiretrovirale di combinazione ad alta efficacia), è frequente l'insorgenza di dislipidemia indotta dai farmaci antiretrovirali che, nel tempo, può contribuire ad un aumento dell'incidenza di eventi cardio-vascolari, sviluppabili anche in giovane età. Da studi di coorte prospettici, se pur non tutti concordi, emerge un rischio relativo di eventi ischemici vascolari pari a circa 1.25 per anno con incremento progressivo e proporzionale alla durata di esposizione alla terapia antiretrovirale. La prevalenza di dislipidemia nei pazienti HIV positivi è variabile in rapporto al tipo di terapia antiretrovirale, comunque è intorno al 25% per la colesterolemia e oltre il 30% per l'ipertrigliceridemia. Alla luce di questi dati, nella pratica clinica l'utilizzo di farmaci ipolipemizzanti nei pazienti con infezione da HIV in trattamento antiretrovirale si è reso necessario, laddove la riduzione dei fattori di rischio cardiovascolare "modificabili" non si riveli sufficiente a mantenere i valori di colesterolemia e trigliceridemia entro i limiti consigliati dalla Carta del Rischio Cardiovascolare dell'ISS e laddove, per motivi clinici e/ o virologici, non sia sostituibile la terapia antiretrovirale in atto. 244 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Evidenze disponibili Vengono considerati a rischio elevato i soggetti che, in base alla combinazione dei 6 principali fattori (età, sesso, diabete, fumo, valori di pressione arteriosa e di colesterolemia), abbiano un rischio uguale o maggiore del 20% di sviluppare un evento cardiovascolare nei successivi 10 anni. Tale rischio può essere stimato utilizzando la carta del rischio cardiovascolare elaborata dall'Istituto Superiore di Sanità. In alternativa è possibile utilizzare l'algoritmo elettronico cuore.exe dell'Istituito Superiore di Sanità, scaricabile gratuitamente dal sito del Progetto Cuore, (www.cuore.iss.it). Tale algoritmo è puntuale e considera in aggiunta ai sei fattori della carta la HDL-colesterolemia e la terapia antipertensiva. Starà al giudizio del medico modulare verso il basso la stima del rischio nei pazienti ipercolesterolemici nei quali è già in atto un controllo farmacologico o non farmacologico di altri fattori di rischio (obesità, ipertensione, diabete). In tali casi, il medico potrà decidere quale o quali trattamenti farmacologici privilegiare, anche in base ai livelli dei diversi fattori considerati, non essendo proponibile assumere medicine per ognuno di essi. Particolari avvertenze L'uso dei farmaci ipolipemizzanti deve essere continuativo e non occasionale. Lo stesso, comunque, va inserito in un contesto più generale di controllo degli stili di vita (alimentazione, fumo, attività fisica, etc.). La strategia terapeutica (incluso l'impiego delle statine) va definita, in prevenzione primaria, in base alla valutazione del rischio cardiovascolare globale e non di ogni singolo fattore di rischio, facendo riferimento alle Carte di Rischio Cardiovascolare elaborate dall'Istituto Superiore di Sanità all'interno del Progetto Cuore (www.cuore.iss.it). Le Carte del Rischio dell'ISS saranno sottoposte a continua verifica ed aggiornamento e sono collegate con un progetto di ricerca denominato RiACE (Rischio Assoluto Cardiovascolare-Epidemiologia) promosso e finanziato dall'Agenzia Italiana del Farmaco (AIFA), per verificare nella pratica assistenziale della Medicina Generale la trasferibilità, l'applicabilità, i carichi assistenziali e gli esiti della prevenzione cardiovascolare primaria e secondaria. Bibliografia 1. Anderson JW. Diet first, then medication for hypercholesterolemia. JAMA. 2003;290:531-3. 2. Arner P. Is familial combined hyperlipidaemia a genetic disorder of adipose tissue? Curr Opin Lipidol.1997;8:89-94. 3. Austin MA, Brunzell JD, Fitch WL, Krauss RM. Inheritance of low density lipoprotein subclass patterns in familial combined hyperlipidemia. Arteriosclerosis 1990;10:520-530. 4. Austin MA, Horowitz H, Wijsman E, Krauss RM, Brunzell J. Bimodality of plasma apolipoprotein B levels in familial combined hyperlipidemia. Atherosclerosis 1992;92:67-77. 5. Babirak SP, Brown BG, Brunzell JD. Familial combined hyperlipidemia and abnormal lipoprotein lipase. Arterioscler Thromb 1992;12:1176-1183. 6. Brunzell JD, Albers JJ, Chait A, Grundy SM, Groszek E, McDonald GB. Plasma lipoproteins in familial combined hyperlipidemia and monogenic familial hypertriglyceridemia. J Lipid Res 1983;24:147-155. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 245 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 7. Cullen P, Farren B, Scott J, Farrall M. Complex segregation analysis provides evidence for a major gene acting on serum triglyceride levels in 55 British families with familial combined hyperlipidemia. Arterioscler Thromb 1994;14:1233-1249. 8. Downs JR, Clearfield M, Weis S, Whitney E, Shapiro, DR, Beere PA, Langendorfer A, Stein EA, Kruyer W, Gotto AM Jr, for the AFCAPS/TexCAPS Research Group. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. JAMA 1998; 279: 1615-22. 9. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. JAMA 2001;285:2486-2497. 10.GISSI-Prevenzione Investigators (Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico). Dietary supplementation with n-3polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet 1999;354:447-455. 11.Goldstein JL, Schrott HG, Hazzard WR, Bierman EL, Motulsky AG. Hyperlipidemia in coronary heart disease. II. Genetic analysis of lipid levels in 176 families and delineation of a new inherited disorder, combined hyperlipidemia. J Clin Invest 1973;52:1544-1568 12.Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med 1998; 339: 229-34. 13.Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensinconvertingenzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145-53. 14.Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high risk individuals: a randomised placebo-controlled trial." Lancet 2002; 360: 7-22 15.Il Progetto CUORE - Studi longitudinali. Ital Heart J 2004; 5: 94S-101S 16.Kissebah AH, Alfarsi S, Evans DJ. Low density lipoprotein metabolism in familial combined hyperlipidemia: mechanism of the multiple lipoprotein phenotypic expression. Arteriosclerosis 1984;4:614-624. 17.L. Palmieri, C. Donfrancesco, S. Giampaoli et al. Favorable cardiovascular risk profile and 10-year coronary heart disease incidence in women and men: results from the Progetto CUORE. Europ J Cardiov Prev 2006; 13:562-570 18.L. Palmieri, S. Panico, D. Vanuzzo et al. per il Gruppo di ricerca del Progetto CUORE. La valutazione del rischio cardiovascolare globale assoluto: il punteggio individuale del Progetto CUORE. Ann Ist Sup Sanità 2004; 40(4). 19.M. Ferrario, P. Chiodini, L.E. Chambless et al. for the CUORE Project Research Group. Prediction of coronary events in a low incidence population. Assessing accuracy of the CUORE Cohort Study prediction equation. Int J Epidemiol 2005;19:1-9 20.Malmberg K, Yusuf S, Gerstein HC, Brown J, Zhao F, Hunt D, Piegas L, Calvin J, Keltai M, Budaj A, for the OASIS Registry Investigators. Impact of diabetes on long-term prognosis in patients with unstable angina and non-Q-wave myocardial infarction: results of the OASIS (Organization to Assess Strategies for Ischemic Syndromes) Registry. Circulation 2000; 102: 1014-9. 21.National Institutes of Health. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Final Report. NIH Publication No. 02-5215 September 2002; VII-1. 22.National Institutes of Health. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Final Report. NIH Publication No. 02-5215 September 2002; II-50. 246 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 23.Pajukanta P, Terwilliger JD, Perola M, Hiekkalinna T, Nuotio I, Ellonen P, Parkkonen M, Hartiala J, Ylitalo K, Pihlajamaki J, Porkka K, Laakso M, Viikari J, Ehnholm C, Taskinen MR, Peltonen L. Genomewide scan for familial combined hyperlipidemia genes in Finnish families, suggesting multiple susceptibility loci influencing triglyceride, cholesterol, and apolipoprotein B levels. Am J Hum Genet 1999;64:1453-1463. 24.Porkka KV, Nuotio I, Pajukanta P, Ehnholm C, Suurinkeroinen L, Syvanne M, Lehtimaki T, Lahdenkari AT, Lahdenpera S, Ylitalo K, Antikainen M, Perola M, Raitakari OT, Kovanen P, Viikari JS, Peltonen L, Taskinen MR. Phenotype expression in familial combined hyperlipidemia. Atherosclerosis 1997;133:245-253. 25.Prevenzione primaria delle malattie cardiovascolari. Bollettino di Informazione sui Farmaci 2004;1:19-23. 26.Rubins HB, Robins SJ, Collins D, Fye CL, Anderson JW, Elam MB, Faas FH, Linares E, Schaefer EJ, Schectman G, Wilt TJ, Wittes J, for the Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial Study Group. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N Engl J Med 1999; 341: 410-8. 27.S. Giampaoli, L. Palmieri, S. Panico et al. Favorable cardiovascular risk profile (Low Risk) and 10-year stroke incidence in women and men: findings on 12 Italian population samples. Am J Epid 2006; 163: 893-902 28.Sacks FM, Tonkin AM, Shepherd J, Braunwald E, Cobbe S, Hawkins CM, Keech A, Packard C, Simes J, Byington R, Furberg CD, for the Prospective Pravastatin Pooling Project Investigators Group. Effect of pravastatin on coronary disease events in subgroups defined by coronary risk factors: the Prospective Pravastatin Pooling Project. Circulation 2000; 102: 1893-900. 29.Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344: 1383-9. 30.Sever PS, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the AngloScandinavian Cardiac Outcomes Trial-Lipid-Lowering Arm (ASCOT-LLA): a multicentre randomised trial. Lancet 2003; 361:1149-1158. 31.Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, Macfarlane PW, McKillop JH, Packard CJ, for the West of Scotland Coronary Prevention Study Group. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995;333: 1301-7 32.Suviolahti E, Lilja HE, Pajukanta P. Unraveling the complex genetics of familial combined hyperlipidemia. Ann Med 2006;385:337-51. 33.Venkatesan S, Cullen P, Pacy P, Halliday D, Scott J. Stable isotopes show a direct relation between VLDL apoB overproduction and serum triglyceride levels and indicate a metabolically and biochemically coherent basis for familial combined hyperlipidemia. Arterioscler Thromb 1993;13:1110-1118. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 247 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 15 La prescrizione a carico del SSN, s u diagnosi e piano terapeutico di strutture specialistiche delle Aziende Sanitarie, è limitata alle seguenti condizioni: – dopo paracentesi evacuativa a largo volume nella cirrosi epatica – Albumina umana – grave ritenzione idrosalina nella cirrosi ascitica, nella sindrome nefrosica o nelle sindromi da malassorbimento (ad es. intestino corto post-chirurgico o da proteino-dispersione), non responsiva a un trattamento diuretico appropriato, specie se associata ad ipoalbuminemia ed in particolare a segni clinici di ipovolemia Background Il trattamento con albumina ha indicazioni non frequenti ed è spesso soggetto ad uso incongruo, sia in ospedale sia nella pratica extraospedaliera. Come documentato dalle evidenze riportate nel testo che segue, l'ipoalbuminemia di per sé non è un'indicazione all'infusione di albumina. L'uso di albumina o di altri colloidi in pazienti in condizioni critiche associate o no a ipovolemia non è preferibile all'uso di soluzioni di cristalloidi. Le soluzioni concentrate di albumina hanno specifiche indicazioni nella cirrosi, rappresentate dalla protezione della funzione renale post-paracentesi e nella peritonite batterica spontanea. Evidenze disponibili Secondo linee guida non recenti elaborate da una Consensus Conference, l'albumina può trovare indicazione in pazienti in condizioni critiche con ipovolemia, ustioni estese o ipoalbuminemia. Più recentemente sono state pubblicate 3 meta-analisi relative all'impiego terapeutico dell'albumina: non vi sono evidenze che l'albumina riduca la mortalità in pazienti in condizioni particolarmente critiche. La prima e la seconda (quest'ultima è un aggiornamento della prima), rispettivamente di 23 e 32 trial, hanno esaminato gli effetti dell'albumina in pazienti in condizioni critiche e con ipovolemia, ustioni o ipoalbuminemia. La prima meta-analisi mostra una mortalità più alta nei pazienti trattati con albumina che in quelli trattati con soluzioni di cristalloidi sia nei pazienti con ipovolemia, che in quelli con ustioni o con ipoalbuminemia. I risultati della seconda metanalisi non mostrano evidenze tali per cui l'albumina, nella stessa tipologia di pazienti, possa ridurre la mortalità: secondo questo aggiornamento, nei pazienti con ustioni è confermato che l'uso di albumina possa aumentare il rischio di morte, mentre nei pazienti con ipovolemia o con ipoalbuminemia il rischio aumenta ma non è stastisticamente significativo (RR = 1,01; IC 95%: 0,92 - 1,10 per gli ipovolemici e RR = 1,38; IC 95%: 0,94 - 2,03 per i pazienti con ipoalbuminemia). I risultati della prima di queste due meta analisi furono esaminati da un gruppo di esperti, riunito dal Committee on Safety of Medicines inglese, il quale concluse che non erano presenti sufficienti evidenze per ritirare l'albumina dal mercato, racco- 248 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i mandando tuttavia prudenza e, in particolare, la sorveglianza per eventuale sovraccarico circolatorio nell'eventuale uso dell'albumina in queste condizioni. La terza meta-analisi. ha esaminato separatamente i trial sull'uso di albumina in differenti condizioni. I risultati evidenziano che l'aumento del rischio di mortalità correlato all'uso di albumina in pazienti gravi è probabilmente basso; i dati mostrano una tendenza, anche se non significativa, all'aumento di mortalità dopo trattamento con albumina nei pazienti chirurgici o traumatizzati (RR = 1,12; IC 95%: 0,85-1,46), negli ustionati (RR = 1,76; IC 95%: 0,97-3,17), e nei pazienti con ipoalbuminemia (RR = 1,59; IC 95%: 0,91-2,78). Risultati sovrapponibili di effetti sfavorevoli dell'albumina si ritrovano in altre due revisioni sistematiche, che esaminavano i trial sull'uso di albumina o di altri colloidi. Anche una recente metanalisi non ha evidenziato un minor rischio di morte associato all'uso di colloidi versus cristalloidi nei pazienti critici. Di maggior interesse per la pratica extraospedaliera è l'eventuale impiego di albumina nella cirrosi e nelle sindromi nefrosiche. Nella cirrosi è generalmente ammesso, con qualche riserva, un effetto favorevole dell'albumina dopo paracentesi evacuativa; più recentemente è stato riportato un effetto favorevole significativo di quantità molto alte di albumina sulla mortalità nella peritonite batterica spontanea (SBP, dall'inglese Spontaneous Bacterial Peritonitis), che rappresenta una severa e frequente complicazione nei pazienti cirrotici con ascite. Limiti del trial sono la mancanza di cecità, e di un dose finding che spieghi la scelta di dosi così elevate di albumina. In entrambi i casi l'effetto sembra mediato attraverso la protezione della funzione renale. Uno schema di trattamento multifasico non usuale, studiato in un trial, ha mostrato un debole effetto favorevole di brevi cicli di albumina nei pazienti con grave ritenzione idrosalina non responsiva al trattamento diuretico; nello stesso trial, però, trattamenti prolungati non miglioravano la sopravvivenza né riducevano significativamente le complicanze. Nella meta-analisi di Wilkes e Navickis sono inclusi quattro trial sull'uso di albumina nella cirrosi, esaminati separatamente da quelli condotti in altra patologia. Fra i quattro trial sono compresi i due sopracitati. Il risultato della meta-analisi dei quattro trial non è significativo (RR = 0,93; IC 95%: 0,671,28); è significativo l'aumento di sopravvivenza nel trial condotto nella SBP, mentre il risultato puntiforme degli altri tre trial è sul versante dell'aumento di mortalità, con intervallo di confidenza che attraversa la linea di equivalenza. Un trial recente dimostrerebbe un aumento di sopravvivenza in pazienti trattati long term con infusioni (25g/settimana nel primo anno, 25g/ogni due settimane nel secondo anno). Tuttavia, i risultati negativi degli studi precedenti e riserve metodologiche di questo studio più recente (p. es: 10 anni per reclutare 100 pazienti consecutivi con cirrosi; sovrapposizione dei 10 anni di reclutamento con i 4 anni di reclutamento di un precedente trial dello stesso gruppo, senza che sia chiaro il rapporto fra i due trial; paracentesi non associate ad infusioni di albumina; analisi per protocol, senza indicazione di withdrawal o cambiamenti di gruppo; non cecità e non indicazione di cecità degli sperimentatori che hanno condotto le analisi suggeriscono di attendere altri trial. Una ulteriore linea di evidenza emerge dall'esame di revisioni non sistematiche e di trattati recenti, che non citano l'impiego dell'albumina come complemento alla terapia diuretica nella cirrosi ascitica; fra queste revisioni, l'aggiornamento al maggio 2000 delle linee guida dello University Hospital Consortium limiterebbe Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 249 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i l'uso dell'albumina alle paracentesi evacuative e conclude che "l'uso dell'albumina senza paracentesi dovrebbe essere evitato". Occasionalmente, l'uso dell'albumina può apparire logico nella sindrome nefrosica o nelle condizioni di malassorbimento o proteino-dispersione intestinale, in cui l'edema massivo è associato a ipovolemia clinicamente manifesta (ipotensione, tachicardia, oliguria). Particolari avvertenze Il plasma e i sostituti del plasma sono spesso usati in pazienti molto gravi, in condizioni instabili. Pertanto è necessario un controllo molto accurato e la terapia idratante ed elettrolitica dovrebbe essere di continuo aggiustata in base alle condizioni del paziente. L'albumina non è rimborsata dal SSN per altre indicazioni autorizzate. Bibliografia 1. Choi PT, et al. Crystalloids vs colloid in fluid resuscitation: a systematic review. Crit Care Med 1999;27:200-10. 2. Cochrane Injuries Group Albumin Reviewers. Human albumin administration in critically ill patients: systematic review of randomised controlled trial. BMJ 1998;317:235-40. 3. Gentilini P, et al. Albumin improves the response to diuretics in patients with cirrhosis and ascites: results of a randomized, controlled trial. J Hepatol 1999;30:639-45. 4. Gines A, et al. Randomized trial comparing albumin, dextran 70, and polygeline in cirrhotic patients with ascites treated with paracentesis. Gastroenterology 1996;111:1002-10. 5. Gines P, et al. Ascites, hepatorenal syndrome, and spontaneous bacterial peritonitis: prevention and treatment. In: McDonald J, et al. Evidence-based gastroenterology and hepatology. BMJ Publ Group, eds. 1999:427-42. 6. Gines P, et al. Renal complications of liver disease. In: Schiff's diseases of the liver, 8th ed. Lippincott Williamds et Wilkins, 1999. 7. Robert I, Alderson P, Bunn F, Chinnoch P, Ker K, Schierhout G. Colloid versus crystalloids for fluid resuscitation in critically ill patients. In: The Cochrane Library, issue 4. Oxford: Update Software, 2004. 8. Romanelli RG et al. Long term albumin infusion improves survival in patients with cirrhosis and ascites: an unblinded randomized trial. World J Gastroenterol 2006;12:403-7. 9. Runyon BA. AASLD Practice Guidelines. Management of adult patients with ascites caused by cirrhosis. Hepatology 1998;27:264-72. 10.SAFE Study Investigators. Effect of baseline serum albumin concentration on outcome of resuscitation with albumin or saline in patients in intensive care units: analysis of data from the saline versus albumin fluid evaluation (SAFE) study. BMJ 2006;333:1044-1046. 11.Schierhout G, Roberts I. Fluid resuscitation with colloid or crystalloid solutions in critically ill patients: a systematic review of randomized trials. BMJ 1998;316:961-4. 12.Sola-Vera J, et al. Randomized trial comparing albumin and saline in the prevention of paracentesis-induced circulatory dysfunction in cirrhotic patients with ascites. Hepatology 2003;37:1147-53. 13.Sort P, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med 1999;341:403-9. 14.The Albumin Reviewers (Alderson P et al). Human albumin solution for resuscitation and volume expansion in critically ill patients. (Cochrane Review). In: The Cochrane Library, issue 4. Oxford: Update Software, 2004. 250 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 15.University Hospital Consortium Guidelines. Technology Assessment: albumin, nonprotein colloid, and crystalloid solutions. UHC Publications, Update May 2000, Oak Brook Illinois:35-9. 16.Vermeulen LC, et al. A paradigm for consensus. The University Hospital Consortium Guidelines for the use of albumin, nonprotein colloid and crystalloid solutions. Arch Intern Med 1995;155:373-9. 17.Wilkes MM, Navickis RJ. Patient survival after human albumin administration. A metaanalyisis of randomized, controlled trials. Ann Intern Med 2001;135:149-64. 18.Woodman R. Doctors advised to take special care with human albumin. BMJ 1999;318:1643. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 251 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 28 La prescrizione per la terapia antitumorale e dell'AIDS a ca– medrossi-proge- rico del SSN è limitata alle seguenti condizioni: – neoplasia della mammella e carcinoma dell'endometrio sterone – sindrome anoressia/cachessia da neoplasia maligna in – megestrolo fase avanzata o da AIDS Background I progestinici megestrolo acetato, medrossiprogesterone acetato sono utilizzati come seconda e terza linea di terapia nel cancro mammario. Trovano, altresì, impiego per il trattamento dei carcinomi endometriali e renali (limitatamente al medrossiprogesterone acetato per via orale) e sono scarsamente impiegati nel cancro prostatico. Le indicazioni cancro dell'endometrio e mammario, per i due steroidi, sono sufficientemente basate su evidenze tali da permetterne il rimborso da parte del SSN. Il loro impiego nel carcinoma renale ed ancor più in quello prostatico è da valutare caso per caso e, relativamente al carcinoma renale, è limitato al medrossiprogesterone acetato per via orale. Evidenze disponibili Megestrolo acetato e medrossiprogesterone acetato per via orale trovano anche impiego, supportato in letteratura, nella cosiddetta sindrome anoressia/cachessia. Questa è caratterizzata da progressiva perdita di peso (>10% del peso ideale), anoressia, nausea cronica, malassorbimento, astenia, cambiamento dell'immagine corporea, impoverimento del Performance Status. Tale sindrome si rileva in pazienti affetti da neoplasia maligna in fase avanzata e da AIDS, fino all'80% in pazienti oncologici terminali, e rappresenta un importante fattore prognostico negativo. Gli obiettivi maggiori dei trattamenti con progestinici riguardano, nell'anoressia/cachessia da cancro e da AIDS, il recupero ponderale, l'aumento dell'appetito e dell'introito calorico. Obiettivi secondari sono costituiti dal controllo della nausea cronica e del dolore e dal miglioramento del Performance Status e della qualità della vita. Le evidenze che megestrolo acetato e medrossiprogesterone acetato sono in grado di conseguire tali obiettivi terapeutici sono mostrate da studi clinici controllati in doppio cieco e con dimensione del campione adeguata. Vi è anche dimostrazione che l'impatto di questi trattamenti sul peso corporeo è dovuto a un aumento reale della massa magra e grassa, e soprattutto grassa, piuttosto che a ritenzione idrica. Gli studi hanno infine evidenziato che il miglior effetto terapeutico si ottiene con dosaggi di medrossiprogesterone acetato di 500-1.000 mg/die e di megestrolo acetato di 160-320 mg/die per via orale. Gli effetti in pazienti con carcinomi gastrointestinali non sembrano molto favorevoli. Effetti antianoressici e di incremento sul peso corporeo sono stati rilevati anche nella fibrosi cistica. 252 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Bibliografia 1. Loprinzi CL, et al. Body-composition changes in patients who gain weight while receiving megestrol acetate. J Clin Oncol 1993;11:152-4. 2. McMillan DC, et al. A prospective randomised study of megestrol acetate and ibuprofen in gastrointestinal cancer patients with weight loss. Br J Cancer 1999;79:495-500. 3. Nasr SZ, et al. Treatment of anorexia and weight loss megestrol acetate in patients with cystic fibrosis. Pediatr Pulmol 1999;28:380-2. 4. Nemechek PM, et al. Treatment guidelines for HIV-associated wasting. Proc Mayo Clin 2000;75:386-94. 5. Simons JP, et al. The effect of medroxiprogesterone acetate on appetite, weigh loss and quality of life in advanced stage non-hormone-sensitive cancer. A placebo controlled multicenter study. J Clin Oncol 1996;14:1077-84. 6. Tehekmeydan NS, et al. Megestrol acetate in cancer anorexia and weight loss. Cancer 1992;5:1268-74. 7. Von Roenn JH, et al. Megstrol acetate in patients with AIDS-related cachexia. Ann Int Med 1994;6:693-9. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 253 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 30 e 30 BIS Fattori di crescita dei leucociti: Le note 30 e 30 bis rimangono in vigore fino alla – filgrastim pubblicazione del Piano Terapeutico AIFA, adot– lenograstim tato con atto separato. – molgramostim – pegfilgrastim 254 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 31 Sedativi della tosse: – diidrocodeina – diidrocodeina + acido benzoico – levodropropizina La prescrizione a carico del SSN è limitata alla seguente condizione: – tosse persistente non produttiva nelle gravi pneumopatie croniche e nelle neoplasie polmonari primitive o secondarie Background La diidrocodeina è un antitussivo ad azione centrale che inibisce la frequenza e l'intensità degli impulsi della tosse. Il sito d'azione della diidrocodeina sembra sia localizzato nel centro bulbare della tosse nel sistema nervoso centrale, mentre la levodropropizina è considerata un farmaco ad azione periferica. Evidenze disponibili Secondo uno studio randomizzato in doppio cieco della durata di 7 giorni coinvolgente 140 pazienti, la diidrocodeina e la levodropropizina hanno mostrato un'efficacia simile nel ridurre la tosse persistente non produttiva in pazienti con cancro al pomone primitivo o metastatico. Gli autori hanno evidenziato che entrambi i farmaci sono efficaci nel ridurre il grado di severità della tosse e che l'attività terapeutica temporale dei 2 antitussivi risulta simile. Anche dal punto di vista della tollerabilità, la percentuale di effetti collaterali è stata la stessa nei 2 gruppi di pazienti, tranne che per la sonnolenza, effetto che si è manifestato maggioramente nel gruppo dei trattati con diidrocodeina (22% vs 8%). L'efficacia antitussiva e la tollerabilità della levodropropizina sono state valutate nei bambini con tosse persistente non produttiva in uno studio che confrontava il farmaco con il suo enantiomero, la dropropizina. I due farmaci hanno mostrato un'efficacia simile, sebbene la levodropropizina risulti più sicura, visto che associata a rischio di sonnolenza diurna minore. L'efficacia del farmaco in pazienti adulti con tosse persistente non produttiva è stata valutata anche in un trial clinico randomizzato, in doppio cieco verso destrometorfano: secondo gli autori l'efficacia antitussiva dei due farmaci è simile, mentre la levodropropizina presenta un profilo di sicurezza migliore. Particolari avvertenze La prescrizione di sedativi per la tosse non è rimborsata dal SSN per altre indicazioni autorizzate. Bibliografia 1. Banderali G, Riva E, Fiocchi A, Cordaro CI, Giovannini M. Efficacy and tolerability of levodropropizine and dropropizine in children with non-productive cough. J Intern Med Res 1995; 23:175-83. 2. Catena E. Daffonchio L. Efficay and tolerability of levodropropizine in adult patients with non-productive cough. Comparison with dextromethorphan. Pulm Pharmacol Ther 1997;10:89-96. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 255 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 3. Luporini G, Barni S, Marchi E et al. Efficacy and safety of levodropropizine and dihydrocodeine on nonproductive cough in primary and metastatic lung cancer. Eur Respir J 1998;12:97-101. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 256 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 32 e 32 BIS Interferoni: – Interferone alfa 2 a ricombinante – Interferone alfa 2 b ricombinante – Interferone alfa-2a peghilato – Interferone alfa-2b peghilato – Interferone n-1 linfoblastoide – Interferone alfa naturale alfa-n3 (leucocitario) – Interferone alfacon-1 La nota 32 e 32bis rimane in vigore fino alla pubblicazione del Piano Terapeutico AIFA, adottato con atto separato. – lamivudina Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 257 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 36 Ormoni androgeni: – testosterone – metiltestosterone La prescrizione a carico del SSN, su diagnosi e piano terapeutico di strutture specialistiche, secondo modalità adottate dalle Regioni e dalle Province autonome di Trento e Bolzano, è limitata alle seguenti condizioni: – ipogonadismi maschili primitivi e secondari – pubertà ritardata Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 258 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 39 La prescrizione a carico del SSN, su diagnosi e piano terapeutico di centri specializzati, Universitari o delle Aziende Sanitarie individuati, dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: Età evolutiva – bassa statura da deficit di GH definito dai seguenti parametri clinico-auxologici e di laboratorio: I. a) statura < -3DS oppure statura < -2DS e velocità di crescita/ anno < -1DS rispetto alla norma per età e sesso, misurata a distanza di almeno 6 mesi con le stesse modalità oppure b) velocità di crescita/anno < -2DS o < -1,5 DS dopo 2 anni consecutivi, anche in assenza di bassa statura; nei primi 2 anni di vita, sarà sufficiente fare riferimento alla progressiva decelerazione della velocità di crescita (la letteratura non fornisce a riguardo dati definitivi in termini di DS) oppure c) malformazioni/lesioni ipotalamo-ipofisario dimostrate a livello neuroradiologico o difetti ipofisari multipli che comportino deficit di GH accertato in base ad una delle modalità del punto b Ormone della e crescita II. a) risposta di GH < 10 μg/L ad almeno 2 test farmacologici (somatotropina) eseguiti in giorni differenti oppure b) risposta di GH < 20 μg/L nel caso uno dei 2 test impiegati sia GHRH + arginina o GHRH + piridostigmina oppure c) secrezione spontanea media di GH nelle 24 ore, o quantomeno nelle 12 ore notturne < 3 μg/L in presenza di normale risposta ai test farmacologici e valori di IGF1 < -2 DS – sindrome di Turner citogeneticamente dimostrata – deficit staturale nell'insufficienza renale cronica – sindrome di Prader Willi in soggetti prepuberi Età adulta – soggetti con livelli di GH allo stimolo con ipoglicemia insulinica <3 μg/L o, in presenza di controindicazioni al test di ipoglicemia insulinica, con picco inadeguato di GH dopo stimoli alternativi, per: a) ipofisectomia totale o parziale (chirurgica, da radiazioni) b) ipopituitarismo idiopatico, post traumatico, da neoplasie sellari e parasellari Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 259 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Background Età evolutiva In soggetti con caratteristiche clinico-auxologiche in accordo con il punto I e con normale secrezione di GH (punto II), la terapia può essere effettuata solo se autorizzata dalla Commissione Regionale preposta alla sorveglianza epidemiologica ed al monitoraggio dell'appropriatezza del trattamento con GH. Per il monitoraggio della prescrizione è necessario far riferimento alla prevalenza del trattamento nella popolazione compresa tra 0 e 18 anni d'età, che è stimabile, in base ai dati della letteratura scientifica internazionale degli ultimi 20 anni, in 1:2000 (tasso di esposizione al trattamento). Va, inoltre, tenuto conto che la coorte dei soggetti affetti dalle principali patologie per cui è indicata la terapia con GH è sostanzialmente stabile nel tempo e distribuita in modo omogeneo sul territorio. Soggetti adulti con deficit di GH presentano un abbassamento della qualità di vita, una riduzione della forza muscolare, un aumento dell'adipe viscerale che, insieme ad un aumento del colesterolo circolante, costituisce un fattore di rischio per complicanze cardiovascolari. In particolare, è stato dimostrato un chiaro aumento dei processi di aterosclerosi con netto incremento della mortalità da cause cardiovascolari. Il trattamento sostitutivo con GH biosintetico va comunque riservato solo ai rari casi nei quali vi sia un severo deficit di GH, dimostrato da un picco di risposta < 3 μg/L dopo ipoglicemia insulinica, oppure, in presenza di controindicazioni al test dell'ipoglicemia (cardiopatie, patologia del SNC, età avanzata), a seguito di un picco inadeguato di GH dopo stimoli alternativi utilizzati con limiti di normalità appropriati alla loro potenza. Il test con GHRH + arginina viene ad oggi ritenuto l'alternativa di prima scelta e, dopo questo stimolo, un severo deficit di GH è dimostrato da un picco dei livelli circolanti di GH < 9 μg/L. Il rigoroso rispetto di tali criteri esclude la possibilità di un uso improprio o eccessivo del farmaco. Evidenze disponibili La nota attualmente in vigore è stata formulata circa due anni fa. Rispetto ad allora non sono stati prodotti dati scientifici tali da supportare un cambiamento del testo della nota vigente. In particolare, per quanto riguarda l'uso del GH in neonati SGA non ci sono dati tali da permettere di prendere in considerazione questa indicazione. La FDA ha ammesso l'uso del GH in bambini SGA, tuttavia la numerosità degli studi è troppo piccola per una valutazione di efficacia solida, anche utilizzando tecniche di analisi bayesiane. Inoltre il follow-up di questi pazienti è troppo breve rispetto alla storia naturale della malattia. La velocità di crescita, infatti, rappresenta un end point intermedio da cui non è possibile inferire l'outcome finale della statura. Gli studi che valutano la statura finale presentano forti carenze metodologiche. Uno studio è su 35 soggetti di cui 18 sono persi al follow up. Un altro studio arruola 114 bambini nel gruppo in trattamento e 34 in quello non trattato. L'analisi viene condotta solo su 77 trattati e su tutti i 34 non trattati: vengono esclusi dall'analisi i cattivi responders, quelli con bassa compliance, con malattie concomitanti e i trattati con GnRH analoghi. La statura finale del gruppo non trattato è -2 DS (+ 0.8) e quella del gruppo trattato -1,4 DS (+1.4). La differenza tra i due gruppi non è statisticamente significativa, anche se nello studio citato il confronto non viene fatto. 260 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Giova ricordare che circa venti anni orsono venne proposta e praticata la terapia con GH in bambini "short normal" cioè di statura -2,5 DS con normale produzione di GH endogeno. Questi bambini mostravano un'aumento della velocità di crescita rispetto ai soggetti non trattati. Tuttavia la statura finale dei trattati e dei non trattati risultò essere simile una volta raggiunta la pubertà. Il GH, sostanzialmente, provocava un'espressione anticipata del potenziale di crescita geneticamente determinato. Particolari avvertenze L'Istituto Superiore di Sanità si farà carico della sorveglianza epidemiologica nazionale mediante un Registro informatizzato dell'ormone della crescita (GH). Il registro nazionale dell'ormone della crescita è uno strumento di sanità pubblica, istituito per garantire la correttezza diagnostica e l'appropriatezza d'uso dell'ormone. I Centri, accreditati dalle Regioni e dalle Province autonome per la diagnosi del deficit di GH e prescrizione della terapia sostitutiva con ormone della crescita, avranno accesso al Registro via web, mediante Userid e Password, e immetteranno i dati in tempo reale. Annualmente l'Istituto Superiore di Sanità provvederà a redigere un rapporto e ad inviarlo all'Agenzia Italiana del Farmaco (AIFA) e alla Conferenza degli Assessori Regionali alla Sanità. Il monitoraggio dell'appropriatezza dell'uso dell'ormone sarà effettuato da Commissioni Regionali che avranno accesso ai dati relativi alla propria regione. Bibliografia 1. American Association of Clinical Endocrinologist AACE clinical practice guidelines for growth hormone use in adults and children. Endocr Pract 1998; 4:165-73. 2. Badaru A, Wilson DM. Alternatives to growth hormone stimulation testing in children. Trends Endocrinol Metab 2004;15:252-8. 3. Buckaway CK, et al. The IGF-I generation test revisited: A marker of the GH sensitivity. J Clin Endocrinol Metab 2001; 86: 5176-83. 4. Cappa M, Loche S. Evaluation of growth disorders in the paediatric clinic. J Endocrinol Invest 2003;26:54-63. 5. Consensus guidelines for the diagnosis and treatment of adults with growth hormone deficiency: summary statement of the Growth Hormone Research Society Workshop on adult growth hormone deficiency. J Clin Endocrinol Metab 1998;83:379-81. 6. Consensus guidelines for the diagnosis and treatment of growth hormone (GH) deficiency in childhood and adolescence: Summary statement of the GH research society. J Clin Endocrinol Metab 2000; 85: 3990-3. 7. Dahlgren J, Albertsson Wikland K. Final Height in Short Children Born Small for Gestational Age Treated with Growth Hormone Ped Research 2005;57: 216-222. 8. Dattani M, Preece M.Growth hormone deficiency and related disorders: insights into causation, diagnosis, and treatment. Lancet 2004;363:1977-87. 9. Guidelines for the use of growth hormone in children with short stature. A report by the Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. J Pediatr 1995;127:857-67. 10.Hoffman DM, et al. Diagnosis of Growth hormone deficiency in adults. Lancet 1994; 344: 482-3. 11.Lissett CA, et al. How many tests are required to diagnose growth hormone (GH) deficiency in adults. Clin Endocrinol 1999; 51: 551-7. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 261 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 12.Maghnie M, Ghirardello S, Genovese E. Magnetic resonance imaging of the hypothalamuspituitary unit in children suspected of hypopituitarism: who, how and when to investigate. J Endocrinol Invest 2004;27:496-509. 13.Maghnie M, Strigazzi C, Tinelli C, Autelli M, Cisternino M, Loche S, Severi F. Growth hormone (GH) deficiency (GHD) of childhood onset: reassessment of GH status and evaluation of the predictive criteria for permanent GHD in young adults. J Clin Endocrinol Metab 1999;84:1324-8. 14.Pena-Almazan S.et al. Growth characteristics of congenitally GH-deficient infants from birth to one year of age. J Clin Endocrinol Metab 2001; 86: 5691-4. 15.Rosilio M et al. Adult height of prepubertal short children born small for gestational age treated with GH. Eur J End 2005; 152: 835-843 16.Saggese G, et al. Diagnosis and treatment of growth hormone deficiency in children and adolescents: towards a consensus. Ten years after the availability of recombinant human Growth Hormone Workshop held in Pisa, Italy, 27-28 March 1998. Horm Res 1998;50:320-40. 17.Sizonenko PC, Clayton PE, Cohen P, Hintz RL, Tanaka T, Laron Z. Diagnosis and management of growth hormone deficiency in childhood and adolescence. Part 1: diagnosis of growth hormone deficiency. Growth Horm IGF Res 200;11:137-65. 18.Takahashi, et al. Short stature caused by mutant growth hormone. N Engl J Med 1996; 334: 432-6 19.Tanaka T, Cohen P, Clayton PE, Laron Z, Hintz RL, Sizonenko PC. Diagnosis and management of growth hormone deficiency in childhood and adolescence--part 2: growth hormone treatment in growth hormone deficient children. Growth Horm IGF Res 2002;12:323-41. 20.Zadik Z, et al. The definition of a spontaneous Growth Hormone (GH) peak: studies in normally growing and GH-deficient children. J Clin Endocrinol Metab 1992;74:801-5. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 262 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 40 Analoghi della somatostatina: – lanreotide – octreotide La prescrizione a carico del SSN, su diagnosi e piano terapeutico di strutture specialistiche secondo modalità adottate dalle Regioni e dalle Province autonome di Trento e Bolzano, è limitata alle seguenti condizioni: – acromegalia – sindrome associata a tumori neuroendocrini Background La somatostatina e i suoi analoghi, octreotide e lanreotide, inibiscono la secrezione del "growth-hormone" (GH) nel 90% dei pazienti affetti da acromegalia, nei quali persista un innalzamento del GH dopo terapia chirurgica o radioterapia o in cui non sussista un'indicazione chirurgica. Tale azione si concretizza in un miglioramento della sintomatologia. Evidenze disponibili Non vi sono al momento dati da studi randomizzati che consiglino l'utilizzo degli analoghi della somatostatina in prima linea in alternativa ai trattamenti locoregionali. Questi farmaci hanno azione inibente sulla produzione di molti peptidi prodotti da tumori neuroendocrini e risultano quindi efficaci nel controllo delle sindromi associate a questa patologia. Il controllo dei sintomi si può ottenere nel 70-90% dei pazienti con tumore carcinoide metastatico e nel 50-85% degli affetti da neoplasie neuroendocrine insulari. Bibliografia 1. Lamberts S, et al. Octreotide. N Engl J Med 1996;334:246-54. 2. Moore D, Meads C, Roberts L, Song F. The effectiveness and cost-effectiveness of somatostatin analogues in the treatment of acromegaly. 2001:81. Birmingham: University of Birmingham, Department of Public Health. http://www.pcpoh.bham.ac.uk/publichealth/wmhtac/pdf/Acromegaly.pdf ultimo accesso verificato il 22/11/2006. 3. Newman CB. Medical management of acromegaly. Endocrinol Metab Clin North Am 1999;28:171-90. 4. Steward PM. Current therapy for acromegaly. Trends Endocrinol Metab 2000;11:128-32. 5. Tomasetti P, et al. Slow-release lanreotide treatment in endocrine gastrointestinal tumors. Am J Gastroenterol 1998;93:1468-71. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 263 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 41 – calcitonina La prescrizione a carico del SSN è limitata alla seguente condizione: – Morbo di Paget Background La calcitonina è un ormone ipocalcemizzante, un peptide di 32 aminoacidi, normalmente prodotto dalle cellule C della tiroide. L'azione ipocalcemica è principalmente dovuta alla potente azione inibitoria esercitata sugli osteoclasti. Questa caratteristica è efficacemente sfruttata nel trattamento dei disordini ossei come la malattia di Paget e nell'ipercalcemia. Evidenze disponibili Per quanto riguarda l'osteoporosi, non vi sono prove univoche di efficacia clinica in termini di riduzione di fratture. Nonostante la calcitonina produca, rispetto al placebo, un aumento della massa ossea, non sono documentate in letteratura variazioni di rilievo dell'incidenza di fratture e, comunque, l'aumento di massa ossea è minore rispetto a quello indotto dall'alendronato. Uno studio condotto dal Cochrane Group per stabilire l'efficacia del trattamento con calcitonina rispetto al placebo, nei pazienti in trattamento con corticosteroidi, non ha evidenziato differenze statisticamente significative tra i due gruppi per quanto riguarda l'aumento di massa ossea e il rischio relativo di fratture. La calcitonina può causare nausea, diarrea e flushing. Alcuni pazienti possono diventare resistenti nelle terapie a lungo termine forse a causa dello sviluppo di anticorpi neutralizzanti. Particolari avvertenze La prescrizione della calcitonina non è rimborsata dal SSN per le altre indicazioni autorizzate. Bibliografia 1. Cranney A, et al. Calcitonin for the treatment and prevention of corticosteroid-induced osteoporosis. Cochrane Database of Systematic Reviews 2000;4. 2. Downs RW Jr,, et al. Comparison of alendronate and intranasal calcitonin far treatment of osteoporosis in postmenopausal women. J Clin Endocrinol Metab 2000;85:1783-8. 3. Gruber HE, et al. Osteoblast numbers after calcitonin therapy: a retrospectiv study of paired biopsies obtained during longterm calcitonin therapy in postmenopausal osteoporosis. Calcif Tissue Int 2000;66:29-34. 4. Mincey BA, et al. Prevention and treatment of osteoporosis in women with breast cancer. Mayo Clin Proc 2000;75:821-9. 5. Muff R, et al. Formation of neutralizing antibodies during intranasal synthetic salmon calcitonin treatment of postmenopausal osteoporis. Osteoporos Int 1991;1:72-5. 6. Sexton PM, et al. Calcitonin. Curr Med Chem 1999;6:1067-93. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 264 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 42 La prescrizione a carico del SSN è limitata alle seguenti condizioni – Morbo di Paget: Bifosfonati: – acido etidronico acido etidronico – acido clodronico – trattamento delle lesioni osteolitiche da metastasi ossee e del mieloma multiplo: acido clodronico Background I bifosfonati rallentano la formazione e la dissoluzione dei cristalli di idrossiapatite. L'effetto clinico dei bifosfonati è legato alla loro capacità di inibire il riassorbimento osseo. Evidenze disponibili È stato anche dimostrato che il bifosfonato acido clodronico agisce non solo mediante l'inibizione dell'attività degli osteoclasti, ma anche tramite una riduzione diretta delle cellule tumorali dell'osso con meccanismi ancora da definire, sia di tipo indiretto (alterazioni del microambiente dell'osso) sia di tipo diretto (apoptosi delle cellule tumorali, oltre che degli osteoclasti). Per quanto riguarda l'osteoporosi postmenopausale, l'etidronato, somministrato ciclicamente per via orale, non ha dimostrato nei trial clinici controllati risultati univoci e quindi non è da considerare di sicura efficacia rispetto a end-point clinici. Particolari avvertenze L'uso dei bifosfonati è stato associato alla comparsa di osteonecrosi della mandibola e della mascella in pazienti oncologici e con osteoporosi. Bibliografia 1. Kyle R. The role of bisphosphonates in multiple myeloma. Ann Intern Med 2000;132:734. 2. Diel IJ, et al. Reduction in new metastases in breast cancer with adjuvant clodronate treatment. N Engl J Med 1998;339:357. 3. Mundy Gr, et al. Bisphosphonates as anticancer drugs. N Engl J Med 1998;339:398. 4. Djulbegovic B, Wheatley K, Ross J, ClarkO, Bos G, GoldschmidtH, Cremer F, AlsinaM, Glasmacher A. Bisphosphonates in multiple myeloma. Cochrane Database of Systematic Reviews 2002; 4 5. Clinical practice guidelines for the diagnosis and management of osteoporosis. Scientific Advisory Board Osteoporosis Society of Canada. CMAJ 1996;155:1113. 6. Ministero della Salute - AIFA. Analisi dei segnali: i bifosfonati. Bollettino d'Informazione sui Farmaci. 2006; 2:79-81. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 265 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 48 La prescrizione a carico del SSN è limitata ai seguenti periodi di trattamento ed alle seguenti condizioni: Farmaci antiulcera: Anti H2: – cimetidina – famotidina – nizatidina – ranitidina – roxatidina, Inibitori di pompa: – esomeprazolo – lansoprazolo – omeprazolo – pantoprazolo – rabeprazolo – durata di trattamento 4 settimane (occasionalmente 6 settimane): • ulcera duodenale o gastrica positive per Helicobacter pylori (Hp) • per la prima o le prime due settimane in associazione con farmaci eradicanti l'infezione • ulcera duodenale o gastrica Hp-negativa (primo episodio) • malattia da reflusso gastroesofageo con o senza esofagite (primo episodio) – durata di trattamento prolungata, da rivalutare dopo un anno: • sindrome di Zollinger-Ellison • ulcera duodenale o gastrica Hp-negativa recidivante • malattia da reflusso gastroesofageo con o senza esofagite (recidivante) Background L'ulcera duodenale è associata a infezione da Hp nel 90-95% dei casi e l'ulcera gastrica nel 75-85%. È stato dimostrato da numerosi trial randomizzati e da meta analisi che l'eradicazione dell'infezione previene le recidive dell'ulcera, riducendole al 5-10% o meno. L'eradicazione è efficace nei linfomi gastrici Hp positivi a basso grado di malignità. Il trattamento eradicante è fortemente raccomandato nell'ulcera duodenale e nell'ulcera gastrica, e lo è con particolare enfasi nei soggetti che hanno sofferto un'emorragia da ulcera per la prevenzione di risanguinamenti. Evidenze disponibili Non ci sono prove convincenti di efficacia del trattamento eradicante nella dispepsia non ulcerosa. Dopo gli iniziali risultati contrastanti, infatti, almeno quattro trial pubblicati negli ultimi due anni hanno dato risultati concordanti che dimostrano l'inefficacia della terapia eradicante. La malattia da reflusso gastroesofageo (MRGE), con o senza esofagite, ha tendenza alle recidive, che possono accentuare il danno esofageo ed esitare in metaplasia dell'epitelio a rischio di evoluzione neoplastica (esofago di Barrett). Nei soggetti oltre 45 anni, se la sintomatologia da reflusso è grave, o continua, o recidivante, è fortemente raccomandata l'endoscopia. Per il trattamento della malattia da reflusso, particolarmente se associata ad esofagite, i farmaci più efficaci sono gli inibitori di pompa protonica, che nella maggior parte dei casi sono sufficienti per somministrazione discontinua e/o a dosi ridotte. I dati disponibili sono in prevalenza negativi 266 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i rispetto a un vantaggio terapeutico dell'eradicazione dell'Hp su frequenza e intensità dei disturbi da MRGE. Un piccolo trial, che dimostrerebbe un vantaggio dall'eradicazione nella MRGE senza esofagite grave, presenta manifeste improprietà metodologiche (es: valutazione non secondo intention to treat; ogni evidenza di vantaggio è azzerata se i dati sono reinterpretati correttamente). Nella 8a edizione di Clinical Evidence l'eradicazione dell'Hp viene giudicata inefficace nel ridurre la frequenza di recidive della MRGE. Infine, anche il Consensus Report di Maastricht 2-2000 cita come consigliabile ("advisable") l'eradicazione dell'Hp nella MRGE solo nei soggetti che richiedano "profonda soppressione long-term della secrezione gastrica". Questa posizione sembra dettata dal timore che l'infezione da Hp associata ad acidosoppressione da inibitori di pompa protonica possa determinare gastrite atrofica, potenziale causa di carcinoma. Tuttavia, questa eventualità è stata rilevata dopo esposizione inusualmente intensa e protratta ad acido-soppressione (trattamento ininterrotto con 20-40 mg di omeprazolo/die per una durata media di 5 anni) ed è contraddetta da altri studi che impiegavano le stesse dosi di omeprazolo in soggetti con MRGE Hp-positivi e non rilevavano né atrofia gastrica né metaplasia. Particolari avvertenze Rimane da considerare il teorico vantaggio dell'eradicazione per prevenire l'insorgenza di carcinoma gastrico, per il quale l'infezione da Hp è solo uno dei fattori di rischio, insieme alla dieta, all'atrofia della mucosa, all'acquisizione dell'infezione nella prima infanzia, a fattori genetici e ad altri sconosciuti; e non c'è alcun indizio che indichi una riduzione di incidenza dopo eradicazione dell'Hp. Se la malattia da reflusso gastroesofageo è associata a infezione da Hp, l'eradicazione del batterio può essere indicata se il reflusso è associato a ulcera peptica o a gastrite cronica grave istologicamente documentata o se il controllo dei disturbi richiede trattamento ininterrotto con dosi elevate di inibitori di pompa protonica (es: omeprazolo, dosi pari o superiori a 20 mg/die). Il trattamento eradicante va effettuato solo nei casi di dispepsia associata a presenza di ulcera gastrica o duodenale. Bibliografia 1. Baldi F, et al. Guidelines for the diagnostic and therapeutic management of patients with gastroesophageal reflux disease. Ital J Gastroenterol Hepatol 1998;30:107-12. 2. Danesh J, Pounder RE. Eradication of Helicobacter pylori and non ulcer dyspepsia. Lancet 2000;355:766-7. 3. Davey Smith G, et al. Adverse socioeconomic conditions in childhood and cause specific adult mortality: prospective observational study. BMJ 1998;316:1631-5. 4. De Boer WA, Tytgat GNJ. Regular review. Treatment of Helicobacter pylori infection. BMJ 2000;320:31-4. 5. Delaney B, et al. Helicobacter pylori infection. In: Godlee F Ed. Clinical Evidence, 8° Edizione 2002, BMJ Publ. Group:458-9. 6. EUROGAST Study Group. An international association between Helicobacter pylori infection and gastric cancer. Lancet 1993;341:1359-62. 7. Inadomi JM, et al. Step-down management of gastroesophageal reflux disease. Gastroenterology 2001;121:1095-100. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 267 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 8. Katzka D. Gastro-esophageal reflux disease. In: Godlee F, 3 eds. Clinical Evidence. London: BMJ Publ Group, 2000:225-35. 9. Kuipers EJ, et al. Atrophic gastritis and Helicobacter pylori infection in patients with reflux esophagitis treated with omeprazole or fundoplication. N Engl J Med 1996;334:1018-22. 10.Lundell L, et al. (the Nordic GERD Study Group). Lack of effect of acid suppression therapy on gastric atrophy. Gastroenterology 1999;11:319-26. 11.Malfertheiner P, et al. Current concepts in the management of Helicobacter pylori infection The Maastricht 2-2000 Consensus report. Aliment Pharmacol Ther 2002;16:167-80. 12.Moayyedi P, et al. Helicobacter pylori eradication does not exacerbate reflux symptoms in gastroesophageal reflux disease. Gastroenterology 2001;121:1120-6. 13.Moss SF, et al. Consensus statement for management of gastroesophageal reflux disease: result of a Workshop meeting at Yale University School of Medicine, Dept of Surgery, Nov 16 et 17, 1997. J Clin Gastroenterol 1998;27:6-12. 14.Parsonnet J. Helicobacter pylori in the stomach - a paradox unmasked. N Engl J Med 1996;335:278-80. 15.Peterson WL, et al. Helicobacter pylori related disease. Guidelines for testing and treatment. Arch Intern Med 2000;160:1285-91. 16.Schwizer W, et al. Helicobacter pylori and symptomatic relapse of gastroesophageal reflux disease: a randomised controlled trial. Lancet 2001;357:1738-42. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 268 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 51 La prescrizione a carico del SSN, su diagnosi e piano terapeutico di strutture specialistiche, secondo modalità adottate dalle Regioni e dalle Province autonome di Trento e Bolzano, è limitata alle seguenti condizioni: Analoghi RH: – buserelina – goserelina – leuprorelina – triptorelina – carcinoma della prostata: buserelina, goserelina, leuprorelina, triptorelina – carcinoma della mammella: goserelina, leuprorelina, triptorelina – endometriosi: goserelina, leuprorelina, triptorelina – fibromi uterini non operabili: goserelina, leuprorelina, triptorelina – pubertà precoce: leuprorelina, triptorelina – trattamento prechirurgico: • durata di 3 mesi: per gli interventi di miomectomia e isterectomia della paziente metrorragica • durata di 1 mese: per gli interventi di ablazione endometriale e di resezione di setti endouterini pervia isteroscopica goserelina, leuprorelina, triptorelina Background Struttura: analoghi dello LHRH. Meccanismo di azione: le dosi iniziali stimolano la produzione di FSH e LH; un trattamento prolungato determina desensibilizzazione dei recettori ipofisari e inibizione della produzione di entrambi gli ormoni gonadotropi. Funzionalmente si determina una condizione di castrazione farmacologica. Evidenze disponibili – Carcinoma prostatico: l'uso clinico di questi principi attivi è soprattutto connesso all'inibizione della produzione degli ormoni gonadotropi. La leuprolide in uno studio randomizzato ha mostrato gli stessi risultati ottenuti con il dietilstibestrolo (DES) in pazienti con malattia metastatica. La goserelina in diversi trial clinici controllati è risultata efficace quanto l'orchiectomia. La stessa evidenza si ha anche per la triptorelina, la buserelina e la leuprorelina. In genere, nella malattia avanzata, entro i primi 3 mesi di trattamento, le risposte obiettive si aggirano intorno al 50%; un ulteriore 25% mostra una stabilità di malattia, mentre il restante 25% progredisce. – Carcinoma mammario: l'uso clinico di questi principi attivi è soprattutto connesso all'inibizione della produzione degli ormoni gonadotropi a seguito dell'induzione dello stato menopausale. Questa indicazione è ovviamente limitata alle donne in premenopausa e perimenopausa (che nel caso siano isterectomizzate abbiano un profilo ormonale conseguente) in cui l'espressione dei recettori per Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 269 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i estrogeni e/o progesterone sia positiva o sconosciuta. Infatti, in queste condizioni i risultati terapeutici sono paragonabili o superiori a quelli della ovariectomia. – Pubertà precoce: il limite inferiore di età per l'inizio della pubertà, ancorché non semplice da definire, può essere stabilito a 7 anni (7-13 anni) per le femmine e a 9 anni (9-13,5 anni) per i maschi. Solo la pubertà precoce di origine centrale (pubertà precoce vera o LHRH dipendente) risponde al trattamento con analoghi stabili del LHRH naturale. L'uso di analoghi del LHRH è stato raccomandato da un comitato di approvazione della FDA. I benefici della terapia per la pubertà precoce includono una completa cessazione del ciclo mestruale nelle ragazze, l'interruzione o un netto rallentamento della maturazione dei caratteri sessuali secondari, il restaurarsi di comportamenti adeguati all'età anagrafica, la prevenzione della maturazione scheletrica precoce; quest'ultimo effetto previene anche la riduzione della statura in età adulta. – Endometriosi: la terapia con reline dell'endometriosi è di elevata efficacia. Scompaiono i dolori, si ha una rapida involuzione degli impianti nell'endometrio ed aumentano le probabilità di successo del trattamento dell'infertilità. – Trattamento prechirurgico: il trattamento per tre mesi con reline di pazienti metrorragiche, in preparazione ad interventi chirurgici sull'utero, porta ad una netta riduzione delle formazioni fibroidi uterine ed aumenta il successo di interventi di tipo conservativo che consentono di preservare la fertilità in donne giovani. Particolari avvertenze La prescrizione degli analoghi RH non è rimborsata dal SSN per altre indicazioni autorizzate. Bibliografia 1. Boepple PA, et al. Impact of sex steroids and their suppression of on skeletal growth maturation. Am J Physiol 1988;255:559-66. 2. Boepple PA, et al. Use of a potent, long-acting agonist of gonadotropinreleasing hormone (GnRH) in the treatment of precocious puberty. Endocr Rev 1986;7:24-33. 3. Cedar MI, et al. Treatment of endometriosis with a long-acting gonadotropin-releasing hormone agonist plus medroxyprogesterone acetate. Obstet Gynecol 1990;75:641-5. 4. Conn PM, Crowley WF. Gonadotropin-releasing hormone and its analogs. Ann Rev Med 1994;45:391-405. 5. Garcia-Giralt E, et al. Phase II trial of decapeptyl (D-TRP-6), a potent luteinizing hormonereleasing hormone analogue in untreated advanced breast cancer. Am J Clin Oncol 1996;19:455-8. 6. Grumbach MM, Styne DM. Puberty: ontogeny, neuroendocrinology, physiology, and disorders. In: Wilson JD et al eds. Williams textbook of endocrinology. 9th ed. W. B. Saunders Company,1998:1509-625. 7. Harvey HA, et al. Medical castration produced by the GnRH leuprolide to treat metastatic breast cancer. J Clin Oncol 1985;3:1068-72. 8. Jonat W. Luteinizing hormone-releasing hormone analogues - the rationale for adjuvant use in premenopausal women with early breast cancer. Br J Cancer 1998;78 (Suppl 4):S5-8. 9. Kaisari AV, et al. Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostate cancer. Br J Urol 1991;67:502-8. 10.Kienle E, Lubben G. Efficacy and safety of leuprorelin acetate depot for prostate cancer. The Gemen Leuprorelin Study Group. Urol Int 1996;56 (Suppl 1):S23-30. 270 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 11.Maheux R. Treatment of uterine leiomyomata: past, present and future. Horm Res 1989;32:125-33. 12.Marini L, et al. Direct antiproliferative effect of triptorelin on human breast cancer cells. Anticancer Res 1994;14:1881-5. 13.Meldrum DR, et al. "Medina oophorectomy" using a long-acting GnRH agonist - a possible new approach to the treatment of endometriosis. J Clin Endocrinol Metab 1982;54:1081-3. 14.Parmar H, et al. Orchiectomy versus long-acting DTrp6LHRH in advanced prostatic cancer. Br J Urol 1987;59:248-54. 15.Robustelli della Cuna FS, Robustelli della Cuna G. Ormoni antitumorali. In: Bonadonna G, Robustelli della Cuna G. Medicina Oncologica. 6° ed. 1999:633-58. 16.Sylvester RJ, et al. The importance of prognostic factors in the interpretation of two EORTC metastatic prostate cancer trial. European organization for Research and Treatment of Cancer (EORTC) Genito-Urinary Tract Cancer Cooperative Group. Eur Urol 1998;33:134-43. 17.Taylor CW, et al. Multicenter randomized clinical trial of goserelin versus surgical ovariectomy in premenopausal patients with receptor-positive metastatic breast cancer: an intergroup study. J Clin Oncol 1998;16:994-9. 18.The Leuprolide Study Group. Leuprolide versus diethylstilbestrol for metastatic prostate cancer. N Engl J Med 1984;311:1281-6. 19.Vogelzang NJ, et al. Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Urology 1995;46:220-6. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 271 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 55 Antibiotici iniettabili per uso extraospedaliero: – – – – – – – – – – – – – – – – – – – cefamandolo cefonicid ceftezolo cefurossima cefmetazolo cefotetan cefoxitina cefodizima cefoperazone cefotaxima ceftazidima* ceftizoxima ceftriaxone cefepime* mezlocillina piperacillina ampicillina + sulbactam piperacillina + tazobactam* ticarcillina + ac. clavulanico* – – – – amikacina gentamicina netilmicina tobramicina La prescrizione carico del SSN degli antibiotici iniettabili per l'uso extra-ospedaliero, è limitata alle seguenti condizioni: – trattamento iniettivo di infezioni gravi delle vie respiratorie, delle vie urinarie, dei tessuti molli, intra-addominali, ostetrico-ginecologiche, ossee e articolari – trattamento iniettivo delle infezioni causate da microrganismi resistenti ai più comuni antibiotici, particolarmente nei pazienti immunocompromessi Background Gli obiettivi della presente nota sono: 1) ottenere il successo terapeutico in caso di infezioni gravi in ambienti extra-ospedalieri, in particolare anche quando sia in causa un agente eziologico resistente ai più comuni antibiotici o nel paziente immunocompromesso; 2) limitare l'induzione di meccanismi di resistenza nei patogeni presenti in comunità. Devono essere considerati due importanti punti: 1. le infezioni extra-ospedaliere sono suscettibili di un trattamento efficace con agenti a spettro più ristretto per via orale (ad es. infezioni di orecchio, naso e gola, sinusiti, infezioni delle basse vie respiratorie, dei tessuti molli, delle vie urinarie); 2. nel trattamento delle infezioni gravi, per massimizzare l'efficacia della terapia antibiotica, devono essere attentamente considerate le caratteristiche farmacocinetiche delle molecole presenti nella nota, utilizzando precisamente, secondo le indicazioni della scheda tecnica, dosi e numero di somministrazioni adeguate, così da ridurre il rischio di induzione di resistenze batteriche. 272 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Evidenze disponibili La scelta terapeutica è quasi sempre su base empirica, basata su una diagnosi eziologica presuntiva, su linee guida locali, nazionali od internazionali, ma, ove possibile, va ricercata la diagnosi microbiologica che consenta una terapia mirata. Concettualmente possiamo suddividere i farmaci presenti nella nota in 6 gruppi. 1. Cefalosporine di II generazione (cefamandolo, cefonicid, ceftezolo, cefurossima) e cefamicine (cefmetazolo, cefotetan, cefoxitina). 2. Penicilline protette (ampicillina + sulbactam). 3. Cefalosporine di III (cefodizima, cefoperazone, cefotaxima, ceftazidima, ceftizoxima, ceftriaxone) e di IV generazione (cefepime). 4. Ureidopenicilline (mezlocillina e piperacillina). 5. Ureidopenicilline e carbossipenicilline protette (piperacillina-tazobactam e ticarcicillina-acido clavulanico). 6. Aminoglicosidi (amikacina, gentamicina, netilmicina, tobramicina). Le prime due classi di farmaci presentano analogie di spettro antibatterico e di attività clinica in infezioni, gravi, sostenute dai più comuni germi comunitari, ma non da Pseudomonas spp. Le ureidopenicilline e le cefalosporine di III e IV generazione dimostrano attività nei riguardi di gram-negativi produttori di beta-lattamasi. Alcune di queste molecole, identificabili con un asterisco, sono efficaci nei confronti di Pseudomonas aeruginosa. Poiché le infezioni sostenute da alcune Enterobacteriaceae produttrici di betalattamasi cosidette ad ampio spettro (ESBL) non sono più confinate solo in ambiente ospedaliero, ma sono in aumento anche in ambito territoriale extra-ospedaliero, va tenuto presente che tali molecole conferiscono alto grado di resistenza a molti antibiotici inseriti nella nota, con la eccezione di cefepime, cefotaxima, cefotetan, cefoxitina, piperacillina/tazobactam e ticarcilliana/clavulanato purché impiegate secondo posologia corretta per dosi e numero di somministrazioni. In particolare le carbossi- e le ureidopenicilline associate ad inibitori delle beta-lattamasi presentano un ampio spettro di efficacia e sono inoltre caratterizzate da una modesta tendenza all'induzione di resistenze. Per quanto riguarda gli aminoglicosidi è indicato l'impiego con E-lattamine in pazienti anziani che vivono in RSA o strutture protette, in pazienti defedati o immuno-compromessi o recentemente dimessi dall'ospedale e/o sottoposti a trattamenti con antibiotici a largo spettro. Particolari avvertenze Un razionale utilizzo degli antibiotici permette di preservare l'ambiente territoriale extra-ospedaliero dalla diffusione delle resistenze batteriche, mantenendolo separato da quello ospedaliero ed evitando il ricorso all'ospedalizzazione per trattare infezioni risolvibili efficacemente al domicilio del paziente. Tali farmaci non dovrebbero rappresentare, di norma, la prima scelta terapeutica, ma vanno riservati a casi selezionati, anche allo scopo di prevenire l'insorgere di ceppi resistenti sul territorio; ciò vale in particolare per gli antibiotici impiegati nei confronti di Pseudomonas aeruginosa contrassegnati da asterisco (*). Per gli aminoglicosidi in particolare è indicato l'impiego in associazione con E lattamine, in pazienti anziani che vivono in RSA o strutture protette, in pazienti defedati o immuno-compromessi o recente- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 273 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i mente dimessi dall'ospedale e/o sottoposti a trattamenti protratti con antibiotici a largo spettro, allo scopo di potenziare o ampliare lo spettro d'azione antibatterica. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 274 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 56 La prescrizione a carico del SSN è limitata al trattamento iniziato in ambito ospedaliero ed al successivo utilizzo in ambito territoriale da parte del Medico di Medicina Generale per garantire la continuità terapeuAntibiotici per continuità tica. ospedale-territorio La prescrivibilità esclusiva in ambito ospedaliero è fi– Aztreonam nalizzata al mantenimento dell'efficacia ed alla con– ertapenem temporanea prevenzione dell'insorgenza di resistenza – imipinem+ cilastatina batterica ai principi attivi. La scelta di iniziare un trat– meropenem tamento ospedaliero con tali farmaci dovrebbe essere – rifabutina riservata alle infezioni gravi e in assenza di alternative – teicoplanina terapeutiche. Ciò non impedisce, tuttavia, dopo la diagnosi e l'inizio del trattamento, il mantenimento della continuità assistenziale ospedale-territorio a carico del SSN, ove fosse necessario proseguire la terapia a domicilio. Background Il problema dell'insorgenza di resistenza batterica è ormai considerato una vera emergenza sanitaria. In considerazione dell'ampio spettro d'azione di questi antibiotici, il loro impiego dovrebbe essere limitato ai casi d'infezione gravi e in assenza di alternative terapeutiche. L'obiettivo della nota è di conservare a tali antibiotici, con una prescrizione inizialmente ospedaliera confortata da adeguate indagini microbiologiche, la loro pienezza di azione antibatterica, evitando il più possibile l'insorgenza di resistenze. Le motivazioni da cui ha origine la nota 56 si basano pertanto non solo sulla criticità d'uso clinico degli antimicrobici in essa compresi, ma anche su rilevanti aspetti medico-sociali a tutela della salute pubblica, per il costante aumento di resistenza verso gli antimicrobici, legato ad un impiego spesso indiscriminato e non selettivo. La nota 56 garantisce di fatto la possibilità di proseguire, qualora necessario, a livello domiciliare ed a carico del Servizio Sanitario Nazionale, una terapia antimicrobica mirata e specifica prescritta in ambito ospedaliero, previa individuazione della patologia, assicurando in modo concreto la continuità assistenziale ospedale-territorio. Evidenze disponibili La nota riguarda antimicrobici di impiego selettivo in determinate affezioni critiche. In particolare: 1) farmaci a spettro antibatterico limitato (teicoplanina, rifabutina); 2) farmaci efficaci verso i soli gram-negativi "difficili", simili, nei riguardi di questi, alle cefalosporine di III e IV generazione (aztreonam); Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 275 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 3) carbapenemici (ertapenem, imipenem+cilastatina, meropenem) da riservare alla terapia mirata dei casi più critici. Particolari avvertenze La prescrizione a carico del SSN è limitata al trattamento iniziato in ambito ospedaliero ed al successivo utilizzo in ambito territoriale da parte del Medico di Medicina Generale per garantire la continuità terapeutica. Bibliografia 1. AHFS Drug information, American Society of Health-System Pharmacists American Hospital Formulary Service, 2000. Aztreonam:226-34; Imipenem and cilastatin sodium:247-56. 2. Antimicrobial resistance. BMJ 1998;317:609-71. 3. Facts and Comparisons. St. Louis: Walters Kluwer, 2000. Aztreonam:1275-7; carbapenem:1269-75; teicoplanin KU37, rifabutin, KU 12:1389. 4. Goodman et Gilman's. The Pharmacological Basis of Therapeutics. Hardman JG et al, eds. 9th ed. New York: McGraw Hill, 1996:1096-7, 1146-7, 1168, 1778, 1036-40. 5. Levy SB. Multidrug resistance - a sign of the times. N Engl J Med 1998;338:1376-8. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 276 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 57 La prescrizione a carico del SSN è limitata alla preAntiemetici (antagonisti dei venzione e al trattamento di nausea e vomito inrecettori serotoninergici) dotti da: – dolasetron – chemioterapia emetizzante – granisetron – radioterapia emetizzante (total body irradiation – ondansetron e sull'addome, entro 24 h dall'ultima applica– tropisetron zione) Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 277 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 59 Lassativi osmotici – lattitolo – lattulosio La prescrizione a carico del SSN è limitata alla seguente condizione patologica: – encefalopatia porto-sistemica in corso di cirrosi epatica Background Il lattulosio e il lattitolo sono disaccaridi semisintetici non assorbiti a livello gastroenterico. Producono diarrea osmotica con un basso pH fecale e prevengono la proliferazione della flora produttrice di ammonio, per cui risultano utili nel trattamento dell'encefalopatia porto sistemica. Tale patologia è rappresentata da un danno reversibile della funzione neurologica associata a disfunzione epatica. Nonostante la frequenza con cui tale condizione si manifesta, sono ancora poco chiari i meccanismi della patogenesi; sembra comunque che sia implicato un aumento della concentrazione di ammonio e che ci possa essere un ruolo di inibizione dei neurotrasmettitori attraverso i recettori dell'acido gamma-aminobitirrico (GABA) a livello del sistema nervoso centrale (SNC) e modificazioni nei neurotrasmettitori centrali e aminoacidi circolanti. Le terapie ad oggi disponibili si basano su diverse ipotesi. Sono comunque presenti pochi studi dai quali derivare i dati di efficacia. Nel 60-80% dei pazienti con encefalopatica epatica si riscontrata un aumento dei livelli di ammonio e la terapia, volta alla riduzione dei livelli di ammonio circolante, porta ad una risoluzione dell'encefalopatia. Il razionale del trattamento a base di lattulosio e lattitolo è dovuto all'assenza di uno specifico enzima disaccaridasi sulla membrana dei microvilli degli enterociti nel piccolo intestino, permettendo così l'entrata dei disaccaridi nel colon. Qui il lattulosio e il lattitolo sono catabolizzati dalla flora batterica ad acidi grassi a catena corta, che abbassano il pH intorno a 5. La riduzione del pH favorisce la formazione dello ione ammonio NH4+ da NH3, ione non assorbibile, intrappolando NH3 nel colon e riducendo effettivamente la produzione di ammonio nel plasma. Vi sono comunque anche altri meccanismi coinvolti che sembrano contribuire all'efficacia clinica di lattulosio e lattitolo. Evidenze disponibili Ad oggi sono disponibili pochi studi che dimostrino l'efficacia terapeutica di lattulosio e lattitolo. Una revisione sistematica, effettuata con l'obiettivo di valutare l'efficacia e la sicurezza dei disaccaridi semisintetici nei pazienti con encefalopatia epatica, verso placebo o nessun tipo di intervento o antibiotici, ha evidenziato che il lattulosio ed il lattitolo sono più efficaci del placebo nel migliore l'encefalopatia portosistemica (RR = 0,62 - in termini di nessun miglioramento - IC 95%: 0,46-0,84); dalla stessa revisione non appare un beneficio significativo dei disaccaridi semisintetici in termini di riduzione di mortalità. Gli autori dell'analisi sottolineano che l'effetto evidenziato potrebbe essere inficiato da bias, considerando la scarsa qualità metodologica dei trial inclusi nella revisione. Infatti limitando l'analisi ai soli studi di elevata qualità metodologica, non emerge una maggiore efficacia dei disaccaridi nei confronti del placebo in termini di rischio di non miglioramento della patologia 278 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i (RR = 0,92; IC 95%: 0,92-2,04); inoltre il lattulosio ed il lattitolo sembrerebbero anche meno efficaci rispetto agli antibiotici in termini di diminuzione del rischio di non miglioramento della patologia (RR = 1,24 IC 95%: 1,02 - 1,50). Gli autori concludono che la revisione non abbia sufficiente potenza per dimostrare un miglior effetto terapeutico dei disaccaridi. Alcuni clinical trials e due metanalisi suggeriscono che il lattitolo sia efficace quanto il lattulosio, per quanto abbia una maggiore palpabilità e meno effetti collaterali. Nei pazienti con deficienza di lattasi, il lattosio non metabolizzato ha la maggior parte degli effetti dei disaccaridi semisintetici nel colon ed è più economico. Particolari avvertenze La terapia con disaccaridi semisinteci è generalmente ben tollerata; i principali effetti collaterali consistono in crampi, diarrea e flautolenza. La prescrizione non è rimborsata dal SSN per altre indicazioni autorizzate. Bibliografia 1. Als-Nielsen, B, Gluud, L, Gluud, C. Nonabsorbable disaccharides for hepatic encephalopathy. Cochrane Database Syst Rev 2004 Issue 2; 2:CD003044. 2. Blanc, P, Daures, JP, Rouillon, JM, et al. Lactitol or lactulose in the treatment of chronic hepatic encephalopathy: Results of a meta-analysis. Hepatology 1992;15:222. 3. Camma, C, Fiorello, F, Tine, F, et al. Lactitol in treatment of chronic hepatic encephalopathy. A meta-analysis. Dig Dis Sci 1993; 38:916. 4. Ferenci, P, Herneth, A, Steindl, P. Newer approaches to treatment of hepatic encephalopathy. Semin Liver Dis 1996; 16:329. 5. Morgan, MY, Hawley, KE. Lactitol vs lactulose in the treatment of acute hepatic encephalopathy in cirrhotic patients: A double blind, randomized trial. Hepatology 1987; 7:1278. 6. Mortensen, PB, Holtug, K, Bonnen, H, Clausen, MR. The degradation of amino acids, proteins, and blood to short-chain fatty acids in colon is prevented by lactulose. Gastroenterology 1990; 98:353. 7. Mortensen, PB. The effect of oral-administered lactulose on colonic nitrogen metabolism and excretion. Hepatology 1992; 16:1350. 8. Riggio, O, Varriale, M, Testore, GP, et al. Effect of lactitol and lactulose administration on the fecal flora in cirrhotic patients. J Clin Gastroenterol 1990; 12:433. 9. Uribe-Esquivel, M, Moran, S, Poo, JL, Munoz, RM. In vitro and in vivo lactose and lactulose effects on colonic fermentation and portal-systemic encephalopathy parameters. Scand J Gastroenterol Suppl 1997; 222:49. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 279 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 65 La prescrizione e la dispensazione a carico del SSN da parte di centri specializzati, Universitari o delle aziende Sanitarie, individuati dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: – per i pazienti con Sclerosi Multipla recidivante-remitFarmaci per la tente e punteggio di invalidità da 1 a 5,5 all'EDSS di Sclerosi Multipla Kurtzke (Kurtzke Expanded Disability Status Scale): – glatiramer acetato – interferoni E-1a e glatiramer acetato; interferone E-1a ricombinante;interfeE-1b ricombinanti rone E-1b ricombinante – per i pazienti con Sclerosi Multipla secondariamente progressiva e punteggio di invalidità da 3 a 6,5 all'EDSS di Kurtzke e almeno 2 ricadute o 1 punto di incremento all'EDSS nei 2 anni precedenti: interferone E-1b ricombinante Background La sclerosi multipla rappresenta una mallattia altamente imprevedibile, sia per decorso clinico sia per prognosi, ed è caratterizzata da un corredo sintomatologico altamente proteiforme. Caratteristica fondamentale di questa malattia è l'estrema variabilità focale, temporale e spaziale con cui essa si manifesta e, a causa di qusta estrema variabilità, nella gestione dei pazienti con sclerosi multipla risulta molto importante una esatta valutazione dello stato clinico al momento della visita per valutare l'eventuale presenza di una riacutizzazione, o per valutare l'eventuale progressione di malattia. Nella sua forma più tipica,la forma recidivante-remittente, la sclerosi multipla si presenta con attacchi clinici acuti seguiti da regressione sintomatologica totale o parziale e da un periodo intercorrente tra un attacco ed un altro che non manifesta alcune progressione della disabilità. Circa l'80% delle forme clessiche a riacutizzazioni e remissioni progredisce in un tempo variabile, nella forma secondariamente progressiva, caratterizzata da riacutizzazioni associate ad un decorso progressivo. Il trattamento mira a ridurre la frequenza delle ricadute e a rallentare il decorso clinico della malattia. Trattandosi di una patologia infiammatoria su base autoimmunitaria, si utilizzano farmaci immunomodulatori in quanto riducono l'intensità con il quale il sistema immunitario attacca il sistema nervoso. L'IFN beta-1a e beta-1b hanno proprietà antivirale e immunomodulatorie. Essi sopprimono la proliferazione dei linfociti T, inibiscono la loro migrazione dalla periferia verso il sistema nervoso centrale e spostano il profilo delle citochine da un tipo pro- a uno antinfiammatorio. L'IFN beta-1a è indicato nel trattamento della forma recidivante-remittente allo scopo di ridurre la frequenza delle esacerbazioni, mentre non sono conclusivi i risultati del trattamento sulla progressione dei sintomi. 280 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Evidenze disponibili Numerosi studi hanno dimostrato l'efficacia dell' IFN beta-1b e dell'IFN beta-1a nella sclerosi multipla recidivante-remittente. Inoltre l'IFN beta-1b si è dimostrato efficace anche nella sclerosi multipla secondariamente progressiva, nella quale immagini di risonanza magnetica mostrano una riduzione nel numero di nuove lesioni. Glatiramer acetato è una sequenza polipeptidica casuale composta da 4 aminoacidi, la cui sequenza assomiglia a quella della proteina basica della mielina, uno dei principali bersagli contro cui è diretta la risposta immunitaria alla base della sclerosi multipla. Il farmaco avrebbe quindi un'azione di tipo competitivo: funzione da falso bersaglio, distraendo il sistema immunitario dalle strutture endogene. In numerosi studi clinici la somministrazione di glatiramer ha significativamente ridotto la frequenza di ricadute di circa il 30% e il numero di lesioni visibili alla risonanza magnetica. Particolari avvertenze L'opportunità di monitorare la prescrizione e la dispensazione (sempre riservata ai centri autorizzati), attraverso schede ad hoc opportunamente adattate per forma clinica di sclerosi multipla e per tipo di farmaco, sarà valutata a livello delle singole Regioni. Bibliografia 1. Comi G, Filippi M, Wolinsky JS, et al: European/Canadian multicenter, double-blind, randomized, placebo-controlled study of the effects of glatiramer acetate on magnetic resonance imaging-measured disease activity and burden in patients with relapsing multiple sclerosis. Ann Neurol 2001; 49: 290-297. 2. Filippini G, Munari L, Incorvaia B, et al. Interferons in relapsing remitting multiple sclerosis: a systematic review. Lancet 2003;361:545-552. 3. Ge Y, Grossman RI, Udupa JK, et al: Glatiramer acetate treatment in relapsing-remitting MS: quantitative MR assessment. Neurology 2000; 54:813-817. 4. Hafler, D.A. Multiple sclerosis. J. Clin. Invest 2004; 113:788-794. 5. Miller DH, Molyneux PD, Barker GJ, et al: Effect of interferon-beta 1b on magnetic resonance imaging outcomes in secondary progressive multiple sclerosis: results of a European multicenter, randomized, double-blind, placebo-contrlled trial. Ann Neurol 1999; 46:850-859. 6. Steinman, L. Immune therapy for autoimmune disease. Science 2004;305:212-216. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 281 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 66 FANS non selettivi* COXIB** La prescrizione dei farmaci antiinfiammatori non steroidei a carico del SSN è limitata alle seguenti condizioni patologiche: – artropatie su base connettivitica – osteoartrosi in fase algica o infiammatoria – dolore neoplastico – attacco acuto di gotta * aceclofenac; acetametacina; acido mefenamico; acido tiaprofenico; amtolmetina; cinnoxicam; dexibuprofene; diclofenac; diclofenac + misoprostolo; fentiazac; flurbiprofene; furprofene; ibuprofene; indometacina; ketoprofene; lornoxicam; meloxicam; nabumetone; naprossene; nimesulide; oxaprozina; piroxicam; proglumetacina; sulindac; tenoxicam. ** celecoxib; etoricoxib Background In dosi singole, i FANS hanno attività analgesica paragonabile a quella del paracetamolo. In dosi adeguate e per somministrazioni ripetute hanno effetto analgesico protratto e attività antinfiammatoria, proprietà che li rendono particolarmente efficaci per il dolore continuo associato a flogosi. Gli inibitori selettivi della ciclossigenasi 2 hanno un'azione simile a quella dei FANS non selettivi come diclofenac e naproxene e ne condividono gli effetti indesiderati. Tra gli inibitori selettivi della ciclossigenasi, celecoxib è registrato in Italia per il trattamento sintomatico dell'artrosi e dell'artrite reumatoide. Il rofecoxib, in precedenza autorizzato per il trattamento sintomatico dell'artrosi e dell'artrite reumatoide, è stato ritirato dal commercio a livello mondiale a causa di un aumento del rischio di eventi gravi cardiovascolari e trombotici (tra cui infarto del miocardio e ictus). L'etoricoxib è registrato per il trattamento sintomatico di artrosi, artrite reumatoide, disturbi muscoloscheletrici cronici, gotta acuta, dismenorrea e odontalgie. Il valdecoxib che era registrato in Italia per il trattamento sintomatico dell'artrosi, dell'artrite reumatoide e della dismenorrea è stato successivamente ritirato dal commercio in tutta Europa a causa di un aumentato rischio di eventi trombotici vascolari (infarto) e di reazioni avverse cutanee gravi. Evidenze disponibili FANS I FANS sono gravati da una incidenza di effetti gastrointestinali sfavorevoli (ulcera peptica e sue complicanze; emorragie, perforazione, ostruzione). Il rischio di ospedalizzazione per una complicanza grave e potenzialmente fatale è stimato fra l'1 e il 2% per anno. Questa incidenza aumenta nei soggetti a rischio, come specificato nella nota 1. Per questo motivo uno dei FANS in nota associa come gastroprotettore il misoprostolo e, pertanto, va riservato ai pazienti a rischio. I FANS possono inoltre ridurre l'efficacia degli antipertensivi e dei diuretici, e, in soggetti predisposti 282 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i e in associazione con altri farmaci nefrolesivi, determinare o aggravare insufficienza renale. COXIB Due sono gli studi clinici fondamentali che hanno esaminato comparativamente efficacia e tollerabilità dei primi due COXIB: lo studio CLASS, che ha comparato il celecoxib con ibuprofen e diclofenac, e lo studio VIGOR, che ha comparato rofecoxib con naprossene. In questi studi ambedue i COXIB, secondo il parere dei ricercatori, hanno dimostrato una efficacia analoga e una minore tossicità gastrointestinale rispetto ai FANS non selettivi prescelti. Purtroppo entrambi gli studi presentano problemi di interpretazione che mettono in discussione questa conclusione. Lo studio CLASS è stato criticato per il modo con il quale è stato condotto ed ha analizzato i dati. Non solo, ma l'obiettivo dello studio, che era quello di dimostrare per il celecoxib una minore gastrolesività rispetto ai FANS tradizionali, è di fatto fallito, essendo l'incidenza di ulcere complicate (l'end-point principale dello studio) analoga per i due trattamenti. Nello studio VIGOR, invece, pur dimostrando il rofecoxib una minore incidenza di effetti indesiderati gastroduodenali (l'end-point primario combinato era costituito dalla incidenza complessiva di ulcere complicate e ulcere sintomatiche) rispetto al naprossene, si riscontrava un inaspettato ma significativo aumento di eventi trombotici cardiovascolari gravi (in particolare infarto del miocardio) nei pazienti trattati con rofecoxib. I risultati degli studi CLASS e VIGOR hanno stimolato l'esecuzione di numerosi altri studi volti a chiarire il rapporto beneficio/rischio dei COXIB. In particolare su due aspetti fondamentali: la reale minore gastrolesività e la possibile maggiore tossicità cardiovascolare rispetto ai FANS tradizionali. La selettività per la COX-2, infatti, può essere un'arma a doppio taglio, cioè da un lato garantire una riduzione del rischio di tossicità gastrointestinale, ma di converso essere anche responsabile di un incremento della frequenza di fenomeni tromboembolici e/o della mortalità totale, vista la più alta prevalenza degli eventi cardiovascolari rispetto a quelli gastrointestinali gravi. Per quanto attiene la dimostrazione di una minore gastrolesività da parte dei COXIB vanno considerati due studi recenti. Il primo è una revisione sistematica di 9 studi clinici (durata > 12 settimane) che hanno paragonato il celecoxib con i FANS non selettivi. I pazienti trattati con celecoxib hanno mostrato una minore incidenza di interruzioni del trattamento dovute a sintomi gastrointestinali rispetto a quelli trattati con FANS tradizionali (6,2% vs 23%), ma tale vantaggio non veniva confermato se si consideravano tutte le cause di interruzione del trattamento. Ancora, i pazienti trattati con celecoxib presentavano una minore incidenza di ulcere gastro-duodenali rilevate routinariamente all'endoscopia eseguita alla fine delle 12 settimane di trattamento. Detta incidenza risultava essere del 6,2% dei pazienti trattati con celecoxib, del 12,0% nei pazienti trattati con celecoxib + aspirina, del 25,0% nei pazienti trattati con FANS tradizionali e del 26,0% nei pazienti trattati con FANS tradizionali più aspirina. L'incidenza delle gravi complicanze (emorragia, perforazione, ostruzione) era, invece, analoga tra i pazienti trattati con celecoxib (2,7%) e quelli che utilizzavano ibuprofen o diclofenac (5,0%) dimostrando così come la scelta dell'end-point terapeutico sia fondamentale per valutare correttamente comparativamente questi farmaci. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 283 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Il secondo è uno studio osservazionale sulle emorragie gastrointestinali occorse in oltre 40.000 pazienti anziani trattati con FANS non selettivi o selettivi e 100.000 controlli. Rispetto ai controlli non utilizzatori di FANS, lo studio dimostra un aumentato rischio di emorragie gastrintestinali nei pazienti trattati con FANS non selettivi (RR 4,0), diclofenac + misoprostolo (RR = 3,0) e rofecoxib (RR = 1,9) ma non con celecoxib (RR = 1,0). I risultati di questi due studi sembrano confermare il dato che i COX-2 inibitori selettivi possono presentare una minore gastrolesività rispetto ai FANS tradizionali, ma anche che tale migliore tollerabilità è dimostrata solo quando si considerano end-point surrogati o combinati (es. ulcere endoscopiche e/o sintomatiche). Mancano dati certi su una significativa minore incidenza di ulcere complicate (emorragia, perforazione, ostruzione), il parametro di valutazione più clinicamente rilevante. Inoltre, questa migliore tollerabilità non è mantenuta nei pazienti in trattamento con ASA, evenienza necessaria e frequente nella fascia di pazienti ai quali viene prescritto un FANS. Quello che è certo è che la selettività per la COX-2 non è di per sé garanzia di minore gastrolesività. In uno studio recente su pazienti che avevano presentato un sanguinamento gastrico da FANS la ricorrenza di un episodio emorragico si è verificata nel 4,9% di pazienti trattati con celecoxib e nel 6,4% di quelli trattati con diclofenac + omeprazolo, una differenza statisticamente non significativa. Per quanto attiene al possibile rischio di un incremento di eventi trombotici vascolari nei pazienti in trattamento con COXIB, i dati disponibili sono ancora incompleti e controversi per taluni composti. Le basi fisiopatologiche a sostegno di un possibile aumento del rischio cardiovascolare nei pazienti trattati con i COXIB sono ampiamente condivise. I COX-2 selettivi agiscono inibendo la sintesi di prostaciclina nella parete vascolare ma non quella del trombossano a livello piastrinico, causando così uno slittamento della bilancia emostatica verso uno stato protrombotico. Divergenze di giudizio sono invece espresse, specie da parte interessata, quando si discute della rilevanza clinica di tale aumento, anche se i dati clinici attualmente a nostra disposizione confermano in larga parte la tossicità cardiovascolare dei COXIB nonché di alcuni dei FANS tradizionali configurando così probabilmente un effetto di classe. I primi dati che indicavano un potenziale incremento dei fenomeni tromboembolici risalgono al 1999-2001 e riguardano lo studio VIGOR. Lo studio che comparava il rofecoxib al naprossene dimostrava un incremento di ben 5 volte di eventi tromboembolici cardiovascolari, soprattutto infarti acuti del miocardio, nei pazienti trattati con rofecoxib rispetto a quelli che assumevano naprossene, rofecoxib ha causato 1 infarto miocardico per ogni evento avverso grave gastro-intestinale (es. sanguinamento) prevenuto. Configurando così un profilo di tollerabilità tutt'altro che favorevole. Dopo quasi 4 anni di discutibili polemiche sul potenziale ruolo antiaggregante protettivo del naprossene, Merk decideva di ritirare dal commercio il farmaco dopo che un secondo studio prospettico di grandi dimensioni (studio APPROVe: Adenomatous Polyp Prevention on Viox) confermava i dati del VIGOR, dimostrando per il rofecoxib un incremento di due volte di eventi cardiovascolari avversi maggiori rispetto al placebo. I dati di questo studio inizialmente sono stati oggetto di una erronea valutazione statistica che portava la Merk a sostenere che il rischio cardiovascolare del rofecoxib si manifestava solo dopo 18 mesi di uso continuativo del far- 284 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i maco. Detta analisi è stata ampiamente confutata e corretta dalla stessa Merk dimostrando che il rischio cardiovascolare aumentava sin dalla prima dose di rofecoxib e rimaneva elevata per tutta la durata della terapia. Nel frattempo altri studi sia randomizzati che osservazionali nonché numerose metanalisi o revisioni sistematiche venivano a confermare la potenziale tossicità cardiovascolare dei COXIB e per alcuni di essi ciò ha significato il ritiro dal commercio in analogia a quanto occorso con il rofecoxib, e tra di essi ricordiamo il valdecoxib e il parecoxib, oppure la interruzione di importanti studi clinici in corso, come lo studio APC (Adenoma Prevention with Celebrex) che dimostrava un aumento di 3 volte del rischio cardiovascolare associato al celecoxib ad alte dosi rispetto al placebo. Particolari avvertenze Non sembrano esserci al momento differenze sostanziali nel profilo di sicurezza tra FANS non selettivi e COX-2 inibitori selettivi in merito alla potenziale nefrotossicità e agli altri eventi avversi. Alla luce di quanto sopra esposto appare chiaro come i dubbi avanzati sul profilo di sicurezza cardiovascolare dei COXIB appaiano tuttaltro che infondati e richiedano un riesame complessivo del rapporto beneficio/rischio di tutti i COXIB nonché di alcuni FANS tradizionali. Rimane ancora aperta la questione se il rischio di complicanze cardiovascolari sia un effetto di classe correlato al meccanismo d'azione di questa categoria di farmaci, quesito importante alla luce della immissione in commercio di nuovi COXIB. Infine il complessivo profilo di sicurezza dato dal rapporto tra tossicità gastrointestinale e rischio cardiovascolare appare ancora insoddisfacente. Risulta prudente perciò riservarne l'impiego al trattamento di pazienti che sono ad "alto rischio" per effetti avversi gravi gastrointestinali e che non sono a rischio cardiovascolare elevato. Questo in attesa che studi di grandi dimensioni randomizzati di confronto tra i vari farmaci, aventi come end-point terapeutici significativi l'incidenza delle ulcere complicate e degli eventi trombotici gravi cardiovascolari possano chiarire il reale rapporto rischio/beneficio di questi farmaci, che rimane a tutt'oggi ancora incerto. La prescrizione dell'associazione misoprostolo + diclofenac* è rimborsata alle condizioni previste dalla nota 1. Bibliografia 1. Bombardier C, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000;343:15201528. 2. Bresailer RS, Sandler RS, Quan H, et al; Adenomatous Polyp Prevention on Vioxx (APPROVe) Trial Investigators. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial (published correction appears in N Engl J Med 2006; 355: 221). N Engl J Med 2005;1092-1102. 3. Bresalier RS, Sandler RS, Quan H, et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005;352:1092-1102. 4. Chan FKL, et al. Celecoxib versus diclofenac and omeprazole in reducing the risk of recurrent ulcer bleeding in patients with arthritis. N Egl J Med 2002;347:2104-2110. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 285 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 5. Deeks JJ, et al. Efficacy, tolerability, and upper gastrointestinal safety of celecoxib for treatment of osteoarthritis and rheumatoid arthritis: systematic review of randomized controlled trials. BMJ 2002;325:619-623. 6. Del Favero A. What is safe prescribing and use of selective COX-2 inhibitors? Comparison with non-selective NSAIDs. In Side Effects of Drugs-Annual 26-Chapter 9. JJ Aronson ed. Elsevier Science B.V. 7. E. Vonkeman H, RBJBrouwers J, AFJ van de Laar M. Understanding the NSAID related risk of vascular events. BMJ 2006; 332:895-898. 8. J Graham D COX-2 Inhibitors, Other NSAIDS, and Cardiovascular Risk. The Seduction of Common Sense. JAMA 2006;193-196. 9. Juni P, Nartey L, Reichenbach S, Sterchi R, Dieppe PA, Egger M M. Risk of cardiovascular events and rofecoxib; cumulative meta-analysis. Lancet 2004; 364:2021-2029. 10. Kearney PM, Baigent C, Godwin J, Halls H, Emberson JR, Patrono C. Do selective cyclooxigenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of artherothrombosis? Meta-analysis of randomised trials. BMJ 2006; 332:1302-1308. 11. Lanza FL. A guideline for the treatment and prevention of NSAID-induced ulcers. Am J Gastroenterology 1998;93:2037-46. 12.Mamdani M, et al. Observational study of upper gastrointestinal hemorrhage in elderly patients given selective cyclooxygenase-2 inhibitors or conventional nonsteroidal antiinflammatory drugs. BMJ 2002;325:624-629. 13.McGettigan P, Henry D, Cardiovascular risk and inhibition of cyclooxygenase: a systematic review of the observational studies of selective and nonselective inhibitors of cydooxygenase-2. JAMA 2006;296:(doi 10.1001/Jama.296.13.jrv60015). 14.Nussmeier NA, Whelton AA, Brown MT, et al. Complications of the COX-2 inhibitors parecoxib and valdecoxib after cardiac surgery. N Engl J Med 2005; 352: 1081-1091. 15.Rahme E, et al. Association between naproxen use and protection against acute myocardial infarction. Arch Intern Med 2002;162:1111-5. 16.Ray WA et al. Non-steroidal anti-inflammatory drugs and risk of serious coronary heart disease : an observational cohort study. Lancet 2002;350:118-23. 17.Silverstein FE, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal antiinflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Longterm Arthritis Safety Study. JAMA 2000;284:1247-1255. 18.Solomon DH, Glynn RJ, Levin R, Avorn J. Nonsteroidal anti-inflammatory drug use and acute myocardial infarction. Arch Intern Med 2002;162:1099-104. 19.Solomon SD, Mcmurray JV, Pfeffer MA, et al. Cardiovascolar risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005; 352: 1071-1080. 20.Watson DJ et al. Lower risk of thrombboembolic cardiovascular events with naproxen among patients with rheumatoid arthritis. Arch Intern Med 2002;162:1105-10. 21.Wright JM. The double-edged sword of COX-2 selective NSAIDs. CMAJ 2002;167:11311137. 22.Zhang JJ, Ding EL, Song Y. Adverse effects of cyclooxygenase 2 inhibitors on renal and arrhythmia events: a class-wide meta - analysis. JAMA 2006;296:(doi: 10.1001/jama.296.13.jrv 60015). Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 286 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 74 Farmaci per l'infertilità La prescrizione a carico del SSN, su diagnosi e piano tefemminile e maschile: rapeutico di strutture specialistiche, secondo modalità adottate dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: – follitropina D da DNA ricombinante – trattamento dell'infertilità femminile: – follitropina E da in donne di età non superiore ai 45 anni con valori di DNA ricombinante FSH, al 3° giorno del ciclo, non superiori a 30 mUI/ml – lutropina alfa – menotropina – trattamento dell'infertilità maschile – urofollitropina Background L'infertilità di coppia è un problema di vaste proporzioni che coinvolge anche in Italia decine di miglialia di persone. L'Organizzazione Mondiale della Sanità stima intorno al 15-20% le coppie con problemi di fertilità nel paesi industrializzati avanzati. L'infertilità di coppia è legata, nel 35% circa dei casi, al fattore femminile, nel 30% al fattore maschile; nel 20% dei casi si rilevano problemi in ambedue i partner e nel 15% dei casi l'infertilità rimane sconosciuta (infertilità inspiegata). Le alterazioni dei fenomeni fisiologici dell'ovulazione rappresentano un'importante causa di infertilità di coppia (18-25% dei casi). L'individuazione dell'ovulazione in queste donne è finalizzata ad indurre lo sviluppo follicolare e la conseguente ovulazione. Il trattamento dell'infertilità femminile con gonadotropine è pertanto consigliato nelle diverse condizioni patologiche di cicli anovulari. L'indicazione all'uso delle gonodatropine si è notevolmente ampliata negli ultimi decenni, in quanto, oltre a situazioni patologiche di infertilità, le gonadotropine vengono utilizzate anche in donne normo-ovulanti sottoposte ad iperstimolazioni ovariche controllate necessarie al ripristino della fertilità mediante tecniche di procreazione medicalmente assistita (FIVET, ICS). L'infertilità maschile ha diverse cause, spesso difficilmente diagnosticabili e soltanto in alcuni casi di alterazione della spermatogenesi (ipogonadismo ipo- o normogonadotropo) esiste un razionale per un intervento terapeutico efficace con gonadotropine. Evidenze disponibili Le gonadotropine follicolostimolanti attualmente in uso si possono ricondurre a due grandi gruppi: 1. gonadotropine di origine estrattiva urinaria; 2. gonadotropine ricombinanti prodotte mediante transfezione della linea cellulare ovarica di criceto cinese con plasmidi contenenti le due sub unità geniche che codificano per l'FSH. Gli studi di confronto tra FSH ricombinante ed urinario sono stati oggetto di consistenti metanalisi nonché di numerosi studi farmaco-economici; tuttavia, le conclusioni in termini di evidenze certe di maggiore efficacia sono attualmente ancora contrastanti. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 287 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Particolari avvertenze Sulla base dei dati di letteratura ed al fine di evitare l'iperstimolazione ovarica, viene suggerito di non superare il dosaggio massimo complessivo di 12.600 UI/paziente diviso in due o più cicli non superando comunque il dosaggio massimo di 6.300 UI/ ciclo nella donna. Nell'infertilità maschile si suggerisce di non superare il dosaggio massimo, per singola prescrizione, di 150 UI di FSH 3 volte alla settimana per 4 mesi. Se dopo i trattamenti con tali dosi non si ottiene un risultato positivo (nel trattamento dell'infertilità), eventuali nuovi trattamenti possono comportare rischi superiori ai risultati attesi. Se effettuato con dosi improprie ed elevate, il trattamento con gonadotropine può essere responsabile: a) della cosiddetta sindrome da iperstimolazione ovarica, con passaggio di liquido nello spazio peritoneale e conseguenti ipovolemia, oliguria, emoconcentrazione, ascite massiva, eventualmente emoperitoneo, shock anche ad esito letale; b) di eventi tromboembolici in concomitanza o indipendenti dalla suddetta sindrome a carico di organi critici (cervello, polmone e delle estremità); c) di complicazioni polmonari (atelettasia, dispnea, tachipnea, sindrome della insufficienza respiratoria acuta), oltre a cisti ovariche, torsione degli annessi, forti caldane, reazioni febbrili, nausea, crampi addominali, meteorismo, gravidanze ectopiche e multiple. Nei casi di iperstimolazione ovarica sono controindicati i rapporti sessuali, per il rischio di insorgenza di gravidanze plurime. Nell'uomo, la somministrazione di gonadotropine provoca ginecomastia, dolore al seno, mastite, nausea, anormalità delle frazioni lipoproteiche, aumento nel sangue degli enzimi epatici, eritrocitosi. Bibliografia 1. AHFS Drug information, American Society of Health-System Pharmacists 2000:2816-9. 2. De Placido G, et al. Recombinant follicle stimulating hormone is effective in poor responders to highly purified follicle stimulating hormone. Human reproduction 2000;15:17-20. 3. Facts and comparisons. St. Louis: Walter Kluwer, 2000:246-58. 4. Filicori M, et al. Comparison of controlled ovarian stimulation with human menopausal gonadotropin or recombinant follicle-stimulating hormone. Fertility and Sterility 2003;80:390-7. 5. Keye WR Jr, et al. In: Infertilità Valutazione e trattamento. Verduci editore 1997;587-91. 6. Leibowitz D, Hoffman J. Fertility drug therapies: past, present, and future. J Obstet Gynecol Neonatal Nurs 2000;29:201-10. 7. Mantovani IG,et al. Pharmaco-economic aspects of in-vitro fertilization in Italy. Human Reproduction 1999;14:953-8. 8. Van Wely M, et al. Human menopausal gonadotropin versus recombinant follicle stimulation hormone for ovarian stimulation in assisted reproductive cycles. In: The Cochrane Library. Issue 1. Oxford: Update Sotware, 2003. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 288 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 75 Farmaci per la disfunzione erettile: La prescrizione a carico del SSN è limitata ai pazienti con: – alprostadil – lesioni permanenti del midollo spinale e compromissione – sildenafil della funzione erettile – vardenafil – tadalafil Background Le lesioni permanenti che coinvolgono il midollo spinale possono compromettere la funzione erettile. Il grado di disfunzione erettile dipende dalla complessità o dal livello della lesione. Farmaci quali l'alprostadil o gli inibitori della fosfodiesterasi di tipo 5 (sildenafil, vardenafil e tadalafil) seppur con meccanismo d'azione differente, sono utilizzati per trattare tale condizione. L'alprostadil, in vendita come soluzione iniettabile per uso intracavernoso, è in grado di indurre un erezione per rilascio diretto della muscolatura liscia; il sildenafil, il vardenafil e il tadalafil sono inibitori della fosfodieterasi di tipo 5, enzima responsabile dell'inattivazione del GMP ciclico. Un aumentato livello intracellulare di GMP ciclico causa una riduzione del calcio citoplasmatico e porta ad un rilasciamento delle cellule muscolari lisce che sono necessarie per l'erezione del pene. Evidenze disponibili Nel novembre 2004, la Agency for Healthcare Research and Quality statunitense nel report di Technology Assessment "Sexuality and Reproductive Health Following Spinal Cord Injury" ha preso in esame il confronto tra la somministrazione di alprostadil intracavernoso e sildenafil per via orale. Sebbene esistano differenze nel disegno degli studi e nelle misure di esito utilizzate, gli autori concludono che il tasso di risposta in termini di erezione soddisfacente da alprostadil è del 90% (random effects pooled estimate: 0.90 [95% C.I. 0.83, 0.97]) vs il 79% con sildenafil a dosaggio variabile da 25-100 mg (random effects pooled estimate: 0.79 [95% C.I. 0.68, 0.90]). Dal punto di vista della sicurezza i due trattamenti sono risultati generalmente ben tollerati. Per quanto riguarda gli altri inibitori della fosfodiesterasi commercializzati dopo il sildenafil (tadalafil e vardenafil), i dati attualmente disponibili non consentono una loro comparazione diretta. Le conclusioni in termini di evidenza, sono sufficienti per riconsiderare il ruolo in terapia del sildenafil e dei suoi congeneri per la prescrizione a carico SSN del trattamento della disfunzione erettile in questa tipologia di pazienti. Bibliografia 1. Brock, GB, McMahon, CG, Chen, KK, et al. Efficacy and safety of tadalafil for the treatment of erectile dysfunction: results of integrated analyses. J Urol 2002; 168:1332. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 289 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 2. Derry F, Hultling C, Seftel AD, Sipski ML. Efficacy and safety of sildenafil citrate (Viagra) in men with erectile dysfunction and spinal cord injury: a review. Urology 2002;60:49-57. 3. Eardley I, Mirone V, Montorsi F, Ralph D, Kell P, Warner MR, Zhao Y, Beardsworth A. An open-label, multicentre, randomized, crossover study comparing sildenafil citrate and tadalafil for treating erectile dysfunction in men naive to phosphodiesterase 5 inhibitor therapy. BJU Int 2005;96:1323-32. 4. Gans WH et al. Efficacy and safety of oral sildenafil in men with erectile dysfunction and spinal cord injury. J Spinal Cord Med 2001;24:35-40. 5. Giuliano F, Hulting C, El Masry WS et al.Randomized trial of sildenafil for the treatment of erectile dysfunction in spinal cord injury. Sildenafil Study Group. Ann Neurol 1999;46:15-21 6. Goldstein, I, Lue, TF, Padma-Nathan, H, et al. Oral sildenafil in the treatment of erectile dysfunction. N Engl J Med 1998;338:1397. 7. Porst, H, Padma-Nathan, H, Giuliano, F, Anglin, G. Efficacy of tadalafil for the treatment of erectile dysfunction at 24 and 36 hours after dosing: a randomized controlled trial. Urology 2003;62:121. 8. Sanchez RA et al. Efficacy, safety and predictive factors of therapeutic success with sildenafil for erectile dysfunction in patients with different spinal cord injuries. Spinal Cord 2001;39:637-643 9. Schmid DM, Schurch B, Hauri D. Sildenafil in the treatment of sexual dysfunction in spinal cord-injured male patients. Eur Urol 2000; 38:184-193. 10.Sexuality and Reproductive Health Following Spinal Cord Injury. Evidence Report (AHRQ Publication No. 05-E003-2) http://www.ahrq.gov/downloads/pub/evidence/pdf/sexlspine/sexlspine.pdf (ultimo accesso verificato il 22/11/07). 11.Urciuoli R, Cantisani TA, CarliniI M, Giuglietti M, Botti FM. Prostaglandin E1 for treatment of erectile dysfunction. Cochrane Database of Systematic Reviews 2004, Issue 2. 12.Valiquette L, Young JM, Moncada I, Porst H, Vezina JG, Stancil BN, Edmunds K, Montorsi F; Vardenafil Study Group. Sustained efficacy and safety of vardenafil for treatment of erectile dysfunction: a randomized, double-blind, placebo-controlled study. Mayo Clin Proc 2005;80:1291-7. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 290 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 76 Sali di ferro: – ferrico gluconato – ferromaltoso – ferroso gluconato La prescrizione a carico del SSN, in situazioni di carenza documentata, è limitata alle seguenti categorie di pazienti: – bambini di età < 3 aa – donne in gravidanza – anziani (>65 anni) La rimborsabilità dei prodotti di ferro a costo più elevato è limitata alle condizioni di maggiore criticità. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 291 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 78 Colliri anti-glaucoma: – apraclonidina – brimonidina – brinzolamide – dorzolamide – latanoprost – travoprost – bimatoprost – – – – – bimatoprost + timololo brimonidina + timololo dorzolamide + timololo latanoprost + timololo travoprost + timololo La prescrizione a carico del SSN, su diagnosi e piano terapeutico di specialisti, secondo modalità adottate dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: in monoterapia: – nel trattamento del glaucoma in pazienti per i quali i E-bloccanti sono inefficaci o controindicati in associazione: – nei pazienti per cui la monoterapia risulti terapeuticamente insufficiente Il trattamento a base di E-bloccanti va considerato di prima scelta, seguito, ove necessario, dalla terapia con uno dei principi attivi singoli o associati in elenco. Background Il glaucoma comprende un gruppo di disturbi caratterizzati da perdita del campo visivo associato a infossamento del disco oculare e a danno del nervo ottico. Il glaucoma si associa in genere a un aumento patologico della pressione intraoculare ma esistono forme in cui la pressione resta nei limiti della norma. Probabilmente la condizione più comune è rappresentata dal glaucoma primario ad angolo aperto (glaucoma cronico semplice, glaucoma ad angolo ampio), in cui l'ostruzione è localizzata nel trabecolato sclerale. Questa condizione è spesso asintomatica e il paziente può perdere una porzione significativa del campo visivo. Il glaucoma acuto ad angolo chiuso (glaucoma primario ad angolo chiuso, glaucoma ad angolo chiuso) deriva dal blocco del flusso di umor acqueo nella camera anteriore ed è un'emergenza medica. Evidenze disponibili Per il trattamento del glaucoma si impiegano farmaci che riducono la pressione intraoculare e che possono avere vari meccanismi d'azione. Betabloccanti topici o analoghi delle prostaglandine sono di solito i farmaci di prima scelta. Per controllare la pressione intraoculare può essere necessario combinare questi farmaci o aggiungerne altri, come per esempio miotici, simpaticomimetici e inibitori dell'anidrasi carbonica. La dorzolamide e la più recente brinzolamide sono inibitori topici dell'anidrasi carbonica. Sono registrati per l'utilizzo in pazienti resistenti o con controindicazione ai betabloccanti. Possono essere utilizzati da soli o in aggiunta a betabloccanti topici. Latanoprost e travoprost sono analoghi delle prostaglandine che aumentano il deflusso uveo-sclerale. Di recente è stato introdotto anche il bimatoprost. Sono usati per ridurre la pressione intraoculare in caso di ipertensione oculare o glaucoma ad angolo aperto. 292 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i La brimonidina è un agonista selettivo alfa 2 adrenergico registrato per l'abbassamento della pressione intraoculare nel glaucoma ad angolo aperto e nell'ipertono oculare in pazienti per i quali i betabloccanti sono controindicati; può essere utilizzata anche in associazione quando il betabloccante da solo non consente di raggiungere un'adeguata pressione intraoculare. L'apraclonidina è un altro agonista alfa 2 adrenergico. La moderna strategia della terapia del glaucoma cronico semplice ad angolo aperto, come suggerita dall'European Glaucoma Society (EGS), prevede l'impiego di un farmaco in monoterapia per il raggiungimento della target pressure individuata per ciascun paziente. Se il primo farmaco usato non è efficace nel ridurre la pressione intraoculare o se non è tollerato, si sostituisce con un altro farmaco. Se invece il primo farmaco è ben tollerato ed efficace, ma non sufficiente a raggiungere la target pressure, le linee guida prevedono l'aggiunta di un altro farmaco a quello in uso. Questi concetti sono ribaditi anche nelle linee-guida dell'American Academy of Ophthalmology. Inoltre, nel proseguimento con la terapia, in caso di progressione dei danni al nervo ottico ed al campo visivo la target pressure dovrebbe essere rivalutata; ulteriori aggiustamenti della target pressure potrebbero essere presi in considerazione se il paziente è rimasto stabile per almeno cinque anni o in presenza di effetti collaterali. Una revisione sistematica e 2 studi randomizzati successivi hanno trovato prove limitate che in soggetti con glaucoma primario ad angolo aperto o ipertensione oculare il trattamento medico con farmaci per uso topico riduce la pressione intraoculare rispetto a placebo od osservazione clinica. La revisione e uno degli studi non hanno rilevato differenze significative fra trattamento medico e placebo in termini di alterazioni del campo visivo a 1-3 anni di follow-up, mentre l'altro studio ha riportato che in soggetti con ipertensione oculare ma senza segni di glaucoma il trattamento medico riduce il rischio a 5 anni di sviluppare un glaucoma primario ad angolo aperto rispetto alla sola osservazione clinica. Particolari avvertenze L'assorbimento sistemico degli inibitori dell'anidrasi carbonica (dorzolamide e brinzolamide) può in rari casi dare effetti indesiderati tipo sulfamidico; se gravi tali effetti possono richiedere la sospensione del trattamento. I pazienti in terapia con latanoprost e travoprost devono essere controllati per verificare la comparsa di alterazioni della colorazione dell'occhio, dato che il latanoprost può incrementare la pigmentazione (bruna) dell'iride; è richiesta particolare attenzione negli occhi con iridi di colore disomogeneo e in caso di trattamento in un occhio solo. Bibliografia 1. Glaucoma Panel, Preferred Practice Patterns Committee. Primary open-angle glaucoma. American Academy of Ophthalmology (AAO); 2005. 2. Kamal D, Garway-Heath D, Ruben S, et al. Results of the betaxolol versus placebo treatment trial in ocular hypertension. Graefes Arch Clin Exp Ophthalmol 2003;241:196-203. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 293 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 3. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol 2002;120:701-713 4. Rossetti L, Marchetti I, Orzalesi N, Scorpiglione N, Torri V, Liberati A. Randomised clinical trials on medical treatment of glaucoma: are they appropriate to guide clinical practice? Arch Ophthalmol 1993;111:96-103. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 294 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 79 La prescrizione a carico del SSN è limitata alle seguenti condizioni di rischio: – soggetti di età superiore a 50 anni in cui sia previsto un trattamento > 3 mesi con dosi > 5 mg/die di prednisone o dosi equivalenti di altri corticosteroidi ac. alendronico, ac. risedronico, ac. alendronico + vitamina D3. Bifosfonati: – ac. alendronico – ac. risedronico – ac. ibandronico – ac. alendronico + vitamina D3 – raloxifene – ranelato di stronzio – teriparatide – ormone paratiroideo – soggetti con pregresse fratture osteoporotiche vertebrali o di femore – soggetti di età superiore a 50 anni con valori di T-score della BMD femorale o ultrasonografica del calcagno < - 4 (o < -5 per ultrasuoni falangi) – soggetti di età superiore a 50 anni con valori di T-score della BMD femorale o ultrasonografica del calcagno < -3 (o < - 4 per ultrasuoni falangi) e con almeno uno dei seguenti fattori di rischio aggiuntivi - storia familiare di fratture vertebrali - artrite reumatoide e altre connettiviti - pregressa frattura osteoporotica al polso - menopausa prima 45 anni di età - terapia cortisonica cronica ac. alendronico, ac. alendronico + vitamina D3, ac. risedronico, ac. ibandronico, raloxifene, ranelato di stronzio. – soggetti che incorrono in una nuova frattura vertebrale moderata-severa o in una frattura di femore in corso di trattamento con uno degli altri farmaci della nota 79 (alendronato, risedronato, raloxifene, ibandronato, ranelato di stronzio) da almeno un anno per una pregressa frattura vertebrale moderata-severa. Soggetti, anche se in precedenza mai trattati con gli altri farmaci della nota 79 (alendronato, risedronato, raloxifene, ibandronato, ranelato di stronzio), che si presentano con 3 o più fratture vertebrali severe (diminuzione di una delle altezze dei corpi vertebrali > 50% rispetto alle equivalenti altezze di corpi vertebrali adiacenti integri) o con 2 fratture vertebrali severe ed una frattura femorale prossimale. La nota si applica su diagnosi e piano terapeutico, della durata di 6 mesi prolungabile di ulteriori periodi di 6 mesi per non più di altre due volte (per un totale complessivo di 18 mesi), di centri specializzati, Universitari o delle Aziende Sanitarie, individuate dalle Regioni e dalle Province autonome di Trento e Bolzano. teriparatide, ormone paratiroideo Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 295 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Prima di avviare la terapia con i farmaci sopraindicati, in tutte le indicazioni è raccomandato un adeguato apporto di calcio e vitamina D, ricorrendo, ove dieta ed esposizione solari siano inadeguati, a supplementi con sali di calcio e vitamina D3 (e non ai suoi metaboliti idrossilati). La prevenzione delle fratture osteoporotiche deve anche prevedere un adeguato esercizio fisico, la sospensione del fumo e la eliminazione di condizioni ambientali ed individuali favorenti i traumi. Non deve essere dimenticato, infine, che tutti principi attivi non sono privi di effetti collaterali per cui va attentamente valutato il rapporto vantaggi e rischi terapeutici. Inoltre la loro associazione è potenzialmente pericolosa e va pertanto evitata. Per l' applicazione della Nota 79 la valutazione della massa ossea con tecnica DXA o ad ultrasuoni deve essere fatta presso strutture pubbliche o convenzionate con il SSN. La prescrizione va fatta nel rispetto delle indicazioni e delle avvertenze della scheda tecnica dei singoli farmaci. Background Il trattamento dell'osteoporosi deve essere finalizzato alla riduzione del rischio di frattura. I provvedimenti non farmacologici (adeguato apporto di calcio e vitamina D, attività fisica) o la eliminazione di fattori di rischio modificabili (fumo, rischi ambientali di cadute) non hanno controindicazioni e possono quindi essere raccomandati a chiunque. L'utilizzo di farmaci è sempre associato a potenziali rischi per cui il loro utilizzo deve essere riservato ai pazienti a rischio più elevato di frattura, che sono poi gli unici per i quali esiste una adeguata documentazione di efficacia. L'utilizzo di farmaci è anche condizionato dal rapporto tra vantaggi e svantaggi la cui stima individuale è spesso complessa e deve tener conto di aspetti di farmaco-economia. Ciò appare particolarmente rilevante per l'utilizzo di teriparatide, da riservare ai pazienti più gravi e quindi a maggior rischio di nuove fratture. La nota 79 prevede il trattamento farmacologico dell'osteoporosi a carico del SSN per pazienti con rischio di frattura sufficientemente elevato da giustificare gli inevitabili rischi connessi a trattamenti di lungo termine. I pazienti con pregresse fratture osteoporotiche sono quelli più a rischio di ulteriori fratture (> 20% a 10 anni). Va anche sottolineato che l'efficacia anti-fratturativa di tutti i prodotti in nota è stata prevalentemente dimostrata in pazienti con una storia pregressa di frattura vertebrale (studi FIT, VERT, BONE e SOTI). Una condizione di rischio analoga è stata anche documentata per i pazienti ultra-cinquatenni in trattamento cortisonico cronico. La documentazione di efficace nell'osteoporosi cortisonica per alcuni farmaci giustifica l'estensione della Nota 79 a donne e uomini in trattamento con dosi medioelevate di corticosteroidi. In altre condizioni (ad esempio bassa massa ossea) la definizione di una soglia di intervento è complicata dall'interagire di più fattori di rischio oltre che dalla minor documentazione di efficacia dei farmaci disponibili. Dall'analisi di studi epidemiologici di grandi dimensioni, condotti in Nord-Europa e negli USA, è stato possibile sviluppare algoritmi per una stima del rischio di frattura a 10 anni, basata sulla valutazione densitometrica (DXA) del femore o ultrasonografica delle falangi in com- 296 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i binazione con altri fattori di rischio. Una ragionevole semplificazione dei suddetti algoritmi consente di identificare due soglie densitometriche ossee a femore o falangi, al di sotto delle quali il rischio di frattura clinica vertebrale a 10 anni sia > 10%: <-4.0 o -3.0 di T score, in relazione alla presenza o meno di ulteriori importanti fattori di rischio. La teriparatide per il suo profilo di sicurezza va riservato a pazienti con una osteoporosi severa e ad altissimo rischio di nuove fratture da fragilità. Questo livello di rischio è identificato dalla presenza di multiple fratture vertebrali severe o dalla comparsa di nuove fratture dopo un congruo periodo di terapia con altri farmaci. La nota prevede che un paziente può essere in nota 79 per teriparatide se ha una delle seguenti condizioni: (a) 3 fratture vertebrali severe; (b) 2 fratture severe e storia di una frattura femorale; (c) 2 fratture vertebrali moderate-severe se una delle due fratture è insorta in corso di terapia con altri framaci della Nota 79; 1 frattura moderata-severa e storia di frattura di femore se una delle due fratture è insorta in corso di terapia con altri framaci della Nota 79. La definizione di severità di frattura è quella descritta da Genant sulla base dei seguenti schemi: Vertebra normale Frattura a cuneo Frattura biconcava Frattura posteriore Frattura lieve Frattura moderata Frattura severa Evidenze disponibili Per tutti i farmaci della Nota 79 è stata documentata l' efficacia sul rischio di fratture vertebrali post-menopausali con percentuali di riduzione del rischio comprese tra 30 e 60% e con un numero di donne da trattare per 3 anni per evitare una frattura vertebrale (Number Needed to Treat, NNT), compresa fra 10 e 20, tra i soggetti a più elevato rischio. In soggetti a minor rischio il NNT a 3 anni è superiore a 200. L'effetto sulle fratture di femore manca del tutto o risulta da sub-analisi o è marginale. Va ricordato che in soggetti anziani per la prevenzione delle fratture di femore sono disponibili più solide documentazioni di efficacia con la correzione dell'appor- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 297 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i to di vitamina D. L'alendronato è disponibile in Nota 79 anche in associazione con vitamina D. L'unico studio comparativo condotto con questa associazione in soggetti non vitamino D- carenti, non dimostra alcun vantaggio rispetto alla formulazione standard. Nel maschio l'efficacia terapeutica è stata valutata in un trial controllato e randomizzato per il solo alendronato, al quale pertanto si riferisce la nota. Il numero dei pazienti del trial (N= 241) non era calcolato per valutare gli effetti del trattamento sulle fratture osteoporotiche. L'efficacia per la prevenzione delle fratture è quindi in parte surrogata dai dati sulla massa ossea. In soggetti in trattamento cortisonico effetti favorevoli dei bifosfonati sulla densità minerale ossea sono stati rilevati in più trial randomizzati. L'efficacia per la prevenzione delle fratture vertebrali (ma non delle fratture non vertebrali) è stata dimostrata in trial randomizzati per risedronato e l'alendronato. In questi e in altri studi, l'esposizione ai corticosteroidi in grado di aumentare in maniera clinicamente rilevante il rischio di fratture osteoporotiche, è generalmente stimata in 7,5 mg/die o più di prednisone o equivalenti. È importante l'osservazione che gli effetti favorevoli dei bifosfonati sulle fratture e sulla densità minerale ossea sono più evidenti in uomini ultra-cinquantenni ed in donne in post-menopausa. Il trattamento con teriparatide riduce il rischio di frattura vertebrale a valori inferiori al 10% in 10 anni anche in soggetti ad alto rischio. Il suo utilizzo è limitato a questi ultimi pazienti per il suo ancora incerto profilo di sicurezza (vedi sotto). Tra le forme severe di osteoporosi va inclusa anche la Osteogenesi Imperfetta. Il neridronato è l'unico famaco con indicazione e prescrivibilità a carico del SSN per questa patologia. Particolari avvertenze Alendronato, risedronato ed ibandronato appartengono alla classe dei bifosfonati. I tre farmaci non sono privi di effetti indesiderati. Tra questi il più comune è la comparsa o accentuazione di esofagite particolarmente in persone con reflusso gastroesofageo o alterata motilità esofagea o che assumono FANS o che sono incapaci di seguire le raccomandazioni del foglietto illustrativo (compressa presa a digiuno con abbondante acqua, rimanenedo in posizione eretta o seduta per almeno trenta minuti). Questo effetto collaterale è apparentemente meno frequente con le formulazioni intermittenti (settimanale o mensile). La terapia con bisfofonati è stata associata alla comparsa di osteonecrosi della mandibola. Questo grave effetto collaterale è stato ossservato quasi esclusivamente tra pazienti che assumono dosi elevate di bisfosfonati per via venosa per il trattamento della ipercalcemia neoplastica e delle metastasi ossee. Le osservazioni tra pazienti che assumono le dosi indicate per l'osteoporosi rimangono sporadiche. Il raloxifene è un modulatore dei recettori estrogenici. I suoi effetti sono similestrogenico su osso (riduzione del turnover) e fegato (riduzione di colesterolo e lipoproteine LDL) e anti-estrogenici su endometrio e mammella. Da studi specifici è emerso che raloxifene ha un effetto neutro sul rischio cardio-vascolare, mentre si associa ad un significativo aumento del rischio di ictus e trombo-embolismo venoso. 298 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Il meccanismo d'azione del ranelato di stronzio è per il momento sconosciuto. Va ricordato che circa il 50-70% delle variazioni densitometriche sono legate ad un artefatto: l'elevato peso atomico dello stronzio che si deposita nel tessuto osseo. La teriparatide stimola la neoformazione di osso soprattutto a livello della colonna. Il trattamento cronico provoca nei ratti la comparsa di osteosarcomi. Ciò giustifica sia la limitata durata dei trattamenti sia la necessità di limitare la prescrivibilità a centri specialistici particolarmente qualificati. Bibliografia 1. Adachi JD et al. Two-year effects of alendronate on bone mineral density and fracture in patients on glucocorticoids. Arthritis and Rheum 2001;44:202-11. 2. Adami S et al. Fracture Incidence and Characterization in Patients on Osteoporosis Treatment: The ICARO Study J Bone Min Res 2006;21:1565-1570. 3. Barrett-Connor E et al. Raloxifene Use for The Heart (RUTH) Trial Investigators. Effects of raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med 2006;355:125-37. 4. Bischoff-Ferrari HA et al Fracture prevention with vitamin D supplementation: a metaanalysis of randomized controlled trials. JAMA. 2005;293:2257-64. 5. Black DM et al. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996;348:1535-41. 6. Chesnut CH et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19:1241-49 7. Cummings SR et al Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998;280:2077-82. 8. De Groen PC, et al. Esophagitis associated with the use of alendronate. N Engl J Med 1996;335:1016-21. 9. Ettinger B, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. JAMA 1999;282:637-45. 10.Harris ST et al. Effects of risedronate treatment on vertebral and non vertebral fractures in women with postmenopausal osteoporosis. JAMA 1999;282:1344-52. 11.Kanis JA et al. Ten-year probabilities of clinical vertebral fractures according to phalangeal quantitative ultrasonography. Osteoporos Int 2005;16:1065-70. 12.Lenchik L, Rogers LF, Delmas PD, Genant HK. Diagnosis of osteoporotic vertebral fractures: importance of recognition and description by radiologists. Am J Roentgenol 2004;183:949-58. 13.Lindsay R et al. Risk of new vertebral fracture in the year following a fracture. JAMA 2001;285: 320-3. 14.McClung M, et al. Effect of risedronate on hip fracture risk in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001;344:333-40 15.Meunier PJ et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004;350:459-68. 16.Migliorati CA et al Bisphosphonate-associated osteonecrosis: a long-term complication of bisphosphonate treatment. Lancet Onco. 2006 ;7:508-14. 17.Neer RM et al Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434-41. 18.Orwoll E et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000;343:604-10. 19.Reginster J et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteop Intern 2000;11:83-91. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 299 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 20.Reginster JY et al Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005;90:2816-22. 21.Società Italiana di Reumatologia et al. Linee Guida per la diagnosi, prevenzione e terapia dell'osteoporosi. Sinossi. Edimes, Pavia, 2006. 22.Van Staa TP et al. The epidemiology of corticosteroid-induced osteoporosis: a metaanalysis. Osteoporos Int 2002;13:777-87 23.Wallach S et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Calc Tissue Int 2000;67:277-85. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto giugno 2007 300 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 82 Antileucotrienici: – montelukast – zafirlukast La prescrizione a carico del SSN è limitata alle seguenti condizioni: – nel trattamento di "seconda linea" dell'asma moderato persistente, in aggiunta agli steroidi per via inalatoria, quando questi non garantiscano un controllo adeguato della patologia, anche dopo associazione con E-2 agonisti – nella profilassi dell'asma da sforzo Quando gli steroidi risultino insufficienti è preferibile, piuttosto che aumentarne il dosaggio, aggiungere un farmaco di "seconda linea". Tra questi la prima scelta è rappresentata dai E-2 agonisti a lunga durata d'azione, seguiti, come seconda scelta, dagli antileucotrienici. Background Nei pazienti affetti da asma lieve-moderata persìstente non controllata da steroidi inalatori, è preferibile aggiungere un farmaco di seconda linea (beta-2 inalatori a lunga durata d'azione, teofillina o antagonisti dei leucotrieni) piuttosto che aumentare la dose di steroide inalatorio. Fra queste terapie di seconda linea, i beta-2 inalatori a lunga durata d'azione rimangono i farmaci di prima scelta. Evidenze disponibili Gli antagonisti dei leucotrieni costituiscono farmaci di seconda linea, da aggiungere quindi agli steroidi inalatori e ai E-2 stimolanti, quando tale associazione non sia sufficiente a controllare la sintomatologia o per mantenere il controllo con dosaggio ridotto di steroide inalatorio in pazienti con asma persistente di moderata entità. Gli steroidi per via inalatoria sono i farmaci di prima linea e di prima scelta nel trattamento dell'asma lieve persistente, ma, quando inefficaci o non tollerati, possono essere sostituiti, come seconda scelta, dagli antagonisti dei leucotrieni. Questi ultimi invece sono sconsigliati nell'asma grave persistente in quanto non efficaci e potenzialmente associati allo sviluppo di complicanze quali la sindrome di ChurgStrauss. Gli antagonisti dei leucotrieni sono consigliati come farmaci di prima scelta nella profilassi dell'asma da sforzo in alternativa ai beta-2 stimolanti a breve o lunga durata d'azione o ai cromoni. Bibliografìa 1. Bjermer L, Bisgaard H, Bousquet J, Fabbri LM, Greening AP, Haahtela T, Holgate ST, Picado C, Menten J, Dass SB, Leff JA, Polos PG. Montelukast and fluticasone compared with salmeterol and fluticasone in protecting against asthma exacerbation in adults: one year, doublé blind, randomised, comparative trial. BMJ 2003;327:891. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 301 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 2. Edelman JM, Turpin JA, Bronsky EA, Grossman J, Kemp IP, Ghannam AF, DeLucca PT, Gormley G.J, Pearlman DS. Oral montelukast compared wìth inhaled salmeterol to prevent exercise-induced bronchoconstriction. A randomized, double-blind trial. Exercise Study Group Ann Intern Med 2000,132:97-104. 3. Global strategy for asthma management and prevention /NHLBI/WHO workshop report. Global Initiative for Asthma Update 2002 Global Initiative for Asthma, National Heart, Lung and Blood Institute. 2002. Document no. 02-3659. 2002. 4. Gross WL. Churg-Strauss syndrome: update on recent developments. Curr Opin Rheumatol 2002;14:11-4. 5. Leff JA,. Busse WW, Pearlman D, Bronsky EA, Kemp J, Hendeles L, Dockhorn R, Kundu S, Zhang J,. Seidenberg BC, Reiss TF. Montelukast, a leukotriene-receptor antagonist, for the treatment of mild asthma and exercise-induced bronchoconstriction. N Engl J Med 1998; 339:147-52. 6. Nelson HS, Busse WW, Kerwin E, Church N, Emmett A, Rickard K, Knobil K. Fluticasone propionate/salmeterol combination provides more effective asthma control than low-dose inhaled corticosteroid plus montelukast. J AÌlergy Clin Immunol 2000;106:1088-95. 7. Price, DB, Hernandez D, Magyar P, Fiterman J, Beeh M, James IG, Konstantopoulos S, Rojas R, van Noord JA, Pons M, Gilles L, Leff JA. Randomised controlled trial of montelukast plus inhaled budesonide versus double dose inhaled budesonide in adult patients with asthma. Thorax 2003;58:211-6. 8. Robinson DS, Campbell D, Barnes PJ. Addition of leukotriene antagonists to therapy in chronic persistent asthma: a randomised double-blind placebo-controlled trial. Lancet 2001;357:2007-11. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 302 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 83 La prescrizione a carico del SSN è limitata alle seguenti condizioni: Sostituti – trattamento sintomatico dei pazienti affetti da malattia di Sjögren o fenomeno di Sjögren (sindrome sicca in corso di patologia autoimlacrimali mune), poiché non è disponile una terapia di tipo causale della malattia La terapia della malattia di Sjögren o fenomeno di Sjögren (sindrome sicca in corso di patologia autoimmune) è attualmente solo sintomatica ed è diretta alla riduzione delle manifestazioni di insufficienza esocrina. La correzione della secchezza oculare può essere effettuata con sostanze di natura diversa, per le quali esista una dimostrazione clinica di efficacia. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 303 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 84 La prescrizione a carico del SSN in soggetti immunocompetenti è limitata alle seguenti condizioni: Virus Herpes Simplex: – trattamento delle infezioni genitali acute: aciclovir, famciclovir, valaciclovir – profilassi e trattamento delle recidive a localizzazione genitale: Farmaci attivi aciclovir, famciclovir, valaciclovir – cheratite erpetica: sui virus aciclovir erpetici: – trattamento della stomatite in età pediatrica: – aciclovir aciclovir – brivudin – famciclovir – valaciclovir Virus Varicella-Zoster: – trattamento della varicella: aciclovir – trattamento delle infezioni da H. Zoster cutaneo: aciclovir, famciclovir, valaciclovir, brivudin La prescrizione dei farmaci attivi sui virus erpetici è rimborsata dal SSN anche per le altre indicazioni autorizzate nei pazienti immunocompromessi. Background La terapia dell'Herpes simplex a localizzazione genitale persegue essenzialmente quattro scopi: • ridurre la durata delle lesioni mucocutanee; • ridurre il dolore associato alle lesioni; • prevenire le complicanze (encefalite, radicolite); • ridurre lo shedding virale riducendo così la trasmissione. Evidenze disponibili L'aciclovir è il farmaco di riferimento per la terapia dell'Herpes simplex a localizzazione genitale, il primo ad essere introdotto negli anni '80, con dimostrata superiorità sul placebo. Valaciclovir e famciclovir sono farmaci più recenti, per i quali è dimostrata una efficacia pari all'aciclovir in studi controllati comparativi con l'aciclovir stesso (mentre non esistono trial comparativi tra i due). Gli schemi raccomandati di terapia sono: prima infezione: • aciclovir: 400 mg x 3 / die per 7-10 gg; • valaciclovir: 500 mg x 2 / die per 7-10 gg; • famciclovir 250 mg x 3 / die per 7-10 gg; 304 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i recidive: • aciclovir: 400 mg x 3 / die per 5 gg; • valaciclovir: 500 mg x 2 / die per 3 gg (*); • famciclovir 250 mg x 2 / die per 5 gg. (*) Un recente studio ha dimostrato l'equivalenza dei trattamenti per 3 vs 5 gg. In modo analogo, esistono trial che dimostrano l'efficacia di aciclovir vs placebo per la profilassi delle recidive dell'Herpes genitale, così come l'equivalenza di valaciclovir e famciclovir con l'aciclovir. Gli scopi della profilassi dell'Herpes genitale sono: • ridurre il numero delle recidive; • ridurre la severità delle recidive; • migliorare la salute psico-sociale del soggetto affetto; • ridurre lo shedding virale asintomatico riducendo così la trasmissione (fino all'80% delle nuove infezioni erpetiche sono acquisite da fonte asintomatica). Gli schemi raccomandati di profilassi sono (in genere per 9 mesi, ripetibile): • aciclovir: 400 mg x 2 / die; • valaciclovir: 500-1000 mg / die; • famciclovir 250 mg x 2 / die. Il vantaggio di famciclovir e valaciclovir rispetto ad aciclovir è nella posologia, con un minor numero di assunzioni giornaliere e/o giorni di trattamento. Per quanto concerne la terapia della varicella, l'aciclovir è il farmaco di riferimento, il primo ad essere introdotto negli anni '80. Non vi sono studi clinici controllati di confronto di valaciclovir e famciclovir con aciclovir. Valaciclovir e famciclovir non sono autorizzati per il trattamento della varicella. Per la terapia dell'Herpes zoster, invece, l'aciclovir non è più generalmente considerato il farmaco di riferimento, sebbene l'efficacia rispetto al placebo rimanga confermata. Valaciclovir risulta infatti più efficace di aciclovir nell'accorciamento della durata del dolore associato alle lesioni cutanee e nella riduzione della neurite posterpetica. Famciclovir è equivalente ad aciclovir in termini di risoluzione delle lesioni cutanee e del dolore associato. Valaciclovir e famciclovir sono stati giudicati equivalenti per quanto riguarda tempo di risoluzione del dolore e nella prevenzione della neuropatia posterpetica. Brivudin è una analogo nucleosidico pirimidinico (a differenza di aciclovir che è un analogo nucleosidico purinico) registrato per la sola indicazione dell'infezione da Herpes Zoster. Gli studi registrativi di Brivudin dimostrano una riduzione statisticamente significativa (da 17 a 13 ore rispetto all'aciclovir) del tempo di eruzione di nuove lesioni vescicolose da VZV. Il tempo di crostizzazione delle lesioni e di scomparsa del dolore associato alla fase acuta sono simili per brivudin e aciclovir. È, inoltre, suggerita la possibile riduzione dell'incidenza (ma non della durata) delle lesioni vescicolose. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 305 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Uno studio ha dimostrato una riduzione statisticamente significativa della neurite post-erpetica (PHN) in soggetti trattati con brivudin vs aciclovir. Gli schemi raccomandati di terapia sono: • aciclovir: 800 mg x 5 / die; • valaciclovir: 1000 mg x 3 / die; • famciclovir 250 - 500 mg x 3 / die; • brivudin 125 mg x 1 / die. Particolari avvertenze La gengivostomatite erpetica è la più comune manifestazione clinica dell'infezione primaria da HSV-1 in età pediatrica. Sebbene si tratti di una malattia autolimitantesi, essa ha un decorso di 10-14 giorni e determina difficoltà alla alimentazione e alla reidratazione che spesso conducono all'ospedalizzazione. In uno studio controllato in bambini di età compresa fra 1 e 6 anni il trattamento con aciclovir ha dimostrato più precoce scomparsa delle lesioni e dei sintomi, riduzione del tempo di viral shedding, basso tasso di ricorrenze, assenza di eventi avversi rispetto al placebo. Bibliografia 1 Amir J, et al. Treatment of HSV gengivostomatitis with acyclovir in children: a randomised double trial blind placebo controlled study. BMJ 1997; 314:1800-3. 2 Beutner KR, et al. Valaciclovir compared with acyclovir for improved therapy for herpes zoster in immunocompetent adults. Antimicrob Agents Chemother 1995;39:1546-53. 3 Cohen JI, et al. Recent advances in varicella zoster virus infection: Ann Intern Med 1999; 130:922-32. 4 Degreef H. Famciclovir, a new oral anti-herpes drug: results of the first controlled clinical study demonstrating its efficacy and safety in the treatment of uncomplicated herpes zoster in immunocompetent patients. Int J Antimicrob Agents 1994;4:241-6. 5 Leone PA, Trottier S, Miller JM. Valacyclovir for episodic treatment of genital herpes: a shorter 3-day treatment course compared with 5-day treatment. Clin Infect Dis. 2002;3:95862. 6 Mertz GJ, et al. Oral famciclovir for suppression of recurrent genital herpes simplex virus infection in women. A multicenre, double-blind, placebo controlled trial. Arch Intern Med 1997;157:343-9. 7 Tyring SK, et al. Randomised, controlled clinica trial on valaciclovir and famciclovir therapy in immunocompetent patients 50 years and older. Arch Fam Med 2000;9:863-9. 8 Wald A. New therapies and prevention strategies for genital herpes. Clin Infect Dis 1999;28(Suppl1):S4-S13. 9 Wassilew SW, Wutzler P; Brivudin Herpes Zoster Study Group. Oral brivudin in comparison with acyclovir for improved therapy of herpes zoster in immunocompetent patients: results of a randomized, double-blind, multicentered study. Antiviral Res. 2003;59:49-56. 10 Wassilew SW, Wutzler P; Brivudin Herpes Zoster Study Group. Oral brivudin in comparison with acyclovir for herpes zoster: a survey study on postherpetic neuralgia. Antiviral Res. 2003;59:57-60. 11 Withley RJ, et al. Acyclovir: a decade later. N Engl J Med 1992;327:782 - 9. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 306 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 85 La prescrizione a carico del SSN, su diagnosi e piano terapeutico delle Unità di Valutazione Alzheimer (UVA) individuate dalle Regioni e dalle Provincie Autonome di Trento e Bolzano, è limitata ai pazienti con malattia di Alzheimer di grado lieve e moderato. Alle UVA è affidato il compito di effettuare o, eventualmente, confermare una diagnosi precedente e di stabilire il grado di severità in accordo alla scala MMSE. Farmaci per Alzheimer (inibitori dell'acetil-colinesterasi): – donepezil – galantamina – rivastigmina Il piano terapeutico deve essere formulato sulla base della diagnosi iniziale di probabile demenza di Alzheimer di grado lieve-moderato. La risposta clinica dovrà essere monitorata ad intervalli regolari dall'inizio della terapia: • a 1 mese, per la valutazione degli effetti collaterali e per l'aggiustamento del piano terapeutico; • a 3 mesi, per una prima valutazione della risposta e per il monitoraggio della tollerabilità: la rimborsabilità del trattamento oltre i tre mesi deve basarsi sul non peggioramento dello stato cognitivo del paziente valutato tramite MMSE ed esame clinico; • ogni 6 mesi per successive valutazioni della risposta e della tollerabilità. Background La demenza, una delle principali cause di disabilità e di disagio sociale per il mondo occidentale, rappresenta una priorità assistenziale la cui rilevanza, soprattutto in termini di costi sociali, è destinata ad aumentare nei prossimi anni a causa del progressivo invecchiamento della popolazione associato anche all'aumento dell'aspettativa di vita. Stime di prevalenza indicano che, rispetto al 2001, nei paesi dell'Europa occidentale ci si dovrà aspettare un incremento del 43% del numero di persone affette da demenza entro il 2020, e del 100% entro il 2040. Considerando la malattia di Alzheimer (DA) la più frequente tra le cause di demenza (43%-64%), il numero stimato di pazienti nella popolazione italiana ultrasessantacinquenne del 2001 è di 492.000 (range 357.000-627.000), con una prevalenza del 3,5% (IC 95% 2,54,5), mentre la sua incidenza è di 23,8 per 1000 anni/persona (IC 95% 17,3-31,7). Gli inibitori reversibili delle acetilcolinesterasi (IACh) sono gli unici farmaci approvati in Italia per il trattamento della DA. Attualmente le molecole presenti in commercio sono donepezil, rivastigmina e galantamina, con indicazione registrata nella DA di grado lieve-moderato. La premessa su cui si è basata l'introduzione in commercio di questi farmaci era la dimostrazione di una loro efficacia nel ritardare il de- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 307 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i clino cognitivo e funzionale associato alla DA, a fronte di un buon profilo di tollerabilità. Tali premesse sembrano però non essere confermate dai risultati di recenti revisioni sistematiche e di uno studio controllato di ampie dimensioni. . Da questi studi risultano di dubbia rilevanza clinica i benefici statisticamente significativi emersi utilizzando sia strumenti di valutazione globale sia scale cognitive. Evidenze disponibili Donepezil, rivastigmina e galantamina sono stati confrontati con il placebo in numerosi studi randomizzati controllati (RCT), inclusi in varie revisioni sistematiche. Non vi sono RCT che confrontino le diverse molecole di IACh tra loro. Recenti revisioni sistematiche hanno sintetizzato i risultati degli RCT che hanno confrontato donepezil e placebo. Rispetto al placebo il donepezil somministrato al dosaggio di 5 o 10 mg/die per periodi che vanno da 3 a 12 mesi produce un miglioramento cognitivo statisticamente significativo. Utilizzando il Mini Mental State Examination (MMSE, punteggio massimo 30 punti) la differenza osservata è di 1,8 punti a favore del donepezil (10 mg/die per 52 settimane), mentre utilizzando la sezione cognitiva della scala a 70 punti Alzheimer Disease Assessment Scale (ADASCog) si osserva un miglioramento di 2,0 e 3,1 punti (rispettivamente con 5 e 10 mg/die per 24 settimane). Il quadro clinico globale valutato mediante la scala a 7 punti Clinician's Interview Based Impression of Change (CIBIC plus) migliora di circa 0,5 punti. Gli effetti avversi più frequenti associati all'uso del donepezil sono di tipo colinergico: diarrea (Absolute Risk Increase rispetto al placebo, ARI = 12%) e nausea (ARI = 5%). L'interruzione della terapia a causa di effetti avversi è significativamente maggiore tra i trattati con donepezil rispetto a quelli con placebo (ARI = 6%)(6), mentre la frequenza di eventi avversi gravi non differisce significativamente. Lo studio AD 2000, finanziato dal servizio sanitario britannico, merita una considerazione particolare in quanto ha il follow-up più lungo mai realizzato su pazienti affetti da AD in trattamento con IACh (3 anni), ed è uno dei pochi RCT pubblicati ad avere considerato come outcome primario il rischio di istituzionalizzazione che d'altra parte non necessariamente rappresenta un buon outcome nella malattia di Alzheimer e nelle demenze in genere. Dei 565 pazienti affetti da AD di grado lieve-moderato, 282 sono stati assegnati a trattamento con donepezil e 283 a placebo; 292 pazienti sono stati seguiti per 60 settimane e 111 fino a 114 settimane. I risultati mostrano che il rischio di istituzionalizzazione dei pazienti sottoposti a trattamento con donepezil non differisce significativamente da quello dei pazienti del gruppo placebo (rischio relativo 0,97; IC 95% 0,72- 1,30 p = 0,80). Anche combinando il rischio di istituzionalizzazione e di progressione della disabilità non sono state osservate differenze significative tra donepezil e placebo (rischio relativo 0,96; IC 95% 0,74-1,24 p = 0,70). Anche per gli altri outcome considerati dallo studio (sintomi comportamentali, psicopatologia dei caregiver, costi assistenziali, tempo non retribuito impiegato dai caregiver per l'assistenza al malato, eventi avversi o decessi, dosi diverse di donepezil) non sono state osservate differenze statisticamente significative rispetto al placebo. I pazienti in trattamento con donepezil hanno mostrato nelle prime 12 settimane un miglioramento medio di 0,9 punti del MMSE e di 308 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 1 punto della scala funzionale Bristol Activities of Daily Living (BADLS). Successivamente, entrambi i gruppi (donepezil e placebo) hanno mostrato un ritmo analogo di peggioramento nel tempo. Durante lo studio, 167 pazienti hanno sospeso in cieco il trattamento con donepezil senza mostrare particolari problemi dopo l'interruzione. Gli autori dello studio hanno inoltre effettuato una valutazione economica mostrando che, nell'ambito del servizio sanitario britannico, la terapia con donepezil non produce sostanziali riduzioni dei costi assistenziali per i pazienti con DA. In sostanza lo studio ha confermato i risultati dei precedenti RCT sugli IACh, dimostrando che l'uso di donepezil produce un miglioramento dei punteggi nelle scale cognitive e funzionali, ma ha messo in dubbio la rilevanza clinica di questi outcome e la costo-efficacia del farmaco. La pubblicazione dello studio ha innescato un dibattito sulla utilità clinica del donepezil (e quindi anche degli altri IACh, vista l'assenza di provate differenze in termini di efficacia tra molecole diverse) nella terapia della DA. Numerose sono state le critiche su aspetti metodologici relativi al disegno e alla conduzione di questa indagine. In particolare è stato sottolineato che la ridotta numerosità di reclutamento rispetto a quanto programmato (565 pazienti invece di 3000), pur permettendo di raggiungere la potenza necessaria per dimostrare o confutare le ipotesi legate agli outcome primari, ha portato a stime con intervalli di confidenza relativamente ampi (compatibili con circa 30% di riduzione e 30% di aumento del rischio associato alla terapia con donepezil). Secondo alcuni autori inoltre, i ripetuti periodi di washout al termine delle varie fasi dello studio potrebbero avere provocato una perdita dei benefici ottenuti mediante terapia con donepezil. Una revisione sistematica Cochrane14 aggiornata al 2003 ha analizzato i risultati di 8 RCT (pubblicati e non) sulla rivastigmina. Rispetto al placebo, il farmaco somministrato a dosi di 6-12 mg/die produce, al termine di un follow-up di 26 settimane, un miglioramento cognitivo quantificabile in 2,1 punti alla ADAS-Cog e un miglioramento funzionale pari a 2,2 punti della Progressive Disability Scale (PDS) nell'attività della vita quotidiana. Nausea (ARI = 17%) e vomito (ARI = 14%) sono gli effetti avversi più comunemente associati alla terapia, e causano il 9% in più di sospensioni del trattamento rispetto al placebo. Per quanto riguarda la galantamina una revisione sistematica che ha incluso 8 trial, di cui 6 pubblicati, mostra un miglioramento cognitivo (testato mediante la scala ADAS-Cog) e globale (scale CIBIC plus o CGIC) rispetto al placebo a dosi comprese tra 16 e 36 mg/die in soggetti con DA di grado lieve-moderato. L'effetto sulla sfera cognitiva sembra aumentare con la durata del trattamento, che tuttavia negli studi considerati non supera i 6 mesi. Fino al 20% dei pazienti trattati con galantamina presenta effetti avversi di tipo colinergico, che causano più frequentemente del placebo sospensioni della terapia (ARI = 14%). Le metanalisi sugli IACh Due metanalisi, pubblicate nel 2004 e nel 2005, hanno analizzato in maniera cumulativa i risultati di RCT di confronto tra i vari IACh in commercio e il placebo. Sostanzialmente le conclusioni dei due lavori sono simili: nei pazienti con DA il trattamento con IACh produce benefici statisticamente significativi sia utilizzando strumenti di valutazione globale (scala CIBIC plus o la scala GCI), sia quando si utilizzano scale cognitive (ad es. la ADAS-Cog). L'effetto terapeutico sul quadro clinico Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 309 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i globale degli IACh rispetto al placebo è del 9% (IC 95% 6-12), corrispondente a un Number Needed to Treat (NNT) di 12 (IC 95% 9-16). Ciò significa che per ottenere un miglioramento clinico globale di qualsiasi entità in un nuovo paziente è necessario trattare 12 pazienti con IACh. L'analisi dei dati di sicurezza, cioè il calcolo del Number Needed to Harm (NNH), porta a stime analoghe: ogni 12 pazienti trattati con IACh (IC 95% 10-18) si avrà un nuovo paziente con effetti avversi. Per quanto concerne la sicurezza degli IACh considerati globalmente, la proporzione dei pazienti trattati che interrompe la terapia è maggiore che nel gruppo placebo (ARI = 8%), particolarmente a causa di effetti avversi (ARI = 7%). L'apparente "pareggio" tra benefici e rischi, in termini di NNT e NNH, va interpretato considerando l'importanza di un potenziale guadagno in termini di deterioramento clinico in un paziente affetto da DA a fronte della comparsa di effetti avversi che, pur potendo portare in molti casi a una sospensione del trattamento, sono reversibili e non gravi. L'entità del miglioramento clinico globale è tuttavia modesta, e la sua ricaduta su esiti assistenziali rilevanti, quali il carico assistenziale per i caregiver o un ritardo nella istituzionalizzazione del paziente, resta ancora da chiarire. La revisione di Kaduszkiewicz et al. include una valutazione accurata della qualità metodologica dei singoli RCT dalla quale emergono problemi sostanziali riguardanti il disegno degli studi e l'analisi dei dati. Scelte metodologiche inappropriate potrebbero aver introdotto dei bias che hanno particolarmente enfatizzato i benefici associati all'uso degli IACh. La presenza di carenze metodologiche e di modesti vantaggi clinici fa concludere gli autori che "le basi scientifiche per raccomandare gli IACh nel trattamento della DA sono discutibili". Implicazioni cliniche dei recenti risultati Tra i pazienti affetti da DA la percentuale attesa di responder alla terapia con IACh, intesi come individui che mostrano un qualsiasi miglioramento accertabile mediante una scala clinica globale, è circa del 10%. Poiché non vi è modo di individuare in anticipo i pazienti che risponderanno alla terapia, una possibile strategia prescrittiva - adottata dall'Agenzia Italiana del Farmaco e da altre istituzioni estere, come il britannico National Institute for Clinical Excellence (NICE) - consiste nel decidere la prosecuzione del trattamento sulla base della risposta clinica a 3 mesi: solo i pazienti che dopo 3 mesi di trattamento non peggiorano o mostrano un miglioramento del punteggio MMSE rispetto alla baseline saranno candidabili a continuare la terapia con IACh. I risultati dello studio osservazionale CRONOS mostrano, infatti, che la presenza di una risposta al trattamento dopo 3 mesi aumenta significativamente la probabilità di mantenere un miglioramento cognitivo anche 9 mesi dopo l'inizio della terapia (OR = 20,6; IC 95% 17,2-24,6). Poiché tuttavia si è visto che i miglioramenti cognitivi associati al trattamento con IACh sono di modesta entità, dovendosi basare sulla risposta individuale di singoli pazienti è opportuno chiedersi se il MMSE, unitamente a una valutazione clinica informale e soggettiva, sia un criterio appropriato per decidere la prosecuzione del trattamento con IACh, considerando che: • nessuno dei trial sugli IACh nella DA ha utilizzato il punteggio MMSE come outcome cognitivo primario, che nella maggioranza degli studi è rappresentato dalla scala ADASCog; il MMSE infatti non è ritenuto, dalla maggior parte degli autori, uno strumento adeguato a misurare l'efficacia degli IACh; 310 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i • analizzando gli studi in cui il MMSE è stato utilizzato come test cognitivo nella DA risulta che il deterioramento atteso annualmente in pazienti non trattati è di circa 3,3 punti (IC 95% 2,9-3,7), e che le differenze osservate tra effetto dei farmaci e placebo (0,68-1,36 punti) sono minori dell'errore medio di stima del MMSE (2,8 punti); • i risultati di recenti RCT mostrano, confermando precedenti osservazioni, che il miglioramento osservato al MMSE durante i primi 3-6 mesi di terapia con donepezil non è predittivo della risposta a lungo termine. Pur senza togliere importanza alla scelta di strumenti idonei a monitorare lo stato cognitivo e funzionale, l'aspetto sostanziale da considerare quando si interpretano i risultati degli studi sugli IACh nella DA è tuttavia un altro, e riguarda la rilevanza clinica delle differenze osservate. Tutti gli RCT pubblicati, eccetto pochi tra cui lo studio AD 2000, hanno considerato come outcome primario una variazione del punteggio di scale cliniche che consentono quantificazioni formali di deterioramento cognitivo, globale o funzionale. Questa scelta nasce dal fatto che, per ottenere l'approvazione di un farmaco come agente antidemenza, la Food and Drug Administration americana richiede la dimostrazione di una differenza significativa rispetto al placebo, utilizzando una delle suddette scale. Come già accennato in precedenza, non è tuttavia chiaro se ai miglioramenti rilevati mediante questi outcome surrogati corrisponda un beneficio anche su misure di esito più rilevanti per i pazienti con DA. La valutazione critica delle prove di efficacia che hanno promosso gli IACh all'attuale ruolo nella terapia della DA insieme con le più recenti revisioni sistematiche e studi clinici portano a dover tenere conto che: • rispetto al placebo, nei pazienti affetti da DA, la terapia con IACh produce benefici cognitivi e funzionali di modesta entità; • questi benefici non hanno ricadute su esiti clinicamente e socialmente più rilevanti, come il rischio di istituzionalizzazione, la progressione della disabilità e il carico assistenziale per i caregiver; • la percezione di efficacia che ha portato alla registrazione e alla rimborsabilità di queste molecole è nata dalle conclusioni positive di singoli RCT i cui risultati potrebbero essere stati distorti a favore degli IACh in conseguenza di discutibili scelte metodologiche riguardanti il disegno dello studio e l'analisi dei dati. Particolari avvertenze La risposta clinica dovrà essere monitorata ad intervalli regolari : • a 1 mese, per la valutazione degli effetti collaterali e per l'aggiustamento del piano terapeutico; • a 3 mesi, per una prima valutazione della risposta e per il monitoraggio della tollerabilità; la decisione sulla eventuale prosecuzione del trattamento oltre i tre mesi dovrà essere basata sul non peggioramento dello stato cognitivo del paziente valutato mediante MMSE e l'esame clinico; l'andamento clinico nei primi mesi di terapia è fortemente indicativo dell'andamento a più lungo termine; nell'ambito del progetto Cronos il 55% dei pazienti rispondenti a 3 mesi (intesi come coloro che hanno avuto una variazione del MMSE di almeno 2 punti) mantengono poi la risposta a 9 mesi, mentre solo il 6% dei pazienti non rispondenti a 3 mesi presenta successivamente una risposta a 9 mesi; Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 311 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i • ripetuta ogni 6 mesi per successive valutazioni della risposta e della tollerabilità. In aggiunta a ciò è opportuno ricordare che il trattamento deve essere interrotto nel caso di scarsa tollerabilità o scarsa compliance e in tutti i casi in cui, secondo il giudizio dell'unità valutativa, il beneficio clinico sia insufficiente per giustificare una continuazione della terapia. Il trattamento deve essere, comunque, interrotto quando il punteggio MMSE abbia raggiunto un valore uguale o inferiore a 10. Le Unità di Valutazione Alzheimer dovranno garantire : • la capacità di valutare il paziente con disturbi cognitivo-comportamentali seguendo un percorso diagnostico strutturato; • la capacità di mantenere un contatto ed una interazione costante con il medico di Medicina Generale in modo da assicurare la continuità dell'assistenza sanitaria al paziente. Criteri NINCDS-ADRDA per la diagnosi di probabile demenza di Alzheimer a) Criteri che devono essere presenti contemporaneamente: – demenza stabilita dall'esame clinico e documentata da test oggettivi (ad es. MMSE) e confermata dalla somministrazione di test neuropsicologici; – deficit in due o più funzioni cognitive; – progressivo deterioramento della memoria e di almeno un'altra funzione cognitiva; – nessun disturbo della coscienza; – comparsa tra i 40 e i 90 anni; – assenza di altre patologie del SNC o malattie sistemiche che possano causare demenza. b) Criteri a supporto della diagnosi: – progressivo deterioramento di specifiche funzioni cognitive quali linguaggio (afasia), capacità motoria (aprassia) e percezione (agnosia); – riduzione della indipendenza nello svolgimento delle attività quotidiane; – storia familiare di disturbi simili; – eventuale quadro di neuroimaging (ad es. atrofia cerebrale). Bibliografia 1. Agenzia Italiana del Farmaco Alzheimer e inibitori delle colinesterasi: c'è qualcosa di nuovo? Bollettino di Informazione sui Farmaci 2006;1:19-25. 2. Birks JS, Harvey R. Donepezil for dementia due to Alzheimer's disease. Cochrane Database Syst Rev 2003. 3. Courtney C, Farrell D, Gray R, et al.; AD2000 Collaborative Group. Long-term donepezil treatment in 565 patients with Alzheimer's disease (AD2000): randomised double-blind trial. Lancet 2004;363:2105-15. 4. Drugs for Alzheimer's disease. Therapeutic Letter 2005; www.ti.ubc.ca/PDF/56.pdf (ultimo accesso verificato il 22/11/2006). 5. Ferri CP, Prince M, Brayne C, et al.; Alzheimer's Disease International. Global prevalence of dementia: a Delphi consensus study. Lancet 2006; 366:2112-7. 6. Holmes C, Burns A, Passmore P, Forsyth D, Wilkinson D. AD2000: design and conclusions. Lancet 2004;364:1213 312 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 7. Kaduszkiewicz H, Zimmermann T, Beck-Bornholdt HP, van den Bussche H. Cholinesterase inhibitors for patients with Alzheimer's disease: systematic review of randomised clinical trials. BMJ 2005; 331:321-7. 8. Lanctot KL, Herrmann N, Yau KK, et al. Efficacy and safety of cholinesterase inhibitors in Alzheimer's disease: a metaanalysis. CMAJ 2003; 169:557-64. 9. National Institute for Clinical Excellence. Guidance on the use of donepezil, rivastigmine and galantamine for the treatment of Alzheimer's disease. Technology Appraisal n. 19. www.nice.org.uk/pdf/ALZHEIMER_full_guidance.pdf (ultimo accesso verificato il 11/22/ 2006). 10.Sano et al. N Engl J Med 1997;336:1216-1222 11.Whitehead A, Perdomo C, Pratt RD, Birks J, Wilcock GK, Evans JG. Donepezil for the symptomatic treatment of patients with mild to moderate Alzheimer's disease: a metaanalysis of individual patient data from randomised controlled trials. Int J Geriatr Psychiatry 2004;19:624-33. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 313 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 87 Antispastici urinari: – ossibutinina La prescrizione a carico del SSN è limitata alla seguente condizione: – pazienti affetti da incontinenza urinaria, nei casi in cui il disturbo minzionale sia correlato a patologie del sistema nervoso centrale (es. ictus, morbo di Parkinson, traumi, tumori, spina bifida, sclerosi multipla). Background In condizioni normali, la minzione ha inizio per contrazione del muscolo detrusore della vescica, mediata dall'innervazione colinergica, cui segue un rilasciamento dello sfintere urinario. In caso di instabilità del detrusore, contrazioni involontarie della vescica causano pollachiuria, bisogno impellente di urinare e incontinenza. L'ossibutinina è un farmaco anticolinergico utilizzato nel trattamento della vescica iperattiva. L'ossibutinina determina un rilasciamento della muscolatura liscia vescicale, sia per la sua attività antimuscarinica sia per un effetto diretto sulla muscolatura liscia. Evidenze disponibili Molti studi clinici hanno dimostrato la reale efficacia dell'ossibutinina nel controllo della iperattività detrusoriale, inclusa l'iperreflessia. Il farmaco, riducendo efficacemente la frequenza della minzione, diminuisce il numero degli episodi di incontinenza e incrementa la capacità della vescica. Thuroff et al. hanno raccolto 15 studi clinici controllati e randomizzati su un totale di 476 pazienti trattati con ossibutinina. La riduzione media dell'incontinenza urinaria osservata in tali soggetti è stata circa il 52% e la riduzione media relativa alla frequenza della minzione nelle 24 ore è stata circa il 33%. In tale studio la compliance dei pazienti è stata del 97% e la comparsa di effetti collaterali (prevalentemente secchezza delle fauci) è stata osservata solo dell'8%. L'efficacia dell'ossibutinina è stata dimostrata anche per somministrazione intravescicale. Bibliografia 1. Amarenco G, Marquis P, McCarthy C, et al. Qualité de vie des femmes souffrant d'impériosité mictionelle avec ou sans fuites: étude prospective aprés traitement par oxybutinine (1701 cas). Presse Medicale 1998;27:5. 2. Palmer LS, ZeboJd K, FirEt CF, et al. Complications of intravesical oxybutynin chloride therapy in the pediatric myelorneningocele population. J Urol 1997;157:638. 3. Thuroff JW, Chartier-Kastler E, Corcus J, et al. Medical treatment and medical side effects in urinary incontinence in the elderly. World J Urol 1998;16 Suppl 1:S48. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 314 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 88 La prescrizione a carico del SSN, su diagnosi di specialisti, seCortisonici per condo modalità adottate dalle Regioni e dalle Province Autonome di Trento e Bolzano, è limitata alle seguenti condizioni: uso topico – pazienti affetti da patologie cutanee gravi e croniche (ad es. psoriasi, dermatite atopica). Background Alcune malattie infiammatorie croniche che colpiscono primariamente la cute, soprattutto quando le lesioni abbiano estensione limitata, possono essere efficacemente controllate, attraverso il ricorso a steroidi per applicazione topica. L'applicazione topica del farmaco offre il vantaggio di limitare, in buona parte, gli effetti al sito di applicazione. Le condizioni cliniche che possono trarre beneficio da un trattamento con steroidi topici comprendono: gli eczemi da contatto, la dermatite atopica, la psoriasi (per lesioni di estensione limitata, in genere inferiore al 10% della superficie corporea), il pemfigoide bolloso, il lichen planus, il lupus eritematoso discoide cronico ed in misura più limitata la vitiligine. In base alla loro potenza, valutata in genere attraverso test di vasocostrizione, gli steroidi topici possono essere classificati come deboli o di classe I (es. idrocortisone, prednisone, clobetasone butirrato), moderatamente potenti o di classe II (es. triamcinolone acetonide, betametasone benzoato e valerato), potenti o di classe III (es. dilfucortolone valerato, betametasone dipropionato, fluocinamide) e molto potenti o di classe IV (es. clobetasolo propionato). Un differente modo di classificare gli steroidi topici prevede classi da 1 a 7 ove la classe 1 comprende steroidi molto potenti e la classe 7 steroidi deboli. L'efficacia degli steroidi topici si può potenziare aumentandone l'assorbimento attraverso medicazioni occlusive. Fondamentale è poi considerare la diversa capacità di assorbimento delle varie zone corporee: se si assume pari a 1 l'assorbimento sull'avambraccio, sullo scroto questo è 40 volte maggiore, 6 volte maggiore sulla fronte e 4 volte maggiore nella regione delle ascelle. Evidenze disponibili Gli steroidi per uso topico sono efficaci nel controllo dei sintomi associati alla dermatite allergica da contatto. Bisogna, tuttavia, notare come gli steroidi topici possano essere, a loro volta, responsabili di sensibilizzazione da contatto. Sebbene largamente impiegati, gli steroidi topici non sembrano efficaci nel trattamento della dermatite irritativa da contatto. Nella dermatite cronica delle mani, condizione in genere multifattoriale, gli steroidi topici hanno documentata efficacia ma non vi sono prove che indichino i vantaggi di brevi cicli con steroidi potenti rispetto ad applicazione prolungata di steroidi di bassa potenza. In uno studio randomizzato un trattamento intermittente (3 applicazioni settimanali) con uno steroide potente come il mometasone, dopo soppressione dei sintomi con trattamento continuativo per 9 settimane, offriva un controllo dei sintomi a 36 settimane nell'83% dei pazienti rispetto al 26% dei pazienti non trattati. Una revisione sistematica conferma l'efficacia degli steroidi topici nel controllo dei sintomi della dermatite atopica. Gli oltre 40 studi analizzati avevano durata molto limitata (1-6 settimane) e valutavano differen- Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 315 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i ti molecole con grande variabilità nella stima degli effetti (13-90% di risposta). Un solo studio controllato e randomizzato considera l'effetto degli steroidi topici nel prevenire le recidive della dermatite atopica una volta ottenuta la remissione clinica. Lo studio mostra come l'applicazione di fluticasone propionato per due giorni consecutivi della settimana per 16 settimane dopo un trattamento continuativo per 4 settimane, permetta un miglior controllo dei sintomi rispetto al placebo. Come indicato da una revisione sistematica, solo dati a breve termine (periodi di trattamento non superiori in genere alle 6-8 settimane) sono disponibili circa gli effetti degli steroidi topici di media e alta potenza nella psoriasi. Le medicazioni occlusive accrescono l'attività clinica in questa condizione. Uno studio controllato e randomizzato indica come il clobetasolo propionato topico sia più efficace degli steroidi sistemici nel controllo del pemfigoide bolloso con lesioni estese e si associ a minore mortalità ed eventi avversi. Come indicato da una metanalisi, la fotoprotezione e l'impiego di steroidi topici risultano misure efficaci nel ridurre l'entità delle manifestazioni cliniche del lupus eritematoso discoide cronico. Gli steroidi topici sono frequentemente impiegati nel controllo dei sintomi del lichen planus sia cutaneo sia mucoso. Le prove disponibili, raccolte in due revisioni sistematiche, sono tuttavia limitate per quanto riguarda le localizzazioni cutanee, mentre sono più convincenti per quanto riguarda gli effetti sulle lesioni mucose. Una revisione sistematica indica come gli steroidi topici potenti per periodi prolungati (4-6 mesi) possano indurre un variabile grado di ripigmentazione nella vitiligine di recente insorgenza e di estensione limitata. Tali trattamenti protratti si associano a frequenti effetti avversi locali. Per ridurre gli effetti avversi sono state proposte modalità di trattamento che prevedono una settimana di sospensione ogni tre settimane di trattamento. Particolari avvertenze Gli steroidi potenti non dovrebbero essere applicati in zone cutanee ad elevato assorbimento (es. aree di piega e scroto). Tali steroidi potenti non sono inoltre consigliabili in età infantile. Gli steroidi non vanno applicati su cute ove siano in atto processi infettivi né su lesioni ulcerative. Per applicazioni protratte si possono osservare effetti collaterali locali come teleangectasie, porpora, ipertricosi, atrofia, strie distense. Per applicazioni protratte su aree estese e in zone ad elevato assorbimento si possono osservare gli effetti avversi sistemici degli steroidi. Bibliografia 1. Chan ES, et al. Interventions for treating oral lichen planus. Cochrane Database Syst Rev 2000; (2):CD001199. 2. Cribier B, et al. Treatment of lichen planus. An evidence based medicine analysis of efficacy. Arch Dermatol 1998;134:1521-30. 3. Hoare C, et al. Systematic review of treatments of atopic eczema. Health Technol Assess 2000;4:1-191. 316 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 4. Jessop S, et al. Drugs for discoid lupus erythematosus. Cochrane Database Syst Rev 2001;(1):CD002954. 5. Joly P, et al. A comparison of oral and topical corticosteroids in patients with bullous pemphigoid. N Engl J Med 2002;346:321-7. 6. Levin C et al. Efficacy of corticosteroids in acute experimental irritant contact dermatitis? Skin Res Technol 2001;7:214-8. 7. Mason J, et al. Topical preparations for the treatment of psoriasis. A systematic review. Br J Dermatol 2002;146:351-64. 8. Mimesh S, Pratt M. Allergic contact dermatitis from corticosteroids: reproducibility of patch testing and correlation with intradermal testing. Dermatitis 2006;17:137-4. 9. Njoo MD, et al. Nonsurgical repigmentation therapies in vitiligo. Meta-analysis of the literature. Arch Dermatol 1998;134:1532-40. 10.Van Coevorden AM, et al. Overview of studies of treatments for hand eczema-the EDEN hand eczema survey. Br J Dermatol 2004;151:446-51. 11.Van der Meer JB, et al. The management of moderate to severe atopic dermatitis in adults with topical fluticasone propionate. Br J Dermatol 1999;140:1114-21. 12.Veien NK, et al. Long term intermittent treatment of chronic hand dermatitis with mometasone furoate. Br J Dermatol 1999;140:882-6. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 317 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Nota 89 Antistaminici La prescrizione a carico del SSN è limitata alle seguenti condizioni: – pazienti affetti da patologie su base allergica di grado medio e grave (rinocongiuntivite allergica stagionale, orticaria persistente non vasculitica) per trattamenti prolungati (superiori ai 60 giorni). Background Le malattie allergiche costituiscono un serio problema sanitario sia per il costante e continuo incremento epidemiologico in Italia (i dati ISTAT si attestano attualmente sul 20% dell'intera popolazione), sia per i risvolti farmaco-economici: i costi per il trattamento e le assenze lavorative e scolastiche. Le forme perenni alterano significativamente la qualità di vita, addirittura tanto quanto l'asma lieve o moderata. La rinite e la rinocongiuntivite allergica rappresentano il più importante fattore di rischio per lo sviluppo di asma bronchiale e spesso le due patologie sono associate. Un non adeguato trattamento delle vie aeree superiori comporta un insuccesso terapeutico nel paziente asmatico. Per questi motivi la rinite allergica deve essere considerata una patologia importante sia per le sue caratteristiche di cronicità sia per il fatto di essere un fattore aggravante l'asma. A tale proposito deve essere sottolineato lo stretto legame esistente tra la rinite allergica e la patologia asmatica: questo nesso è talmente cruciale che l'OMS ha stilato un documento che valuta appunto l'impatto della rinite allergica sull'asma (ARIA Document "Allergic Rhinitis and its Impact on Asthma"). Da tale documento emerge il concetto che la rinite allergica è caratterizzata da un processo infiammatorio strettamente dipendente dall'esposizione all'allergene causale, anche in assenza di sintomi. Si evince inoltre che un trattamento ottimale della rinite allergica può prevenire l'insorgenza di asma o migliorare l'asma coesistente. Il documento ARIA ha anche rivisitato la classificazione e i protocolli terapeutici della rinite allergica. La nuova classificazione è basata sulla durata dei sintomi e prevede due forme: intermittente e persistente. La seconda è caratterizzata dalla presenza di sintomi rinitici per più di quattro giorni alla settimana e per più di quattro settimane consecutive. A seconda dell'impatto sulle attività del soggetto, del senso di fastidio e delle ripercussioni sul sonno, la rinocongiuntivite allergica è riclassificata in base all'intensità dei sintomi. Il trattamento pertanto deve essere differenziato a seconda della forma e della gravità. Tale trattamento deve essere indirizzato verso obiettivi prioritari: l'antagonismo degli effetti indotti dai mediatori sugli organi bersaglio e la riduzione dell'accumulo delle cellule infiammatorie attivate. In questa ottica, l'istamina costituisce il più importante mediatore patogenetico. Evidenze disponibili Gli antistaminici sono farmaci che esplicano il loro ruolo con differenti meccanismi tra i quali il principale è il blocco del recettore H1 per l'istamina. I farmaci di seconda generazione possiedono proprietà farmacologiche aggiunte che differiscono tra le diverse molecole. Gli antistaminici sono in grado di bloccare il rilascio di mediatori da basofili e mastociti. Possono avere anche un effetto antinfiammatorio. 318 Commissione provinciale del Farmaco Bologna N ot e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i Gli antistaminici di seconda generazione si sono dimostrati più efficaci e accompagnati da minori effetti collaterali di sedazione rispetto a quelli di prima generazione, nonché da migliore compliance (monosomministrazione). Nell'orticaria acuta e cronica sono efficaci sintomatici. Sono in grado di ridurre il numero, la dimensione e la durata delle lesioni cutanee negli episodi di orticaria. Nell'orticaria cronica si ottengono risultati migliori nella somministrazione continua rispetto a quella intermittente al bisogno (36). Nei casi di orticaria vasculitica la risposta agli antistaminici non è ottimale. Nella dermatite atopica gli antistaminici non hanno effetto sul decorso della malattia. Particolari avvertenze Le attuali evidenze non supportano l'uso di antistaminici nella terapia dell'asma (Gina 2001). Gli antistaminici non sono indicati nel raffreddore comune sia in monoterapia sia associati a decongestionanti. Bibliografia 1. Abdelaziz M, Devalia J, Khair O, et al. Effect of fexofenadine on eosinophil induced changes in ephitelial permeabilità and cytochine release from nasal ephitelial cells of petients with seasonal allergic rhinitis. J Allergy Clin Immunol 1998;101:410-20. 2. Berger WE. Overview of allergic rhinitis. Ann Allergy Asthma Immunol. 2003; 90:7-12 3. Black AK, Greaves MW. Antihistamines in urticaria ed angioedema. Clin Allergy Immunol 2002;17: 249-86. 4. Bousquet J, Campbell A, Michel F. Antiallergic activities of antiistamines. In: Church M, Rihouz J, editors. Therapeutic index of antihistamines, Lewiston NY. Hogrefe et Huber; 1992;57-95. 5. Bousquet J, Van Cauwenberg P, Khaltaev N. Allergic rhinitis and ist impact on asthma. J Allergy Clin Immunol. 2001;108: 147-334. 6. Bousquet J, Van Cauwenberg P. Requirements for medications commonly used in the treatment of allergic rhinitis. Allergy 2003;58:192-7. 7. BousquetJ, Vignola AM, Demoly P. Links between rhinitis and asthma. Allergy 2003;58:691-706. 8. Braunstahl GJ, Fokkens W. Nasal involvement in allergic asthma. Allergy 2003;58:1235-43 9. Breneman DL. Cetirizine versus hydroxyzine and placebo in chronic idiopathic urticaria. Ann Pharmacother 1996;30:1075-9. 10.Campbell A, Michel FB, Bremard-Oury C, et al. Overview of allergic mechanisms. Ebastine has more than an antihistamine effect. Drugs 1996;1:15-9. 11.Campbell AM, Chanez P, Marty-Ane C, et al. Modulation of eicosanoid and histamine release from human dispersed lung cells by terfenadine. Allergy 1993;48:125-9. 12.Ciprandi G, Buscagli S, Pesce GP, et al. Minimal persistent infiammation is present at mucosal level in asymptomatic rhinitic patients with allergy due to mites. J. Allergy Clin. Immunol. 1995;96:971-9. 13.Ciprandi G. Passalacqua G, canonica GW. Effects of H1 antihistamines on adhesion molecules: a possibile rationale for long-term treatment. Clin Exp Allergy 1999;3:49-53. 14.Crampette L, Mainprice B, Bloom M, Bousquette J, Campbell AM. Inhibition of mediator and cytokine release from dispersed nasal polyp cells by terfenadine: Allergy 1996;51:346-9. 15.De Sutter AIM, Lemiengre M, Campbell H. Antihistamines for the common cold. Cochrane Database of Systematic Reviews 2003, Issue 3. 16.Dykewicz MS. Rhinitis and sinusitis. J. Allergy Clin Immunol 2003; 111:s520-9 17.Faraj BA, Jackson RT. Effect of astemizole on antigen-mediated histamine release from the blood of patients with allergic rhinitis. Allergy 1992;47:630-4. 18.Finn AF, Kaplan AP, Fretwell R, et al. A double-blind placebo controlled trial of fexofenadine HCL in the treatment of chronic idiopathic urticaria. J Allergy Clin Immunol 1999;104:1071-8. Prontuario terapeutico della Provincia di Bologna – aggiornato a giugno 2007 319 No t e A I F A 2 0 0 6 - 2 0 0 7 p e r l ' u s o a p p ro p r i a t o d e i f a rm a c i 19.Foreman J, Rihoux J. The antiallergic activity of H histamine receptor antagonistis in relation to their action on cell calcium. In: Church M, Rihoux J editors. Therapeutic index of antihistamines, Lewiston NY. Hogrefe et Huber; 1992;32-46. 20. Genovese A, PatellaV, De-Crescenzo G, et al. Loratadine and desethoxycarbonyl-loratadine inhibit the immunological release of mediators from human Fc ipsilon RI+cells. Clin Exp Allergy 1997;27: 559-67. 21.Global Strategy for Asthma Management and Prevention - updated April, 2002. NIH Publication No.02 - 3659, 2002. 22.Greaves MW.Chronic urticaria. N Engl J Med 1995;332:1767-72. 23.Hannuksela M, Kalimo K, Lammintausta, et al. Dose ranging study: cetirizine in the treatment of atopic dermatitis in adults. Ann Allergy 1993;70:127-33. 24.Howarth PH ABC of allergies: pathogenic mechanisms: a rational basis for treatment. BMJ 1998;316:758-61. 25.Klein PA, Clark RAF. An evidence-based review of the efficacy of antihistamines in relieving pruritus in atopic dermatitis. Arch Dermatol 1999;135:1522-5. 26.Leurs R, Church MK, Tagliatela M. H1 antihistamines: inverse agonisms, antinflammatory actions and cardiac effects. Clin Exp Allergy 2002;32:489-98. 27.Meltzer EO. Quality of life in adults and children with allergic thinitis J Allergy Clin Immunol 2001;108:S1. 28.Nasch DB, Sullivan SD, Mackowiak J Optimising quality of care and cost effectiveness in trating allergic thinitisi in a managed case setting. Am J Manag Care 2000; 6:3-15 29.Paolieri F, Battifora M, Riccio AM, et al. Terfenadine and fexofenadien reduce in vitro ICAM1 expression on human continuous cell lines. Ann Allergy asthma Immunol 1998;81:601-7. 30.Raptopoulou- Gigi M, Ilonidis G, Orphanou-Koumerkeridou H, et al. The effect of loratadine on activated cells of the nasal mucosa in patients with allergic rhinitis. J Invest Allergol clin Immunol 1993;3: 192-7. 31.Ricca V, Landi M, Ferrero P, Bairo A, Tazzer C, Canonica GW, Ciprandi G. Minimal persistent infiammation is present also in patients with seasonal allergic rhinitis. J Allergy Clin Immunol 2000;105:54-7. 32.Simon FE, Silver NA, Gu X, et al. Skin concentrations of antiH1 receptor antagonistis. J Allergy Clin Immunol 2001;107:526-30. 33.Simon FE, Simon Kj. Clinical pharmacology of new histamine H1 receptor antagonists. Clin Pharmacokinet 1999;36:329-52. 34.Simon FE, Simon KJ. The pharmacology and use of H1-receptor antagonist drugs. N Engl J Med 1994;330: 1633-70. 35.Simons FE, Simons KJ Clinical pharmacology of H1-antihistamines. Clin Allergy Immunol 2002;17:141-178. 36.Simons FE. H1-antihistamines: more relevant than ever in the treatment of allergic disorders. J Allergy Clin Immunol 2003; 112:S42-52. 37.Slater JW, Zechnich AD, Haxby DG. Second-generation antihistamines: a comparative review. Drugs 1999;57:31-47. 38.Temple DM, McCluskey M. Loratadine, an antihistamine, blocks antigen-and ionophoreinduced leukotriene release from human lung in vitro. Prostaglandins 1988;35:549-54. 39.Togias A. Rhinitis and asthma: evidence for respiratory system integration. J Allergy Clin Immunol. 2003;111:1171-83. 40.Triggiani M, Gentile M, Secondo A, et al. Histamine induced exocytosis and IL6 production from human lung macrophages through interaction with H1 receptors. J Immunol 2001;166:4083-91. 41.Verlato G, Corsico A, Villani S, Cerveri I, Migliore E, Accordino S, et al. Is the prevalence of adult asthma and allergic rhinitis still increasing? Results of an Italian study. J Allergy Clin Immunol 2003; 111:1232-8. Data aggiornamento novembre 2006 Prossimo aggiornamento previsto novembre 2007 320 Commissione provinciale del Farmaco Bologna Sede della Segreteria Scientifica c/o Dipartimento per l’ Assistenza Farmaceutica AUSL di Bologna. Via Gramsci, 12- 40121 Bologna. Dott.ssa Elisabetta Pasi Tel. 051/6079919 – Fax 051/6079628 mail: [email protected] !ZIENDE 3ANITARIE DI "OLOGNA
Scaricare