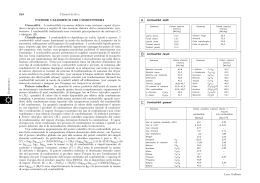
CHIMICA APPLICATA Applicazioni della Termochimica: Combustioni Combustioni Il comburente più comune è l’ossigeno dell’aria Aria secca: ! 78% N2 21% O2 1% gas rari Combustioni Parametri importanti: ! 1.Potere calorifico 2.Aria necessaria per la combustione (aria teorica di combustione) 3.Volume e composizione dei fumi 4.Temperatura di fiamma (temperatura teorica di combustione) 5.Temperatura di ignizione e limiti di infiammabilità Potere calorifico (Q) quantità di calore sviluppata durante la combustione completa di ! ! 1 kg di combustibile solido o liquido 1 Nm3 di combustibile gassoso Kcal/kg ⇔ kJ/kg Kcal/Nm3 ⇔ kJ/Nm3 ! ! 1 Nm3 = quantità di gas che in c.n. (0°C e 1 atm) occupa un volume di 1m3 ! 44,6 moli Potere calorifico (Q) in sostanza è il ∆H° del processo riferito ad una massa in kg o Nm3 • si ottiene dai ∆H° di reazione • misura sperimentale (calorimetro) • dato tecnico significativo anche di natura contrattuale • confronto di qualità fra combustibili Valori medi del potere calorifico di alcuni combustibili Solidi - liquidi (kcal/kg) Gassosi (kcal/Nm Legna stagionata 2500-3200 Biogas 5000-5500 Legna secca 3800-4700 Biogas purificato 8500 Carbone di legna 6500-8000 Gas illuminante 4500-5000 Torba 3000-4000 Gas d’acqua 2300-2700 Lignite 4000-5200 Gas d’aria 800-1000 Litantrace 7500-8900 Gas misto 1100-1300 Antracite 8000-8500 Gas d’altoforno 700-750 Coke 6700-8000 Butano 28500 Benzina 11000-12000 Propano 21500 Gasolio 10000-11000 GPL 26500 Olio combustibile 10000 Metano 8900 Potere calorifico Occorre distinguere tra potere calorifico superiore ed inferiore a seconda dello stato di aggregazione in cui si trova l’acqua prodotta Potere calorifico superiore Qs H2O prodotta allo stato liquido Potere calorifico inferiore Qi H2O prodotta allo stato vapore Il calore sviluppato è maggiore quando l’acqua prodotta è allo stato liquido rispetto a quando essa si trova allo stato vapore 15 C7H6O2(s) + — O2(g) 2 2 1 ΔH2 ΔH1 7 CO2(g) + 3 H2O(g) ΔHeva 7 CO2(g) + 3 H2O(l) Evaporazione: processo endotermico H2O(l) H2O(g) ΔHevap = ΔH°f(H2O(g))-ΔH°f(H2O(l)) ΔHevap =-241.82-(-285.83)=+44.01 kJ/mole potere calorifico inferiore 44, 01(kJ/mole) 1000 (moli) 18 kg di H2O tra i prodotti 1 = 585(kcal/kg) 4, 18 kcal per vaporizzare 1 kg di H2O Per i combustibili solidi o liquidi per i quali sono note umidità e analisi elementare: % in peso di H2O (umidità) % in peso di H kg di H2O per 1 kg di combustibile = kg di acqua nei prodotti Per i combustibili di composizione chimica nota, il potere calorifico può essere calcolato dalle entalpie di reazione delle reazioni di combustione dei componenti 70% CH4 ⇒ CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) Mix gas 20% H2 ⇒ 2H2(g) + O2(g) → 2H2O(l) ∆H= - 890,8 kJ ∆H= - 572,4 kJ 10% N2 ⇒ non brucia ! Nm3 1 di mix gas 0,70 Nm3 CH4 ⇒ 0,20 Nm3 H2 ⇒ 0,70 Nm3 x 44,6 moli/Nm3 = 31,21 moli 0,20 Nm3 x 44,6 moli/Nm3 = 8,92 moli Nella combustione completa si suppone che: C CO2 H H 2O S SO2 N N2 Metilammina: 2 CH3-NH2 + 9/2 O2 → 2 CO2 + 5 H2O + N2 Mercaptano: CH3-SH + 3 O2 → CO2 + 2 H2O + SO2 Un GPL commerciale contiene il 70% in massa di propano, C3H8 (potere calorifico Qsup =1,02x105 kJ/Nm3), 30% butano, C4H10 (Qsup = 1,34x105 kJ/Nm3) ed ha una densità pari a 550 kg/m3. Calcolare la frazione molare del butano nella miscela ed il potere calorifico superiore della miscela. Un olio combustibile presenta la seguente composizione in peso: 70% carbonio, 21% idrogeno e 9% zolfo. Calcolare il potere calorifico inferiore. ΔHºf(CO2 (g)) = -393,51 kJ/mol, ΔHºf(H2O (l))=-285,83 kJ/mol, ΔHºf(H2O (g))=-241,82 kJ/mol, ΔHºf(SO2 (l))=-296,83 kJ/mol Combustioni Parametri importanti: ! 1.Potere calorifico 2.Aria necessaria per la combustione (aria teorica di combustione) 3.Volume e composizione dei fumi 4.Temperatura di fiamma (temperatura teorica di combustione) 5.Temperatura di ignizione e limiti di infiammabilità Aria Teorica Di Combustione quantità di aria necessaria alla combustione Volume e Composizione Dei Fumi quantità e composizione dei prodotti Come miscela comburente si adopera comunemente l’aria Composizione volumetrica aria secca: ! 21% O2 78% N2 1% gas rari Si inglobano nell’azoto tutti i gas che non partecipano alla combustione 79 parti in vol. di N2 21 parti in vol. di O2 1 mole di O2 à 3,8 moli di N2 Per un combustibile gassoso il calcolo è semplice e diretto: CH4 + 2 O2 → CO2 + 2 H2O 1 L di metano 2 L di ossigeno 1 L di anidride carbonica 2 L di acqua alla stessa temperatura e pressione moli = volumi (principio di Avogadro) Considerando anche l’azoto 1 m3 di anidride carbonica 10,6 m3 di fumi prodotti 2 m3 di acqua vapore 7,6 m3 di azoto CH4 + 2 O2 + 7,6 N2 → CO2 + 2 H2O + 7,6 N2 1 m3 di metano 2 m3 di ossigeno 7,6 m3 di azoto 9,6 m3 di aria teorica di combustione Nel caso di combustibili solidi o liquidi, puri o in miscela,occorre tenere presente la composizione elementare Se, ad esempio, un olio combustibile presenta la seguente composizione in peso: 75% carbonio, 21% idrogeno e 4% zolfo, dalla combustione di 1kg di olio si avrà: 0,75 kg 0,21 kg 0,04 kg C + O2 2H + ½O2 S + O2 2,60 Nm3 di O2 necessario 12,53 Nm3 di aria teorica 1,40 Nm3 CO2 H 2O SO2 2,34 Nm3 acqua vapore 0,03 Nm3 Fumi Dalla massa di combustibile alla composizione dei fumi 0,75 kg C + O2 CO2 1,40 Nm3 Dalla massa di combustibile alla composizione dei fumi 0,21 kg 2H + ½O2 H 2O 2,35 Nm3 acqua vapore Dalla composizione dei fumi alla quantità di aria teorica Fumi C + O2 2H + ½O2 S + O2 1,40 Nm3 1,40 Nm3 CO2 2,35/2=1,17 Nm3 H 2O SO2 0,03 Nm3 2,35 Nm3 acqua vapore 0,03 Nm3 2,61 Nm3 O2 aria teorica = 2,61 + 2,61×3,80 = 12,53 Nm3 O2 N2 Esempio Calcolare l’aria teorica di combustione per 3,00 L di etanolo (C2H5OH, densità = 0,79 g cm-1). Esempio Calcolare volume e composizione dei fumi di combustione di 2,00 Nm3 di etano (C2H6) che bruciano in aria al 20% in eccesso. Combustioni Parametri importanti: ! 1.Potere calorifico 2.Aria necessaria per la combustione (aria teorica di combustione) 3.Volume e composizione dei fumi 4.Temperatura di fiamma (temperatura teorica di combustione) 5.Temperatura di ignizione e limiti di infiammabilità Temperatura teorica di combustione (temperatura (adiabatica) di fiamma) temperatura massima raggiungibile nel corso della combustione nell’ipotesi che tutto il calore sviluppato venga utilizzato dal sistema per il riscaldamento dei prodotti gassosi Temperatura teorica di combustione Limite teorico (superiore) parte interna della fiamma valutazione del combustibile sistema di non-equilibrio! (termodinamica?) Caso reale: calcolo complesso capacità termiche reazioni di dissociazione (endotermiche) dei prodotti soluzioni numeriche iterative Metodo di calcolo approssimato Q = nC T Temperatura di fiamma Calore di combustione Q= ni CP i (Taf T0 ) i numero di moli prodotti gassosi (fumi) Capacità termiche molari Temperatura ambiente Metodo di calcolo approssimato Temperatura di fiamma Calore di combustione Q= Volume dei componenti dei fumi Vi Ci (Taf T0 ) i capacità termiche volumiche Temperatura ambiente Metodo di calcolo Potere calorifico inferiore Taf = T0 + Esempio: 1 H2 (g) + O2 (g) 2 CP(H2O(g)) = 35,58 J K-1 moli-1 CP(N2(g)) = 29,12 J K-1 moli-1 ∆Hf (H2O(g)) = - 241,82 kJ Q i ni CP i H2 O(g) Dipendenza dal tipo di comburente Q aria teorica eccesso di aria ossigeno Qi T T T 1 2 3 T Temperature medie di fiamma combustibile comburente Pressione (atm) T(K) Acetilene Aria 1 2600 Acetilene Ossigeno 1 3410 Monossido di carbonio Aria 1 2400 Monossido di carbonio Ossigeno 1 3220 Eptano Aria 1 2290 Eptano Ossigeno 1 3100 Idrogeno Aria 1 2400 Idrogeno Ossigeno 1 3080 Metano Aria 1 2210 Metano Aria 20 2270 Metano Ossigeno 1 3030 Metano Ossigeno 20 3460 Alte Temperature Ad alta temperatura (a partire da circa 1700-1800°C) si hanno reazioni di decomposizione: 2 CO2 → 2 CO + O2 2 H2O → 2 H2 + O2 ∆H = 565,7 kJ ∆H = 483,7 kJ La dissociazione è tanto più spinta quanto più alta è la temperatura e più bassa la pressione Le reazioni di dissociazione sono endotermiche e, assorbendo una parte del calore disponibile, è come se, a partire da un certo punto, il potere calorifico diminuisse all’aumentare della temperatura: Q Curva di riscaldamento dei fumi in assenza di fenomeni dissociativi presenza di dissociazione Qi T’f Tf T La temperatura teorica di combustione risulta più bassa di quella calcolabile senza tenere conto dei fenomeni dissociativi Per raggiungere la più alta temperatura possibile, conviene a volte regolare il rapporto combustibile/comburente in modo da evitare una combustione completa, con formazione però di sostanze meno soggette alla decomposizione termica. Ad esempio, nella combustione acetilene – ossigeno: C2H2(g) + 5/2 O2(g) → 2 CO2(g) + H2O(g) C2H2(g) + O2(g) → 2 CO(g) + H2(g) ∆H = - 1255,2 kJ ∆H = - 447,7 kJ Si preferisce far avvenire l’ossidazione parziale, raggiungendo una più elevata temperatura, a causa della minor tendenza alla dissociazione da parte di CO e H2 L’elevata temperatura raggiungibile non è legata ad una tonalità termica particolarmente elevata, bensì alla bassa tendenza alla dissociazione dei prodotti ! Fra le tipiche reazioni di combustione, quella tra cianogeno e ossigeno permette di raggiungere una temperatura maggiore (~4500°C): ! C2N2(g) + O2(g) → 2 CO(g) + N2(g) ∆H = - 529,3 kJ Combustioni Parametri importanti: ! 1.Potere calorifico 2.Aria necessaria per la combustione (aria teorica di combustione) 3.Volume e composizione dei fumi 4.Temperatura di fiamma (temperatura teorica di combustione) 5.Temperatura di ignizione e limiti di infiammabilità Temperatura di ignizione Temperatura minima a cui si deve portare una miscela combustibile/comburente affinché abbia inizio la combustione Sostanza Temperatura ignizione (°C) in aria Idrogeno 572 Monossido di carbonio 610 Metano 632 Etano 472 Propano 493 Butano 408 Etilene 490 Acetilene 305 Benzene 580 Cetano 235 Benzina 280 - 420 Limiti di infiammabilità (inferiore e superiore) Definiscono il rapporto (min e max) combustibile/comburente affinchè la combustione si propaghi a tutta la massa della miscela P,T (STD) Sostanza % min di gas in volume % max di gas Idrogeno 4 75 Monossido di carbonio 13 74 Metano 5 15 Etano 3 12 Propano 2 9.5 n-Butano 2 8 Etilene 3 29 Acetilene 2.5 80 Benzene 1.5 7 Gas d’acqua 6 73 Gas naturale 5 15 Gas d’alto forno 35 75 in volume Limiti di infiammabilità (inferiore e superiore) Un aumento di temperatura provoca sempre un allargamento del campo di infiammabilità ! fino a 400°C, un incremento di 100°C comporta un abbassamento del limite inferiore di ~ 10% e un aumento del limite superiore di ~ 5%
Scaricare