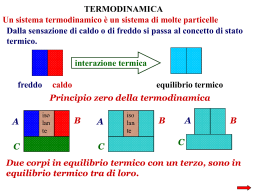
Seconda Scuola Estiva AIF per studenti della Scuola Superiore Fondamenti di Termodinamica Vincenzo Orofino Dipartimento di Fisica, Università del Salento Richiamo concetti basilari di dinamica Pressione esercitata da una forza: F p A Energia meccanica (totale): E Ek E p 1 mv2 m g h 2 Teorema lavoro-energia: E L fd Sistemi termodinamici Importante risultato sperimentale: ogni volta che si dissipa energia meccanica, hanno luogo fenomeni di riscaldamento. Ad esempio nel caso del pendolo si riscalda il punto di sospensione; nell’auto che si ferma si riscaldano i freni, ecc. La termodinamica è quella parte della fisica che descrive i processi di riscaldamento o raffreddamento (fenomeni termici) e l loro correlazione con i processi dinamici. Il sistema è il corpo o l’insieme dei corpi sotto esame. L’ambiente esterno è l’insieme di tutti i corpi che possono interagire con il sistema. Parametri di stato Un sistema macroscopico viene descritto ricorrendo a grandezze macroscopiche d’insieme che descrivono caratteristiche del sistema nel suo complesso. Tali grandezze sono dette parametri di stato (o variabili termodinamiche). Parametri di stato sono il volume, la pressione, la massa volumica, la temperatura ecc. Lo stato di un sistema termodinamico è definito quando i valori dei parametri di stato sono univocamente determinati. Agitazione termica Un qualunque fluido è costituito da un gran numero di particelle (sia singoli atomi che molecole) in un continuo moto disordinato definito agitazione termica. Questo fenomeno sta alla base dei cosiddetti moti browniani. Moto browniano di una microparticella di resina di raggio intorno a 3 micron. I punti, congiunti con segmenti, rappresentano le successive posizioni della particella osservata al microscopio ad intervalli di 30 s da un punto iniziale A ad uno finale B. Temperatura La temperatura è una grandezza correlata all’energia cinetica media della particelle di un sistema. In particolare, per un gas a bassa pressione (gas ideale): Ek , med 3 kT 2 dove k è una costante e T è la temperatura del sistema misurata in un’opportuna unità di misura chiamata kelvin (vedi in seguito). Equilibrio termico (1) Si considerino due sistemi A e B, come in figura, inizialmente posti a temperature TA e TB, rispettivamente (con TA < TB). Equilibrio termico (2) Finché i sistemi sono separati da una parete adiabatica (caso a) le loro temperature non cambiano. Se la parete adiabatica viene rimossa o sostituita con una parete diatermica (caso b), dopo un adeguato tempo i due si portano entrambi ad una stessa temperatura T (TA < T < TB). Una volta raggiunta questa situazione si dice che i due sistemi sono in equilibrio termico. Principio zero – Calore (1) Principio zero della termodinamica: Due sistemi interagenti fra loro, ma isolati dall’ambiente esterno, si portano all’equilibrio alla stessa temperatura. Se due corpi a diversa temperatura vengono messi a contatto, il corpo più caldo cede calore al più freddo. Il calore è l’energia scambiata da due corpi (o tra due parti dello stesso corpo) a causa della loro diversa temperatura. Principio zero - Calore (2) Quando due sistemi sono in equilibrio termico, tra di essi non si verifica nessuno scambio netto di energia sotto forma di calore. Il calore può trasformarsi in energia meccanica, così come l’energia meccanica può trasformarsi in calore. La termodinamica studia i fenomeni nei quali si verificano trasformazioni di calore in altre forme di energia, oppure le trasformazioni inverse. Termometri: scala centigrada (1) Il metodo di taratura si attua assegnando per convenzione i valori: T = 100 °C alla temperatura dell’acqua pura al punto di ebollizione in atmosfera standard; T = 0 °C alla temperatura dell’acqua pura al punto di congelamento in atmosfera standard. In linea di principio il termometro misura una qualunque grandezza X che dipende dalla temperatura (l’altezza di una colonna di liquido, la resistenza elettrica di un conduttore, la pressione di un gas, ecc.). Termometri: scala centigrada (2) Il procedimento di misura si attua in due stadi: 1) Si pone il termometro in equilibrio termico con acqua pura prima al punto di ebollizione e poi al punto di congelamento, misurando i due valori X100 e X0, rispettivamente. 2) Si pone il termometro in equilibrio termico con il corpo di cui si vuole determinare la temperatura, misurando per la grandezza termometrica il valore X. Assumendo una dipendenza lineare dell grandezza termometrica dalla temperatura, si ha: T (100 X X0 ) C X 100 X 0 Termometri: scala Kelvin (1) La scala Kelvin si basa sull’osservazione che esiste un limite inferiore alla temperatura che un qualunque corpo può assumere. Tale limite viene assunto come lo zero di questa scala termometrica (T = 0 K, zero assoluto). Per convenzione si assegna alla temperatura dell’acqua pura al punto triplo in atmosfera standard l’esatto valore T = 273.16 K. N.B.: Si definisce punto triplo, quella particolare configurazione fisica dell’acqua pura in cui le sue tre fasi di aggregazione (solida, liquida e aeriforme) coesistono in equilibrio. Termometri: scala Kelvin (2) Il procedimento di misura si attua in due stadi: 1) Si pone il termometro in equilibrio termico con acqua pura al punto triplo, misurando il valore Xtr. 2) Si pone il termometro in equilibrio termico con il corpo di cui si vuole determinare la temperatura, misurando per la grandezza termometrica il valore X. Assumendo una proporzionalità diretta tra la grandezza termometrica e la temperatura (X = 0 per T = 0 K), si ha: X T (273.16 )K X tr Termometri: scala Kelvin (3) La relazione tra il valore della temperatura in gradi centigradi (TC) e quella assoluta in kelvin (T ) è: TC = T – 273.15 La temperatura del ghiaccio fondente (ossia la temperatura del punto di congelamento dell’acqua) è pari a 273.15 K. La temperatura dello zero assoluto è TC = – 273.15 °C. E’ importante notare che: T C = 1 °C T = 1 K Equazione di stato di un gas ideale (1) Si definisce gas perfetto o ideale un gas le cui proprietà rappresentano il comportamento limite dei gas reali quando la loro massa volumica (densità) tende a zero. Per i gas perfetti esiste la seguente relazione empirica tra pressione p, volume occupato V, numero di molecole N e temperatura assoluta T (equazione di stato del gas perfetto): pV N k T dove k = 1.38 1023 J/K è la cosiddetta costante di Boltzmann. Equazione di stato di un gas ideale (2) Due variabili termodinamiche (in genere p e V) sono sufficienti per descrivere lo stato di un gas ideale. Lo stato di un gas ideale è rappresentato da un punto in un diagramma cartesiano V-p (detto piano di Clayperon). Trasformazioni termodinamiche (1) Un sistema compie una trasformazione termodinamica se, agendo dall’esterno, si varia almeno una delle sue variabili termodinamiche. Durante una trasformazione il sistema non può essere isolato: esso scambia energia con l’ambiente. Rappresentazione grafica nel piano di Clayperon di trasformazioni termodinamiche tra due stati A e B. Trasformazioni termodinamiche (2) Una trasformazione durante la quale: il sistema non scambia calore con l’ambiente, è detta trasformazione adiabatica; resta costante il volume del sistema, viene chiamata trasformazione isovolumica (o isocora); resta costante la pressione del sistema, viene detta trasformazione isobara; resta costante la temperatura del sistema, è chiamata trasformazione isoterma. Lavoro (1) Un modo per trasferire energia dall’ambiente al sistema (o viceversa) è quello di compiere lavoro sul sistema (o far compiere lavoro al sistema). Si consideri un gas contenuto all’interno di cilindro isolato termicamente chiuso da un pistone mobile (v. figura). Lavoro (2) La forza F’, che il gas esercita sul pistone (risultante dagli urti tra molecole del gas e pistone), produce uno spostamento dx del pistone stesso. Lo scambio di energia tra sistema ed ambiente esterno si può esprimere come il lavoro compiuto da tale forza: dL F dx p A dx p dV (lavoro infinitesimo compiuto sull’ambiente dal gas a pressione p), Lavoro (3) oppure come il lavoro compiuto dalla forza che il pistone esercita sulle molecole del gas: dL F dx p A dx p dV (lavoro infinitesimo compiuto dall’ambiente sul gas). Per una variazione finita di volume da Vi a Vf, il lavoro compiuto dal gas è: Vf L p dV Vi Lavoro (4) Il lavoro compiuto dall’ambiente sul sistema è invece: Vf L p dV L Vi Il modulo del lavoro eseguito sul gas è uguale all’area sottesa dalla curva che rappresenta la funzione p = p(V). Il segno di L è determinato dalla disuguaglianza tra Vi = V1 e Vf = V2. Lavoro (5) Importanti casi particolari Lavoro svolto a volume costante Per qualsiasi trasformazione in cui il volume rimanga costante (isocora) il lavoro è nullo. L 0 (V costante) Lavoro svolto a pressione costante In una trasformazione di questo tipo (isobara) si ha: Vf Vf L p dV p dV p (V f Vi ) Vi Vi ( p costante) Calore (1) Secondo la teoria fluidistica il calore era concepito come una sostanza imponderabile (fluido calorico o semplicemente calorico) permeante tutti i corpi. Mettendo a contatto due corpi a diversa temperatura si pensava che tale fluido passasse dal corpo a temperatura maggiore a quello a temperatura minore fino a quando i due corpi avessero raggiunto la stessa temperatura. Secondo questa teoria un corpo risultava più caldo di un altro poiché possedeva una maggiore quantità di fluido calorico. Tale errata concezione del calore fu abbandonata quando si intuì che il calore non è altro che una forma di energia. Calore (2) Si riconsideri il sistema in figura già discusso in precedenza. In tal caso la variazione di energia interna del sistema è: Vf Eint L p dV Vi Calore (3) Tale equazione esprime una media macroscopica che considera tutti i singoli scambi di energia tra le molecole del gas e quelle dell’ambiente (pistone). Tali scambi energetici avvengono in genere non solo quando le pareti del contenitore sono mobili ma anche quando sono fisse. Consideriamo un gas all’interno di un contenitore rigido dalle pareti diatermiche. Se si riscaldano le pareti del contenitore, si può osservare un aumento di temperatura del gas e quindi di energia interna. Calore (4) In questo caso l’equazione precedente, che rappresenta il principio di conservazione dell’energia meccanica, è inadatta a descrivere gli scambi energetici tra sistema e ambiente poiché non ci sono parti in movimento e quindi non c’è variazione di volume. Calore (5) Si introduce quindi un nuovo concetto statistico chiamato calore che rappresenta il valor medio dell’energia scambiata tra sistema e ambiente, sempre a causa delle collisioni tra le molecole dell’uno e dell’altro, energia che non può essere macroscopicamente espressa come un lavoro meccanico. Il calore è la somma di un grandissimo numero di lavori infinitesimi individuali, tali da non poter essere espressi complessivamente, a livello macroscopico, come il prodotto di una forza per uno spostamento medio. In tal caso (trasformazione isocora) la variazione di energia interna del sistema vale: Q = 0 Trasformazione adiabatica Calore ed equilibrio termico Quando tra ambiente e sistema (o tra due sistemi) non si verifica alcuno scambio netto di energia sotto forma di calore, si dice che essi sono in equilibrio termico. Il calore è una forma di energia in transito che passa da un sistema all’ambiente esterno o viceversa quando tra sistema ed ambiente vi è una differenza di temperatura. Calore e lavoro Analogie tra calore e lavoro •Il calore, come il lavoro, non è una proprietà intrinseca di un sistema. •La quantità di calore che il sistema assorbe o cede in una trasformazione dipende dal tipo di trasformazione. 1) L Q : è sempre possibile la trasformazione integrale 2) Q L : non è possibile la trasformazione integrale (altrimenti sarebbe possibile il cosiddetto moto perpetuo di seconda specie) Calore e temperatura Differenze tra calore e temperatura I concetti di calore e temperatura sono distinti. a) Si può aumentare la temperatura di un corpo senza cedergli calore (durante una compressione adiabatica). b) Si può cedere calore ad un corpo senza far variare la sua temperatura (durante un processo di fusione o di evaporazione). Calore: unità di misura Caloria (Piccola caloria) = 1 cal la quantità di calore necessaria per innalzare da 14.5 a 15.5 °C la temperatura di 1 g di acqua. Grande caloria = 1 Cal =1000 cal = 1 Kcal 1 cal = 4.186 J 1 Kcal = 4186 J Calore specifico (1) Si definisce calore specifico (o capacità termica specifica) del materiale che costituisce un corpo di massa m, il rapporto: C Q c m m T A temperature ordinarie e per ordinari intervalli di temperatura, c è praticamente costante. La quantità di calore Q necessaria per aumentare la temperatura di un corpo di massa m da un valore iniziale Ti ad uno finale Tf vale quindi: Q m c (T f Ti ) Calore specifico (2) Sostanza c [J/(kg K)] Piombo 129 Tungsteno 135 Argento 236 Rame Sostanza c [J/(kg K)] Mercurio 139 Etanolo 2430 Acqua 4190 387 Alluminio 900 Carbonio 502 Sorgenti di calore e termostati Si definisce sorgente termica qualsiasi corpo che sia in grado di fornire calore ad uno o a più altri corpi. Il calore si ottiene sempre come il risultato della trasformazione di altre forme di energia. Viene chiamato invece termostato un particolare corpo in grado di fornire o assorbire calore senza che ciò modifichi apprezzabilmente la sua temperatura. Un termostato è un qualunque corpo massivo costituito da una sostanza con un elevato calore specifico. Primo principio della termodinamica (1) In una trasformazione adiabatica: Eint L In una trasformazione isocora: Eint Q In una trasformazione generica: Eint L Q (Primo principio della termodinamica) Primo principio della termodinamica (2) Il primo principio della termodinamica rappresenta l’applicazione del principio di conservazione dell’energia a sistemi aventi un gran numero di particelle. Pressione (1) Pressione ordinaria Data una forza di modulo F agente su una superficie di area A come in figura, si definisce pressione esercitata dalla forza il rapporto: F cos FN p A A con FN componente della forza normale alla superficie. Pressione (2) Pressione interna di un fluido Si chiama pressione interna di un fluido in un punto P la pressione esercitata dal fluido su una superficie di area A centrata intorno a P (dovuta agli urti delle molecole del fluido contro la superficie stessa). La pressione interna di un fluido è indipendente dalla giacitura di A e dalla forma del contenitore.
Scaricare