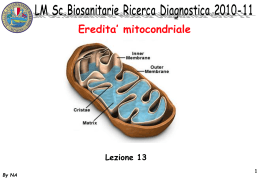
Prevenire l'invecchiamento Invecchiamento e mitocondri Veri e propri generatori in miniatura, i mitocondri impiegano l’ossigeno respirato per produrre l’energia necessaria al funzionamento della cellula. La produzione di energia è accoppiata però alla produzione di radicali liberi derivati dall’ossigeno, un processo che avviene direttamente nel cuore del mitocondrio. Questa perdita irrimediabile di prodotti tossici comporta il deterioramento dei componenti del mitocondrio, in particolare del suo DNA. La disorganizzazione del genoma mitocondriale sotto gli attacchi permanenti dei radicali liberi si riflette sulle sue capacità bioenergetiche del mitocondrio, infatti il disfunzionamento mitocondriale appare come causa maggiore di deterioramento e di morte cellulare. Il processo è direttamente coinvolto nella senescenza e in molte patologie degenerative associate all’invecchiamento. Mitocondri ed energetica cellulare E’ ormai dagli anni ’50 che si sa che i mitocondri sono le centrali energetiche della cellula, una vera e propria fucina nella quale i carburanti dell’organismo vengono bruciati e convertiti in energia. I mitocondri impiegano infatti l’ossigeno respirato e i “combustibili” provenienti dagli zuccheri, dai grassi e dalle proteine per produrre, sotto forma di ATP (adenosina trifosfato), l’energia necessaria al corretto funzionamento cellulare. I diversi complessi enzimatici responsabili di questa produzione formano, all’interno del mitocondrio, la cosiddetta catena respiratoria mitocondriale. Una caratteristica assolutamente speciale dei mitocondri è che essi possiedono un proprio sistema genetico, cioè le loro personali molecole di DNA. Questo sistema genetico “privato”, indipendente dal quello contenuto nel nucleo della cellula, fornisce l’informazione necessaria alla fabbricazione di sottounità importanti della catena respiratoria mitocondriale. Gli altri costituenti del mitocondrio e della sua catena respiratoria sono invece sintetizzati dalla cellula secondo le specifiche previste dal genoma cellulare. Il mitocondrio vive quindi in totale simbiosi con la cellula, secondo un accordo di reciprocità rispettato da entrambi gli elementi. Questa parziale dipendenza del mitocondrio dalla cellula ospite e l’esistenza di un sistema genetico “in proprio” trova origine nell’evoluzione; è infatti generalmente ammesso che i mitocondri provengano dai batteri incorporati nelle cellule primitive circa 1.5 miliardi di anni fa. A quei tempi, l’arricchimento progressivo dell’atmosfera in ossigeno ha probabilmente favorito la cooperazione tra un batterio capace di impiegare questo elemento (il futuro mitocondrio), e un microrganismo abituato a un’esistenza anaerobica (la cellula primitiva). Da allora, i batteri consumatori di ossigeno hanno perso una parte del loro genoma e sono diventati dipendenti dalla loro cellula ospite per la sintesi della maggior parte dei loro composti. In cambio, la cellula ospite ricorre ai loro servizi poiché solo questi organi sono in grado di produrre energia in una forma che essa può utilizzare direttamente. Tuttavia, questo scambio presenta dei limiti: il sistema energetico di cui è dotata la cellula primitiva è infatti imperfetto, e anche se le ha permesso di adattarsi e sopravvivere in un ambiente gassoso nuovo, i prodotti tossici che genera contribuiscono alla sua distruzione. Si è visto che la produzione di energia a partire dall’ossigeno attraverso la catena respiratoria terminava con l’emissione di prodotti tossici, i radicali liberi derivanti dall’ossigeno. Queste forme attive dell’ossigeno sono prodotti secondari obbligatori della respirazione mitocondriale, che reagiscono fortemente con il DNA, i lipidi delle membrane e gli enzimi contenuti nei mitocondri. Basta sapere che viene liberato nel mitocondrio sotto forma attivata il 5% dell’ossigeno consumato dalla catena respiratoria per capire immediatamente il pericolo rappresentato da questi prodotti deleteri. Una delle conseguenze di questa perdita di radicali liberi ossigenati è rappresentata dal deterioramento del DNA mitocondriale, più vulnerabile perché posto in immediata prossimità dei sistemi di trasferimento di energia, e quindi costantemente esposto alle forme attivate dell’ossigeno che sfuggono alla catena respiratoria. D’altra parte, come il DNA cellulare, anche questo DNA possiede proteine protettive chiamate istoni che possono sottrarlo all’azione nefasta dei radicali liberi. Infine, diversamente dal DNA nucleare, quello mitocondriale è privo di un efficace sistema di riparazione. Gli attacchi ossidativi si traducono in genere con mutazioni e rotture dei mattoni del DNA. Non riparate, queste rotture comportano a loro volta la perdita (delezione) di frammenti importanti del DNA mitocondriale. Le mutazioni sono favorite dal fatto che la totalità del genoma mitocondriale viene impiegata in modo permanente per garantire il funzionamento bioenergetico del mitocondrio; in confronto, solo il 7% del genoma nucleare viene impiegato, quale che sia il grado di stimolazione di una cellula, anche molto specializzata. La congiunzione dell’insieme di questi fattori contribuisce, in normali condizioni di funzionamento cellulare, a un rischio di mutazione del DNA mitocondriale 12 volte più elevato rispetto al genoma cellulare. Inoltre, il rischio di mutazione/delezione del DNA mitocondriale è più importante proprio perché la cellula è una grande consumatrice di energia, come nel caso delle cellule del sistema nervoso, del cuore, dei muscoli, dei reni, del fegato e dei sistemi endocrini. Le conseguenze di queste mutazioni sono particolarmente gravi per le cellule che non hanno la capacità di dividersi, come quelle nervose e muscolari. Queste cellule non possono infatti rinnovare rapidamente le loro componenti e accumulano perciò mitocondri difettosi. Energetica cellulare mitocondriale e invecchiamento Le mutazioni e le delezioni del genoma mitocondriale si riflettono sulla sintesi e l’attività dei componenti della catena respiratoria, codificati dalle molecole di DNA. Le capacità bioenergetiche dei mitocondri diminuiscono fino a un livello-limite al di sotto del quale il normale funzionamento delle cellule e la loro sopravvivenza non possono più essere garantiti. Verso la fine degli anni ’80, molti studi hanno consentito di stabilire una relazione tra alcune patologie che coinvolgono il sistema nervoso e i muscoli e le anomalie mitocondriali. Si è dimostrato che la maggior parte delle anomalie della struttura e della funzione dei mitocondri trova origine nelle mutazioni delle molecole di DNA; queste osservazioni sono alla base dell’ipotesi secondo la quale le mutazioni e le delezioni del DNA mitocondriale, che avvengono per tutta la vita dell’individuo all’interno di ogni cellula, sono responsabili della perdita di capacità bioenergetica dei tessuti e degli organi associati al processo di senescenza. In effetti, gli studi mostrano che la quantità di energia prodotta dai mitocondri sotto forma di ATP declina in maniera significativa con il progredire dell’età, soprattutto nelle cellule non rinnovabili come i neuroni. Quando si analizzano le attività biochimiche associate ai diversi complessi enzimatici della catena respiratoria codificati dal DNA mitocondriale, si evidenziano dei deficit sempre più importanti con l’avanzare dell’età. Il numero di cellule muscolari nelle quali si rilevano malfunzionamenti è moltiplicato per 10 tra i 40 e i 90 anni, per contro l’attività di altri enzimi presenti nel mitocondrio ma sintetizzati a partire dal DNA nucleare resta generalmente intatta anche con l’aumentare dell’età. I diversi complessi enzimatici che costituiscono la catena respiratoria sono formati dall’associazione, in proporzione variabile, di proteine codificate sia dal DNA mitocondriale, sia dal DNA nucleare. Si è potuto dimostrare che l’intensità del deficit enzimatico di un particolare complesso, durante l’invecchiamento, varia in funzione del suo contenuto in sottounità codificate dal DNA mitocondriale. Il declino delle attività della catena respiratoria con il progredire dell’età sembra essere dovuto essenzialmente all’accumulo di delezioni nel DNA mitocondriale. La frequenza di queste delezioni aumenta in modo esponenziale a partire dai 50 anni per raggiungere livelli considerevoli nelle persone molto anziane e si riscontra soprattutto nel cervello, il cuore, i muscoli e i reni. Queste delezioni sono ovviamente legate allo stress ossidativo. La ricerca ha inoltre evidenziato, nel processo di invecchiamento, una relazione molto stretta tra l’intensità delle lesioni ossidative del DNA mitocondriale e la frequenza delle perdite di frammenti del genoma mitocondriale. I nuovi mezzi tecnologici di cui disponiamo oggi per indagare i molti frammenti mancanti dal genoma mitocondriale mostrano che la perdita di DNA con l’età può arrivare fino all’85% del DNA mitocondriale totale. I calcoli condotti sull’aumento di frequenza di queste delezioni in funzione dell’età suggeriscono che la totalità del DNA mitocondriale sarebbe frazionata all’età di 126 anni, imponendo perciò questo limite alla longevità umana. Disfunzionamento mitocondriale e malattie degenerative Le delezioni del DNA mitocondriale non intervengono solo nel processo generale di senescenza, ma anche in alcune patologie degenerative che a esso sono associate. La malattia di Parkinson è una tra le molte. Questa patologia, dovuta alla degenerazione di alcune cellule nervose, i neuroni dopaminergici in una precisa zona del cervello, è caratterizzata anche da una riduzione importante dell’attività della catena respiratoria mitocondriale nei neuroni prelevati da questa area cerebrale nei soggetti affetti. La frequenza delle delezioni del DNA mitocondiale è 10 volte più importante nei neuroni dopaminergici provenienti dai pazienti parkinsoniani che nelle cellule identiche prelevate in soggetti della stessa età ma indenni alle malattie neurologiche. La neurotossina MPTP, che blocca il funzionamento della catena respiratoria e induce la formazione dei radicali liberi, provoca specificamente la degenerazione dei neuroni dopaminergici: i soggetti accidentalmente esposti a questa tossina presentano infatti un quadro clinico comparabile a quello della malattia di Parkinson. Le anomalie del funzionamento mitocondriale sembrano anche coinvolte nella comparsa e nello sviluppo della malattia di Alzheimer, nella quale sono state osservate importanti diminuzioni dell’attività di alcuni complessi enzimatici della catena respiratoria nella regione cerebrale classicamente aggredita da questa malattia. In queste zone, la degenerazione delle vie di comunicazione tra i neuroni è in parte dovuta al deficit energetico dei mitocondri presenti a livello dei sistemi di connessione intracellulare; le anomalie strutturali dei mitocondri e le mutazioni delle loro molecole di DNA sono state osservate con grande frequenza a livello della corteccia cerebrale in pazienti con malattia di Alzheimer. Le delezioni del DNA mitocondriale e il deficit nella produzione energetica che esse comportano compromettono anche il funzionamento delle cellule del cuore. Nei soggetti giovani o di mezza età, si sono osservati casi di cardiomiopatia spesso mortali legati a specifiche delezioni del genoma mitocondriale; queste mutazioni possono riguardare fino al 50% del DNA mitocondriale totale del muscolo cardiaco. Queste patologie sono in genere familiari, ma anche nei soggetti più anziani indenni alle cardiopatie si sono osservate delezioni del DNA mitocondriale nelle cellule miocardiche. Nella maggior parte dei casi si tratta di delezioni multiple, non specifiche e di grandi dimensioni, 1.000 volte più frequenti che nei soggetti giovani e normali. La loro frequenza aumenta in presenza di un insulto cardiaco, ed è probabile che un certo numero di cardiopatie negli anziani, per le quali non si trova eziologia precisa, sia legato a un’alterazione della funzione mitocondriale. Simili delezioni del genoma mitocondriale si osservano anche, con minore frequenza, a livello dei muscoli scheletrici. Si ritiene che la perdita progressiva di massa ossea e di forza muscolare (sarcopenia) durante l’invecchiamento sia in parte conseguenza di una diminuzione delle capacità bioenergiche mitocondriali. La disorganizzazione progressiva del genoma mitocondriale sotto gli attacchi permanenti dei radicali liberi generati a livello della catena respiratoria appare quindi come una delle maggiori cause di deterioramento cellulare e organico. Il declino della funzione mitocondriale, secondario alle alterazioni molecolari dovute alle forme attivate dell’ossigeno, è uno dei principali mediatori della senescenza e delle malattie degenerative che le sono associate. “'Terreno Oncologico' positivo è indice di alterazione genetica del DNA mitocondriale materno. Ciò vuol dire che nei soggetti con 'Terreno Oncologico' positivo, a monte c’è una ben definita citopatia mitocondriale, stato di sofferenza respiratoria della cellula, da me chiamata ICAEM (Istangiopatia Congenita Acidosica Enzimo- Metabolica), derivante a sua volta da un’alterazione genetica del DNA mitocondriale quasi sempre di parte materna. C’è da comprendere il fatto che l’ICAEM rivela lo stato di sofferenza della cellula, con particolar riguardo al DNA mitocondriale, e di conseguenza dei mitocondri, responsabili dell’ossigenazione cellulare. In caso di alterazione del DNA mitocondriale, è chiaro che l’ossigenazione mitocondriale diviene carente. Bisogna migliorare la respirazione mitocondriale ed il funzionamento della catena respiratoria, cioè dei processi ossido-riduttivi, riducendo conseguentemente il 'Reale Rischio Congenito' di cancro, in caso ci fosse. “ Possibilità terapeutiche Il genoma mitocondriale si rinnova in modo autonomo, indipendentemente da qualsiasi divisione cellulare. Rinforzando i mezzi di difesa antiossidanti dell’organismo, ma anche quelli associati alle membrane biologiche e quelli in soluzione nei liquidi intracellulari, è teoricamente possibile limitare le lesioni ossidative e le delezioni del DNA mitocondriale. Questa azione preventiva dovrebbe consentire di ricostituire uno stock di mitocondri perfettamente funzionanti e dal genoma non alterato. Si ignora se gli antiossidanti correntemente utilizzati abbiano la capacità di diminuire la frequenza delle delezioni del DNA mitocondriale osservate durante l’invecchiamento. Un’altra strategia terapeutica consiste nell’apporto di cofattori necessari al funzionamento della catena respiratoria come l’ubiquinone, più noto come coenzima Q10. Durante i processi di produzione energetica, il coenzima Q10 favorisce il trasporto degli elettroni tra i primi tre complessi enzimatici della catena respiratoria, e nella sua forma ridotta esso figura come un potente antiossidante, capace di prevenire l’ossidazione dei lipidi delle membrane e delle lipoproteine LDL che si accumulano sulle pareti vascolari formando le placche di ateroma. La concentrazione di coenzima Q10 diminuisce con l‘età in molti tessuti, e molti studi suggeriscono che esso è più efficace della vitamina E nella prevenzione dell’ossidazione delle lipoproteine LDL. Il coenzima Q10 è stato impiegato per trattare alcune patologie cardiache o neurologiche secondarie a un’alterazione mitocondriale, e ottimi risultati sono stati ottenuti in un numero ancora limitato di casi. Il coenzima Q10 viene proposto nel quadro della lotta alla senescenza e particolarmente nella prevenzione delle patologie cardiache e neurodegenerative associate all’invecchiamento. Un altro agente terapeutico, l’acetil-l-carnitina, sembra invece in grado di riparare alcune carenze dell’attività mitocondriale che si osservano durante l’invecchiamento. In particolare, l’acetil-l-carnitina aumenta la produzione di energia sotto forma di ATP e migliora le capacità di trascrizione del DNA mitocondriale, favorendo in tal modo il rinnovamento dei componenti della catena respiratoria. Gli effetti favorevoli dell’acetil-l-carnitina su molti parametri fisiologici associati alla funzione mitocondriale sembrano in effetti legati alla sua capacità di alimentare la macchina mitocondriale; la carnitina facilita il trasporto degli acidi grassi all’interno del mitocondrio per far sì che vengano trasformati in carburante utilizzabile da parte della catena respiratoria mitocondriale. Ristabilire un corretto apporto di acidi grassi restaura quindi le capacità bioenergetiche dei mitocondri e consente di mantenere un’attività ottimale delle cellule. È stata studiata la relazione tra il consumo di O2 e la generazione di specie reattive all’ossigeno (ROS). Chiaramente, dosi elevate e/o l’inadeguata rimozione di ROS, specialmente dell’anione superossido, hanno indotto lo “stress ossidativo” imputato nella patogenesi di molte malattie cardiovascolari, inclusa l’ipercolesterolemia, l’arteriosclerosi, l’ipertensione, il diabete e l’infarto (28). Uno dei principali sistemi di difesa antiossidanti contro l’O2 è la superossido dismutasi (SOD). SOD2 è un manganese mitocondriale (Mn) contenente un enzima (Mn-SOD) ed è localizzato nella matrice mitocondriale; abbiamo pertanto selezionato questa isoforma per chiarire l’implicazione dei mitocondri. Il ruolo essenziale di SOD2 nel preservare la funzione dei mitocondri è stata di recente dimostrata da ratti Mn-SOD-deficienti con infarto, affetti da funzione endoteliale marcatamente compromessa (29). In questa sede abbiamo mostrato che l’espressione di ROS, indotta dall’esposizione ad ipossia, è significativamente regredita con CF attraverso un aumento importante di Mn-SOD, la cui espressione nel tempo è fluttuante (Fig.5), come è stato ben dimostrato anche di recente (30). Questo risultato indica che CF sostiene la resistenza delle EC contro la tossicità delle ROS, preservando così la loro vitalità e l'attività funzionale anche in condizioni di stress ossidativo provocato da ipossia. La risposta ipossica delle EC è strettamente regolata dal regolatore centrale di ipossia HIF-1alpha, la cui attivazione induce la trascrizione di potenti citochine pro-angiogeniche e funzioni a valle neo-acquisite (3). In questo studio mostriamo che CF inibisce il trasloco di HIF-1alfa nel nucleo e l’espressione sovraregolata di Glut-1, suggerendo che CF interferisce con il percorso ipossico e può essere considerato un nuovo regolatore della risposta ipossica endoteliale. Sosteniamo che l’inibizione di HIF-1alfa sia mediata dall’attivazione di Mn-SOD, visto che la loro espressione sulle stesse HUVEC è inversamente correlata. Inoltre, il collegamento tra la generazione eccessiva di ROS, la perdita di Mn-SOD e l’attivazione di HIF-1alfa è stata di recente ben documentata nelle EC polmonari ipertensive (31). Proponiamo che CF sia in grado di preservare l'attività dei mitocondri e una respirazione ottimale attraverso un meccanismo doppio, la generazione di Mn-SOD e l’inibizione di HIF1alfa, prevenendo così le disfunzioni endoteliali. CF può essere candidato nel supporto del trattamento di malattie caratterizzate da complicazioni cardiovascolari. Altre sostanze L’HGH, Human Growth Hormone o ormone della crescita, contribuirebbe a mantenere efficiente il sistema immunitario e a costruire una sana potenza muscolare. I livelli di questo ormone decrescono progressivamente nel tempo. Uno studio provocatorio condotto nello stato del Dakota mostra una sopravvivenza decisamente maggiore, rispetto al gruppo di controllo, di ratti trattati con iniezioni di HGH; DHEA, deidroepiandrosterone, è un ormone prodotto dalla ghiandola adrenale ed è il precursore degli ormoni steroidei come il testosterone e gli estrogeni. Il DHEA cala precipitosamente con l’avanzare dell’età, sia negli uomini, sia nelle donne. Alcuni studi hanno dimostrato che l’assunzione di DHEA può migliorare la funzione neurologica e immunitaria, e che esso può svolgere una funzione protettiva rispetto ad alcuni tipi di cancro e alle malattie cardiovascolari; Il testosterone. E’ l’ormone che regola la libido in entrambi i sessi, la sua produzione cala con l’avanzare dell’età. Il testosterone svolge tra l’altro un ruolo importantissimo nella costruzione e nel mantenimento della massa muscolare; La melatonina è l’ormone prodotto dalla ghiandola pineale ed è un antiossidante molto potente rilasciato ogni notte nell’organismo per indurre il sonno e il recupero delle forze. La melatonina potrebbe possedere proprietà anticancro; L’acido alfalipoico è considerato da alcuni studi un potente antiossidante che contrasta le attività dei radicali liberi nei mitocondri. L’acido alfalipoico sarebbe inoltre in grado di riciclare altri antiossidanti come la vitamina E, riportandola nella sua forma originale dopo la detossificazione dai radicali liberi. Alcuni studi sembrano indicare che l’acido alfalipoico può ridurre il danno da glicazione conseguente alla concentrazione eccessiva di zuccheri nel sangue, spesso caratteristica dell’età, e che può migliorare alcune manifestazioni del diabete, da alcuni descritto come una forma accelerata di invecchiamento; La cisteina è un aminoacido solforato non essenziale impiegato per la sintesi delle proteine. La procisteina è una forma modificata di cisteina che alcuni studi considerano più sicura e potente della cisteina. Cistina e procisteina svolgerebbero un ruolo non trascurabile nella sintesi del glutatione, un potente antiossidante presente in ogni cellula dell’organismo e responsabile della disposizione delle proteine nella corretta struttura. La concentrazione di questi elementi diminuisce con il progredire dell’età; Il nicotamide adenina dinucleotide (NADH) è un coenzima che assiste gli enzimi responsabili della produzione mitocondriale di energia. Il NADH svolge un ruolo importante nella generazione di ATP (Adenosina Trifosfato), il “carburante” del corpo, e secondo alcuni studi sarebbe efficace nel trattamento delle malattie di Parkinson e di Alzheimer. Il NADH è indispensabile per la rigenerazione del glutatione dopo ossidazione; Insieme al betacarotene, il licopene è membro di una famiglia di pigmenti vegetali noti come carotenoidi. Tra i più di 600 carotenoidi, il licopene e il carotene sono i più importanti. Sono questi i pigmenti che conferiscono alle foglie, ai pomodori e ad altri vegetali i loro caratteristici colori vivaci. Il licopene è il miglior candidato antiage della sua classe di componenti perché è il più efficace nel contrastare un radicale libero particolarmente pericoloso, l’ossigeno “singlet”. Inoltre, il licopene viene rigenerato e può detossinare le molecole pericolose senza venire distrutto. I suoi livelli diminuiscono con l’età anche se si mangiano regolarmente i frutti e le verdure che lo contengono; Same gocce sublinguali Multivitamine spray Silicio colloidale gocce La vitamina E è il composto liposolubile che protegge le membrane cellulari dal danno ossidativo. E’ in grado di rompere la catena autoperpetuante di reazioni ossidative negli acidi grassi insaturi presenti nelle membrane ma contribuisce anche a mantenere efficiente l’attività antiossidante del selenio e agisce congiuntamente a questo minerale per potenziare la funzione immunitaria; La vitamina B5 (acido pantoteico) è un costituente del coenzima A, coinvolto in molte reazioni chimiche indispensabili per la vita, compresa la detossificazione da alcune sostanze pericolose; La vitamina B6 (piridoxina) svolge un ruolo fondamentale in molti processi vitali, è indispensabile per il metabolismo degli aminoacidi come la tiroxina e la fenilalanina, ed è un cofattore essenziale, insieme alla vitamina B6 e all’acido folico, per le difese dell’organismo dai livelli elevati di omocisteina, un aminoacido solforato associato all’arteriosclerosi, alle malattie cardiache e all’infarto; Gli antiossidanti sintetici. Comprendono il BHT (idrossitoluene butilato), l’etossichina, 2-mercapto-etilamina, e l’NDGA (acido nordiidroguaiaretico). L’uso prolungato di questi componenti è nocivo per l’organismo; Selenio. E’ considerato un potente antiossidante, ma a elevati dosaggi produce effetti collaterali tossici; Cromo picolinato. Contribuisce a controllare il livello degli zuccheri nel sangue ed è considerato un potenziale agente antiglicosilazione. Secondo alcuni studi, questo componente aiuterebbe a ridurre la massa grassa e a potenziare quella magra, contribuendo a controllare i livelli di colesterolo; Il pregnenolone è noto anche con il nome di “ormone madre” in quanto è il precursore di molti ormoni come il DHEA, il testosterone e gli estrogeni. Alcuni studi hanno dimostrato che il neurosteroide ha effetti stimolatori sulla memoria;
Scaricare