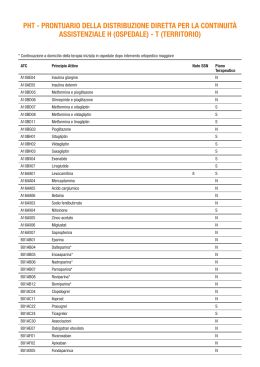
Guida sull’uso dei farmaci Riferimenti Normativi e Modulistica per una corretta prescrizione Considerazioni generali sulle scelte che sono state alla base della formulazione del Prontuario Terapeutico Aziendale della ASL BAT. Criteri adottati La scelta dei farmaci contenuti nel prontuario è stata improntata alla necessità di porre a disposizione dei curanti uno strumento duttile, organico e aggiornabile, in grado di offrire una serie di sostanze scelte secondo criteri scientifici ed economici. Si è fatto riferimento a considerazioni pratiche, scegliendo farmaci: 1) Ampiamente diffusi nei protocolli diagnostico-terapeutici; 2) Disponibili nelle formulazioni più congrue ai bisogni terapeutici; 3) Largamente in uso nella ASL BAT e nella stessa Regione Puglia presso i Presidi Ospedalieri ed il territorio. Criteri scientifici Valutazioni scientifiche sono state estrapolate dal complesso delle conoscenze farmacologiche sull’efficacia clinica, la tollerabilità e la farmacocinetica dei farmaci scelti. Per ogni sostanza si è tenuto conto degli effetti indesiderati e delle reazioni avverse, come segnalati nella letteratura internazionale per numero e importanza, della tossicità acuta e cronica, del sinergismo d’azione con possibili interferenze con altri principi attivi. Sono state tenute in considerazione la tollerabilità, il rapporto rischio/beneficio, le caratteristiche di biodisponibilità, la diffusione tissutale e l’attività terapeutica. Criteri economici Si sono considerate le ragioni di approccio economico ai farmaci secondo il concetto di costo/beneficio ed in un’ultima analisi del miglior risultato possibile al prezzo più adeguato. MEDICINA BASATA SULL’EVIDENZA E P.T.A. Come riferimento alle scelte dei farmaci ed alla loro effettiva efficacia terapeutica si pone come referenza quanto rilevato dalla letteratura internazionale in ordine ai principi della “Medicina basata sull’evidenza”. Si è considerato utile l’approccio, così come riportato nella formulazione del P.T.O. dell’Università degli Studi di Messina, che appare particolarmente icastico e fruibile. “Gradi e livelli delle raccomandazioni nella valutazione evidence based della documentazione scientifica con particolare riguardo a terapia, prevenzione e danno. Fonte: Adattato da NHS center for EBM, University of Oxford **Grado raccomandazione A *Livello evidenza 1a Reviews sistematiche (SR), metanalisi (omogenee) di trials clinici randomizzati (RCTs) basati su dati individuali dei pazienti *Livello evidenza 1b Reviews sistematiche (SR), metanalisi (omogenee) di trials clinici randomizzati (RCTs) basati su misure d'effetto sommarie *Livello evidenza 1c RCT singoli nei quali il più basso limite di confidenza relativo all'effetto del trattamento supera il beneficio minimo più importante (con stretto intervallo di confidenza) *Livello evidenza 1d Trials clinici non randomizzati con drammatico effetto del trattamento **Grado di raccomandazione B *Livello evidenza 2a Reviews sistematiche omogenee relative a studi di coorte *Livello evidenza 2b Studi singoli di coorte e trials clinici randomizzati di qualità inferiore (con ampi intervalli di confidenza relativi all'effetto del trattamento) *Livello evidenza 3a Reviews sistematiche omogenee relative a studi caso-controllo *Livello evidenza 3b Singoli studi caso-controllo **Grado raccomandazione C *Livello evidenza 4 Serie di casi (anche studi di scarsa qualità del tipo caso-controllo e di coorte) **Grado raccomandazione D *Livello evidenza 5 Opinione di esperto senza esplicito approccio critico o basata sulla fisiologia. Commento evidence based: I livelli sopra esposti si adattano alla valutazione della rilevanza della documentazione scientifica al fine di produrre linee guida, protocolli terapeutici, aggiornamenti dei prontuari terapeutici. Il grado della raccomandazione prodotta (A>B>C>D) esprime il valore della stessa, ottenuta selezionando il materiale di riferimento in base alla consistenza della evidenza scientifica, prodotta dalla documentazione esaminata. (livello evidenza degli studi: 1a>1b>1c>1d>2a>2b>3a>3b>4>5) Implicazioni per i ricercatori: la preparazione di uno studio clinico andrebbe effettuata in base alla piramide delle evidenze sopra esposta. In particolare ad esempio uno studio mirato a valutare l'efficacia di un trattamento farmacologico dovrebbe rispondere ai requisiti di validità di un trial controllato randomizzato ed in particolare: - l'assegnazione dei pazienti e' stata effettuata con un valido sistema di randomizzazione? - la lista di randomizzazione e' stata tenuta celata? - il follow-up dei pazienti e' stato sufficentemente lungo e completo? - e' stata effettuata una analisi ITT (intention to treat)? - il doppio cieco e' stato applicato? - i pazienti appartenenti ai diversi bracci del trial sono stati trattati in maniera similare (ad eccezione della terapia sperimentale)? - i gruppi di pazienti avevano caratteristiche simili all'inizio del trial? - E' stata correttamente valutata numericamente e statisticamente la rilevanza degli effetti del trattamento (RRR, RRI, NNT o NNH, CI 95%)?” La Regione Puglia ha inteso dare cogenti indicazioni in ordine alla individuazioni di misure di contenimento della spesa farmaceutica ospedaliera ed ha formulato vari provvedimenti normativi tra i quali significativa, ai sensi della determinazione del P.T.A., appare la D.G. n. 177 del 26/02/2007 che di seguito si riporta. _______________________ DELIBERAZIONE DELLA GIUNTA REGIONALE 26 febbraio 2007, n. 177 Piano di contenimento della spesa farmaceutica ospedaliera. Articolo 12 Legge regionale 28 dicembre 2006, n. 39. L’Assessore alle Politiche della Salute, sulla base dell’istruttoria espletata dall’Ufficio n. 3, con la collaborazione tecnica dell’A.Re.S. confermata dal Dirigente f.f. dello stesso Ufficio e dal Dirigente del Settore, riferiscono: Con la legge regionale 28 dicembre 2006 n. 39 ai fini della razionalizzazione e contenimento della spesa ospedaliera sono stati previsti piani di intervento ai vari livelli decisionali e gestionali. OMISSIS ………….. LA GIUNTA Visto l’art. 48 della legge 326 del 24.11.03; Visto il patto per la salute stipulato tra Governo e Regioni il 28.08.06; A voti unanimi espressi nei modi di legge, DELIBERA Alla luce di tutto quanto su esposto, ed al fine di realizzare su base annua una riduzione del 10% della spesa farmaceutica ospedaliera, di approvare il Piano delle azioni volte al contenimento di detta spesa farmaceutica all’interno degli ospedali articolato nel seguente modo: Piano delle azioni Il piano delle azioni che la Regione Puglia ha previsto per il contenimento della spesa farmaceutica all’interno degli ospedali si articolerà in modo tale da consentire l’attuazione di programmi di. 1. rafforzamento della farmacovigilanza attiva in ambito ospedaliero nell’ambito delle iniziative che afferiscono al Progetto Regionale di cui alla delibera DGR 1470/2005. 2. iniziative di informazione sui farmaci indipendente da logiche di natura promozionale, 3. monitoraggio dell’appropriatezza prescrittivi in ospedale. 4. governo della spesa farmaceutica attraverso la politica del Prontuario terapeutico ospedaliero regionale; 5. contrasto alle acquisizioni di farmaci, nell’ambito di attività promozionali, che condizionano la prescrizione territoriale; 6. gestione informatizzata dei consumi di farmaci in ambito ospedaliero con possibilità di monitoraggio farmaco-epidemiologico espresso in DDD 7. studi di farmaco-utilizzazione riguardanti strategie terapeutiche con farmaci innovativi. 8. attuazione del protocollo applicativo del Regolamento Regionale del 17 novembre 2003 nelle ASL ed Aziende Ospedaliere della Regione; 9. linee Guida per l’utilizzo appropriato dei farmaci per i quali è prevista la redazione del piano terapeutico; 10. acquisti per area e lotti di equivalenza; 11. razionalizzazione della logistica anche attraverso magazzini centralizzati. 1. Iniziative di FV attiva Nell’ambito del progetto di farmacovigilanza approvato con provvedimento di Giunta regionale n. 1470/05 sono stati conferiti incarichi di natura professionale per 24 mesi sia a personale amministrativo che a: • 24 farmacisti assegnati alle aree farmaceutiche delle Aziende territoriali • 1 farmacista presso, la A.O. Universitaria Policlinico di Bari; • 1 farmacista presso la A.O. Universitaria Ospedali Riuniti di Foggia; • 1 farmacista presso l’ARES, Tutti i farmacisti sono stati impegnati nell’attività di farmacovigilanza e di formazione/informazione, con il supporto del personale amministrativo. In particolare i farmacisti incaricati nelle aziende territoriali hanno svolto programmi di lavoro orientato, prevalentemente, al monitoraggio della spesa farmaceutica territoriale ed ad attività formativa/informativa volta ai medici e pediatri di famiglia. Al fine di implementare l’attività formativa/informativa all’interno degli ospedali, con particolare riferimento al corretto utilizzo delle note AIFA, nella consapevolezza che una corretta prescrizione di farmaci nell’ospedale può avere una ricaduta positiva sull’intera spesa farmaceutica, si prevede di implementare il personale per ciascuna azienda territoriale, ospedaliera e universitaria. Per il conferimento di incarichi professionali fino al 31/12/2007, mediante scorrimento della graduatoria riferita alla procedura selettiva espletata dall’ARES in applicazione della citata delibera n.1470/05, nella misura di numero 2 farmacisti per le ASL di Bari - Lecce - Foggia - Taranto; numero 1 farmacista per ASL BAT - BR - Azienda Ospedaliera Universitaria Policlinico - Azienda Ospedaliera Universitaria Ospedali Riuniti Foggia. Il relativo onere finanziario per l’anno 2007 ammonta ad Euro 6.116.049,97, e trova regolare copertura sul capitolo 751085 del bilancio 2006 In ragione del finanziamento che il Ministero della salute dovesse confermare per l’anno 2008 si potrà proseguire anche sulla base della verifica dei risultati raggiunti, nell’attuazione del progetto conferendo incarichi professionali mediante nuova procedura selettiva ai sensi della legge. 2. Iniziative di informazione sui farmaci, indipendente da logiche di natura promozionale. Allo scopo contribuiranno: • la regolamentazione sull’informazione medico scientifica adottata dalla Giunta Regionale con provvedimento del 28 dicembre 2006, n 2022; • l’utilizzo di tutti gli strumenti culturali messi a disposizione dei professionisti dall’AIFA quali: a) il Bollettino di Informazione sui Farmaci; b) Guida all’Uso dei Farmaci; c) Clinical Evidence, d) Farmaci in gravidanza; d) Il Formulario Nazionale e) il processo di informazione indipendente sui farmaci, avviato con le riviste messe a disposizione del medico di medicina generale che verrà esteso agli operatori ospedalieri. 3.Monitoraggio appropriatezza prescrittiva in ospedale Con Determinazione del 4 gennaio 2007, pubblicata sulla Gazzetta ufficiale n. 07 del 10 gennaio 2007, sono state emanate le note AIFA 2006 – 2007 per l’uso appropriato dei farmaci. Atteso che le note AIFA devono essere tenute in considerazione e osservate anche dai medici ospedalieri e specialisti, negli ospedali ed in particolare nelle Farmacie Ospedaliere saranno istituite postazioni per il monitoraggio dell’appropriatezza prescrittiva. In conformità a quanto disposto dal D.L.vo 502/92 e successive modificazioni ed integrazioni, in tema di erogazioni appropriate ed efficacia, è obiettivo della Regione valorizzare la posizione nevralgica dei Servizi di Farmacia Ospedaliera per effettuare l’analisi dei comportamenti prescrittivi in ambito ospedaliero. Ciò comporterà la verifica delle prescrizioni effettuate alla dimissione o alle visite specialistiche con lo scopo di promuovere usi razionali del farmaco nel corso del 2007. A tal fine, a breve prenderà il via un progetto, finanziato con risorse ex artt. 34-34 bis D. 662/96 per la realizzazione degli obiettivi di piano sanitario nazionale per circa 2 milioni di euro. Il progetto interessa le due aziende ospedaliero universitarie (circa 2.500 posti letto) e gli ospedali siti nei capoluoghi di provincia per ulteriori 2000 posti letto circa. 4. Governo della spesa farmaceutica attraverso la politica del Prontuario terapeutico ospedaliero regionale; Formulazione del Prontuario Terapeutico Ospedaliero Regionale per il governo della spesa farmaceutica all’interno delle Strutture Ospedaliere, articolato per categorie terapeutiche secondo la classificazione ATC (Anatomico Terapeutico Chimico), da sottoporre a periodici aggiornamenti allo scopo di renderlo attuale rispetto alle più recenti conoscenze terapeutiche e farmacologiche al fine di ridurre il rischio di errori di terapia, nonché per il controllo ed il monitoraggio dell’uso appropriato dei farmaci innovativi Per la realizzazione di tale obiettivo, si renderà necessario il contributo scientifico e professionale della Commissione Terapeutica regionale che verrà istituita con idoneo provvedimento entro il 31 marzo 2007 b) Commissione Terapeutica Regionale La Commissione Terapeutica Regionale é un organismo multidisciplinare dotato di tutte le particolari competenze cliniche, farmacologiche, e farmaceutiche necessarie a garantire una gestione del Prontuario. Le funzioni della Commissione Regionale saranno quelle di: • curare la redazione e l’aggiornamento semestrale del Prontuario Terapeutico Ospedaliero Regionale, con particolare riguardo ai farmaci equivalenti, • analizzare periodicamente (ogni tre mesi) e valutare i consumi dei farmaci negli Ospedali della Puglia, con particolare attenzione per il controllo ed il monitoraggio dell’uso appropriato dei farmaci innovativi, in sintonia con la Commissione della appropriatezza prescrittiva. • rilasciare i pareri su protocolli di trattamento farmacologici. Il farmacista ospedaliero devo garantire l’applicazione del PTOR, attraverso attività di informazione/ vigilanza e gestione dei farmaci/dispositivi medici e promuovere attività orientate ad assicurare un utilizzo sicuro e razionale dei prodotti. 5. Contrasto sulle acquisizioni di farmaci nell’ambito di attività promozionali, che condizionano la prescrizione territoriale. Le Aziende Sanitarie devono vigilare affinché, fatto salvo quanto previsto per i campioni gratuiti, non vengano concessi a titolo gratuito medicinali. Per i farmaci destinati ad uso “compassionevole” o a sperimentazioni cliniche si deve fare riferimento alla specifica normativa vigente (Decreto 8.5.2003 e D.L.vo 211/2003). 6. Gestione informatizzata dei consumi di farmaci in ambito ospedaliero con possibilità di monitoraggio farmaco epidemiologico espresso in DDD Al fine di effettuare in maniera più efficace il monitoraggio del consumo dei farmaci in ambito ospedaliero. Le Direzione generali delle aziende sanitarie, degli IRCCS ed Enti ecclesiastici, saranno sensibilizzate ad implementare la gestione informatica delle farmacie ospedaliere. I consumi di farmaci potranno essere sviluppati utilizzando il sistema di misurazione di consumo dei farmaci più condiviso, la DDD (Dose teorica media di farmaco assunta giornalmente da un paziente adulto dal peso di 70 chili) attraverso l’utilizzo di appositi software di gestione. La disaggregazione dei vari livelli di ATC fino al principio attivo consentirà di effettuare valutazioni retrospettive o prospettiche a seconda della direzione dell’analisi farmaco-epidemiologica da effettuare e del fenomeno prescrittivo che si vuole osservare. Nell’ambito della realizzazione degli obiettivi di cui sopra, la Regione ha approvato apposito protocollo d’intesa con l’IMS, per la gestione del progetto Sfera. 7. Studi di farmaco-utilizzazione riguardanti strategie terapeutiche con farmaci innovativi. La Commissioni per la appropriatezza prescrittiva, appronterà un piano di intervento finalizzato alla conduzione anche di Studi Osservazionali di farmaco-utilizzazione valutando le risposte nelle popolazioni di pazienti sottoposti a tali terapie. La conduzione di tali studi sarà importante per valutare l’accuratezza diagnostica, l’applicazione dei criteri di inclusione previsti dalle Autorità Regolatorie, la risposta alle terapie nelle condizioni della pratica clinica reale, in pazienti affetti da condizioni di co-morbilità 8. Attuazione del protocollo applicativo del Regolamento Regionale del 17 novembre 2003 N. 17 nelle ASL ed Aziende Ospedaliere della Regione. Con il provvedimento in parola sono state adottate modalità organizzative che tendono al contenimento della spesa farmaceutica come di seguito: • attribuzione al medico curante della. Prescrizione farmaceutica con oneri a carico dei SSR, • obbligo da parte di tutti i medici ospedalieri e dei convenzionati interni di adeguarsi a tutte le norme sull’appropriatezza prescrittiva e di informare il paziente sull’erogabilità o meno a carico del SSN della prescrizione farmaceutica; • obbligo del medico dipendente ASL e dello specialista convenzionato di indicare solo il principio attivo e, ove nel caso, la nota AIFA. Nel quadro delle iniziative finalizzate al contenimento della spesa farmaceutica, si darà massimo impulso a detto Regolamento tramite: • incontri organizzati dalle Direzioni sanitarie dei presidi ospedalieri per favorire la regolare applicazione delle norme; • monitoraggio sull’applicazione delle note AIFA in ambito ospedaliero, con l’ausilio della commissione regionale della appropriatezza prescrittiva. • verifiche degli interventi attraverso analisi retrospettive sui consumi di farmaci condotte interdisciplinarmente da farmacisti dell’ospedale e del territorio. Le iniziative dovranno coinvolgere le Strutture Ospedaliere private accreditate 9. Linee Guida per l’utilizzo appropriato dei farmaci per i quali è prevista la redazione di un Piano terapeutico. Da parte della Commissione regionale per l’appropriatezza prescrittiva da una prima indagine sull’utilizzo dei piani terapeutici sono emerse alcune criticità. Pertanto saranno avviate campagne di informazione volte a tutti gli operatori sanitari finalizzate ad un appropriato utilizzo del piano terapeutico in sintonia con le indicazioni fornite dalla Agenzia italiana del farmaco (AIFA) 10. Acquisti per Area / Lotti di equivalenza L’adozione del Prontuario Terapeutico Ospedaliero Regionale favorirà l’attivazione della unioni d’acquisto per approvvigionamento dei farmaci con le migliori evidenze in termini di efficacia e sicurezza. Le gare saranno organizzate per lotti semplici, lotti composti e lotti di equivalenza comprendenti principi attivi sovrapponibili sia in termini di efficacia clinica che di sicurezza. All’interno del lotto di equivalenza il criterio di aggiudicazione farà riferimento all’offerta economicamente più vantaggiosa valutatone anche l’impatto sulla spesa territoriale. 11. Logistica (Magazzini centralizzati) Laddove le situazioni geografiche lo consentano i Direttori Generali individueranno spazi adeguati da adibire a magazzini centralizzati. Nella gestione dei magazzini di farmacia ospedaliera si punterà su una efficace organizzazione logistica come cardine per poter effettuare un elevato turnover di articoli il cui approvvigionamento dovrà basarsi sulla definizione di una scorta minima e di un punto di riordino. Il primo parametro viene definito come la quantità o la giacenza di magazzino sotto la quale si va in area di crisi; il secondo parametro come la quantità o la giacenza di magazzino oltre la quale si rende necessario ordinare le voci di interesse. La definizione di entrambi i parametri dovrà essere curata da farmacisti che integreranno nelle valutazioni dati storici e dati epidemiologici in un contesto dinamico di interventi di razionalizzazione. Prima dell’invio di qualsiasi ordine da, parte delle farmacie ospedaliere dovranno essere effettuati tutti i controlli incrociati finalizzati ad accertare che non ci siano margini di spreco. Per i farmaci ad alto costo le aziende dovranno porre in essere ogni utile intervento e procedura intesa alla definizione di “contatti estimatori” al fine di ridurre gli oneri finanziari connessi con la giacenza delle scorte di farmaci. Fra le procedure, particolare rilievo, anche per il significato nell’ambito dei programmi di risk management, assumerà quella elaborata allo scopo di ridurre le quantità di medicinali scaduti. Di disporre la pubblicazione sul B URP ai sensi dell’art. 6 lett. h della legge regionale n. 13/94. Il Segretario della Giunta Il Presidente della Giunta Dr. Romano Donno On. Nichi Vendola Criteri di costruzione del Prontuario Per ciascun Principio Attivo viene riportato: - Codice ATC - via di somministrazione I farmaci sono stati accorpati in gruppi terapeutici, in ordine alfabetico secondo la classificazione ATC. I farmaci in fascia H per la cura dell’AIDS ed i farmaci Oncologici fanno riferimento, per il loro impiego terapeutico, alla loro introduzione nel prontuario Terapeutico Regionale e non sono quindi riportati in questo P.T.A. della ASL BAT nella loro totalità, sono soggetti, quindi, al loro automatico inserimento nel P.T.Aziendale a seguire la loro introduzione nel P.T.O.R.. I farmaci con specifiche note AIFA sono soggetti ai criteri prescrittivi anche nell’ambito ospedaliero. Di seguito si riportano le categorie classificate nel sistema ATC: Categoria ATC ATC - A Apparato gastrointestinale A01 A02 A03 A04 A05 A06 A07 A09 A10 A11 A12 A16 Stomatologici Farmaci per i disturbi correlati alla secrezione Farmaci per i disturbi funzionali gastrointestinali Antiemetici ed antinausea Terapia biliare ed epatica Lassativi Antidiarroici, antinfiammatori ed antimicrobici intestinali Digestivi inclusi gli enzimi Farmaci usati nel diabete Vitamine Integratori minerali Altri farmaci dell’apparato gastrointestinale e del metabolismo ATC - B Sangue ed organi emopoietici B01 B02 B03 B05 Antitrombotici Antiemorragici Farmaci antianemici Succedanei del plasma e soluzioni perfusionali ATC - C Sistema cardiovascolare C01 C02 C03 C04 C07 C08 Terapia cardiaca Antipertensivi Diuretici Vasodilatatori periferici Betabloccanti Calcioantagonisti C09 C10 Sostanze ad azione sul sistema renina-angiotensina Sostanze ipolipemizzanti ATC - D Dermatologici D01 D03 D05 D06 D07 D08 D10 D11 Antimicotici per uso dermatologico Preparati per il trattamento di ferite e ulcerazioni Antipsoriasici Antibiotici e chemioterapici per uso dermatologico Corticosteroidi preparati dermatologici Antisettici e disinfettanti Preparati antiacne Altri preparati dermatologici ATC - G Sistema genito-urinario ed ormoni sessuali G01 G02 G03 G04 Antimicrobici ed antisettici ginecologici Altri ginecologici Ormoni sessuali e modulatori del sistema genitale Urologici ATC - H Preparati ormonali sistemici, esclusi gli ormoni sessuali H01 H02 H03 H04 H05 Ormoni ipofisari, ipotalamici ed analoghi Corticosteroidi sistemici Terapia tiroidea Ormoni pancreatici Calcio-omeostatici ATC - J Antimicrobici generali per uso sistemico J01 J02 J04 J05 J06 Antibatterici per uso sistemico Antimicotici per uso sistemico Antimicobatterici Antivirali per uso sistemico Sieri immuni ed immunoglobuline ATC - L Farmaci antineoplastici ed immunomodulatori L01 L02 L03 L04 Antineoplastici Terapia endocrina Immunostimolanti Sostanze ad azione immunosoppressiva ATC - M Sistema muscolo-scheletrico M01 M02 M03 M04 M05 Farmaci antinfiammatori ed antireumatici Farmaci per uso topico per dolori articolari e muscolari Miorilassanti Antigottosi Farmaci per il trattamento delle malattie delle ossa ATC - N Sistema nervoso N01 N02 N03 Anestetici Analgesici Antiepilettici N04 N05 N06 N07 Antiparkinsoniani Psicolettici Psicoanalettici Altri farmaci del sistema nervoso ATC - P Farmaci antiparassitari, insetticidi e repellenti P01 P02 P03 Antiprotozoari Antielmintici Ectoparassiticidi, compresi antiscabbia, insetticidi e repellenti ATC - R Sistema respiratorio R01 R03 R05 R06 R07 Preparati sinologici Farmaci per le sindromi ostruttive delle vie respiratorie Preparati per la tosse e le malattie da raffreddamento Antistaminici per uso sistemico Altri preparati per il sistema respiratorio ATC - S Organi di senso S01 Oftalmologici ATC - V Vari V03 V04 V06 Tutti gli altri prodotti terapeutici Diagnostici Agenti nutrizionali Altre informazioni inerenti i farmaci nella legislazione attuale: Classi di concedibilità o altre abbreviazioni : A concedibile SSN A/N° concedibile SSN limitatamente alle indicazioni terapeutiche previste dalle note AIFA C non concedibili SSN H concedibile SSN solo da strutture ospedaliere P diagnosi e piano terapeutico di centri specializzati, Universitari o delle Aziende sanitarie, individuate dalle Regioni e dalle Provincie autonome PSO l'impiego a carico del SSN dei medicinali autorizzati per la psoriasi a placche da moderata a severa negli adulti che non hanno risposto o presentano una controindicazione o sono intolleranti ad altre terapie sistemiche, incluse ciclosporina e metotressato o PUVA, è ammesso secondo il protocollo di studio "PSOCARE: trattamento della psoriasi con farmaci sistemici in Italia" su indicazione dei centri autorizzati dalla regione. All’atto della registrazione, la Commissione Unica del Farmaco (CUF), poi AIFA (agenzia del farmaco), attribuendo il farmaco alla Classe, ne definisce il regime di distribuzione, la rimborsabilità a carico del Servizio Sanitario e le modalità di dispensazione (con Ricetta Ripetibile (RR) o Ricetta Non Ripetibile (RNR). I farmaci sono quindi classificati in una delle seguenti: - Classe A: farmaci essenziali e per le malattie croniche a totale carico del S.S.R. - Classe H: farmaci utilizzabili solo in ambiente ospedaliero - Classe C: farmaci a totale carico dell’Assistito La CUF, poi AIFA dal 2004, ha introdotto la rilevanza terapeutica, classificando i farmaci sulla base dei seguenti parametri: - efficacia clinica desunta dalla letteratura scientifica; - tipo di patologia curata; - effetti sul decorso della malattia; - accettabilità da parte del paziente. A parità degli elementi sopra elencati viene rimborsato dal Servizio Sanitario Regionale il farmaco a prezzo più basso. Per alcuni farmaci, la CUF, poi AIFA, ha posto delle limitazioni di prescrivibilità, attribuendovi la Nota CUF, oggi AIFA (secondo la quale, un particolare farmaco, passa in fascia A limitatamente alle indicazioni espressamente indicate dall’AIFA) o vincolandolo all’attivazione del Registro ASL o della Segnalazione di Piano Terapeutico. Le limitazioni prescrittive relative alle note CUF, oggi AIFA, non sempre coincidono con le indicazioni autorizzate e riportate nella rispettiva scheda tecniche e pertanto va posta attenzione anche alle indicazioni autorizzate dal Ministero della Sanità per le singole specialità medicinali. Le Note costituiscono uno strumento di indirizzo che non interferisce con la libertà di prescrizione del farmaco da parte del Medico, ma limitano la rimborsabilità di alcuni farmaci alla cura di una ristretta cerchia di patologie che l’AIFA ha individuato in base alla efficacia documentata e a valutazioni economiche. *Note AIFA già note CUF: Consentono la prescrizione a carico del SSN di alcuni farmaci, definiti da provvedimenti ministeriali specifici, limitatamente alle indicazioni esplicitate dalla singola nota (quindi non per tutte le indicazioni per le quali il farmaco è registrato dal Ministero della Salute). *Determinazione AIFA del 29.10.2004 Revisione note CUF. *Registro ASL: Aveva lo scopo di attivare un sistema di sorveglianza sull’uso di alcuni, definiti, farmaci per i quali vi era la possibilità di un uso improprio o eccessivo, in condizioni in cui non si avevano dati certi di efficacia terapeutica e di sicurezza a lungo termine. La prescrizione dei farmaci sottoposti a Registro ASL, doveva essere accompagnata da una segnalazione, a validità annuale, al Servizio Farmaceutico dell’ASL di residenza del paziente, da parte del Medico Specialista che faceva diagnosi, mediante la compilazione di un’apposita scheda in triplice copia. Le tre copie destinate: - due copie consegnate al paziente, per l’attivazione del Registro ASL presso il Distretto di residenza, che provvedeva ad una vidimazione; - una copia per il Medico o la Struttura Specialistica. *Abolito con provvedimento normativo. SEGNALAZIONE DI DIAGNOSI E PIANO TERAPEUTICO: Il Piano Terapeutico ha finalità similari a quelle previste per il Registro ASL. La prescrizione dei farmaci sottoposti a “Segnalazione di diagnosi e piano terapeutico”deve essere effettuata, da parte del Medico Specialista previa compilazione di un’apposita scheda in triplice copia. Le tre copie sono destinate: - una copia trasmessa, a cura del medico o della struttura che pone diagnosi, al servizio farmaceutico dell’ASL di residenza del paziente (preferibilmente entro 30 giorni dalla compilazione ); - una copia inviata al MMG tramite il paziente; - una copia per il Medico o la Struttura Specialistica. Modalità di dispensazione dei farmaci OSP 1 medicinale da utilizzare esclusivamente in centri ospedalieri autorizzati. OSP1 A medicinale da utilizzare esclusivamente in ospedali, case di cura e cliniche. OSP1 B medicinale da utilizzare esclusivamente in ospedali, case di cura. OSP1 C medicinale da utilizzare medicinale da utilizzare esclusivamente in ospedali, case di cura, cliniche e studi specializzati. OSP1 D medicinale da utilizzare esclusivamente in ambito ospedaliero o ad esso assimilabile. OSP1 E medicinale da utilizzare esclusivamente in ospedali, case di cura e studi specialistici radiologici. OSP1 F medicinale da utilizzare esclusivamente in ospedali, case di cura cliniche e centri specializzati dotati di apparecchiature N.M.R OSP1 H medicinale da utilizzare farmaci utilizzabili esclusivamente in ospedali. OSP1 I medicinale da utilizzare farmaci utilizzabili esclusivamente negli ospedali, cliniche, case di cura e nei Sert(Legge 49/2006) OSP1 J medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambito ospedaliero OSP1 K medicinale da utilizzare esclusivamente negli ospedali e case di cura (L. 49/2006) OSP1 L medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambito Ospedaliero o in struttura ad esso assimilabile. OSP1 M medicinale da utilizzare esclusivamente negli ospedali, case di cura, cliniche specializzate e ambulatori oculistici. OSP1 N medicinale da utilizzare esclusivamente negli ospedali e case di cura autorizzate all'impiego di radio farmaci OSP1 O medicinale da utilizzare esclusivamente negli ospedali , cliniche, case di cura e dello specialista in chirurgia o anestesia (legge 49/2006). OSP1 P medicinale da utilizzare esclusivamente negli ospedali e case di cura con reparti specializzati in dialisi. OSP1 Q medicinale da utilizzare esclusivamente negli ospedali e case di cura e degli specialisti in oncologia e gastroenterologia. OSP1 S medicinale da utilizzare esclusivamente in centri ospedalieri in neurologia, oftalmologia, neuropsichiatria infantile, fisiatria e ortopedia pediatrica. OSP1 X medicinale da utilizzare esclusivamente in ambiente ospedaliero, case di cura e da specialisti radiologi. OSP1 U medicinale da utilizzare esclusivamente in spedali e case di cura specializzati dotati di reparti di terapia intensiva. OSP2 medicinale soggetto a prescrizione medica limitativa, utilizzabile in ambiente ospedaliero o in una struttura assimilabile o in ambito extraospedaliero secondo disposizioni regionali. OSP2 A medicinale da utilizzare esclusivamente in ospedali, case di cura e ambulatori specialistici OSP2 D medicinale soggetto a prescrizione medica limitativa, utilizzabile in ambiente ospedaliero o in ambito extraospedaliero secondo disposizioni regionali.(sulla base di protocolli di studio Psocare) OSP2 E diagnosi e prescrizione da parte di centri specializzati individuati dalle regioni con distribuzione diretta da parte delle strutture pubbliche . OSP2 F medicinale da utilizzare esclusivamente in ospedali , case di cura e ambulatori attrezzati per endoscopie OSP2 G medicinale soggetto a prescrizione medica limitativa, utilizzabile in ambiente ospedaliero o in struttura ad esso assimilabile. DISPOSIZIONI MINISTERIALI PER LE RICETTE (SIGLE E ABBREVIAZIONI) APPLICAZIONE AL SERVIZIO SANITARIO NAZIONALE MPS Uso riservato al medico specialista. Vietata la vendita al pubblico RL7 Da vendersi dietro presentazione di ricetta medica di specialista oncologo, ematologo ed infettivologo o di un centro ospedaliere RL12 Da vendersi dietro presentazione di ricetta medica rilasciata da un centro ospedaliere autorizzato RL16 Da vendersi dietro presentazione di ricetta medica non rinnovabile rilasciata da centri autorizzati RL17 Medicinale soggetto a prescrizione medica limitata non rinnovabile RL18 Medicinale soggetto a prescrizione medica da rinnovare volto per volta vendibile al pubblico su prescrizione di centri ospedalieri o dello specialista nefrologo, ematologo, internista, chirurgo, anestesiologo, pediatra, emotrasfusionista, oncologo RL19 Medicinale soggetto a prescrizione medica limitativa RL21 Medicinale prescrivibile dalle strutture ospedaliere e RL23 case di cura specializzate Medicinale dispensabile al pubblico con ricetta medico rilasciata da un medico specialista RMR-RNR Medicinale soggetto a prescrizione medica ministeriale a ricalco: decreto del Presidente della Repubblica 309/1990 per le indicazioni rimborsate. RNR: Medicinale soggetto a prescrizione medica da rinnovare volta per volto per le indicazioni non rimborsate. RMS Da vendersi dietro presentazione di ricetto ministeriale speciale, da conservare in originale per 5 anni; specialità soggetta al D.P.R. 309/90 – Tab.1 RM t l Ricetta ministeriale speciale. Tab I RnR Da vendersi dietro presentazione di ricetta medica da rinnovare volto per volta. RnR1 Da vendersi dietro presentazione di ricetto medica da rinnovare volta per volta, specialità soggetto al D.P.R. 309/90 -Tab. IV RnR2 Da vendersi dietro presentazione di ricetta medica do rinnovare volta per volta, specialità soggetto al D.P.R. 309/90-Tab. V RnR11 Ricetta medica da utilizzare una sola volta, nella ricetta il medico deve dichiarare di aver fornito al paziente tutte le informazioni sulle dosi, effetti collaterali, modalità tecniche necessarie per una utilizzazione corretta del prodotto. RnR16 Da vendersi dietro presentazione di ricetta medica da rinnovare volta per volta. Specialità soggetta al D.P.R. 309/90 Tab IV, in terapia del dolore. Ricetta ministeriale a ricalco (RMR) (L12/2001) RnR1tlV Ricetta non ripetibile. Tab IV, la dispensazione è limitata ad una sola confezione; specialità soggetta al D.P.R. 309/90 RnR1tV Ricetta non ripetibile. Tab V, la dispensazione è limitata ad uno sola confezione; specialità soggetta al D.P.R. 309/90 RnR2tlV Ricetta non ripetibile. Tab IV, la dispensazione è limitata a due confezioni; specialità soggetta al D.P.R. 309/90 RnRD Ricetta non ripetibile. Il medico deve dichiarare nella ricetta di aver fornito al paziente tutte le informazioni su dosi, effetti collaterali, modalità di assunzione RnRS Ricetta non ripetibile rilasciata da centri ospedalieri RnRS1 Ricetta non ripetibile specialistica: neurologia, neurochirurgia, medicina interna, diabetologia, ortopedia e traumatologia RnRS2 Ricetta non ripetibile su indicazione di Centri Ospedalieri o di Specialisti RnRS3 Ricetta non ripetibile specialistica: Neuropsichiatria. Attestazione dell'esecuzione settimanale della conta e della formula leucocitaria. La compatibilità dei valori riscontrati con l'inizio, prosecuzione e ripresa RnRS4 Ricetta non ripetibile, rilasciata dallo specialista esperto nella gestione della demenza di Alzheimer RnR t l V Ricetta non ripetibile. Tab IV RnR t V Ricetta non ripetibile. Tab V RnR t V I Ricetta non ripetibile. Tab VI Rr Da vendersi dietro presentazione di ricetta medica RRL Medicinale soggetto a prescrizione medica limitativa, vendibile al pubblico su prescrizione di centri ospedalieri o di specialisti RrLim Ricetta ripetibile su indicazione dello specialista oncologo o ematologo o di un centro ospedaliero RrOsp1 Ricetta ripetibile rilasciata da Centri Universitari e Ospedalieri, specializzati nel trattamento degli ipostaturalismi, individuati dalle province autonome di Tren e Bolzano. RrS2 Da vendersi solo su prescrizione di strutture pubbliche a tal fine riconosciute RrS3 Ricetta ripetibile specialistica: Oncologia, ematologia o centro ospedaliero RrS5 Ricetta ripetibile specialistica: nefrologia, medicina interna ed ematologia Rr t V Ricetta ripetibile. Tab V Rr t V I Ricetta ripetibile. Tab VI Sop Medicinale senza obbligo di prescrizione Odo Uso esclusivo del medico odontoiatria Otc Medicinale di automedicazione Oft Uso riservato al medico oculista, vietata la vendita al pubblico Osp Medicinale do utilizzare in ospedale e casa di cura, vietata la vendita al pubblico Osp1 Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero. Osp2 Medicinali da utilizzare in ospedali e case di cura, soggetti al D.P.R. 309/90 - Tab I. Vietata la vendita al pubblico Osp4 Medicinali da utilizzare in ospedali, cliniche, case di cura e stadi specializzati, vietata la vendita al pubblico Osp5 Medicinali da utilizzare in ospedali e case di cura con reparti specializzati in dialisi, vietata la vendita al pubblico Osp6 Medicinali da utilizzare in ospedali, case di cura, cliniche specializzate e ambulatori oculistici, vietato la vendita al pubblico Osp8 Medicinali da utilizzare in ospedali, case di cura e cliniche, vietata la vendita al pubblico Osp10 Medicinali da utilizzare in ospedali, case di cura e ambulatori specialistici, vietata la vendita al pubblico Osp11 Medicinali da utilizzare in ospedali e case di cura autorizzate all'impiego di radiofarmaci, vietata la vendita al pubblico Osp12 Medicinali da utilizzare in ospedali e case di cura specializzati, dotati di reparti di terapia intensiva vietata la vendita al pubblico Osp13 Medicinali da utilizzare in ospedali, case di cura e ambulatori attrezzati per endoscopie. Osp14 Medicinali da utilizzare in ospedali, case di cura, cliniche e centri diagnostici specializzati, dotati di apparecchiature N.M.R. Osp15 Medicinale uso riservato a medici specialisti in: chirurgia plastica, chirurgia maxillo facciale, dermatologia, oftalmologia. Vietata la vendita al pubblico. Osp17 Uso riservato ai centri ospedalieri oculistici e neurologici specializzati, vietata la vendita al pubblico Osp18 Medicinali da utilizzare in ospedali e case di cura, soggetti al DPR 309/90 - Tab V, vietata la vendita al pubblico Osp19 Medicinali da utilizzare esclusivamente in ambiente ospedaliero, case di cura e da specialisti Osp20 Medicinali da utilizzare in ospedali, vietata la vendita al pubblico. Osp22 Uso riservato agli ospedali e case di cura autorizzate all'uso di radioisotopi, vietata la vendita al pubblico Osp23 Uso limitato agli ospedali, alle cliniche, alle case di cura e studi specialistici radiologia, vietata la vendita al pubblico Osp27 Medicinale utilizzabile esclusivamente in ambiente ospedaliero o in ambiente ad esso assimilabile (art. 9 decreto legislativo 30.12.92, n.539) Osp29 Medicinale utilizzabile esclusivamente in ambiente ospedaliero e riservata ai medici specializzati in Pneumatologia, in Fisiopatologia respiratoria, Medicina del lavoro, Otorinolaringoiatria, Pediatria, Allergologia Osp31 Medicinale riservata agli ospedali, alle cliniche, alle case di cura, ai Ser. T.: soggetto al D.P.R. 309/90 -Tab.l; vietata la vendita al pubblico Osp32 Utilizzo esclusivo in ambito ospedaliero, case di cura e agli specialisti in oncologia e gastroenterologia, vietata la vendita al pubblico Osp36 Medicinale da utilizzare esclusivamente in centri ospedalieri oculistici, neurologici specializzati, oftalmologia, neuropsichiatria infantile, fisiatria ed ortopedia pediatrica. Vietata la vendita al pubblico. Glossario corrente in riferimento alle richieste ed alle reazioni avverse di farmaci. Rmp: richiesta motivata personalizzata crf doc: documento redatto dalla Commissione Regionale Farmaci MS : scheda monitoraggio del Ministero della Salute. Defined Daily Dose o dose definita giornaliera. E’ la dose di mantenimento, identificata convenzionalmente, per un giorno di terapia in soggetti adulti (70 Kg), relativamente all’indicazione terapeutica principale della sostanza. È unità di misura che consente il confronto tra specialità contenenti la stessa sostanza a diversi dosaggi. NPT Nutrizione parenterale Totale DDL Dear Doctor Letter (AIFA) Comunicazione AIFA per il medico RCP Riassunto delle Caratteristiche del Prodotto (Scheda Tecnica) Registro AIFA Monitoraggio AIFA all'indirizzo: http://aifa-onco.agenziafarmaco.it Scheda AIFA monitoraggio indirizzo: http://monitoraggio-farmaci.agenziafarmaco.it/ Scheda albumina Richiesta personalizzata secondo raccomandazioni d'uso aziendali [orf] Farmaco orfano per malattia rara Farmaci Equivalenti Poiché la spesa farmaceutica è in costante ascesa, per garantire ai cittadini un’assistenza farmaceutica adeguata, è indispensabile individuare modalità di contenimento. Ecco perché negli ultimi anni è stata richiesta una maggiore attenzione prescrittiva, sono state introdotte dalla CUF (1994), poi AIFA dal 2004 le note limitative, sono state adottate misure nazionali (Finanziaria 2001) per lo sviluppo del mercato dei Farmaci Equivalenti con l’introduzione del sistema di rimborso dei farmaci secondo il prezzo di riferimento. Ciò significa che quando esistono due farmaci identici, con la stessa capacità terapeutica, la cui unica differenza è il prezzo, il SSN fornisce gratuitamente quello a prezzo più basso; qualora il paziente desideri il farmaco equivalente più costoso, dovrà pagare la differenza. Questa soluzione è stata già adottata da tempo, da diversi paesi europei, mentre il mercato farmaceutico italiano è caratterizzato da un’anomalia che lo differenzia dai principali paesi europei, con una quota di mercato dei generici praticamente trascurabile. Le ragioni di questa situazione sono da ricercare nell’assenza di una legislazione specifica fino al 1996, nelle abitudini prescrittive, nella durata della copertura brevettuale dei principi attivi e nell’introduzione (nel 1991) del Certificato di Protezione Complementare che prevedeva l’estensione della tutela brevettuale in funzione del periodo intercorso tra la data di deposito della domanda di brevetto e la data del decreto con cui viene concesso l’AIC. Dal 1996, dopo l’emanazione della normativa che disciplina la registrazione dei generici, nonostante molte aziende avessero già ottenuto l’AIC per numerosi generici, questi per altri due anni, non sono starti commercializzati e quindi sono stati irreperibili sul mercato. Attualmente invece, l’elenco dei farmaci generici prescrivibili e disponibili sul mercato, è in continuo incremento ed è oggi possibile generare un risparmio. FARMACI STUPEFACENTI PRINCIPIO ATTIVO - SPECIALITA’ MEDICINALE alfentanil FENTALIM FIALE EV 5 MG 10 ML buprenorfina SUBUTEX COMPRESSE 2 MG buprenorfina SUBUTEX COMPRESSE 8 MG buprenorfina TEMGESIC FIALE EV O IM 0,3 MG ML buprenorfina TEMGESIC COMPRESSE SL 0,2 MG codeina CODEINA GOCCE ORALI 20 MG/ML 50 ML fenobarbital FENOBARBITAL ELISIR 0,3% 100 ML fenobarbital GARDENALE COMPRESSE 50 MG fenobarbital GARDENALE COMPRESSE 100 MG fenobarbital FENOBARBITAL FIALE IM 100 MG 1 ML fenobarbital LUMINALETTE COMPRESSE 15 MG fentanil DUROGESIC CEROTTO 25 MCG/ORA fentanil DUROGESIC CEROTTO 50 MCG/ORA fentanil FENTANEST FLACONE EV O IM 0, 1 MG 2 ML fentanile+droperidolo LEPTOFEN FIALE IM O EV 10 ML flunitrazepam DARKENE COMPRESSE 2 MG ketamina KETALAR FIALE IM O EV 100 MG 2 ML metadone EPTADONE FIALE IM 10 MG 1 ML metadone METADONE SCIROPPO 0,1% 20 MG morfina cloridrato MORFINA CLORIDRATO FIALE IM O EV 10 MG 1 ML morfina cloridrato MORFINA CLORIDRATO FIALE IM O EV 20 MG 1 ML morfina solfato MS CONTIN DISCOIDI 10 MG morfina solfato MS CONTIN DISCOIDI 30 MG morfina solfato MS CONTIN DISCOIDI 60 MG morfina+atropina CARDIOSTENOLO FIALE IM 1 ML oxibato sodico ALCOVER FLACONE OS 17,5% 140 ML pentazocina TALWIN FIALE IM O EV 30 MG 1 ML pentazocina TALWINTAB COMPRESSE 50 MG petidina PETIDINA FIALE EV O IM 100 MG 2 ML remifentanil ULTIVA FIALE EV 1 MG 3 ML sufentanil FENTATIENIL FIALE EV 0,25 MG 5 ML Antidoti ANTIDOTO - INDICAZIONE CLINICA 4-metilpirazolo (fomepizolo) fiale 1,5 g 1,5 ml. Trattamento precoce o tardivo dell’intossicazione da glicole etilenico in alternativa all’etanolo Acetilcisteina fiale fiale 5 g 25 ml. Intossicazione da paracetamolo, amanitine (amanita phalloides) e solventi epatotossici (1,2-dicloropropano, tetracloruro di carbonio) Alcool etilico fiale 70% 10 ml. Avvelenamento da alcool metilico, glicole etilenico e derivati (anticongelanti per auto) Amido polvere. Intossicazione da iodio per ingestione Atropina solfato fiale 0,5 mg 1 ml Intossicazione da antiparassitari organofosforici, carbamati, fisostigmina, funghi ad azione muscarinica (Inocybe, Clitocybe) Blu di metilene fiale 1% 10 ml. Metaemoglobinemia da vari agenti tossici, quali: anilina, nitriti inorganici, nitrobenzene, anestetici locali (mepivacaina, bupivacaina) e fenoli Calcio cloruro fiale 10% 10 ml. Intossicazione da acido fluoridrico, fluoruri, fluoro; intossicazione da calcio-antagonisti Calcio disodico edetato (EDTA) fiale 10% 10 ml. Avvelenamento da piombo ed altri metalli pesanti (cromo, cobalto, manganese, rame) Calcio folinato fiale 25 mg. Sovradosaggio da antagonisti dell’acido folico e riduzione degli effetti tossici indotti da aminopterine e metotrexato Calcio gluconato fiale 10% 10 ml. Intossicazione da acido fluoridrico, fluoruri, fluoro; intossicazione da calcio-antagonisti Calcio gluconato gel cutaneo 2,5%. Ustioni da acido fluoridrico e fluoruro di sodio Carbone adsorbente attivato polvere. Utile per impedire l’assorbimento di gran parte delle sostanze tossiche (ad es. amfetamine, barbiturici, oppiacei) Cimetidina fiale 200 mg 2 ml. Sovradosaggio da paracetamolo Colestiramina cloridrato polvere. Coadiuvante nelle intossicazioni da digitalici, curarina, Amanita Phalloides, paracetamolo ed altre sostanze che si legano alla colestiramina a livello gastrointestinale Deferossamina fiale 500 mg 5 ml. Intossicazione da ferro e alluminio Dimercaprolo (BAL) fiale 100 mg 2 ml. Intossicazione da metalli e metalloidi (arsenico, oro, mercurio, bismuto, nichel, etc) Dimeticone gocce e gel. Antischiuma indicato per tutte le sostanze tensioattive schiumogene (detersivi, shampoo, etc) Ditizone cialde 300 mg. Avvelenamento da tallio Fab-antidigitale fiale 40 mg. Intossicazione da digitalici (digossina, digitossina) Fenitoina fiale 250 mg 5 ml. Intossicazione da digitatici Fentolamina mesilato fiale 10 mg 1. ml Trattamento dell’ischemia provocata dall’iniezione accidentale di epinefrina Fisostigmina fiale 1 mg 1 ml. Intossicazione da anticolinergici, antidepressivi triciclici, fitomenadione, antiparkinsoniani, funghi (Amanita Muscaria e Panterina) Flumazenil fiale 0,5 mg 5 ml e 1 mg 10 ml. Intossicazione o sovradosaggio da benzodiazepine, zolpidem e zopiclone Glucagone fiale 1 mg 1ml. Intossicazione da ipoglicemizzanti, beta-bloccanti e calcio antagonisti Glutatione ridotto fiale 600 mg. Coadiuvante nelle intossicazioni da alcool etilico e da alcuni gruppi di farmaci (chemioterapici antineoplastici, antitubercolari, neurolettici, antidepressivi e paracetamolo) Idrossicobalamina fiale 2% 5 ml. Avvelenamento da cianuri Idrossicobalamina flaconi 2,5 g 100 ml. Avvelenamento da cianuri Naloxone fiale 0,4 mg 1 ml. Intossicazione da stupefacenti oppiacei Neostigmina fiale 0,5 mg 1 ml. Sovradosaggio da tubocurarina o da altri bloccanti neuromuscolari competitivi Olio di vasellina (paraffina liquida). Usato in alternativa ai purganti salini in caso di ingestione di idrocarburi, olii essenziali, solventi organici alogenati e non (trielina, carbonio tetracloruro, etc) Penicillamina capsule 150 mg. Intossicazione da sali di rame, piombo, mercurio e cadmio Potassio cloruro fiale 2 mEq 10 ml. Intossicazione digitalica in pazienti con ipopotassemia Potassio permanganato polvere da diluire. Avvelenamento da alcaloidi, digitatici Pralidossima fiale 200 mg 10 ml. Avvelenamento da antiparassitari organo fosforici Protamina solfato fiale 1% 5 ml. Iperdosaggio da eparina Siero antibotulinico. Intossicazione da cibi contaminati dall’esotossina prodotta dal Clostridium Botulinum Siero antiofidico fiale. Intossicazione da morso di vipere europee Siero gangrena gassosa fiale im 25000 UI 10 ml. Neutralizzazione delle alfa tossine prodotte da Clostridium novyi, perfringens e septicum. Sodio nitrito fiale 3% 10 ml Avvelenamento da cianuri Sodio tiosolfato fiale 10% 10 ml. Avvelenamento da cianuri Tampone fosfato (tampone di Sorensen) pH 8 flaconi 500 ml Ingestione di acidi forti (es. acido muriatico) ed alcali caustici (es.varechina) Tionina fiale 0,2% 10 ml. Avvelenamento da metaemoglobinizzanti Vitamina C o acido ascorbico. Avvelenamento da metaemoglobinizzanti Vitamina K1 o fitomenadione fiale 10 mg 1 ml. Intossicazione da anticoagulanti cumarinici (es. warfarina e acenocumarolo) ontuari Forme farmaceutiche e abbreviazioni correnti sir f f + solv fl +solv fl iniet cpr cps gtt polv gran scir sosp cr pom pen ung emuls sol polv coll pom oft spr sup fiale-siringhe fiale fiale + fiale solvente flaconcini + fiale solvente flaconcini/fialoid preparazione iniettabile compresse capsule gocce os/liqiodo os polvere granulato sciroppo sospensione crema pomata penna unguento emulsione soluzione polvere u.e. collirio pomata oftalmica spray supposte cpr vag tavolette/compr. vaginali ov ovuli lav vag lavande vaginali coll colluttorio conf confetti loz lozione schiu schiuma aeros aerosol cer cerotti cand vag candelette vaginali tbf tubo siringa carp carpule cpr eff cpr effervescenti ung oft unguento oftalmico cart cartuccia polv inal polvere per inalazione f + sir fiala + siringa cpr riv compresse rivestite schiu ret schiuma rettale sosp ret sospensione rettale polyamp ampolla polipropilene AD adulti BB bambini ev/iv endovenosa id intradermica im intramuscolare inal inalatoria intracaver intracavernosa intratec intratecale ivas intravasale loc locale nas nasale (sistemica) oft oftalmica os orale rett rettale sc sottocutanea subling sublinguale td transdermica trach endotracheale vag vaginale vesc intravescicale Gal medicinale galenico m.p. materia prima Cogna I farmaci prescritti in dimissione ospedaliera. La normativa della Regione Puglia ha come fondamento normativo: REGOLAMENTO REGIONALE 17 Novembre 2003 N. 17 "Regolamento per le Prescrizioni ed il Monitoraggio in materia di Assistenza Sanitaria", in applicazione dell'Art. 15-decies del D. Lgs 502/92 e successive modificazioni, del co. 4 dell'Art.1 della L.425/96 e della L.405/01" PRESIDENTE DELLA GIUNTA REGIONALE Viste le linee di programmazione definite dal Piano Sanitario Regionale 2002-2004 di cui alla DGR n.2087 del 27/12/2001,che ha predisposto un atto di indirizzo e coordinamento di prime misure uniformi,su tutto il territorio regionale, in materia di formazione, informazione ed appropriata prescrizione delle prestazioni mediche, farmaceutiche, specialistiche ed ospedaliere. Vista la delibera di Giunta Regionale n.1661 del 04/11/2003 con la quale si approva il Regolamento per le prescrizioni ed il monitoraggio in materia di assistenza sanitaria, in applicazione dell'art.15decies del D.Lgs 502/92 e successive modificazioni, del co.4 dell'art.1 della L.425/96 e della L.425/01. Visto l'art. 121 della Costituzione, così come modificato dalla legge costituzionale 22 novembre 1999 n. 1, nella parte in cui attribuisce al Presidente della Giunta Regionale l' emanazione dei regolamenti regionali. EMANA il seguente Regolamento: Premessa Scopo del presente atto di indirizzo e coordinamento è la definizione di linee guida e di prime misure uniformi in materia di formazione, informazione ed appropriata prescrizione delle prestazioni mediche, farmaceutiche, specialistiche ed ospedaliere finalizzate all'integrazione comprensoriale dell'assistenza sanitaria in esecuzione della DGR 15 Luglio 1999, n.1003 e delle linee di programmazione definite dal Piano Sanitario 2002-2004 di cui alla DGR 27 Dicembre 2001 n. 2087. Formazione ed Informazione omissis… In particolare in materia di assistenza farmaceutica, le Aziende Ospedaliere, gli Enti Ecclesiastici Ospedalieri, gli IRCCS pubblici e privati e le Aziende USL curano la formazione e l'informazione del personale medico e specialistico dipendente e convenzionato, anche mediante l'invio o la pubblicazione nei siti internet delle stesse, di indicazioni alle quali i medici devono attenersi con particolare riguardo ai provvedimenti della Commissione Unica del Farmaco circa le limitazioni della prescrivibilità del farmaco a carico del SSR, in applicazione dell' Art. 31 della L. 833/78 e del co.4 dell' Art. 1 della L. 425/96. L'Area farmaceutica delle Aziende USL, le strutture di farmacia delle Aziende Ospedaliere, degli Enti ed Istituti Ospedalieri pubblici e privati, partecipano attivamente alla definizione e alla attuazione dei programmi formativi aziendali inerenti l'uso del farmaco, predispongono materiale conoscitivo ed informativo, collaborano con le OO.SS. mediche ai fini della formazione. omissis… Le Aziende Sanitarie e gli IRCCS pubblici devono destinare specifiche risorse per la formazione del personale sanitario. Attuazione della Programmazione Regionale In quanto atto di coordinamento, il documento costituisce strumento di attuazione della programmazione regionale in materia di appropriatezza della prestazione sanitaria, come tale assume natura regolamentare e di indirizzo nei confronti di tutti i Soggetti interessati. I principi desumibili dal presente atto si applicano per analogia a tutti i casi qui non previsti, salve specifiche disposizioni di legge o regolamentari dell'Esecutivo Regionale. La mancata esecuzione da parte delle Aziende e degli Istituti Sanitari pubblici delle funzioni di monitoraggio nei termini previsti , dà luogo da parte della Regione nei confronti degli stessi alle ulteriori sanzioni previste dalla normativa regionale in materia di debito informativo. Per il miglioramento del servizio ai cittadini, al fine di garantire la prescrizione farmaceutica per urgenza terapeutica e alla dimissione ospedaliera, i Medici delle unità operative ospedaliere di Accettazione e/o Pronto Soccorso delle Aziende Ospedaliere pubbliche e private, devono essere dotati del ricettario unico regionale. I medici dipendenti e gli specialisti ambulatoriali interni, nel caso di visita specialistica richiesta dal medico curante, al fine di prescrivere direttamente eventuali indagini specialistiche necessarie per rispondere al quesito diagnostico posto, devono essere dotati del ricettario unico regionale specificatamente contrassegnato , che non può essere utilizzato, in alcun modo, per la prescrizione farmaceutica. Tale indicazione assume particolare valenza per il follow up dei pazienti affetti da patologia neoplastica. In caso di mancato rispetto delle indicazioni regionali sull'appropriato utilizzo del ricettario unico regionale, gli oneri derivanti dalla non corretta prescrizione devono essere posti a carico del medico prescrittore dipendente o specialista convenzionato interno. Le Aziende Ospedaliere, gli Enti Ecclesiastici e gli IRCCS pubblici e privati di cui sopra, devono richiedere alla Azienda USL territorialmente competente i ricettari del SSR. Le Aziende Ospedaliere e gli Istituti Pubblici e privati destinatari dei ricettari, prima di distribuire gli stessi, devono provvedere, nello spazio "Timbro e Firma del Medico" ad apporre specifico timbro che contenga le seguenti informazioni: (a) Denominazione Istituto/Azienda Sanitaria (b) Cod. Istituto (ad es. "Policlinico, cod. 160-907) (c) Cod. Identificativo Individuale del Soggetto Prescrittore (non è ammesso il solo riferimento alla Unità Operativa di appartenenza). Analogamente a quanto previsto per i Medici di Medicina Generale ed i Pediatri di Libera Scelta, il codice identificativo del "soggetto prescrittore" deve essere compatibile con i formati previsti dai tracciati di rilevazione delle prestazioni sanitarie adottati dal SISR . I Medici di continuità assistenziale, rispetto ai quali vanno adottate modalità identificative analoghe a quelle innanzi indicate, devono limitare la loro attività prescrittiva esclusivamente per assicurare una terapia d'urgenza e per coprire un ciclo di terapia non superiore alle 48 - 72 ore. I Medici di continuità assistenziale non possono trascrivere sul ricettario del SSR prescrizioni effettuate da altri medici. Resta ferma l'autonomia del medico di continuità assistenziale di condividere, e quindi trascrivere, le prescrizioni delle sole terapie d'urgenza, che vanno sempre acquisite agli atti. Le Aziende USL devono assicurare la diffusione delle suddette disposizioni, nonché la presenza di specifica informativa agli Utenti in ogni sede di guardia medica. Linee Guida sulle modalità prescrittive ed indirizzi per l'appropriatezza delle prestazioni I seguenti indirizzi e linee guida di carattere generale tengono conto in particolare per i Medici di Medicina Generale ed i Pediatri di Libera scelta di quanto previsto dai relativi DPR 270/00 e DPR 272/00, nonché dalla DGR 203/02. 1. La prescrizione farmaceutica sul modulario del SSR è redatta di norma dal Medico di Medicina Generale (MMG) e dal Pediatra di Libera Scelta (PLS). I Medici ospedalieri, Universitari e gli specialisti ambulatoriali nella proposta di prescrizione farmaceutica che deve essere indirizzata al Medico di assistenza primaria, sono tenuti ad indicare esclusivamente il principio attivo e non il nome commerciale della specialità medicinale, nel rispetto delle note CUF. Fermi i casi di urgenza (ad es., pronto soccorso ospedaliero), in caso di dimissione ospedaliera, i medici dipendenti dal SSR, dovranno richiedere al Servizio Accettazione o/e al Pronto Soccorso la trascrizione della terapia sul ricettario unico regionale in dotazione.(vedi DPR 270/00 art. 36 punto 7: "La prescrizione farmaceutica in caso di urgenza terapeutica o di necessità è compilata anche dai medici dipendenti e dagli specialisti convenzionati interni, secondo le disposizioni di cui all'art. 15decies del D.L. 502/92 e successive modificazioni). 2. All'atto della dimissione ospedaliera o del referto di consulenza specialistica, dovrà essere annotata l’erogabilità del farmaco indicato secondo le norme CUF. Si intende che tutti i medici, dipendenti o convenzionati interni , devono adeguarsi alle norme sull'appropriatezza prescrittiva. In caso di incertezza o dubbi, il quesito va posto al Direttore di Distretto o al Direttore Sanitario del Presidio Ospedaliero, che risponde sentito il Dirigente dell'Area Farmaceutica.(vedi art. 15-decies D.L.502/92 e successive modificazioni). 3. La richiesta di prestazioni specialistiche e di diagnostica da eseguirsi entro trenta giorni dalla dimissione ospedaliera deve essere redatta direttamente dal medico ospedaliero sul ricettario unico regionale. 4. Nel caso di visita specialistica ambulatoriale, gli approfondimenti diagnostici ritenuti necessari per la risposta al quesito del medico curante sono prescritti direttamente dal medico specialista sul ricettario unico regionale. 5. Il Medico prescrittore, nel caso di richiesta di visita specialistica o di indagine diagnostica, avrà cura di indicare sul ricettario unico il motivo della prestazione richiesta o il quesito diagnostico. Nel caso il paziente richieda il rispetto della privacy, il quesito andrà indicato su foglio intestato e consegnato al paziente, che lo mostrerà soltanto allo specialista o diagnosta consultato. In tal caso si specificherà sulla ricetta del SSN "quesito allegato". (vedi DD.PP.RR. 270/00 art. 37 punto 2 e 272/00 art. 35 p. 2 : "La richiesta di indagine, prestazione o visita specialistica deve essere corredata dalla diagnosi o dal sospetto diagnostico. Essa può contenere la richiesta di consulto specialistico secondo le procedure previste dall'art. 34 DPR 270/00 e art. 32 DPR 272/00"). 6. Le certificazioni relative ad assenze dal lavoro connesse o dipendenti da prestazioni sanitarie eseguite da medici diversi da quelli di libera scelta non spettano al medico di medicina generale, che non è tenuto alla trascrizione. (vedi DPR 270/00 art. 38 e circolare INPS n. 99 del 13.5.1996). 7. Nel caso di prescrizione di presidi, siringhe e prodotti dietetici e di ogni altro ausilio a carico del SSR, il Medico rilascerà all'assistito, su ricettario unico, la relativa richiesta per la erogazione diretta da parte dell'Azienda USL, da realizzarsi anche mediante la rete delle farmacie territoriali pubbliche e private, in vigenza degli accordi di cui alla DGR 203/02. La prescrizione non può eccedere il fabbisogno riferito ad un anno e l'erogazione, il relativo frazionamento e/o limitazione sarà disposto dall'Azienda secondo modalità organizzative dalla stessa fissate ovvero, in presenza di specifici indirizzi regionali, in esecuzione di dette disposizioni (vedi DD.PP.RR. 270/00 art. 36 e 272 art. 34). 8. E' compito del medico curante verificare la corrispondenza tra la diagnosi e le limitazioni prescrittive emanate dalla CUF e, nei casi in cui, in precedenti prescrizioni o/e in proposte di prescrizione, riscontri incongruità o prescrizioni non appropriate al quadro clinico dell'assistito, ha ovviamente titolo a modificarle o a non procedere alla prescrizione di detti farmaci. 9. Si rammenta inoltre che: per singola ricetta non può essere prescritto un numero di confezioni superiore a due; per la cura delle patologie di cui al DM 329/99 ed in favore dei soggetti con invalidità riconosciuta al 100% è consentita la prescrizione fino ad un massimo di tre pezzi per ricetta; la prescrizione non può comunque superare i sessanta giorni di terapia; i medicinali pluriprescrivibili di cui all'articolo 9 della legge n. 405/2001, quali medicinali a base di antibiotici in confezione monodose, medicinali a base di interferone per i soggetti affetti da epatite cronica ed i medicinali somministrati esclusivamente per fleboclisi possono essere prescritti fino ad un massimo di sei pezzi per ricetta; i farmaci non a carico del SSR (classe C o classe A in caso di indicazioni non ricomprese nelle note CUF), debbono essere prescritti su ricettario personale, salvo quanto previsto dalle norme riguardanti gli invalidi di guerra. Presso il comitato permanente regionale per la medicina generale e la pediatria di libera scelta è istituito l'Osservatorio regionale sulla appropriatezza prescrittiva, con il compito di verificare la corretta applicazione , da parte dei medici prescrittori, delle norme relative al presente regolamento. La Regione Puglia mette a disposizione dell'osservatorio strumenti idonei (fax, indirizzo di posta elettronica) a recepire le segnalazioni dei cittadini o degli operatori sanitari inerenti a eventuali violazioni del presente regolamento. L'Osservatorio, entro trenta giorni dalla segnalazione, invia al direttore generale territorialmente competente una comunicazione relativa alla inosservanza segnalata. Il direttore generale a sua volta entro trenta giorni adotta gli opportuni provvedimenti e ne da comunicazione all'Osservatorio. L'Osservatorio , sulla base del monitoraggio effettuato, formulerà, all'Assessorato alla Sanità, proposte idonee al miglioramento dell'appropriatezza prescrittiva. Il presente Regolamento sarà pubblicato nel Bollettino Ufficiale della Regione. E' fatto obbligo a chiunque spetti di osservarlo e farlo osservare come Regolamento della Regione Puglia. DISTRIBUZIONE DIRETTA DI FARMACI ALLA DIMISSIONE Normativa di riferimento è il Regolamento della Distribuzione Diretta di farmaci ai sensi dell’articolo 12, punto 1 lettera e) della L.Regionale del 20/12/2006 n.39, oggetto della D.G.R. n.1761 del 29/9/2009, pubblicata sul BURP n .154 del 5/10/2009. La distribuzione diretta dei medicinali (farmaci rimborsabili dal SSN e compresi nel Prontuario Ospedaliero), al fine di garantire la continuità del trattamento farmacologico, deve essere effettuata, limitatamente al primo ciclo, per il periodo immediatamente successivo alla dimissione dal ricovero ospedaliero o alla visita specialistica presso gli ambulatori ospedalieri. Per primo ciclo di terapia deve intendersi una terapia per un massimo di 30 giorni. La modulistica, allegata , è parte integrante della menzionata Deliberazione. Tabella riassuntiva di farmaci a continuità terapeutica domiciliare a seguire di indicazione ospedaliera FARMACI PHT PATOLOGIA ATC PRINCIPIO ATTIVO NOTA P* Acromegalia H01CB02 Octeotride 40 P Tumore neuroendocrino H01CB03 Lanreotide 40 P Anemia mediterranea V03AC01 Deferoxamina P Angina cronica stabile C01EB17 Ivabradina P Angioedema ereditario B02AB03 C1- Inibitore P Artrite reumatoide grave L04AA13 Leflunomide Carenza primaria e secondaria di carnitina; secondaria a dialisi Coagulopatie gravi A16AA01 Levocarnitina B02BB01 Fibrinogeno Umano P B02BD01 Complesso Protrombinico Umano P B02BD02 Fattore VIII di Coagulazione Ricombinante P B02BD02 Fattore VIII di Coagulazione Naturale B02BD02 Moroctocog Alfa P B02BD02 Octocog Alfa P B02BD03 Complesso Protrombinico Antiemofilico umano Umano P B02BD04 Fattore IX di Coagulazione Naturale P B02BD05 Fattore VII di Coagulazione naturale P B02BD09 Nocago Alfa P H01BA02 Desmopressina P Condilomi superficiali carcinomi basocellulari superficiali D06BB10 Imiquimod P Diabete A10AE04 Insulina glargine A10AE05 Insulina Detemir A10BG03 Pioglitazone A10BG02 Rosiglitazone A10BG04 Rosiglitazone + Metformina A10BD05 Pioglitazone + Metformina A10BH01 Sitagliptin P A10BX04 Exenatide P A10BH02 Vildagliptin P A10BD08 Metformina+vildagliptin P A10BD07 Sitagliptin+metformina P N07BB04 Naltrexone N07BC02 Metadone Emolisi neonatale J06BB01 Ig Umana Anti-D (Rh) Epatite cronica C J05AF05 Lamivudina L03AB01 L03AB04 Disassuefazione da oppiacei P 8 P P P ex32bis P Interferone Alfa Naturale ex32 P Interferone Alfa-2a ex32 P L03AB05 Interferone Alfa-2b ex32 P L03AB06 Interferone Alfa-N1 ex32 P L03AB09 Interferone Alfacon-1 ex32 P 103AB10 Peginterferone Alfa-2b ex32 P L03AB11 Peginterferone alfa-2a ex32 P Fibrosi cistica R05CB13 Damase Alfa Infertilità maschile e femminile G03AG02 Menotropjna 74 P G03GA04 Urofollitropina 74 P G03GA05 Follitropina Alfa 74 P G03GA06 Follitropina Beta 74 P G03GA07 Lutropina alfa 74 P H01CA01 Gonodorelina J05AB11 Valaciclovir J05AB06 Valganciclovir P J05AD01 Foscarnet P J05AB06 Valganciclovir P J05AD01 Foscarnet P P01CX01 Pentamidina P V03AE02 Sevelamer P V03AE03 Lantanio P H05BX01 Cinacalcet P Infezioni virali da VZV, HSV, CMV in trapiantati d'organo Infezioni virali e fungine in pazienti affetti da HIV Iperfpsfatemia in dializzati Iperparatiroidismo in dializzati A11CC07 Paracalcitolo Ipogonadismo ipogonatropo G03BA03 Testosterone Ischemia cerebrovascolare B01AC05 Ticlopidina Malattie neoplastiche terapie di supporto Anemie gravi B03XA01 P P 84 P 36 P Epoetina Alfa ex 12 P B03XA01 Epoetina Beta ex12 P B03XA02 Darbepoetina Alfa ex12 P B03XA01 Epoetina zeta ex12 P B03XA03 Metossipolietilenglicole-epoetina beta ex 12 P H01CB02 Octreotide 40 P H01CB03 Lanreotide 40 P L01XX14 Tretinoina L02AE01 Buserelina 51 P L02AE02 Leuprorelina 51 P L02AE03 Goserelina 51 P L02AE04 Triptorelina 51 P L02BB01 Flutamide L02BB03 Bicalutamide L03AA02 Filgrastim (R-Methug-Csf) ex30 P L03AA10 Lenograstim (R-Hug-Csf) ex30 P L03AA03 Molgramostim (R-Humg-Csf) ex30 P L03AA13 Pegfilgrastim ex30 bis P L03AB01 Interferone Alfa Naturale ex32 P L03AB04 Interferone Alfo-2a ex32 P P L03AB05 Interferone Alfa-2b ex32 P L03AB06 Interferone Alfa-N1 ex32 P D06BB10 Imiquimod V03AF01 Mesna P N04BX02 Entacapone P NOABX01 Tolcapone P N04BX03 Entacapone + levodopa + carbidopa P N06DA02 Donepezil 85 P N06DA03 Rivastigmina 85 P N06DA04 Galantamina 85 P Morbo di Alzheimer di grado moderato N06DX01 Memantina 85 P Nanismo ipofisario H01AC01 Somatropina 39 P Norcolessia N06BA07 Modofinil Patologie endometriali- Pubertà precoce L02AE02 Leuprorelina 51 P L02AE03 Goserelina 51 P L02AE04 Triptorelina 51 P N05AH02 Clozapina P N05AH03 Olanzapina P N05AH04 Quetiapina P N05AX08 Risperidone P N05AX12 Aipiprazolo P V03AF03 Calcio Folinato N05AX13 Paliperidone L03AB07 Interferone Beta-1a *** 65 P L03AB08 Interferone Beta-1b *** 65 P L03AX13 Glatiramer Acetato *** 65 P N06BA04 Metifenidato P N06BA09 Atomoxetina P Sindrome coronarica acuta, senza innalzamento del tratto ST. PTCA con applicazione di stent. Terapia antiaggregante a breve termine in associazione con ASA. Terapia antiaggregante a lungo termine in pazienti con controindicazione all'ASA e ticlodipina. B01AC04 Clopidogrel Trapianto d'organo L04AA05 Tocrolimus P L04AA18 Everolimus P L04AA10 Sirolimus P C01EB17 Ivabradina P Trattamento disturbo bipolare di tipo maniacale pazienti adulti trattamento schizofrenia N05AE04 Ziprasidone P Trombosi venosa profonda: profilassi B01AB04 Dalteparina** B01AB05 Enoxaparina** B01AB06 Nadroparina** B04AB07 Parnaparina** B04AB08 Reviparina** Morbo di Parkinson Morbo di Alzheimer di grado lieve-moderato Psicosi grave: Pazienti seguiti da servizi psichiatrici e di igiene mentale Rescue dopo terapia con antagonisti dell'acido djdrofolico Sclerosi multipla P 11 ex 9 bis P B04AB12 Bemiparina** B01AX05 Fondaparina ** Continuazione a domicilio della terapia iniziata in ospedale dopo un intervento ortopedico maggiore. *** Farmaci distribuiti direttamente dai centri specializzati individuati dalla Regione. I FARMACI SOGGETTI A NORME PER LA LORO CONCEDIBILITA’ Vari farmaci sono soggetti alla formulazione di un piano terapeutico al fine della loro concedibilità secondo le indicazioni dell’AIFA ( Agenzia Italiana del Farmaco). Alcuni piani terapeutici sono individuati come specifico modello dall’AIFA. Di seguito si riportano farmaci per cui si prevede piano terapeutico e moduli (alcuni preordinati dall’AIFA) per redigere il piano terapeutico. Vi sono farmaci con nota AIFA e piano terapeutico e farmaci senza nota, ma soggetti alla formulazione del piano terapeutico. Di seguito vengono riportati i due gruppi di farmaci. Medicinali con nota AIFA e piano terapeutico Nota AIFA 8 Levocarnitina Nota AIFA 15 Albumina umana Nota AIFA 36 Metiltestosterone – Testosterone Nota AIFA 39 Somatropina Nota AIFA 40 Lanreotide – Octreotide Nota AIFA 51 Buserelina - Triptorelina - Goserelina- Leuprorelina Nota AIFA 65 Glatiramer acetato-Interferone β-1 e interferone β-1b ricombinanti Nota AIFA 74 Follitropina Alfa e Beta da DNA ricomb - Menotropina- Urofollitropina Nota AIFA 78 Apraclonidina; Brimonidina; Brinzolamide; Dorzolamide; Latanoprost; Travoprost; Bimatoprost; Dorzolamide+Timololo; Latanoprost+Timololo (Sospesa dal 12.6.2009 all’11 dicembre 2009) Determinazione Aifa 6 maggio 2009) Nota AIFA 79 Teriparatide Nota AIFA 85 Donezepil; Galantamina; Rivastigmina Nota AIFA 88 Cortisonici per uso topico Medicinali con piano terapeutico (non soggetti a specifica nota) anastrazolo aripiprazolo atomoxetina bicalutamide C1 inibitore cinacalcet clozapina Complesso protrombinico concentrato attivato Complesso protrombinico umano deferoxamina desmopressina Dornase alfa entacapone everolimus exemestane Fattore IX di coagulazione naturale Fattore VII di coagulazione naturale Fattore VIII di coagulazione naturale e ricombinante Fibrinogeno umano gonadorelina imiquod Immunoglobulina umana anti-D Insulina detemir ivabridina leflunomide letrozolo Levodopa-carbidopa-entacapone mesna modanafil Moroctocog alfa naltrexone Nonacog alfa olanzapina paracalcitolo pentamidina pergolide Pioglitazone quetiapina rasaglicina risperidone rosiglitazone sevelamer Sirolimus tacrolimus tolcapone tretinoina valganciclovir - REGIONE PUGLIA AZIENDA SANITARIA LOCALE BAT SCHEDA DI SEGNALAZIONE DIAGNOSI E PIANO TERAPEUTICO (1) Paziente …………………………… Cognome …………………………………. Nome Età………………….DATA DI NASCITA…………………………….Sesso M F CODICE FISCALE DELL’ASSISTITO………………………………………………………………. ASL di appartenenza dell’assistito……………………………..Provincia………..Regione……….. DIAGNOSI………………………………………………………………………………………….. ………………………………………………………………………………………………………….. MEDICO SPECIALISTA Dr/Prof…………………………………………………………………… Centro Reparto ……………………………………………………………………………. Day-hospital …………………………………………………………………………… Ambulatorio …………………………………………………………………………….. Altro ……………………………………………………………………………… …………………………………………………………………………… PROGRAMMA TERAPEUTICO: Farmaco/i Prescritto/i …………………………………………………………………………….. NOTA AIFA…………………………………………………………………………………………………….. POSOLOGIA………………………………………………………………………………………….. DURATA PREVISTA DEL TRATTAMENTO(2)……………………………………………………… PRIMA PRESCRIZIONE [] PROSECUZIONE DELLA CURA [] DATA TIMBRO E FIRMA DEL MEDICO PRESCRITTORE ……………………………………………………………... 1. 2. 3. TIMBRO DEL CENTRO ………………………………………. Da redigere in triplice copia ed inviare al servizio Farmaceutico della ASL ed al medico curante tramite l’assistito. La terza copia deve essere trattenuta dal medico che compila la scheda. Non oltre un anno. In caso di prosecuzione della terapia, redigere nuova scheda I dati identificativi del medico risultano indispensabili al fine di poter inviare eventuali comunicazioni. REGIONE PUGLIA AZIENDA SANITARIA LOCALE BAT Scheda prescrizione statine Cognome______________________________________Nome_____________________________ Diagnosi_________________________________________________________________________ Valori di LDL Colesterolo___________________________________________________________ Soggetti a Rischio elevato con Colesterolo LDL < o = 150 Soggetti a Rischio elevato con Colesterolo Soggetti a Rischio molto Elevato LDL > 150 (SCA; Ictus Recente; Rivascolarizzazione Coronarica Recente, Diabete + Coronaropatia) IL MEDICO PRESCRITTORE (Timbro e firma) TIMBRO DEL CENTRO PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI ERITROPOIETINE (ex Nota 12) Centro prescrittore ______________________________________________________________________________ Medico prescrittore (nome e cognome) ______________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. ____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ La prescrizione di eritropoietine è a carico del SSN per le seguenti condizioni cliniche: Trattamento dell’anemia (Hb 11 g/dL e suo mantenimento tra 11 e 12 g/dl) associata ad IRC in pazienti adulti e in soggetti pediatrici (per Darbepoetina sono disponibili dati in età pediatrica solo per pazienti con età 11 anni) sia in trattamento dialitico che in trattamento conservativo Trattamento dell’anemia (Hb 10 g/dL) in pazienti adulti oncologici che ricevono chemioterapia antiblastica; in caso di Hb 8 mg/dL è indicato il ricorso all’emotrasfusione Principi attivi: eritropoietina alfa, eritropoietina beta, darbepoetina alfa eritropoietina zeta Trattamento dell’anemia (Hb 11 g/dL e suo mantenimento tra 11 e 12 g/dl) associata ad IRC in pazienti adulti Principi attivi:metossipolietileglicole-eritropoietina beta Trattamento per incrementare la quantità di sangue autologo nell’ambito di programmi di predonazione con le limitazioni previste in scheda tecnica Principi attivi: eritropoietina alfa, eritropoietina beta, eritropoietina zeta Farmaco prescritto eritropoietina alfa eritropoietina beta metossipolietilenglicole-eritropoietina beta darbepoetina alfa eritropoietina zeta eritropoietina biosimilare alfa Dosaggio______________________________________________ Durata prevista del trattamento ____________________________ Prima prescrizione Data ___/_____/____ Prosecuzione della cura Timbro e firma del clinico prescrittore Le epoetine alfa e beta vengono erogate direttamente dal servizio farmaceutico territoriale, ai sensi della Legge 648/96, nelle seguenti indicazioni terapeutiche: sindromi mielodisplastiche; anemia refrattaria con sideroblasti e senza sideroblasti; anemia (Hb<10g/dl o riduzione dell’emoglobina ≥ 2 g/dl durante un qualsiasi periodo di 4 settimane di trattamento) nei pazienti trapiantati di fegato o con diagnosi clinica o istologica di cirrosi, che ricevono ribavirina in combinazione con interferone standard o peghilato e che presentano risposta virologica alla terapia; anemia in pazienti HIV pluritrattati (Hb<8,5g/dl). PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI INTERFERONI (Ex Nota 32) Centro prescrittore ________________________________________________________________________________ Medico prescrittore (nome e cognome) ________________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. _____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ La prescrizione di interferoni è a carico del SSN per le seguenti condizioni cliniche: Epatite cronica B: Epatite cronica B HBV-DNA-positiva con ipertransaminemia Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa-2a peghilato; interferone alfa naturale leucocitario* Epatite cronica B-delta (monoterapia) Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* Epatite C: in combinazione con ribavirina o in monoterapia, se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C in pazienti adulti con ipertransaminasemia e positività per HCV-RNA, inclusi pazienti con malattia epatica avanzata (cirrosi epatica compensata – Child A) e/o con coinfezione da HIV, mai trattati in precedenza con interferoni o in recidiva dopo precedente trattamento con interferoni Principi attivi: interferone alfa-2a peghilato; interferone alfa 2-b peghilato; interferone alfa-2a ricombinante; interferone alfa-2b ricombinante Nota: vi sono evidenze in letteratura di maggiore efficacia degli interferoni peghilati rispetto agli interferoni ricombinanti. * Interferone alfa naturale leucocitario è previsto solo in caso di intolleranza agli interferoni ricombinati (presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interferoni e che ne impediscano la prosecuzione in presenza di risposta terapeutica). in combinazione con ribavirina (o in monoterapia se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C, senza ipertransaminasemia, in soggetti senza scompenso epatico, positivi per HCVRNA sierico, mai trattati in precedenza con interferoni o in recidiva dopo precedente trattamento con interferoni. Principi attivi: interferone alfa-2a peghilato in combinazione con ribavirina o in monoterapia, se esistono controindicazioni alla ribavirina, trattamento dell’epatite cronica C in pazienti adulti con ipertransaminasemia e positività per HCV-RNA: da riservare a pazienti con problemi di intolleranza agli interferoni (presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interferoni, e che ne impediscano la prosecuzione in presenza di risposta terapeutica). Non utilizzare nei pazienti non responders a precedenti cicli di trattamento con interferoni Principi attivi: interferone alfa naturale leucocitario Altre patologie: leucemia a cellule capellute Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* leucemia mieloide cronica Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* sarcoma di Kaposi correlato all’AIDS o ad altre condizioni cliniche di immunodepressione Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* linfoma non Hodgkin follicolare Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* melanoma maligno Principi attivi: interferone alfa-2a ricombinante; interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* carcinoma renale avanzato Principio attivo: interferone alfa-2a ricombinante; interferone alfa naturale leucocitario* linfoma cutaneo a cellule T Principio attivo: interferone alfa-2a ricombinante mieloma multiplo Principio attivo: interferone alfa-2b ricombinante; interferone alfa naturale leucocitario* * Da impiegare in caso di intolleranza agli interferoni ricombinati (in presenza di documentata intolleranza soggettiva o neutropenia o piastrinopenia con conta dei neutrofili persistentemente inferiori a 750/mmc e/o piastrine persistentemente inferiori a 50.000/mmc, che compaiano in corso di terapia con altri interferoni, e che ne impediscano la prosecuzione in presenza di risposta terapeutica tumore carcinoide Principio attivo: interferone alfa-2b ricombinante micosi fungoide Principio attivo: interferone alfa naturale leucocitario Farmaco prescritto interferone alfa 2a ricombinante interferone alfa 2b ricombinante interferone alfa 2b peghilato interferone alfa naturale leucocitario interferone alfa 2a peghilato Dosaggio___________________________________________________ Durata prevista del trattamento _________________________________ Prima prescrizione Data____________ Prosecuzione cura Timbro e firma del clinico prescrittore L’interferone alfa-2a e alfa-2b ricombinanti viene erogato direttamente dal servizio farmaceutico territoriale, ai sensi della Legge 648/96, nelle seguente indicazione terapeutica: in monoterapia nel trattamento dell’epatite acuta da HCV. PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI LAMIVUDINA (ex Nota 32 bis) Centro prescrittore ________________________________________________________________________________ Medico prescrittore (nome e cognome) ________________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. _____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ La prescrizione di lamivudina è a carico del SSN per le seguenti condizioni cliniche: Epatite cronica B HBV-DNA-positiva, con malattia avanzata (con riscontro istologico di ponti portocentrali e/o diagnosi clinica di cirrosi) in cui l’interferone sia controindicato, o non tollerato o inefficace, come terapia soppressiva senza limiti temporali né di associazione Epatite cronica B HBVDNA positiva senza malattia avanzata, come terapia di durata definita e senza limiti di associazione Portatori cronici di HbsAg per il trattamento e per la prevenzione delle riesacerbazioni dell’epatite B conseguenti a terapie con chemioterapici antitumorali o farmaci immunosoppressivi o a trapianto di midollo o di organo solido, senza limiti temporali né di associazione Soggetti HbsAg negativi portatori di anticorpi anti HBV per la prevenzione delle riesacerbazioni dell’epatite B conseguenti a terapie con chemioterapici antitumorali o farmaci immunosoppressivi in grado di causare importante immunodepressione, senza limiti temporali Farmaco prescritto lamivudina cp 100 mg Lamivudina sospensione 5 mg/mL Dosaggio_________________________________________________ Durata prevista del trattamento _______________________________ Prima prescrizione Data________________________ Prosecuzione cura Timbro e firma del clinico prescrittore PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI IVABRADINA Centro prescrittore ________________________________________________________________________________ Medico prescrittore (nome e cognome) ________________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. _____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ La prescrizione di ivabradina è a carico del SSN solo se rispondente alla seguente condizione : Trattamento sintomatico dell’angina pectoris cronica stabile in pazienti in ritmo sinusale, che abbiano una controindicazione o un’intolleranza ai beta-bloccanti o ai calcio-antagonisti. Farmaco prescritto ivabradina 5 mg compresse ivabradina 7.5 mg compresse Dosaggio_________________________________________________ Durata prevista del trattamento _______________________________ Prima prescrizione Data________________________ Prosecuzione cura (motivo……………………….) Timbro e firma del clinico prescrittore PIANO TERAPEUTICO AIFA PER PRESCRIZIONE SSN DI FA TTORI DI CRESCITA LEUCOCITARI (ex Nota 30 e 30bis) Centro prescrittore ________________________________________________________________________________ Medico prescrittore (nome e cognome) ________________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. _____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ La prescrizione di fattori di crescita granulocitari è a carico del SSN per le seguenti condizioni cliniche: Trattamento della neutropenia febbrile da chemioterapia (*) ( filgrastim, lenograstim, pegfilgrastim) (*) da intendersi condizione clinica comprensiva anche della profilassi Neutropenia congenita (filgrastim) Trapianto di midollo osseo ( filgrastim, lenograstim)) Mobilizzazione di cellule staminali periferiche ( filgrastim, lenograstim)) Neutropenia HIV correlata o correlata ai farmaci antiretrovirali in pazienti pluritrattati che necessitino di farmaci ad azione neutropenizzante ( filgrastim, lenograstim)) Farmaco prescritto filgrastim lenograstim lenograstim Dosaggio_________________________________________________ Durata prevista del trattamento _______________________________ Prima prescrizione Data________________________ Prosecuzione cura Timbro e firma del clinico prescrittore I fattori di crescita filgrastim e lenograstim vengono erogati direttamente dal servizio farmaceutico territoriale, ai sensi della Legge 648/96, nella seguente indicazione terapeutica: nel trattamento della neutropenia (neutrofili<750/l) nei pazienti trapiantati di fegato o con diagnosi clinica di cirrosi, che ricevono interferone standard o peghilato o in monoterapia o in combinazione con ribavirina e che presentano risposta virologica precoce alla terapia. PIANO TERAPEUTICO PRESCRIZIONE FARMACI BIOLOGICI Centro prescrittore ________________________________________________________________________________ Medico prescrittore (nome e cognome) ________________________________________________________________ Tel _________________________________ e-mail ____________________________________________________ Paziente (nome e cognome) _________________________________________________________________________ Data di nascita__________________________________ Sesso M F Codice Fiscale ____________________________________________________________________________________ Residente a ___________________________________________________________ Tel. _____________________ Regione _________________________________________________________________________________________ AUSL di residenza ______________________________ Prov. ____________________________________________ Medico di Medicina Generale _______________________________________________________________________ Piano terapeutico Farmaco prescritto_________________________________________ Dosaggio____________________________ Prima prescrizione Cambio posologia/trattamento Durata prevista del trattamento _______________________ Prosecuzione cura Prescrizione conforme alla D.G.R.n.255/09 (P.D.T. per la cura dell’Artrite Reumatoide) Data________________________ Timbro e firma del clinico prescrittore PIANO TERAPEUTICO PER PRESCRIZIONE DI CLOPIDOGREL Centro prescrittore __________________________________________________________ Nome cognome del clinico prescrittore __________________________________________ recapito telefonico _____________ Paziente (nome,cognome) ___________________________________________ età ______ sesso M F tessera sanitaria n° ____________________ Indirizzo _______________________________________________ Tel. ________________ AUSL di residenza___________________________________________________________ La prescrizione di clopidogrel è a carico del SSN solo se rispondente a una delle seguenti condizioni: Sindrome coronarica acuta senza innalzamento del tratto ST (angina instabile o infarto miocardio senza onda Q) in associazione con ASA (trattamento di 6 mesi rinnovabile per 1-2 volte)1 Angioplastica percutanea (PTCA) con applicazione di stent 2,3: non medicato (trattamento di 1 mese in associazione con ASA) medicato (trattamento di 12 mesi in associazione con ASA) Terapia antiaggregante a breve termine per la prevenzione secondaria dell’infarto in associazione con ASA4,5 Terapia antiaggregante a lungo termine per la prevenzione secondaria dell’infarto e dell’ictus, in pazienti per i quali esiste controindicazione a ASA o ticlopidina Dose e durata del trattamento Dose/die: ________________ Durata prevista del trattamento: __________________ Indicare se: Prima prescrizione Prosecuzione della cura (motivo: ……………………………………………..) Data ___/____/____ Timbro e firma del clinico prescrittore PIANO TERAPEUTICO per la prescrizione di Prasugrel nel trattamento della sindrome coronarica acuta Azienda Sanitaria_____________________________________________________________________ Unità Operativa Cardiologica del medico proscrittore _________________________________________ Nome e Cognome del cardiologo prescrittore ________________________________tel. _______________ Paziente (nome,cognome) _______________________________Data di nascita _____________ sesso M F Codice Fiscale ______________________________ Regione ____________________________ Indirizzo _______________________________________________ Tel. ________________ AUSL di residenza___________________________________________________________ La prescrizione di Prasugrel è a carico del SSN nelle seguenti condizioni: Prevenzione di eventi di origine aterotrombotica, trattamento per max12 mesi, in associazione con aspirina, in pazienti con: Sindrome coronarica acuta senza sopraslivellamento ST, sottoposti ad intervento coronarico percutaneo; Infarto miocardico acuto con sopraslivellamento ST, sottoposti ad intervento coronarico percutaneo primario o ritardato. prima prescrizione (per una durata massima di 1 mese) Inizio terapia antiaggregante Proseguimento di altre terapie antiaggreganti Motivo del cambio terapia: inefficacia terapeutica prosecuzione di terapia (max 6 mesi) reazione avversa ulteriore prosecuzione di terapia (a completamento dell’anno di trattamento)) Dose iniziale di carico(specificare): ________________ Dose/die di mantenimento(specificare): __________________ Durata del trattamento(specificare)________________________________________ Data ___/____/____ Timbro e firma del cardiologo prescrittore Ai fini della rimborsabilità da parte del SSN il Piano Terapeutico è a carico delle strutture cardiologiche del SSN o convenzionate con esso SEGNALAZIONE DELLE REAZIONI AVVERSE NELL’USO DEI FARMACI È possibile, e capita con discreta frequenza, che l’uso di un farmaco, da solo o in associazione, possa determinare delle reazioni avverse presumibilmente non attese o non attese nella importanza poi rilevata.Tanto accade in diverse occasioni e circostanze ed è importante rilevare le reazioni avverse verificatesi e comunicarle. L’esperienza del fatto va raccolta al fine di migliorare la sicurezza terapeutica e giungere sempre più ad un equilibrio favorevole nel bilancio tra l’azione benefica del medicamento e gli effetti collaterali che si verificano.Si parla di effetti avversi per distinguerli più propriamente dalla semplice manifestazione allergica pur importante e da rilevarsi.Vengono ad evidenziarsi in realtà effetti farmacologicamente attivi e palesi in soggetti con diversi corredi genetici che altrimenti non sono stati prima resi noti. La buona riuscita terapeutica deve tenere in conto la più antica delle prescrizioni mediche “primo non nuocere”. Le comunicazioni di reazioni avverse vanno fatte al servizio di farmacovigilanza della ASL che le inoltra all’AIFA, secondo quanto disposto dal codice comunitario Dlgs 219 del 24.06.2006 titolo IX farmacovigilanza. L’insieme delle comunicazioni possono far modificare le schede informative dei farmaci, far aumentare le precauzioni d’uso o far finanche ritirare il farmaco dal commercio nei casi più gravi e diffusi. Esiste una modulistica predisposta dall’Agenzia Italiana del Farmaco ed introdotta dal DM 12.12.2003 che si riporta di seguito: scheda da compilarsi da parte del paziente che è stato vittima dell’evento sfavorevole scheda destinata all’operatore sanitario (medico, farmacista, infermiere professionale) che ha rilevato la reazione avversa. Il Dlgs del 21.11.2003 ha inoltre istituito l’elenco dei farmaci sottoposti a monitoraggio intensivo, aggiornato semestralmente dall’AIFA, per i quali, come per i vaccini, dovranno essere segnalate tutte le reazioni osservate gravi, non gravi, attese ed inattese. L’elenco e la modulistica potranno essere consultati e scaricati collegandosi al link del sito aziendale: www.aslbat.it/Attività Istituzionali/Farmacovigilanza. Le segnalazioni dovranno essere inviate al Responsabile di Farmacovigilanza della Asl al fax: 0883/483429. MODELLO MINISTERIALE DI SCHEDA DA COMPILARSI A CUR SCHEDA DI SEGNALAZIONE DI REAZIONE AVVERSE destinata al cittadino 1) 2) 3) 4) 5) Quale reazione indesiderata ha osservato? Quando? Quanto è durata? Quali medicinali stava prendendo? Quante volte al di? a) b) c) d) fiale supposte uso locale per bocca _____________________________ _____________________________ _____________________________ _____________________________ _____________________________ _____________________________ 6) Da quanto tempo? a) b) c) d) e) ___________________ ___________________ ___________________ ___________________ ___________________ ___________________ 7) Per quale disturbo? ___________________________________ ___________________________________ ___________________________________ ___________________________________ ___________________________________ ___________________ ___________________ ___________________ ___________________ ___________________ 8) Il farmaco le è stato prescritto dal medico? 9) L'aveva già preso in passato? 10) Ha mai avuto la stessa reazione? 11) Con quale medicinale? 12) Chi è il suo medico curante? (cognome, nome, indirizzo e telefono) _______________________________________________________________ SI SI SI ____________ 13) Lo ha informato? 14) Come è stata curata la reazione? - sospeso il medicinale - ridotta la dose - altre (specificare) SI NO SI SI ____________ NO NO 15) Adesso la reazione è scomparsa? SI NON del tutto NO Completamente Data USL n. _____________________ FIRMA __________________________ _______________________ NO NO NO ____________ Indirizzo e n. tel. del paziente __________________________ _ Osservazioni del medico della USL a cui viene riferito il caso: FIRMA ___________________________ REGIONE PUGLIA AZIENDA SANITARIA LOCALE BAT Scheda per la prescrizione e dispensazione dei farmaci classificati in fascia H OSP2 UNITA’ OPERATIVA__________________________________________________________________________ Il/Sottoscritto/a Dottor/dottoressa__________________________________________________________________ In servizio presso questa Unità operativa dichiara che: IL PAZIENTE_________________________________________________________________Sesso □M □F NATO IL________________ A_______________________________________________ PROV._______________ CODICE FISCALE______________________________________________________________________________ RESIDENTE A_____________________________________ PROV. ________ REGIONE___________________ DIAGNOSI______________________________________________________________________________________ Necessita, per la cura della sua patologia, del farmaco__________________________________________________ Dose giornaliera_______________________________Durata ciclo terapeutico gg___________per max 12 mesi (*) Dichiara, altresì, che il detto ciclo terapeutico, insostituibile, indispensabile e alternativo di ospedalizzazione, sarà effettuato a domicilio del paziente sotto la mia responsabilità dopo aver adeguatamente informato il medico curante ed istruito il paziente sulle modalità di somministrazione e possibili effetti collaterali che potrebbero richiedere un cambiamento della posologia o una interruzione della terapia stessa. Dichiara, inoltre di aver acquisito agli atti il consenso informato del paziente e l’autorizzazione al trattamento dei dati personali. L. 675/1996. IL MEDICO PRESCRITTORE (Timbro e firma) Il farmacista, come indicato dal medico proscrittore della sopra indicata U.O., □ consegna il farmaco prescritto □ non può erogare il farmaco prescritto per la seguente motivazione________________________________________ IL FARMACISTA (Timbro e firma) CONSEGNA DEL FARMACO (max 30 gg di terapia) N. Data Specialità Quantità consegnata Firma per ricevuta Documento (*) Non oltre i 12 mesi. Per l’eventuale proseguimento della terapia, redigere un nuovo modulo. Firma e timbro del farmacista Medicinali a totale carico del SSN ai sensi della Legge 648/96. (www.Aifa.it/informazione,Sperimentazione e Ricerca/Sperimentazione clinica/Legge 648/96) Questa sezione è stata predisposta per rendere facilmente accessibili tutti gli atti, normativi ed amministrativi, emanati in merito all'art. 1, comma 4, della legge 648/96 e verrà costantemente aggiornata. Comunicato sull'ambito di applicazione dell'art.1, comma 4, DL 536/96, convertito dalla legge 648/96. Che cosa è la L. 648/96? E' una legge che consente di erogare a carico del S.S.N., quando non vi è alternativa terapeutica valida, previo parere della CUF (ora Commissione consultiva Tecnico Scientifica dell’AIFA - CTS): 1. medicinali innovativi in commercio in altri Stati ma non sul territorio nazionale; 2. medicinali ancora non autorizzati ma sottoposti a Sperimentazione clinica; 3. medicinali da impiegare per una indicazione terapeutica diversa da quella autorizzata. I medicinali che acquisiscono parere favorevole dalla CTS vengono inseriti in un elenco. L'elenco è visionabile in questa sezione insieme ai provvedimenti/determinazioni nei quali sono indicate le condizioni e le modalità d'uso dei singoli medicinali. Un elenco (aggiornato a maggio 2008) riepilogativo dei medicinali riporta le relative indicazioni terapeutiche e i riferimenti della G.U. in cui trovare i provvedimenti/determinazioni di inclusione completi. Come si può accedere alla L. 648/96? Le modalità per accedere alla legge sono indicate nel provvedimento CUF datato 20 luglio 2000 (art. 2). Cosa deve fare chi utilizza i medicinali della L. 648/96? A. Attenersi alle indicazioni riportate nel provvedimento/determinazione di inserimento specifico per ogni medicinale nel rispetto di quanto previsto nel provvedimento CUF 20 luglio 2000 in merito a: - art. 4: rilevamento e trasmissione dei dati di monitoraggio clinico ed informazioni relative a sospensioni del trattamento; - art. 5: acquisizione del consenso informato, modalità di prescrizione e di dispensazione del medicinale; - art. 6: rilevamento e trasmissione dei dati di spesa. B. Utilizzare, per la trasmissione all’AIFA, le schede predisposte per: a) parametri clinici (provvedimento 31.01.2001) b) dati di spesa (provvedimento 20.07.2000). Elenco Medicinali A-E Acido cis-retinoico Trattamento adiuvante neuroblastoma stadio 3° e 4° G. U. 19.09.2000 n. 219 Errata Corrige 04.10.2000 n.232 Adalimumab Trattamento di pazienti con uveite severa refrattaria correlata ad Artrite Idiopatica Giovanile, che abbiano dimostrato intolleranza o resistenza al trattamento con infliximab G. U. 07.02.2007 n. 31 Rettifica G.U. 19.04.2007 n. 91 Adenosin-deaminasi (Adagen) Immunodeficienza combinata grave da deficit di adenosindeaminasi G. U. 03.03.1999 n. 51 Azacitidina (Vidaza) Trattamento di pazienti adulti non eleggibili al trapianto di cellule staminali emopoietiche con: sindromi mielodisplastiche (SMD) a rischio intermedio-2 e alto secondo l’International Prognosis Scoring System (IPSS), leucemia mielomonocitica cronica (LMMC) con il 10-29% di blasti midollari senza disordine mieloproliferativo, leucemia mieloide acuta (LMA) con 20-30% di blasti e displasia multilineare, secondo la classificazione dell’Organizzazione Mondiale della Sanità (OMS). G.U. n. 86 del 14/4/09 Bevacizumab (Avastin) Trattamento delle maculopatie essudative non correlate all'età, Trattamento delle maculopatie essudative correlate all'età già in trattamento con bevacizumab, Trattamento del glaucoma neovascolare. G.U. 16.03.2009 n. 62 Biotina Deficit multiplo di carbossilasi nelle due forme: deficit di biotinidasi, deficit di olocarbossilasi sintetasi G. U. 10.02.2001 n. 34 Bortezomib (Velcade) In combinazione con desametasone per il trattamento dei pazienti affetti da Mieloma Multiplo refrattario/recidivato. G.U. n. 142 del 22/6/09 Cetuximab Trattamento di carcinomi squamocellulari recidivanti e/o metastatici del distretto testa-collo, come terapia di prima linea in combinazione con cisplatino e 5-fluorouracile. G. U. 12.12.2008 n. 290 Ciclosporina A Nefrite lupica G. U. 20.12.1999 n. 297 Eculizumab (Soliris) Trattamento dell'emolisi intravascolare dei pazienti con EPN che non abbiano effettuato precedenti trasfusioni. G.U. 12.12.2008 n. 290 Epoetina alfa e beta Emoglobinuria parossistica notturna G. U. 11.03.1998 n. 58 Epoetina alfa e beta Sindromi mielodisplastiche G. U. 10.03.2000 n. 58 Elenco medicinali F-M Gemtuzumab ozogamicin (Mylotarg) Trattamento della leucemia mieloide acuta in combinazione con chemioterapia standard di induzione. G.U. n. 130 dell’8/4/09 Idebenone (Mnesis) Trattamento della miocardiopatia nei pazienti affetti da Atassia di Friedreich. G.U. 9/05/09 n. 106 Idrossiurea Trattamento di pazienti con beta talassemia non trasfusione-dipendente e con sindromi falcemiche che presentino una sintomatologia grave e/o invalidante G.U. 9/06/06 n. 132 Idursulfase (Elaprase) Trattamento di pazienti con mucopolisaccaridosi di tipo II (MPS II – Sindrome di Hunter) G.U. 17/06/06 n. 139 Infliximab Trattamento di pazienti con uveite severa refrattaria correlata ad Artrite Idiopatica Giovanile G. U. 07.02.2007 n.31 Rettifica G.U. 19.04.2007 n. 91 Interferone alfa-2b Micosi fungoide G. U. 14.04.2003 n.87 Interferone alfa ricombinante Trattamento della trombocitemia essenziale per i pazienti non candidabili ai trattamenti ora disponibili sul mercato G.U. 28.05.2007 n. 122 Interferone alfa ricombinante Particolari Emangiomi G. U. 02.03.1999 n. 50 Interferone alfa ricombinante Forme refrattarie M. Behçet G. U. 21.04.99 n.92 Interferone gamma Fibrosi polmonare idiopatica G. U. 15.06.2000 n. 138 Lamivudina Profilassi della recidiva di epatite HBV correlata dopo trapianto di fegato, nei pazienti HBV-DNA positivi prima del trapianto, in associazione alle Ig G specifiche G. U. 19.09.2000 n. 219 L-Arginina Patologie conseguenti a difetti enzimatici del ciclo dell'urea G. U. 10.03.00 n.58 Lenalidomide Trattamento di pazienti anemici trasfusione-dipendenti, con sindrome mielodisplastica a rischio basso o intermedio -1, portatori di delezione 5q- associata o meno ad altre anomalie cromosomiche. G. U. 11.11.2008 n. 264 Metotrexato Trattamento medico della gravidanza ectopica G. U. 21.01.2008 n. 17 Micofenolato mofetile Malattia "trapianto verso ospite", acuta e cronica, resistente o intollerante tratt. 1° e 2° linea, dopo trapianto allogenico di cellule staminali emopoietiche G. U. 19.09.2000 n. 219 Mitotane (Lysodren) Sindrome di Cushing grave G. U. 05.09.2000 n. 207 Elenco medicinali N-Z Octreotide Acetato Diarrea secretoria refrattaria G. U. 15.07.2005 n. 163 Octreotide Ipotensione ortostatica grave in disfunzioni generalizzate del Sistema Nervoso Vegetativo G. U. 15.06.2000 n. 138 Octreotide Acetato Fistole pancreatiche G. U. 15.07.2005 n. 163 Octreotide formulazione a rilascio prolungato Angiomatosi non suscettibile di altri trattamenti farmacologici e/o asportazione chirurgica G. U. 24.03.2001 n. 70 Plerixafor (Mozobil) In combinazione con G-CSF per incrementare la mobilizzazione delle cellule staminali ematopoietiche al sangue periferico per la raccolta e il conseguente trapianto autologo in pazienti con linfoma o mieloma multiplo che mobilizzano scarsamente G. U. n. 223 del 25/09/09 Ribavirina Terapia della recidiva da HCV in pazienti sottoposti a trapianto di fegato per epatopatia cronica C G. U. 20.12.1999 n. 297 Ribavirina Terapia dell’epatite cronica e della cirrosi compensata da virus dell’epatite C, in combinazione con gli interferoni peghilati, nei pazienti con talassemia major o talassemia intermedia che necessitano di terapia trasfusionale G.U. n. 208 dell’08/09/2009 Tetraidrobiopterina Iperfenilalaninemia da carenza congenita di 6-piruvoiltetraidropterina sintetasi G. U. 02.12.1998 n. 282 Tiopronina Cistinuria in associazione all'alcalinizzazione delle urine G. U. 06.04.2001 n. 81 Trientine diidrocloridrato Trattamento del Morbo di Wilson per i pazienti non candidabili o non rispondenti al trattamento con zinco acetato. G. U. 09.05.2008 n. 108 Valganciclovir Trattamento "pre-emptive" dell’infezione da CMV in pazienti sottoposti a trapianto di midollo osseo o di cellule staminali emopoietiche. G. U. 21.01.2008 n. 17 Zinco solfato Trattamento del Morbo di Wilson per pazienti non candidabili o non rispondenti al trattamento con zinco acetato. G. U. 23.04.2008 n. 96 Errata Corrige 03.05.2008 n. 103 REGIONE PUGLIA AZIENDA SANITARIA LOCALE BAT Scheda per la prescrizione e dispensazione dei farmaci ai sensi della Legge 648/96 UNITA’ OPERATIVA__________________________________________________________________________ Il/Sottoscritto/a Dottor/dottoressa__________________________________________________________________ In servizio presso questa Unità operativa dichiara che: IL PAZIENTE_________________________________________________________________Sesso □M □F NATO IL________________ A_______________________________________________ PROV._______________ CODICE FISCALE______________________________________________________________________________ RESIDENTE A_____________________________________ PROV. ________ REGIONE___________________ DIAGNOSI______________________________________________________________________________________ Necessita, per la cura della sua patologia, del farmaco__________________________________________________ Dose giornaliera_______________________________Durata ciclo terapeutico gg___________per max 12 mesi (*) Dichiara, altresì, che il detto ciclo terapeutico, insostituibile, indispensabile e alternativo di ospedalizzazione, sarà effettuato a domicilio del paziente sotto la mia responsabilità dopo aver adeguatamente informato il medico curante ed istruito il paziente sulle modalità di somministrazione e possibili effetti collaterali che potrebbero richiedere un cambiamento della posologia o una interruzione della terapia stessa. Dichiara, inoltre di aver acquisito agli atti il consenso informato del paziente e l’autorizzazione al trattamento dei dati personali. L. 675/1996. IL MEDICO PRESCRITTORE (Timbro e firma) Il farmacista, come indicato dal medico proscrittore della sopra indicata U.O., □ consegna il farmaco prescritto □ non può erogare il farmaco prescritto per la seguente motivazione________________________________________ IL FARMACISTA (Timbro e firma) CONSEGNA DEL FARMACO (max 30 gg di terapia) N. Data Specialità Quantità consegnata Firma per ricevuta Documento (*) Non oltre i 12 mesi. Per l’eventuale proseguimento della terapia, redigere un nuovo modulo. Firma e timbro del farmacista PRESCRIZIONE DI MEDICINALI “OFF LABEL” La Deliberazione della G.R. del 26 febbraio 2007, n.178 (Adempimenti ex art.1, comma 796,lettera Z, della Legge 27 dicembre 2006, n. 296 -Legge finanziaria 2007-) dispone in materia di prescrizione di medicinali “off label” e cioè al di fuori delle indicazioni o modalità d’uso o posologia per le quali il medicinale è stato autorizzato all’immissione in commercio. Si riporta uno stralcio del suddetto provvedimento: art. 2 qualora il farmaco debba essere utilizzato nell’ambito di strutture ospedaliere il medico può prescrivere per singoli e rari casi, sotto la sua diretta responsabilita e previsainformazione del paziente e acquisizione del consenso dello stesso, i farmaci oggetto del presente regolamento, in conformità delle disposizioni vigenti, art. 3 la prescrizione su apposito modello, deve essere autorizzata dal Direttore Sanitario della Azienda Sanitaria di appartenenza; art.4 a tale richiesta devono essere allegati: consenso informato del paziente/documentazione di mancanza di valida alternativa terapeutica/letteratura scientifica che documenti l’uso consolidato del farmaco conformemente a Linee Guida o lavori apparsi su pubblicazioni accreditate in campo internazionale; art.5 la responsabilità della corretta applicazione della normativa riguardante l’utilizzo di terapie farmacologiche con modalità o indicazioni diverse da quelle autorizzate a carico del SSN è attribuita al Direttore Sanitario delle Aziende Sanitarie Locali, delle Aziende Ospedaliere, delle Aziende Ospedaliere Universitarie e degli IRCSS. Art.6 il Direttore Sanitario può avvalersi come organo consultivo del Comitato Etico Aziendale REGIONE PUGLIA Azienda Sanitaria Locale BAT Unità Operativa __________________________________________ data ____________________ Alla U.O. Farmacia ________________________________________________________________ Oggetto: Richiesta di fornitura di medicinali prodotti industrialmente per impiego diverso da quello autorizzato “OFF LABEL” (comma 2 art 3 del D.L. 17 Febbraio 1998 n. 23. Legge di conversione 8 Aprile 1998 n. 94). Il sottoscritto Dr. __________________________________________________________________ chiede la fornitura della seguente specialità medicinale per l’uso diverso da quello autorizzato: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ per il paziente _________________________________________________ (iniziali) ___________ quantità richiesta __________________________________________________________________ (indicare quantità e forma farmaceutica - es. fiale, compresse, ecc) posologia ______________________________________________________ per n. giorni _______ Dichiara che l’impiego avverrà sotto la sua diretta e personale responsabilità per la seguente indicazione: ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Dichiara inoltre di aver ottenuto o che otterrà il consenso informato del paziente al trattamento. Il Medico dell’U.O. Il Primario dell’U.O. (firma per esteso e timbro) (firma per esteso e timbro) N.B. – (comma 2 art. 3 del D.L. 17 Febbraio 1998 n. 23. Legge di conversione 8 Aprile 1998 n. 94) In singoli casi il Medico può, sotto la sua diretta responsabilità e previa informazione del paziente e acquisizione del consenso dello stesso, impiegare un medicinale prodotto industrialmente per una indicazione o una via di somministrazione o una modalità di somministrazione o di utilizzazione diversa da quella autorizzata. Qualora il Medico stesso ritenga, in base a dati documentabili, che il paziente non possa essere utilmente trattato con i medicinali per i quali sia già approvata quella indicazione terapeutica o quella via di somministrazione e purché tale impiego sia noto e conforme a lavori apparsi su pubblicazioni scientifiche accreditate in campo nazionale. MEDICINALI ESTERI PER USO UMANO NON AUTORIZZATI ITALIA (D.M. 11/02/1997 e D.M. 16/11/2007) IN I centri specialistici ospedalieri competenti, valutata la indispensabilità ed insostituibilità della prescrizione, la certificano e predispongono la documentazione necessaria (richiesta di importazione, consenso informato del paziente da cui si evinca la consapevolezza di assenza di alternative terapeutiche e la circostanza che trattasi di farmaco non registrato in Italia, piano terapeutico con assunzione di responsabilità da parte del medico) ed inviano la richiesta alla farmacia del P.O. MODULISTICA PER RICHIESTE INDIRIZZATE ALLA FARMACIA DEL P.O. modulo richiesta nominativa modulo richiesta gabesato mesilato modulo richiesta di soluzioni di Cloruro di Potassio e di soluzioni contenenti Potassio modulo richiesta albumina RICHIESTA PER L’INSERIMENTO DI NUOVI FARMACI NEL P.T.A. La possibilità di inserire nuovi farmaci nel prontuario è connessa allo sviluppo della ricerca e alla realizzazione di farmaci con più favorevole rapporto costo/beneficio. All’uopo è previsto un modulo da inviare presso la segreteria della commissione aziendale apposita che è posta nell’ambito della Direzione Sanitaria Aziendale. REGIONE PUGLIA AZIENDA SANITARIA BAT MODULO PER LA RICHIESTA DI INSERIMENTO DI UN NUOVO FARMACO/FORMULAZIONE NEL PRONTUARIO TERAPEUTICO AZIENDALE Alla SEGRETERIA SCIENTIFICA della COMMISSIONE TERAPEUTICA AZIENDALE c/o Direzione Sanitaria Aziendale Via Fornaci, 201 – Andria PRESIDIO OSPEDALIERO_____________________________________________________________ UNITA’ OPERATIVA___________________________________________________________________ NOME COMMERCIALE_________________________________________________________________ PRINCIPIO ATTIVO______________________________________________COD ATC______________ FORMULAZIONE______________________________________________________________________ DOSAGGIO___________________________________________________________________________ INDICAZIONI TERAPEUTICA______________________________________________________________ ______________________________________________________________________________________ _____________________________________________________________________________________ CLASSIFICAZIONE A.I.F.A.______________________________________________________________ FARMACI COMPARABILI GIA’ PRESENTI NEL PTO__________________________________________ _____________________________________________________________________________________ MOTIVAZIONI CLINICHE GENERALI PER L’USO DEL FARMACO_______________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ VANTAGGI CLINICI E/O ORGANIZZATIVI RISPETTO AAL PROTOCOLLO TERAPEUTICO IN USO_______________________________________________________________________ ______________________________________________________________________________ VALUTAZIONI FARMACO-ECONOMICHE____________________________________________ ______________________________________________________________________________ ______________________________________________________________________________ POTENZIALI RISCHI ASSOCIATI AL TRATTAMENTO__________________________________________ FARMACO SUPERATO O EQUIVALENTI DA ELIMINARE DAL PTO_______________________________ Si allegano due studi clinici controllati condotti secondo validi criteri metodologici ed Eventuali referenze bibliografiche di linee-guida nazionali e/o internazionali. Data_________________________
Scarica