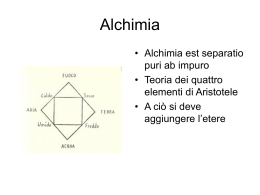
AVOGADRO: LA CHIMICA E LA SCIENZA DEL SUO TEMPO Bolis Chiara, Pora Stela, Ricci Eleonora, Sabatini Laura Classe IV D, Liceo Scientifico N. Rodolico Firenze L'Alchimia è un'antica pratica proto-scientifica che combina elementi di chimica, fisica, astrologia, arte, semiotica, metallurgia, medicina, misticismo e religione. Vi sono tre grandi obiettivi che si propongono gli alchimisti. Il più importante traguardo dell'alchimia è la trasmutazione dei metalli in oro o argento. Essi tentarono di creare la panacea universale, un rimedio che dovrebbe curare tutte le malattie e prolungare indefinitamente la vita. La pietra filosofale era la chiave per questi obiettivi. Questa mitica sostanza, che potrebbe essere una polvere, un liquido o una pietra, avrebbe avuto il potere di rendere possibili entrambe. Il terzo obiettivo consisteva nel creare la vita. L'alchimia può essere considerata come il precursore della scienza moderna della chimica prima della formulazione del metodo scientifico. L'alchimia, oltre ad essere una disciplina fisica e chimica, implicava un'esperienza di crescita ed un processo di liberazione e di salvezza dell'artefice dell'esperimento. In quest'ottica la scienza alchemica veniva metafisicizzata e sacralizzata, assumendo connotati mistici e soteriologici. Cosicchè i processi e simboli alchemici posseggono sovente un significato interiore relativo allo sviluppo spirituale in connessione con quello prettamente materiale della trasformazione fisica. Per comprendere gli alchimisti, bisogna considerare come la conversione di una sostanza in un'altra, sarebbe dovuta sembrare magica in una cultura senza alcuna conoscenza formale di fisica o chimica. Per gli alchimisti non vi era ragione alcuna di separare la dimensione materiale da quella simbolica o filosofica. In quei tempi una fisica priva di una componente metafisica sarebbe stata parziale ed incompleta al pari di una metafisica sprovvista di manifestazione fisica. La trasmutazione dei metalli di base in oro simbolizza un tentativo di arrivare alla perfezione e superare gli ultimi confini dell'esistenza. Gli alchimisti credevano che l'intero universo stesse tendendo verso uno stato di perfezione, e l'oro, per la sua intrinseca natura di incorruttibilità, era considerato la più perfetta delle sostanze. La scienza dell'alchimia ebbe inoltre una notevole evoluzione nel tempo, iniziando quasi come un'appendice metallurgico-medicinale della religione, maturando in un ricco coacervo di studi, trasformandosi nel misticismo ed alla fine fornendo alcune delle fondamentali conoscenze empiriche nel campo della chimica e della medicina moderne. Fino al XVIII secolo, l'alchimia era considerata una scienza seria in Europa; per esempio, Isaac Newton impiegò molto più tempo allo studio dell'alchimia piuttosto che a quello dedicato all'ottica o alla fisica, per le quali è famoso. Il declino dell'alchimia iniziò nel XVIII secolo con la nascita della chimica moderna, che fornì una più precisa e reale struttura per le trasmutazioni della materia, e la medicina, con un nuovo grande disegno dell'universo basato sul materialismo razionale. La storia dell'alchimia è diventata un prolifico campo per speculazioni accademiche. Via via che l'ermetico linguaggio degli alchimisti andava gradatamente decifrato, gli storici hanno cominciato a trovare connessioni intellettuali tra quella disciplina ed altre componenti della storia culturale occidentale, come le società mistiche, del tipo di quella dei Rosacroce, la stregoneria e naturalmente l'evoluzione della scienza e della filosofia. Alchimia nell'antico Egitto Gli alchimisti occidentali generalmente fanno risalire l'origine della loro arte all'antico Egitto. La città di Alessandria in Egitto fu un centro di conoscenza alchemica, e conservò la propria preminenza fino al declino della cultura egiziana antica. Sfortunatamente non esistono documenti originali egizi sull'alchimia. Questi scritti, qualora fossero esistiti, andarono perduti nell'incendio della Biblioteca di Alessandria, nel 391. La leggenda vuole che il fondatore dell'alchimia egiziana fu il dio Thot, chiamato Hermes-Thoth o Hermes il tre volte grande (Ermes Trismegisto) dai Greci. Secondo la leggenda il dio avrebbe scritto i quarantadue libri della conoscenza, che avrebbero coperto tutti i campi dello scibile, fra cui anche l'alchimia. Il simbolo di Ermes era il caduceo, che divenne uno dei principali simboli alchemici. La Tavola di Smeraldo di Hermes Trismegistus, che è nota solamente attraverso traduzioni greche ed arabe, è generalmente considerata la base per la pratica e la filosofia alchemica occidentale. Alchimia grecoalessandrina Le dottrine alchimistiche della scuola greca passarono attraverso tre fasi evolutive: l'alchimia come tecnica, cioè l'arte prechimica degli artigiani egizi, l'alchimia come filosofia ed infine quella religiosa. I Greci si appropriarono delle dottrine ermetiche degli Egiziani, mescolandole, nell'ambiente sincretistico della cultura alessandrina, con le filosofie del Pitagorismo e della scuola ionica e successivamente dello Gnosticismo. La filosofia pitagorica consiste essenzialmente nella credenza che i numeri governino l'universo e che siano l'essenza di tutte le cose, dal suono alle forme. Il pensiero della scuola ionica era basato sulla ricerca di un principio unico e originario per tutti i fenomeni naturali; questa filosofia, i cui esponenti principali furono Talete ed Anassimandro, fu poi sviluppata da Platone ed Aristotele, le cui opere finirono per diventare parte integrante dell'alchimia. Si delinea, come base della nuova scienza, la nozione di una materia prima che forma l'universo, e che può essere spiegata solamente attraverso attente esplorazioni filosofiche. Un concetto molto importante, introdotto in quel tempo da Empedocle, è che tutte le cose nell'universo erano formate solamente da quattro elementi: terra, aria, acqua e fuoco. A questi elementi Aristotele aggiunge l'etere, la materia di cui sono formati i cieli e che viene denominata quintessenza. La terza fase si differenzia dalla precedente di speculazione filosofica per le caratteristiche di una religione esoterica, per l'abbondanza di rituali misterici e per il linguaggio. Nei primi secoli dell'età imperiale, in età ellenistica, si sviluppò una letteratura di carattere filosofico-soteriologico-religiosa. Il supporto dottrinale di questa letteratura è una forma di metafisica che si rifà al Neoplatonismo ed al Neopitagorismo. Alchimia nell'Europa medievale L'Occidente riprende contatto con la tradizione alchimistica greca attraverso gli Arabi. L'incontro tra la cultura alchimistica araba ed il mondo latino avviene per la prima volta in Spagna, probabilmente ad opera di Gerberto di Aurillac, che più tardi divenne Papa Silvestro II. Il materiale alchimistico dei testi arabi verrà rielaborato durante tutto il XIII secolo. A Tommaso d'Aquino vengono attribuiti alcuni opuscoli alchemici, nei quali è dichiarata la possibilità della produzione dell'oro e dell'argento. Il primo vero alchimista dell'Europa medievale deve essere considerato Roger Bacon un Francescano che esplorò i campi dell'ottica e della linguistica oltre agli studi alchemici. Le sue opere, oltre ai numerosi pseudo-epigrafi a lui attribuiti, furono utilizzate dagli alchimisti dal XV al XIX secolo. Alla fine del XIII secolo l'alchimia si sviluppò in un sistema strutturato di credenze, grazie anche all'opera di Arnaldo da Villanova, con il suo Rosarium Philosophorum, e soprattutto con Raimondo Lullo, che divenne presto una leggenda per la sua presunta abilità alchemica. Nel XIV secolo l'alchimia ebbe una flessione a causa dell'editto di Papa Giovanni XXII, che vietava la pratica alchemica, fatto che scoraggiò gli alchimisti appartenenti alla Chiesa dal continuare gli esperimenti. L'alchimia fu comunque tenuta viva da uomini come Nicholas Flamel, il quale è degno di nota solamente perché fu uno dei pochi alchimisti a scrivere in questi tempi travagliati. Nell'alto medioevo gli alchimisti si concentrarono nella ricerca dell'elisir della giovinezza e della pietra filosofale, credendo che fossero entità separate. In quel periodo molti di loro interpretavano la purificazione dell'anima in connessione con la trasmutazione del piombo in oro. Alchimia nel Rinascimento e nell'età moderna In questo periodo magia e medicina, alchimia e scienze naturali e addirittura astrologia e astronomia operano in una sorta di simbiosi, legate le une alle altre in modo spesso inestricabile. Agli inizi del XVI secolo uno dei maggiori interpreti di questo coacervo di discipline scientifiche fu il medico, astrologo, filosofo e alchimista Heinrich Cornelius Agrippa von Nettesheim. La sua influenza fu di modesta entità, ma come Flamel, produsse opere alle quali fecero riferimento tutti gli alchimisti posteriori. Fece molto per cambiare l'alchimia da una filosofia mistica ad una magia occultista. Inoltre mantenne vive le filosofie degli antichi alchimisti, che includevano scienza sperimentale, numerologia, ecc., aggiungendovi la teoria magica, che rinforzava l'idea di alchimia come credenza occultista. Il nome più importante di questo periodo è, senza dubbio, Paracelso, il quale diede una nuova forma all'alchimia, spazzando via un certo occultismo che si era accumulato negli anni e promuovendo l'utilizzo di osservazioni empiriche ed esperimenti tesi a comprendere il corpo umano. La iatrochimica di Paracelso era basata sulla teoria che il corpo umano fosse un sistema chimico nel quale giocano un ruolo fondamentale i due tradizionali principi degli alchimisti, e cioè lo zolfo ed il mercurio, ai quali lo scienziato ne aggiunse un terzo: il sale. Paracelso era convinto che l'origine delle malattie fosse da ricercare nello squilibrio di questi principi chimici e non dalla disarmonia degli umori, come pensavano i galenici. Quindi, secondo lui, la salute poteva essere ristabilita utilizzando rimedi di natura minerale e non di natura organica. Anche molte personalità politiche del periodo si interessarono all'alchimia. Tra questi: Caterina Sforza e suo nipote Cosimo I de' Medici. Il declino dell'alchimia occidentale Il declino dell'alchimia in Occidente fu causato dalla nascita della scienza moderna con i suoi richiami a rigorose sperimentazioni scientifiche. Nel XVII secolo Robert Boyle (foto a destra) diede l'avvio al metodo scientifico nelle investigazioni chimiche, alla base di un nuovo approccio alla comprensione della trasformazione della materia, che di fatto rivelò la futilità delle ricerche alchemiche della pietra filosofale. Anche gli enormi passi avanti compiuti dalla medicina nel periodo seguente la iatrochimica di Paracelso, supportati dagli sviluppi paralleli della chimica organica, diedero un duro colpo alle speranze dell'alchimia di reperire elisir miracolosi, mostrando l'inefficacia se non la tossicità dei suoi rimedi. Nel 1772 un nobiluomo francese, Antoine Lavoisier cominciò a dedicarsi a esperimenti sulla combustione. Pesando gli oggetti prima e dopo la combustione egli constatò che, bruciando, acquistavano peso. Egli osservò, inoltre, che facendo avvenire la combustione dentro un recipiente chiuso non aveva luogo alcun cambiamento di peso. Anche se le sostanze contenute nel recipiente mutavano di forma, il loro peso complessivo rimaneva, al termine della combustione, identico a quello misurato in precedenza. Non vi erano prove che venisse ceduto il flogisto, anzi gli esperimenti stavano a indicare che una sostanza, bruciando, acquista qualche cosa dall'aria. Il peso acquistato dal campione che bruciava era identico a quello perduto dall'aria; pertanto, effettuando la combustione in recipiente chiuso, non si registrava mutamento risultante di peso. Basandosi su queste e su altre osservazioni Lavoisier formulò l'ipotesi che il ruolo dell'aria nel corso della combustione non consistesse nell'asportare il flogisto, bensì nel fornire ossigeno. Se un oggetto brucia viene allontanato ossigeno dall'aria, ed esso viene incorporato nell'oggetto che brucia. In verità non vi è motivo di ritenere che il flogisto esista. L'essersi basato su esperimenti attentamente controllati, servendosi di determinazioni quantitative, ha meritato a Lavoisier la fama di padre della chimica moderna. Ridotta ad un arcano sistema filosofico, scarsamente connesso al mondo materiale, l'Ars magna subì il fato comune di altre discipline esoteriche quali l'astrologia e la cabala; esclusa dagli studi universitari e ostracizzata dagli scienziati, si cominciò a guardare ad essa come l'epitome della superstizione. Dopo aver goduto per più di duemila anni di un così grande prestigio intellettuale e materiale, l'alchimia uscì in tal modo dall'universo del pensiero occidentale, salvo ricomparire nelle opere di studiosi a cavallo tra scienza, filosofia ed esoterismo, quali lo psicanalista Carl Gustav Jung e il pensatore Julius Evola. Amedeo Avogadro Nato in un'antica famiglia nobile piemontese, Amedeo Avogadro fu un brillante studente, si laureò molto giovane (20 anni) in diritto ecclesiastico e iniziò a praticare. Comunque, poco dopo si dedicò allo studio della fisica e della matematica, le sue scienze preferite, e nel 1809 cominciò a insegnarle al liceo di Vercelli (dove la sua famiglia aveva dei possedimenti). Durante la sua permanenza a Vercelli scrisse una memoria nella quale dichiarava un'ipotesi che viene oggi chiamata Legge di Avogadro: Spedì questa memoria al «Journal de Physique, de Chemie et d'Histoire naturelle di De Lamétherie» e venne pubblicata nell'edizione del 14 luglio 1811 con il titolo Essai d'une manière de déterminer les masses relatives des molecules élémentaires des corps, et les proportions selon lesquelles elles entrent dans ces combinaisons. La Legge di Avogadro implica che le relazioni tra i pesi di volumi identici di gas differenti (a temperatura e pressione uguale), corrispondono alle relazioni tra i rispettivi pesi molecolari. Quindi, i pesi molecolari relativi, possono essere calcolati dal peso dei gas. Avogadro sviluppò questa ipotesi dopo che Joseph Louis GayLussac pubblicò la sua legge sui volumi (e i gas combinati) nel 1808. La principale difficoltà che Avogadro dovette risolvere fu la grande confusione che regnava al tempo su atomi e molecole – uno dei più importanti contributi del lavoro di Avogadro fu quello di distinguere gli uni dalle altre, ammettendo che anche particelle semplici potevano essere composte da molecole, e che queste ultime sono composte da atomi. John Dalton, ad esempio, non considerava questa possibilità. Avogadro in realtà non usò la parola "atomo" in quanto i termini "atomo" e "molecola" erano usati in maniera quasi indistinta. Egli considerava l'esistenza di tre tipi di "molecole", comprese le "molecole elementari" (i nostri "atomi"). Oltre a ciò, diede una particolare attenzione alla definizione di massa, come distinta dal peso. Nel 1814 pubblicò Mémoire sur les masses relatives des molécules des corps simples, ou densités présumées de leur gaz, et sur la constitution de quelques-uns de leur composés, pour servir de suite à l'Essai sur le même sujet, publié dans le Journal de Physique, juillet 1811, sulla densità dei gas. Nel 1820 divenne professore all'Università di Torino; nel 1821 pubblicò un'altra memoria, Nouvelles considérations sur la théorie des proportions déterminées dans les combinaisons, et sur la détermination des masses des molécules des corps e poco dopo Mémoire sur la manière de ramener les composès organiques aux lois ordinaires des proportions déterminées. Con sospetto entusiasmo, prese parte ai movimenti politici rivoluzionari del 1821 (contro il re di Sardegna), cosicché due anni dopo venne rimosso dalla sua posizione (o, come venne dichiarato ufficialmente, l'università era lieta di permettere a questo interessante scienziato, di prendere una pausa di riposo dai pesanti doveri dell'insegnamento, in modo da essere in grado di dare una migliore attenzione alle sue ricerche). Comunque, con il tempo il suo isolamento politico venne gradualmente ridotto, in quanto le idee rivoluzionarie ricevevano una crescente attenzione da parte di casa Savoia, fino a quando nel 1848 Carlo Alberto emise una costituzione moderna (lo Statuto Albertino). Ben prima di ciò (1833), a seguito della crescente attenzione per i suoi lavori, Avogadro venne richiamato all'Università di Torino, dove insegnò per altri venti anni. Nel 1841 completò e pubblicò il suo lavoro in 4 volumi: Fisica dei corpi ponderabili, ossia Trattato della costituzione materiale de' corpi. Molto poco si sa della sua vita privata e della sua attività politica; nonostante il suo aspetto sgradevole (almeno a giudicare dalle rare immagini trovate), era conosciuto come un discreto tombeur de femmes anche se uomo religioso e devoto a una vita sobria. Ebbe sei figli. Molti studi storici confermano che patrocinò e aiutò alcuni cospiratori sardi che stavano organizzando una rivoluzione sull'isola, bloccata all'ultimo momento dalla concessione dello statuto da parte di Carlo Alberto. Alcuni dubbi comunque permangono, considerando l'esiguità delle prove. Avogadro occupò incarichi pubblici in statistica, meteorologia, e pesi e misure (introdusse il sistema metrico decimale in Piemonte) e fu un membro del Reale Concilio Superiore sulla Pubblica Istruzione. La comunità scientifica non riservò grande attenzione alle sue teorie, quindi l'ipotesi di Avogadro non fu accettata immediatamente quando fu annunciata. André-Marie Ampère fu in grado, tre anni dopo, di ottenere lo stesso risultato, con un altro metodo (nel suo Sur la détermination des proportions dans lesquelles les corps se combinent d'après le nombre et la disposition respective des molécules dont leurs particules intégrantes sont composées), ma lo stesso sguardo indifferente fu dato anche alle sue teorie. Solamente con gli studi di Gerhardt, Laurent e Williamson sulla chimica organica, fu possibile dimostrare che la Legge di Avogadro era indispensabile a spiegare perché la stessa quantità di molecole, portate allo stato di vapore, avessero lo stesso volume. La diatriba venne finalmente conclusa da Stanislao Cannizzaro, come venne annunciato al Congresso di Karlsruhe (1860, quattro anni dopo la morte di Avogadro), dove egli spiegò che queste eccezioni avvenivano a causa della dissociazione molecolare che occorreva a determinate temperature, e che la Legge di Avogadro poteva determinare non solo le masse molari, ma come conseguenza, anche le masse atomiche. Clausius, con la sua teoria cinetica dei gas fu in grado di dare un'altra conferma della Legge di Avogadro. Non molto dopo, nelle sue ricerche riguardanti le soluzioni diluite (e la conseguente scoperta delle analogie nel comportamento di soluzioni e gas), J. H. van 't Hoff aggiunse il suo consenso finale al trionfo dello scienziato italiano, che da allora è considerato il fondatore della teoria atomico-molecolare. In onore dei contributi di Avogadro alla teoria delle moli e dei pesi molecolari, il numero di molecole in una mole è stato ribattezzato Numero di Avogadro. La legge di Avogadro afferma che: volumi eguali di gas diversi a parità di pressione e temperatura contengono lo stesso numero di molecole. Attraverso questa legge si introduce il numero di Avogadro (NA = 6,0221415 x 1023) e il concetto di mole. Il numero di Avogadro è il numero di atomi di carbonio-12 presenti in 12 grammi di questa sostanza. La mole è la quantità di materia contenente un numero di oggetti uguale al NA. " Numero di Avogadro, chiamato così in onore di Amedeo Avogadro e denotato dal simbolo NA o N, è il numero di elementi contenuti in una mole. Viene formalmente definito come il numero di atomi di carbonio-12 presenti in 0,012 kg di tale sostanza. Significato fisico del Numero di Avogadro Anche se definito in termini di carbonio-12, il Numero di Avogadro si applica a qualsiasi materiale. Corrisponde al numero di atomi o molecole necessario a formare una massa pari al peso atomico del materiale (in grammi). Il Numero di Avogadro compare anche in altre relazioni fisiche, come fattore di scala tra costanti microscopiche e macroscopiche: la costante universale dei gas R e la costante di Boltzmann kB: R = kBNA la costante di Faraday F e la carica elementare qe: F = qeNa Valore numerico Al momento non è tecnologicamente possibile contare il numero esatto di atomi in 0,012 kg di carbonio-12, quindi il valore preciso del Numero di Avogadro è sconosciuto. Il valore raccomandato dal CODATA del 2002 per il Numero di Avogadro è dove il numero tra parentesi rappresenta la deviazione standard dell'ultima cifra del valore. A scopo di semplificazione, il Numero di Avogadro viene a volte arrotondato a: che è sufficientemente accurato per la maggior parte delle applicazioni. Connessione tra massa dei protoni e dei neutroni Un atomo di carbonio-12 consiste di 6 protoni e 6 neutroni (che hanno approssimativamente la stessa massa) e da 6 elettroni (la cui massa è trascurabile al confronto). Si potrebbe quindi pensare che un NA di protoni o neutroni abbia massa 1 grammo. Anche se questo è approssimativamente corretto, la massa di un protone libero è di 1,00727 uma, quindi una mole di protoni ha una massa di 1,00727 g. Similarmente, una mole di neutroni ha massa pari a 1,00866 g. Chiaramente, 6 moli di protoni combinate con 6 moli di neutroni dovrebbero avere massa superiore a 12 g. Ci si potrebbe chiedere quindi come è possibile che una mole di atomi di carbonio12, che deve consistere di 6 moli di neutroni, 6 di protoni e 6 di elettroni, possa avere una massa di appena 12 g. Cosa ne è della massa in eccesso? La risposta è legata all'equivalenza massa-energia, derivata dalla teoria della relatività ristretta. Nella struttura del nucleo, i protoni e i neutroni sono tenuti assieme dalla forza nucleare forte. I legami corrispondono a stati di energia potenziale minore rispetto ai protoni e neutroni liberi e isolati. In altre parole durante la formazione del nucleo atomico viene liberata una grande quantità di energia e, poiché la massa è equivalente all'energia, si ha una "perdita di massa" del nucleo rispetto alla semplice somma delle masse dei protoni e dei neutroni liberi. La differenza tra massa del nucleo e la somma delle masse dei suoi componenti non è costante e dipende dalla forza dei legami. È massima per gli elementi più stabili (in particolare l'elio-4) ed è minore per gli elementi meno stabili, cioè con legami nucleari più deboli (come gli elementi radioattivi). Per il carbonio-12 la differenza è all'incirca dello 0,7% e rende conto, per definizione, della massa "mancante" in una mole dell'elemento. Si può quindi dire che NA è il rapporto tra massa in grammi di una mole di elemento e la sua massa nucleare in uma, tenendo però conto che è un'approssimazione, anche se molto precisa; perché la massa di un nucleo atomico non dipende solo dal numero di protoni e neutroni che lo compongono ma anche dalla sua struttura. Misurazione sperimentale del numero di Avogadro Esperienza di laboratorio effettuata dalle alunne Per determinare il numero di Avogadro esistono molti metodi. Il metodo da noi utilizzato e’ quello con l’acido oleico. L’idea è la seguente: se lasciamo cadere una goccia di acido sulla superficie dell’acqua essa si espande in modo simmetrico formando un cerchio. L’espansione avviene poiché inizialmente le molecole di acido sono accatastate l’una sull’altra nella goccia. A contatto con l’acqua si forma un cilindro di acido che diminuisce di altezza man mano che si allarga. Quando non si allarga più possiamo formulare l’ipotesi che si sia arrivati ad uno strato monomolecolare di acido; a questo punto l’altezza del cilindro dà un’ indicazione delle dimensioni della molecola. Conoscendo il peso atomico dell’acido oleico e la sua densità, è possibile risalire al numero di Avogadro (almeno come ordine di grandezza). Per fare la misura seguiamo tre metodi diversi. Materiale occorrente una vaschetta di dimensioni opportune (30 x 40 cm) due palloncini tarati da 100 cm3 2 pipette oppure un cilindro 2 contagocce 1 righello 1 microsiringa Reagenti acido oleico polvere di talco acetone Procedimento La prima operazione consiste nel preparare una soluzione di acido oleico che sia in grado di formare una macchia di circa 12-15 cm di diametro. Si prepara adesso la vaschetta con l’acqua; si aspetta che l’acqua sia perfettamente ferma e si versa la polvere di talco in modo da ottenere uno strato sottilissimo e uniforme. La polvere di talco presenta la caratteristica di galleggiare sulla superficie dell’acqua e quindi consente di visualizzare bene i bordi della macchia. Usando il contagocce affilatissimo, si preleva un po’ di soluzione e se ne lascia cadere una goccia al centro della bacinella, in modo da ottenere una “macchia” dai contorni quanto più regolari possibili. Si attende fino a quando la “macchia” si stabilizza e quindi si misura il suo diametro in 2 o 3 punti, facendone poi la media (d). Il raggio della macchia è pertanto dato da r = d/2 Il volume di una goccia si può conoscere per via indiretta, contando il numero di gocce necessarie a formare un volume di 1 cm3 Conviene ripetere più volte la misura del numero di gocce e farne la media. Il volume di acido oleico puro è 0,1% del volume della goccia e quindi è dato da: Vac. oleico = Vgoccia. Conoscendo il raggio della macchia (r) ed il volume di acido oleico usato (Vac. oleico ), si risale prima alla superficie (S = π∙r∙2) e poi all’altezza delle molecole (h = V/S). Conoscendo la densità dell’acido oleico (d = 0,87 g∙ cm-3), si può risalire alla stima della massa della molecola di acido oleico (m = d∙V). La goccia di acido oleico si spande sulla polvere di talco formando una macchia quasi circolare, della quale si deve misurare il diametro. Calcolo del volume della molecola di acido oleico Prima di effettuare qualsiasi calcolo, dobbiamo immaginare per questa molecola di acido oleico una forma geometrica ben definita. Potremmo, ad esempio, fare l’ipotesi che essa sia cubica oppure sferica. Esempio numerico: ammettiamo che il diametro della macchia sia di 13,5 cm e che il numero di gocce necessario a formare 1 cm3 sia pari a 65; ne deriva che: Vgoccia = 1/65 = 0,015 cm3 Smacchia = π∙r∙2 = 143,12 cm2 Rmacchia = 6,75 cm H = Vac. oleico / Smacchia =1,05∙10-7 Dac. oleico = 0,873 g/cm3 l’altezza (h) coincide col lato del cubo e poiché il volume del cubo è dato da l3 , basta utilizzare l’altezza trovata in precedenza per stimare la dimensione della molecola (Vcubo). In base ai valori sopra indicati Vcubo = 0,015 cm3 Calcolo del numero di particelle contenute in una mole di acido oleico Abbiamo così trovato il volume di una molecola; possiamo adesso risalire al numero di Avogadro, considerando che il rapporto fra il volume di una mole di acido oleico ed il volume di una singola molecola dà il numero di particelle. Il volume molare (Vmolare) si determina conoscendo la MM (massa molare) dell’acido oleico e la sua densità: Vmolare = MM / d La MM dell’acido oleico è 282,4 mentre la densità è pari a 0,87; il Vmolare risulta pertanto 282/0,87 = 324 Infine si calcola N, eseguendo il rapporto fra Vmolare ed il volume della singola molecola (Vcubo ) N = Vmolare / Vcubo = 324/(1,16x10-21) = 2,749∙ 1023 Conclusioni Il risultato ottenuto, considerando l’elevatissimo valore del numero di Avogadro N pari a 6,02∙1023 , si può ritenere accettabile; tuttavia ripetendo la prova più volte ed eseguendo la media dei risultati si può ottenere un valore ancora più vicino a quello reale. Una considerazione importante sul numero di Avogadro è che la quantità in grammi corrispondente alla massa atomica di ogni elemento, contiene un numero fisso di particelle, pari a 6,023 ∙1023
Scaricare