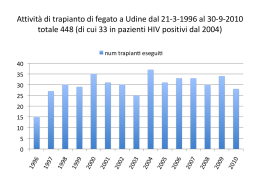
Indice CAPITOLO 1 1.1 L’epatite cronica da HCV nei soggetti con infezione da HIV ....................................... pag. 2 1.2 Il trapianto di fegato nei soggetti HIV positivi .............................................................. pag. 3 1.2.1 La terapia antiretrovirale .................................................................................. pag. 4 1.2.2 La terapia dell’epatite da HCV ......................................................................... pag. 7 1.2.3 La coinfezione HBV ......................................................................................... pag. 8 1.2.4 L’epatocarcinoma ............................................................................................. pag. 11 1.2.5 Interazioni tra terapia antiretrovirale ed immunosoppressori ........................... pag. 13 1.3 Esperienza italiana dei trapianti di fegato ..................................................................... pag. 15 1.3.1 Indicazioni e controindicazioni al trapianto di fegato ...................................... pag. 16 1.3.2 Requisiti minimi per l’immissione in lista di trapianto di fegato nell’adulto ... pag. 19 1.3.3 Requisiti per l’immissione in lista di attesa di trapianto di fegato nell’adulto con infezione da HIV ............................................................................... pag. 22 CAPITOLO 2 2.1 Obiettivi dello studio ..................................................................................................... pag. 25 2.2 Materiali e metodi ......................................................................................................... pag. 25 2.3 Risultati ......................................................................................................................... pag. 28 2.4 Discussione ................................................................................................................... pag. 32 2.5 Conclusioni ................................................................................................................... pag. 34 BIBLIOGRAFIA ........................................................................................................ pag. 35 Capitolo 1 ANALISI DELLA LETTERATURA 1.1 L’EPATITE CRONICA DA HCV NEI SOGGETTI CON INFEZIONE DA HIV Nel mondo circa 130 milioni di soggetti sono portatori di infezione cronica HCV; di questi circa 4-5 milioni sono contemporaneamente infettati con il virus HIV. In America e nell’Europa Occidentale la prevalenza di HCV negli HIV positivi è dal 72 al 95% tra i tossicodipendenti, dall’1 al 12% tra gli omosessuali e dal 9 al 27% tra gli eterosessuali [1]. L’infezione acuta da HCV guarisce nel 15-45% dei soggetti. Nei soggetti che sviluppano un’infezione cronica, il 20 - 30% presenta una malattia epatica progressiva che può evolvere in cirrosi nell’arco di 20 – 30 anni e può progredire in insufficienza epatica ed epatocarcinoma. Dal 1996, con l’introduzione di una terapia antiretrovirale altamente attiva (HAART), si è assistito ad una riduzione significativa dell’incidenza delle infezioni opportunistiche in HIV che in passato rappresentavano i maggiori determinanti di mortalità. D’altra parte la maggiore sopravvivenza ha determinato negli anni la progressione di malattie epatiche, soprattutto HBV ed HCV correlate, di cui spesso questa popolazione è coinfetta. Una recente metanalisi di circa 30 lavori, comprendenti più di 100.000 pazienti, ha evidenziato un incremento della mortalità nell’era post-HAART, non tanto a causa di malattie AIDS definenti, bensì per la concomitante presenza di HCV che, attivando la risposta immunitaria, induce più velocemente l’apoptosi delle cellule T helper CD4+ nei pazienti HIV positivi e una più rapida progressione verso uno stato di immunodeficienza severa [2]. Numerosi studi hanno dimostrato come la concomitante presenza di infezione da HIV e da virus epatitici maggiori determini una progressione più veloce della malattia epatica verso uno 2 stadio terminale di cirrosi scompensata. È stato dimostrato come nei soggetti HIV-HCV positivi sia presente un’aumentata espressione intraepatica delle citochine pro infiammatorie, responsabili della progressione della fibrosi (Kuntzen 2008 [3]). Recentemente Barreiro [4] ha evidenziato come la presenza del genotipo CC della IL28B aumenti il rischio di sviluppare una cirrosi HCV correlata nei soggetti HIV positivi: infatti i soggetti che presentano questo genotipo mostrano un grado di infiammazione maggiore rispetto ai soggetti con varianti CT/TT. La tossicità epatica dovuta ai farmaci antiretrovirali, può aggravare la malattia epatica nei soggetti con epatite cronica HCV e determinare anche insufficienza d’organo. 1.2 IL TRAPIANTO DI FEGATO NEI SOGGETTI HIV POSITIVI 1.2.1 La terapia antiretrovirale La mancata disponibilità di farmaci efficaci per il controllo della replica virale HIV, con la conseguente difficoltà a trattare le infezioni opportunistiche e la marcata immunodepressione indotta dai farmaci antirigetto hanno escluso la popolazione sieropositiva all’accesso al trapianto di fegato fino all’avvento della HAART. Diversi studi retrospettivi eseguiti nei primi anni 90 confermavano proprio il fallimento del trapianto d’organo solido nei pazienti sieropositivi. Nel 1990 Tzaskis [5] ha analizzato 25 pazienti (10 bambini e 15 adulti) che avevano ricevuto un trapianto di organo solido (di cui 15 fegato) tra il 1981 e il 1988 e avevano contratto l’infezione da HIV prima o durante il trapianto. I risultati ottenuti dimostravano, dopo una mediana di followup di 2,75 anni, una sopravvivenza generale del 52 %, con un risultato migliore nella sottopopolazione pediatrica (70%). Il trapianto quindi sembrava associato ad una riduzione di sopravvivenza libera da patologie AIDS definenti rispetto ad una popolazione di emofilici non trapiantati. Nel 1994 Buscart [6] ha pubblicato uno studio osservazionale, condotto su 11 pazienti sottoposti a trapianto di fegato che avevano contratto l’infezione da HIV tra il 1985 e il 1987, 3 durante o subito dopo il trapianto. Tutti i soggetti assumevano terapia immunosoppressiva a tre farmaci ed i risultati ottenuti sono stati abbastanza deludenti: dopo un follow-up di circa 52 mesi l’82% della popolazione ha presentato complicanze HIV correlate, mentre il 27% è morto per cause HIV relate. Questi studi dimostrarono le difficoltà e i rischi esistenti nel trapiantare una popolazione così particolare; d’altro canto l’esiguo numero di soggetti interessati non determinava il raggiungimento di una significatività statistica. Inoltre era dimostrato che una piccola percentuale di pazienti sopravviveva: quindi in particolari condizioni, allora ancora sconosciute, il trapianto di fegato rappresentava una possibilità concreta. In era pre-HAART, la percezione comune era che il trapianto accelerasse la progressione in uno stadio di AIDS conclamato, che aveva come causa principale l’utilizzo dei farmaci immunosoppressori. Inoltre si era dimostrato come la sopravvivenza di questa particolare popolazione fosse inferiore a quella dei soggetti sieronegativi sottoposti a trapianto. Per tutti questi motivi, l’infezione da HIV fu considerata criterio di esclusione nella valutazione dei pazienti candidabili al trapianto per malattia epatica in stadio terminale. Con l’introduzione della HAART nel 1996 lo scenario dei trapianti in HIV è completamente cambiato. La possibilità di disporre di una terapia che consentiva un buon controllo della replica virale ha reso fattibile la trapiantabilità di soggetti affetti da malattia epatica. Il lavoro di Fung 2004 [7] ha analizzato in modo critico le condizioni che in passato avevano escluso gli HIV positivi dai trapianti: l’azione immunosoppressiva dei farmaci antirigetto nei confronti di un equilibrio immunologico precario per la malattia di base; la possibilità di una replica virale incontrollata che avrebbe potuto favorire la comparsa di mutazioni; le interazioni tra farmaci antiretrovirali ed immunosoppressori sulla farmacocinetica e farmacodinamica di entrambi con conseguenti effetti tossici o sub terapeutici; la recidiva di infezione da HCV, che avrebbe accelerato la progressione della fibrosi e del rigetto. Infine, non da sottovalutare, la perplessità dell’opinione 4 pubblica circa la possibilità di offrire il trapianto a soggetti HIV positivi che avrebbe potuto determinare una riduzione delle donazioni. I diversi studi effettuati negli ultimi anni, sottolineano che, selezionando accuratamente il candidato, è possibile controllare e gestire le criticità rilevate da Fung e quindi offrire la possibilità del trapianto anche ai soggetti HIV positivi ottenendo buoni risultati. Uno degli studi più interessanti in tal proposito è quello di Ragni del 2003 [8], nel quale l’outcome di sopravvivenza di una coorte coinfetta viene paragonato a quello di una monoinfetta: dopo un follow-up mediano di 12, 24 e 36 mesi la sopravvivenza complessiva è, rispettivamente 87.1, 72.8 e 72.8%, del tutto paragonabile a quella della coorte di controllo (86.6, 81.6 e 77.9). La sopravvivenza risultava essere condizionata in modo significativo da: una conta di CD4 inferiore a 200 cell/mm3 ed una viremia HIV >400 copie/mL nel post-trapianto, l’interruzione della HAART per tossicità nel post-trapianto e l’insufficienza epatica da HCV. Al contrario non si raggiunge la significatività statistica per la scelta del regime immunosoppressore o per la modalità di contagio dell’infezione da HIV. In conclusione si dimostra come la sopravvivenza di una popolazione HIV positiva è sovrapponibile a quella di una HIV negativa (comparabile per età, sesso e razza); in particolare la sopravvivenza è comparabile tra soggetti HIV-positivi / HCV-positivi e HIV-negativi / HCV-positivi, dimostrando così che la sieropositività non è di per sé una barriera al trapianto. Questi dati vengono confermati anche da altri studi. Norris nel 2004 [9] ha studiato una coorte di 14 pazienti HIV positivi, sottoposti a trapianto per insufficienza d’organo da HCV o HBV o esotossica, ed ha paragonato la sopravvivenza di questi sottogruppi con le rispettive coorti monoinfette. La sopravvivenza totale della popolazione sieropositiva a 1, 2 e 5 anni è stata rispettivamente del 78.6%, 69.8% e 62.1%. Analizzando i sottogruppi si nota come la sopravvivenza sia molto più alta nei soggetti con coinfezione HBV o epatite esotossica, con percentuali praticamente sovrapponibili rispetto ai soggetti HIV negativi (86.4 vs 100, 82 vs 100 e 80.4% vs 100 rispettivamente ad 1, 2 e 5 anni). Diversi sono i risultati nella popolazione coinfetta 5 con HCV. In questo caso la sopravvivenza è di gran lunga inferiore rispetto alla medesima popolazione HCV monoinfetta.Questi dati dimostrano che non solo non ci sono differenze statisticamente significative in termini di sopravvivenza tra soggetti HIV positivi ed HIV negativi, ma anche che, quando si analizzano le cause di morte, queste sono da imputare ad una riattivazione di HCV piuttosto che allo stato di immunodeficienza acquisita. Duclos-Vallée [10] in uno studio monocentrico del 2005 ha evidenziato come la riattivazione dell’infezione da HCV sia la causa principale di morte sia nella popolazione monoinfetta che coinfetta (20% e 37% rispettivamente). Inoltre l’infezione da HCV progredisce in maniera significativamente più veloce verso la fibrosi nei soggetti coinfetti. Nella curva di sopravvivenza a 2 e 5 anni solo il 65% e il 43% della popolazione sieropositiva presenta uno stadio di Metavir inferiore a F3, mentre il 90% a 2 anni e l’82% a 5 presenta uno stadio di fibrosi elevata. Gli stessi risultati sono stati ottenuti dal gruppo di de Vera nel 2006 [11]. In uno studio casocontrollo hanno dimostrato come la recidiva di epatite C nella popolazione coinfetta causi più frequentemente la perdita del graft (la sopravvivenza del graft a 1-3-5 anni nella popolazione HIV / HCV è rispettivamente del 63%, 51.9% e 31.1% rispetto a 68.2%, 64.1% e 64.1% della popolazione HCV) e quindi aumenti la mortalità di questi soggetti (sopravvivenza cumulativa a 1-3-5 anni è rispettivamente del 66.7%, 55.6% e 33.3% vs 75.7%, 71.6% e 71.6%), ed inoltre la progressione verso uno stadio di cirrosi è molto più frequente e precoce. Lo studio retrospettivo di Mindikoglu del 2008 [12] conferma in parte questi dati. Analizzando una coorte di 138 soggetti HIV positivi e confrontandola con un’altra di 30.520 soggetti HIV negativi, tutti sottoposti a trapianto di fegato nel periodo dal 1997 al 2007, conclude che la popolazione coinfetta ha una sopravvivenza inferiore alla monoinfetta (70% vs 81%); tuttavia quando si analizza la sottopopolazione HIV positiva non coinfetta da virus HBV e/o HCV, questo trend scompare; infatti nessuno dei 24 pazienti HIV positivi non coinfetti da virus B o C è deceduto in un periodo di follow-up di 1.2 anni/persona. In conclusione, i soggetti monoinfetti HIV hanno una prognosi migliore rispetto ai coinfetti HIV/HCV, che a loro volta hanno una sopravvivenza 6 peggiore rispetto ai monoinfetti HCV. 1.2.3 La terapia dell’epatite da HCV I risultati riportati evidenziano il ruolo prognostico negativo della recidiva dell’epatite C e sottolineano l’importanza di potere effettuare una terapia anti HCV efficace. La recidiva dell’infezione da HCV dopo trapianto si manifesta rapidamente nella totalità dei pazienti viremici pre-OLT. La recidiva della malattia HCV (documentato danno istologico) si sviluppa nel 75-80% dei pazienti nel post-trapianto, con un quadro di epatite acuta entro circa 1-6 mesi. La storia naturale della malattia post-trapianto è variabile; in genere è più rapida rispetto a quella su fegato nativo, evolvendo verso una forma cronica in circa l’80-90% dei pazienti, con una progressione verso la cirrosi in circa il 25-30% dei soggetti entro 5-7 anni dall’intervento. La patogenesi del danno epatico in corso di recidiva di infezione HCV è multifattoriale: fattori virologici (alta carica HCV pre-OLT, genotipo 1, coinfezione con Cytomegalovirus); caratteristiche del ricevente (età avanzata, sesso femminile, diabete nel post-trapianto); caratteristiche del graft (età avanzata del donatore, prolungato insulto ischemico); regime immunosoppressivo (stato di immunodepressione profonda, episodi di rigetto che hanno richiesto l’impiego di boli di steroide).[13] La terapia antivirale della recidiva di epatite HCV, sia nei soggetti monoinfetti HCV che nella popolazione con HIV +, non ha offerto ad oggi risultati incoraggianti. Numerosi sono, purtroppo, i fattori predittivi di non risposta virologica (fallimento di pregresse terapie con interferoni, elevati livelli di viremia HCV basale, elevata prevalenza dl genotipo 1, lo stato di immunosoppressione, alterazioni ematologiche). Un altro elemento importante è la scelta del momento più opportuno per effettuare il trattamento. Una terapia antivirale pre-trapianto consentirebbe di ridurre la viremia HCV prima del trapianto o addirittura l’eradicazione dell’infezione e ridurrebbe il rischio di recidiva nel post-OLT; questo potrebbe essere la scelta per soggetti con cirrosi in fase di compenso ma portatori di epatocarcinoma; rischioso potrebbe essere per i cirrotici in classe B-C Child per l’elevata tossicità 7 (mielosoppressione ed infezioni).[14] Una seconda possibilità potrebbe essere una terapia preemptive post-trapianto, cioè nella fase precoce della reinfezione del graft, entro le prime 4-6 settimane dall’intervento nella prima fase della ripresa viremica ma prima delle manifestazioni conclamate; le condizioni cliniche di questa fase potrebbero necessitare la riduzione dei dosaggi e/o la sospensione del trattamento; iniziando precocemente la terapia si rischia di trattate anche quelle forme con decorso benigno [15]. L’approccio più impiegato è quello di iniziare il trattamento antivirale a malattia conclamata, in una fase più lontana dall’intervento in cui il paziente è più stabile, ha una minore stato di immunodepressione e una maggiore tollerabilità da farmaci antivirali [16]. In letteratura sono riportati i risultati di terapie della recidiva di HCV per i soggetti con infezione da HIV. Fung nel suo studio del 2004 riprende i risultati del gruppo di Pittsburgh [13] sulla terapia della recidiva da HCV. Dei 12 pazienti HIV/HCV trattati con terapia di combinazione (ribavirina ed interferone), solo 2 hanno ottenuto una risposta virologica sostenuta. Più incoraggianti sono i risultati ottenuti da de Vera [11]. Dei 15 pazienti coinfetti in cui era stata dimostrata istologicamente la recidiva di epatite HCV, sottoposti a terapia combinata (interferone/ interferone peghilato + ribavirina), il 66% ha ottenuto una risposta biochimica, con una normalizzazione della transaminasi entro le 8 settimane dall’inizio del trattamento; di questi il 40% ha ottenuto anche una risposta virologica, comprese 4 risposte virologiche sostenute, con una mediana di 22 settimane di trattamento. Nello stesso studio viene anche analizzata la tollerabilità della terapia: l’effetto collaterale più comunemente riscontrato è l’affaticamento, mentre sono stati necessari aggiustamenti dei dosaggi di ribavirina ed interferone per la comparsa di anemia e leucopenia che, in alcuni casi, hanno necessitato di terapia di supporto con fattore di crescita granulocitario ed eritropoietina. A questo riguardo è molto interessante lo studio di Duclos-Vallèe del 2008 [18], in cui si confronta la risposta virologica e la tollerabilità della terapia anti-HCV in entrambi i gruppi: a prescindere dalla terapia di combinazione utilizzata (interferone/interferone pegilato + ribavirina) e 8 dal dosaggio, si ottiene una risposta virologica durante trattamento del 75% nella popolazione monoinfetta, con 3 risposte virologiche sostenute, e del 21% nella popolazione coinfetta, di cui 3 pazienti con risposta virologica sostenuta. In questi ultimi la risposta virologica è stata raggiunta più lentamente: in un caso dopo 6 mesi di trattamento, nei restanti due dopo 18 mesi dall’interruzione della terapia. Per quanto riguarda la tollerabilità, la popolazione sieropositiva ha sperimentato più frequentemente gli effetti collaterali, soprattutto l’astenia che permaneva anche riducendo i dosaggi dell’interferone. In alcuni casi si è assistito anche ad effetti collaterali gravi: un paziente è deceduto per acidosi lattica insorta al quarto mese di terapia, mentre un altro ha avuto un episodio di pancreatite acuta dopo qualche settimana dall’inizio del trattamento. Wojcick [19] nel 2007 ha studiato i risultati di una terapia antivirale effettuata per recidiva di epatite C in 4 pazienti HIV/HCV sottoposti a trapianto di fegato. Modulando la durata e il dosaggio di una terapia antivirale precoce in base alla comparsa degli effetti collaterali e alla riduzione della carica viremica, si è ottenuta una risposta virologica sostenuta in tutti e quattro i pazienti. 1.2.4 La coinfezione HBV Un’altra problematica nella popolazione in esame è la contemporanea infezione con il virus dell’epatite B. Attualmente è possibile controllare molto bene la viremia HBV utilizzando gli analoghi nucleosidici/nucleotidici come lamivudina, tenofovir, adefovir, entecavir e telbivudina. Anche nel periodo post-trapianto si può prevenire la recidiva di infezione utilizzando gli stessi analoghi in associazione o meno con immunoglobuline anti-HBs. Diversi studi hanno analizzato l’outcome di questi pazienti. Il più ampio in tal senso è quello prospettico di Thio [20] del 2002, che prevedeva il reclutamento, nei periodi 1984-85 e 1987-1991, di 5293 omosessuali, afferenti alla coorte MACS (Multicenter AIDS Cohort Study), e il controllo semestrale degli stessi fino al Marzo 2000. L’end-point dello studio era di quantificare la 9 percentuale di mortalità legata a malattia epatica suddividendo la coorte in 4 gruppi: soggetti HIV/HBsAg-, HIV+/HBsAg-, HIV-/HBsAg+ e HIV+/HBsAg+. I risultati ottenuti sono per l’epoca paradigmatici: i soggetti HIV positivi hanno un rischio relativo di mortalità correlato a malattia epatica di 33.8 volte superiore alla popolazione HIV negativa (61 vs 1), con un aumento da 2.5 a 4 morti/1000 persone-anno dopo l’avvento della HAART nel 1996. Ma il rischio è notevolmente aumentato nella popolazione coinfetta (HIV+/HBsAg+). Quest’ultima presenta una mortalità legata a malattia epatica di 8 volte superiore alla popolazione HIV+/HBsAg- e di 19 volte rispetto alla popolazione moinfetta da HBV. Questi dati dimostrano come la concomitante presenza di virus HIV e HBV determini una maggiore progressione della malattia epatica verso la fibrosi, molto probabilmente associata sia ad una disreattività del sistema immunitario che alla tossicità della HAART utilizzata all’epoca; in ogni caso, pur non valutando pazienti trapiantati di fegato, questo studio evidenzia come sia importante, in termini di sopravvivenza, controllare la replicazione del virus HBV nei soggetti coinfetti. Terrault [21] nel 2006 ha analizzato, attraverso uno studio retrospettivo di coorte, l’outcome di 35 pazienti coinfetti HIV-HBV, trapiantati di fegato tra il 2000 e il 2002 presso l’Università della California di San Francisco. Gli end-points primari prevedevano la determinazione della prevalenza di lamivudino-resistenza, la sopravvivenza durante l’attesa in lista trapianto e la proporzione di soggetti sottoposti al trapianto. Inoltre nel periodo sono state considerate la frequenza di fallimento della profilassi anti-HBV (intesa come rilevabilità dell’HBV DNA) e la progressione della malattia da HIV (intesa come presenza di infezioni opportunistiche e/o neoplasie). I risultati ottenuti sono paradigmatici: la maggior parte dei pazienti muore in lista di attesa perché non elegibile al trapianto; solo il 26% del totale presenta i criteri di trapiantabilità. Di questi solo l’11% giunge al trapianto con una sopravvivenza nel post-trapianto del 100%; inoltre non si assiste a recidiva di malattia epatica né a progressione dell’infezione da HIV, grazie all’utilizzo di farmaci altamente attivi nel controllare la replicazione di entrambi i virus e delle immunoglobuline anti-HBs. 10 Un altro dato importante che emerge è che il 67% dei pazienti presenta un virus resistente alla lamivudina, per tale motivo è stato necessario aggiungere farmaci di nuova generazione per controllare la replica virale (30% tenofovir, 13% adefovir e 4% adefovir+tenofovir). Questo studio si presta a diverse riflessioni. Innanzitutto l’importanza di valutare lo stadio di malattia epatica, in quanto la maggior parte dei soggetti viene riferito al centro trapianti o troppo presto (quando non hanno ancora i criteri di trapiantabilità) o troppo tardi (quando la malattia è cosi avanzata da determinare la morte del paziente). In secondo luogo la possibilità di controllare la replica virale e quindi la progressione della malattia epatica, utilizzando sia nel pre- che nel posttrapianto farmaci altamente attivi anche nei confronti di virus lamivudina-resistenti. Infine la necessità di monitorare frequentemente lo stato di HBV portatore in questi soggetti, per identificare immediatamente un’eventuale emergenza di virus resistenti e quindi compiere scelte terapeutiche volte a minimizzare il rischio di complicanze legate all’infezione epatica. Gli stessi risultati sono ottenuti da Tateo [22] in uno studio del 2009. La sopravvivenza dei pazienti e del graft è del 100%, mentre non vi è evidenza di recidiva di infezione da HBV, né come replica virale né come riscontro di HBV DNA integrato nelle cellule del fegato trapiantato. Uno studio più recente è quello di Coffin [23] del 2010, in cui, attraverso uno studio prospettico multicentrico, vengono analizzati 22 pazienti coinfetti HIV-HBV sottoposti a trapianto dal 2001 al 2007. Anche in questo caso, gli end-points primari prevedevano l’outcome di sopravvivenza, l’efficacia della profilassi anti-HBV nel post-trapianto e l’insorgenza di varianti resistenti alla lamivudina. I risultati ottenuti sono analoghi ai precedenti: la sopravvivenza cumulativa a 1 e 3 anni è del 85% nei coinfetti vs il 100% dei monoinfetti, nessuno dei pazienti presenta una recidiva clinica, sierologica ed istologica di infezione da HBV. Gli autori commentano questi risultati come il successo dell’utilizzo di una potente ed efficace profilassi combinata nel post-trapianto. Infatti anche i pazienti che presentano una viremia HBV rilevabile al momento del trapianto ottengono un ottimo controllo della replica virale, con HBV DNA undetectable. 11 Questi risultati dimostrano quindi una migliore sopravvivenza dei pazienti coinfetti HIV-HBV rispetto ai coinfetti HIV-HCV, sottolineando l’importanza di disporre di una terapia altamente efficace nel controllo della viremia e, di conseguenza, della progressione di malattia. 1.2.5 L’epatocarcinoma Un ulteriore problema da considerare in questa categoria di pazienti è la concomitante presenza di un carcinoma epatocellulare (HCC). Circa l’80% degli epatocarcinomi insorgono su una cirrosi da eziologia virale (HBV o HCV) [24]. Nel 1997 lo studio del gruppo di Bruno S [25] ha dimostrato in una coorte di 163 pazienti affetti da cirrosi HCV correlata, che il 13, 5% di questi pazienti sviluppava HCC precocemente, con una prevalenza maggiore nei soggetti affetti da genotipo 1b (ODDS RATIO 6.14) Nel 2004 il gruppo di Davila [26] ha analizzato i fattori di rischio legati allo sviluppo di HCC su una coorte di pazienti afferenti al programma nazionale di Sorveglianza ed Epidemiologia (SEER-Medicare) dal 1993 al 1999. La proporzione di HCC riferibili ad infezione da HCV aumentava dall’11% del 1993 al 21% del 1999, mentre quella associata ad infezione da HBV aumentava dal 6 all’11%. Nell’analisi multivariata aggiustata per età, sesso, razza e provenienza geografica, risultava che il rischio di sviluppare HCC per infezione da HCV ed HBV era rispettivamente del 226% e del 67%. Per quanto riguarda la popolazione sieropositiva, diversi studi hanno affrontato la questione se l’infezione da HIV possa di per sè aumentare il rischio di sviluppare HCC nei pazienti affetti da epatopatia. Infatti è dimostrato che la sieropositività aumenta il rischio di sviluppare tumori extraepatici, come Linfomi non Hodgkin e sarcoma di Kaposi, molto probabilmente per il ruolo oncogenico della proteina Tat. Al contrario diversi studi di coorte non hanno evidenziato un’aumentata incidenza di tumori epatici nella popolazione monoinfetta HIV [27]. 12 Nel 2001 lo studio francese Mortavic [28] ha analizzato le cause di morte in una coorte di 25178 pazienti HIV positivi, stratificandole in base all’era pre-HAART e post-HAART. I decessi dovuti ad insufficienza epatica aumentavano significativamente dal 1995 al 2001 (dal 1.55 al 14.3%) con una proporzione dovuta all’HCC di 5 volte maggiore (dal 4.7% al 25%), e tutti erano legati alla concomitante infezione da HCV. Questo risultato si può spiegare con il fatto che l’infezione da HIV accelera la progressione della malattia epatica da HCV ed HBV e quindi indirettamente aumenta la possibilità di sviluppare HCC. Questa conclusione è confermata anche da uno studio di Mc Ginnis [29] del 2001, che ha confrontato l’incidenza di HCC tra 14018 pazienti HIV positivi e 28036 HIV negativi, paragonabili per età e sesso e distribuzione geografica. Aggiustando i risultati per infezione da HCV e consumo di alcol, non esisteva un rischio aumentato di sviluppare HCC dovuto all’infezione da HIV. Nel 2004 il gruppo italiano GICAT [30] ha esaminato 41 casi di HCC occorsi nella popolazione sieropositiva e li ha paragonati a 384 casi di controlli HIV negativi nel periodo 19951998. I risultati evidenziavano ancora una volta come fosse la presenza di infezione da HCV a determinare in entrambi i gruppi la progressione verso HCC, anche se nella popolazione HIV positiva si assisteva ad un processo di epatocarcinogenesi molto più precoce. Nel 2007 uno studio retrospettivo multicentrico USA-Canada [31] ha evidenziato come non ci fossero differenze statisticamente significative di sopravvivenza tra soggetti HIV negativi ed HIV positivi, che venivano sottoposti a trapianto per HCC. Uno studio più recente del gruppo di Duclos-Vallée [32] ha paragonato la sopravvivenza e la recidiva di HCC nei soggetti HIV positivi e HIV negativi, che venivano trapiantati per insufficienza epatica ed HCC. La sopravvivenza a 1 e 3 anni è stata del 81% e 74% nella popolazione HIV positiva e del 93% e 85% nella popolazione HIV negativa, senza una differenza statisticamente significativa (p=0.07). Per quanto riguarda la recidiva di HCC, questa si è verificata nel 31% dei soggetti HIV positivi e nel 15% dei soggetti HIV negativi, con una progressione più rapida nella 13 popolazione sieropositiva; in ogni caso queste differenze non sono state statisticamente significative. 1.2.6 Interazioni tra terapia antiretrovirale ed immunosoppressori Infine bisogna analizzare le interazioni farmacologiche tra terapia antiretrovirale ed immunosoppressori. In letteratura non esistono molti studi riguardo questa problematica. È noto come entrambe le classi di farmaci competano, per la metabolizzazione a livello epatico, per gli stessi citocromi, comportandosi nei confronti degli stessi come inibitori o induttori dell’attività enzimatica. Gli inibitori della calcineurina (come tacrolimus e ciclosporina) sono metabolizzati dagli isoenzimi 3A2 e 3A4 del citocromo P450, verso i quali si comportano come inibitori dell’attività enzimatica; allo stesso modo lavorano gli inibitori delle proteasi (soprattutto ritonavir), mentre gli analoghi non nucleosidici (in particolar modo efavirenz) sono attivatori degli isoenzimi 3A2 e 3A4. Questo comporta la necessità di aggiustare continuamente la posologia dei farmaci per ottenere una concentrazione plasmatica efficace. Jain [33], nel 2003, ha analizzato l’influenza dell’assunzione di lopinavir/ritonavir sulla concentrazione plasmatica di tacrolimus in 3 pazienti sieropositivi, sottoposti a trapianto tra il 1997 e il 2002. In tutti e tre i pazienti una volta ottenuto il dosaggio plasmatico terapeutico di tacrolimus veniva introdotta terapia HAART con lopinavir/ritonavir: si assisteva immediatamente ad un aumento delle concentrazioni plasmatiche di immunosoppressore, tali da indurre una riduzione del dosaggio fino ad una volta a settimana o addirittura interromperne l’assunzione per diversi giorni per riportare le concentrazioni plasmatiche ai range di normalità. Inoltre se veniva interrotta la terapia con lopinavir/ritonavir le concentrazioni plasmatiche di tacrolimus rientravano nei limiti di tollerabilità. 14 L’autore spiegava tale fenomeno come una completa inibizione da parte dell’inibitore delle proteasi dell’attività del citocromo P450 3A e quindi un’aumentata escrezione biliare, che a sua volta attivava il circolo enteroepatico, con un maggior assorbimento intestinale di tacrolimus. Bisogna però ricordare che la dose utilizzata nel 2002 di lopinavir/ritonavir era molto più alta di quella attuale (400/100 mg x 2 die vs 200/50 mg x 2 die), per cui le concentrazioni dell’immunosoppressore risentivano dell’effetto dose. Nel 2006 il gruppo di Guaraldi [34] ha pubblicato l’esperienza di due pazienti HIV positivi trapiantati di fegato per cirrosi a cui veniva somministrata ciclosporina 300 mg/die con una concentrazione plasmatica terapeutica tra i 250 e i 400 ng/mL; dopo 12 giorni era introdotta la HAART. Un paziente riceveva amprenavir boosterizzato con ritonavir, l’altro fosamprenavir da solo. A distanza di 48 ore dall’assunzione dei farmaci le concentrazioni plasmatiche della ciclosporina erano molto più alte nel primo paziente (1200 ng/mL vs 600 ng/mL), necessitando di una riduzione di 12 volte della dose (50 mg/die) rispetto all’altro paziente a cui veniva ridotta la dose di solo 3.5 volte (175 mg/die). Per cui considerando che entrambi i regimi HAART sono in grado di sopprimere la replica virale, è preferibile utilizzare un PI non boosterizzato. Nel 2007 il gruppo di Frassetto [35] ha condotto degli studi di farmacocinetica su 35 pazienti HIV positivi, sottoposti a trapianto di fegato o rene; un terzo di questi pazienti assumeva una HAART contenente un inibitore delle proteasi (PI), un terzo un analogo non nucleosidico (NNRTI) e un terzo una combinazione di entrambi (PI+NNRTI), tutti i pazienti associavano la ciclosporina come immunosoppressore. I soggetti che assumevano nevirapina (NNRTI) non necessitavano di cambiamenti di dosi o di intervalli nell’assunzione della ciclosporina, in quanto si mantenevano concentrazioni plasmatiche sovrapponibili a quelle dei pazienti HIV negativi. L’introduzione invece di efavirenz (NNRTI) determinava un aumento della dose dell’immunosoppressore (da 189 a 275 mg alla settimana 2 e da 147 a 279 mg alla settimana 12), a causa di una riduzione dei livelli plasmatici di ciclosporina del 30%. Quando invece si introduceva un PI era necessario ridurre le dosi di ciclosporina ed 15 aumentare gli intervalli di tempo dell’assunzione (57 mg ogni 21 ore se il PI era assunto da solo o 25 mg ogni 33 ore se il PI era associato a ritonavir). Se si analizzava infine il terzo dei pazienti che assumevano una combinazione di PI+NNRTI, quest’ultima non influenzava la dose di ciclosporina, ma determinava solo un allungamento dell’intervallo di assunzione. Da alcuni anni nuovi farmaci antiretrovirali, in particolare raltegravir e maraviroc, caratterizzati da un’attività più modesta nei confronti dei citocromi epatici e da un ottimo controllo viroimmunologico, vengono impiegati nella pratica clinica. Ripercorrendo l’analisi della letteratura degli ultimi anni, si può affermare quindi che la condizione di sieropositività non è di per sé una controindicazione assoluta al trapianto. 1.3 ESPERIENZA ITALIANA DEI TRAPIANTI DI FEGATO Il primo trapianto di fegato è stato eseguito in Italia nel 1982 a Roma; negli anni si sono aggiunti nuovi centri, fino ad un totale attuale di 19 centri autorizzati con un’attività complessiva di 800 trapianti. La qualità dei risultati è eccellente come risulta dall’ultimo report del Centro Nazionale Trapianti per il periodo 2000-2008: la sopravvivenza ad un anno del paziente e dell’organo è rispettivamente del 87.1% e del 83.2%. L’attività del centro di Ancona si pone in linea con la media nazionale con una sopravvivenza ad un anno del paziente e dell’organo del 82.5% e 80.3%; questi risultati sono ottenuti nonostante una complessità di casi molto alta, con un indice di rischio del donatore di 1.807 vs la media nazionale di 1.790 e con un indice di rischio per età del ricevente e caso complesso rispettivamente del 2.129 e 0.824 (rispetto una media nazionale del 2.090 e 0.886). 16 L’AISF ha istituito la prima commissione sul trapianto di fegato in Italia nel 1998, seguita da una seconda nel 2004, che ha prodotto il primo documento di indirizzo sul trapianto di fegato dove sono state riportate le indicazioni e controindicazioni al trapianto. Nel 2006 il Comitato di segreteria dell’AISF ha istituito una commissione permanente sul trapianto di fegato che nel 2008 ha revisionato le precedenti linee guida sul trapianto di fegato. 1.3.1 Indicazioni e controindicazioni al trapianto di fegato Malattie non neoplastiche Indicazioni consolidate al trapianto di fegato: Malattie colestatiche (cirrosi biliare primitiva, CBP; colangite sclerosante primitiva, CSP) ed autoimmuni; Cirrosi alcolica, purchè sia documentata, da almeno 6 mesi, la completa astensione dall’alcol; Cirrosi HBV e HDV correlata, purchè sia iniziata, nella fase pre-trapianto, terapia antivirale capace di abbattere e sopprimere la carica virale; Cirrosi HCV correlata. Indicazioni consolidate meno frequenti: Cirrosi criptogenetica, Malattia di Wilson, Cirrosi da emocromatosi genetica, Deficit di alfa1-antitripsina, Amiloidosi da transtiretina, Malattia di Budd-Chiari, Malattia policistica. Malattie neoplastiche Epatocarcinoma su cirrosi: I potenziali candidati a trapianto per HCC su cirrosi, non resecabili, debbono avere le seguenti caratteristiche: 17 presenza di un singolo nodulo di HCC (≤ 5 cm di diametro) oppure fino a tre noduli, ciascuno di diametro non superiore a 3 cm assenza di localizzazioni tumorali extraepatiche (linfonodali o in altre sedi metastatiche) assenza di invasione vascolare neoplastica dei principali rami venosi intraepatici (portali, sovraepatici) o extraepatici (vena porta, vena cava) confermata o sospettata alle valutazioni di imaging pre-operatorie. Tali criteri sono noti come Criteri di Milano e rimangono gli unici parametri validati in studi prospettici e nell’esperienza dei maggiori Centri. L’utilizzo di tali criteri comporta una sopravvivenza attesa del paziente a 5 anni pari a circa il 70% con una percentuale di recidiva tumorale inferiore al 25%. Indicazioni controverse o marginali al trapianto di fegato nell’adulto: Epatocarcinoma primitivo (HCC) “oltre” i criteri di Milano (espansione dei criteri convenzionali) Il downstaging (retrostadiazione) dell’epatocarcinoma (possibilità mediante tecniche di chemioembolizzazione o di termoablazione di mantenere o far rientrare entro i criteri di Milano soggetti con HCC originariamente considerati al di fuori di essi) Infezione da HIV Colangiocarcinoma (solo all’interno di protocolli sperimentali) Metastasi da tumori neuroendocrini (solo all’interno di protocolli sperimentali prospettici e associato alla creazione di un registro nazionale dei casi trattati) Emangioendotelioma epitelioide Neoplasie benigne 18 Controindicazioni assolute: Neoplasie maligne extraepatiche in atto Neoplasie maligne pregresse con risposta completa al trattamento e con follow-up <5 anni (salvo valutazione oncologica collegiale indicativa di basso rischio di recidiva neoplastica e/o metastasi) Trombosi portale neoplastica Epatocarcinoma primitivo, al di fuori delle indicazioni precedenti Colangiocarcinoma non resecabile, al di fuori delle indicazioni precedenti Insufficienza multi organo Ipertensione polmonare grave con PAM ≥ 45mmHg, non correggibile con terapia medica Sindrome epatopolmonare con saturazione di O2 < 50% in aria ambiente Infezione da HIV, al di fuori del Programma Nazionale di trapianto di fegato da cadavere in HIV, per i Centri che ne fanno parte Malattie cardiovascolari e polmonari avanzate (valutazione collegiale specialistica) Osteoporosi grave con fratture spontanee vertebrali e con impotenza funzionale HBV-DNA > 20.000 UI/ml al momento del trapianto Infezioni batteriche in atto sostenute da germi non identificati (tranne infezioni dell’albero biliare in trattamento), per le quali è possibile adottare una esclusione temporanea dalla lista attiva Dipendenza attiva da stupefacenti o da alcol Malattie psichiatriche gravi (schizofrenia, psicosi maggiori, severi disturbi della personalità). In questi casi poiché la vigente Legislazione Italiana non esclude la disponibilità di cure mediche, in particolare salvavita, nell’indicazione a trapianto di fegato appare ragionevole valutare gli ulteriori seguenti punti: I. la presenza di un 19 adeguato sostegno familiare e/o la possibilità di accedere in maniera efficace ai Servizi Sociali del territorio che garantiscano un supporto adeguato al fabbisogno del paziente; II. un giudizio qualificato specialistico psichiatrico, neurologico e psicologico; III. una valutazione globale pluridisciplinare del caso. Mancata compliance del paziente Disordine neurologico grave (malattia di Alzheimer, danni neurologici irreversibili, ecc.) Controindicazioni relative Trombosi portale parziale (non neoplastica) Interventi chirurgici pregressi estesi su organi addominali Obesità ( BMI > 30) Chirurgia pregressa dei quadranti superiori dell’addome Pazienti in terapia sostitutiva con metadone o analoghi. 1.3.2 Requisiti minimi per l’immissione in lista di trapianto di fegato nell’adulto Per ciascuna delle indicazioni consolidate al trapianto di fegato è raccomandato il rispetto di precisi criteri minimi per l’iscrizione in lista di attesa. Tali criteri hanno lo scopo di identificare attraverso strumenti diversi la severità della malattia epatica del paziente ed attribuire di conseguenza un rischio di mortalità nel breve-medio termine. Nel momento in cui tale rischio supera quello derivante dall’intervento di trapianto, il paziente viene ritenuto avere i requisiti minimi di candidabilità al trapianto epatico, che di norma si considerano quando il rischio di morte ad un anno è > 10%, corrispondente nel cirrotico ad un score di Child-Turcotte-Pugh (CTP) > 7. Cirrosi epatica (di qualunque etiologia) I requisiti minimi raccomandati per considerare un paziente cirrotico per l’inserimento in lista 20 di attesa per trapianto epatico sono: 1. Cirrosi con score di Child-Turcotte-Pugh ≥ 7 2. Cirrosi con score di Child-Turcotte-Pugh < 7 solo se associata ad episodio di recente scompenso (ascite severa, encefalopatia porto-sistemica, sanguinamento da varici gastro-esofagee, peritonite batterica spontanea) non dovuto a fattori precipitanti rimuovibili 3. Coesistenza di HCC entro i criteri di Milano anche con score di Child-TurcottePugh < 7 Malattie colestatiche croniche I modelli predittivi di sopravvivenza sono stati validati per la cirrosi biliare primitiva (CBP) e per la colangite sclerosante primitiva (PSC). In entrambe le patologie il criterio minimo di immissione in lista è legato alla presenza di un rischio di mortalità del paziente senza trapianto, ad un anno dall’osservazione, >10%. Un ulteriore criterio clinico può essere rappresentato dalla presenza di prurito intrattabile o di marcata astenia, gravemente condizionanti la qualità della vita. Età del candidato al trapianto di fegato Le curve di sopravvivenza dei pazienti sottoposti a trapianto di fegato in relazione all’età del ricevente nel periodo 1988-2005, dedotte dai dati del ELTR evidenziano come vi sia una significativa ridotta sopravvivenza sia a 5 che a 10 anni dal trapianto nei pazienti con età > 60 anni rispetto ai pazienti più giovani. La ridotta sopravvivenza è per lo più legata ad un peggiore stato nutrizionale, alla presenza di un più marcato depauperamento muscolare, alla maggior frequenza di severa encefalopatia epatica e di insufficienza renale al momento del trapianto e ad una maggior durata della ospedalizzazione post trapianto, sia nei reparti di terapia intensiva che nei reparti di degenza ordinaria. Recentemente è stato evidenziato inoltre come i riceventi 21 con età più avanzata presentino un rischio maggiore di mortalità post trapianto indipendente dal funzionamento del graft. Nonostante non vi sia un valore assoluto di età codificato per candidare o meno un paziente al trapianto di fegato, i dati scientifici, unitamente alla sempre crescente scarsità di organi in relazione alle richieste, indicano come in un ottica di razionalizzazione delle risorse, l’età massima alla quale candidare un paziente al trapianto epatico, in assenza di co-morbidità, non debba essere superiore a 65 anni. Epatocarcinoma (HCC) In pazienti con cirrosi epatica in classe A di Child-Turcotte-Pugh, rappresentano criteri minimi per l’inserimento in lista: presenza di nodulo singolo con dimensioni all’interno dei criteri di Milano, non trattabile con terapie curative alternative al trapianto (resezione, termoablazione, alcolizzazione) In pazienti con malattia cirrotica in classe B o C di Child-Turcotte-Pugh, rappresentano criteri minimi per l’inserimento in lista: presenza di noduli singoli o multipli, con caratteristiche dimensionali e di numero riconducibili a quanto previsto dai criteri di Milano 1.3.3 Requisiti per l’immissione in lista di attesa di trapianto di fegato nell’adulto con infezione da HIV Il 31 Maggio 2002 il Consiglio superiore di Sanità ha espresso parere positivo per l’avvio di un protocollo per il trapianto di fegato nel soggetto HIV positivo, sottolineando l’attività sperimentale del protocollo e la parità nelle scelte dei candidati al trapianto tra pazienti HIV negativi e HIV positivi. 22 I criteri per l’inserimento in lista trapianto di fegato sono identici a quelli dei pazienti HIV negativi; per i soggetti HIV positivi, però, sono stati inclusi criteri aggiuntivi per l’ingresso in lista trapianto di fegato. I criteri di inclusione sono i seguenti: Infezione da HIV documentata da test Elisa e confermata da Western blot Età superiore ai 18 anni e capacità di esprimere consenso informato Pazienti mai trattati con terapia antiretrovirale con conta di CD4+ circolanti ≥ 200 cell/microL Pazienti in terapia antiretrovirale con conta dei linfociti CD4+ circolanti ≥ 200 cell/microL, stabile da almeno 6 mesi e HIV RNA undetectable al momento dell’inclusione in lista Compliance al trattamento antiretrovirale e immunosoppressivo e alla profilassi delle infezioni opportunistiche, se indicata I criteri di esclusione sono i seguenti: Storie di patologie opportunistiche, per cui al momento attuale non sono possibili opzioni terapeutiche valide Diagnosi di sarcoma di Kaposi viscerale Storia di neoplasia (eccezion fatta per il carcinoma basocellulare e il carcinoma della cervice in situ con disease-free status documentata da almeno 5 anni). Nell’ottica di un protocollo sperimentale sono stati considerati anche gli end point che dovranno, in futuro, determinare l’efficacia, in termini di sopravvivenza, del protocollo stesso. Gli end point sono i seguenti: Sopravvivenza di organo e paziente a 1, 3 e 5 anni (end point primario) Percentuale di pazienti AIDS-free a 1, 2, 3, 4 e 5 anni dal trapianto Incidenza di complicanze infettive AIDS-correlate e non Incidenza di episodi di rigetto 23 Incidenza di infezioni da HCV e HBV e loro evoluzione nel post-trapianto Interazioni farmacocinetiche Variazioni della viremia di HIV e della conta dei linfociti CD4+ Variazioni della viremia dei virus epatitici e degli indici di funzionalità epatica. Il 14 ottobre 2009 il protocollo sperimentale è stato dichiarato concluso ed è stato avviato un Programma Nazionale “ Il trapianto epatico nei soggetti con infezione da HIV” che ricalca sostanzialmente le caratteristiche del precedente protocollo sperimentale per quanto riguarda i criteri di arruolamento in lista, l’unità di monitoraggio del CNT, i requisiti dei Centri Trapianto autorizzati, ecc. Per quanto riguarda i criteri aggiuntivi di inclusione sono stati modificati con i seguenti: Infezione da HIV documentata Capacità di fornire/acquisire il Consenso informato Pazienti mai trattati con terapia antiretrovirale con conta di linfociti CD4+ circolanti, stabilmente > 100/mmc. Pazienti in terapia antiretrovirale, senza precedenti infezioni opportunistiche “AIDS defining” con conta dei linfociti CD4+ >100/mmc, stabile da almeno 6 mesi. HIV-1- RNA undetectable al momento dell’inclusione in lista; è ammessa la presenza di attiva replicazione virale di HIV in pazienti con malattia epatica scompensata e, per tale motivo, intolleranti alla terapia antiretrovirale purchè presentino una documentata risposta alla terapia antiretrovirale nell’ultimo ciclo terapeutico Pazienti con storia di una o più patologie opportunistiche “AIDS defining” devono avere conta dei linfociti CD4 > 200/mmc, stabile da almeno 6 mesi e HIV-RNA undetectable, se in trattamento, o documentata risposta alla terapia antiretrovirale nell’ultimo ciclo terapeutico 24 Compliance al trattamento immunosoppressivo e antiretrovirale ed alla profilassi delle infezioni opportunistiche, se indicata I pazienti verranno monitorati, a cura del centro che ha in carico il paziente, per CD4 e HIVRNA con cadenza trimestrale durante la permanenza in lista d’attesa. La perdita di uno o più criteri di inclusione determina uscita temporanea dalla lista fino al recupero di validità di tutti i criteri di inclusione. Immodificati sono rimasti i criteri di esclusione come le procedure del programma. 25 Capitolo 2 DESCRIZIONE DELLO STUDIO 2.1 OBIETTIVI DELLO STUDIO Con questo studio abbiamo voluto valutare i risultati ottenuti nel trapianto di fegato in soggetti HIV positivi con coinfezione HCV presso il Centro Trapianti di Ancona dopo 4 anni di attività; il primo trapianto in un paziente HIV positivo, infatti, è stato effettuato il 22 aprile 2007. L’obiettivo primario è stato confrontare la sopravvivenza nel gruppo degli HIV positivi rispetto ad un gruppo di soggetti HIV negativi con coinfezione da HCV. Con gli obiettivi secondari sono state valutate: le cause del decesso il decorso della recidiva di HCV la frequenza della recidiva di HCC gli effetti del trapianto nell’evoluzione dell’infezione da HIV 2.2 MATERIALI E METODI Sono stati raccolti retrospettivamente i dati di una coorte di pazienti HIV positivi, affetti da cirrosi HCV scompensata, sottoposti a trapianto di fegato nel periodo 2005-2011 c/o il centro trapianti di Ancona e confrontati con la coorte di pazienti HIV negativi affetti da cirrosi HCV scompensata e sottoposti a trapianto di fegato nello stesso periodo. Tutti i pazienti selezionati rispondevano ai requisiti di inserimento in lista trapianto di fegato presenti nei protocolli nazionali. I pazienti affetti anche da HCC, inseriti in lista in accordo con i criteri di Milano, sono stati sottoposti a chemioembolizzazione o ablazione con radiofrequenza per 26 controllare la progressione di malattia quando necessario in base alla valutazione dei medici referenti. Per la valutazione dell’epatopatia di base sono stati considerati i punteggi di Child-Pugh e il Meld score. Tutti i pazienti, al momento dell’inserimento in lista, sono stati sottoposti ad accertamenti ematici, sierologici, strumentali, radiologici e a visite specialistiche (cardiologica, psicologica, dermatologica, anestesiologica) allo scopo di escludere la presenza di patologie o condizioni morbose che potevano controindicare il trapianto. I pazienti HIV positivi hanno effettuato ulteriori indagini utili alla valutazione della condizione viro-immunologica e ad escludere la presenza di infezioni opportunistiche in atto. In tutti i soggetti donatori è stata eseguita la sierologia per HIV, HBV, HCV, CMV e sono state effettuate biopsie sul fegato per determinare la presenza e l’entità della steatosi. Il trapianto di fegato è stato eseguito tramite allocazione, nel ricevente, di fegato proveniente da donatore cadavere. Il metodo di ricostruzione includeva, generalmente, anastomosi della vena porta del donatore con quella del ricevente, secondo la tecnica “piggy back”, ed anastomosi tra l’arteria epatica del ricevente e quella del donatore, con ricostruzione del dotto biliare o coledocodigiunostomia. Durante l’intervento, se necessario, sono stati infusi emazie, piastrine e plasma. La terapia immunosoppressiva è stata iniziata già nella fase immediata post trapianto con steroidi o Ab monoclonali (Simulect) e nelle 24-48 ore successive al trapianto è stato proseguito il trattamento con steroidi e tacrolimus o ciclosporina, con successiva aggiunta di everolimus o rapamicina o micofenolato. La terapia antiretrovirale è stata reintrodotta al momento della ripresa della funzionalità epatica (mediamente entro due settimane post-trapianto): è stata mantenuta, ove possibile, l’HAART assunta dal paziente nel pre-trapianto, sostituendo o eliminando farmaci potenzialmente epatotossici e/o mielotossici (come nevirapina, ritonavir, AZT, DDI, etc.). L’intolleranza alla HAART è stata definita come interruzione continua della terapia per danno tossico. 27 Tutti i pazienti, nel pre-trapianto, sono stati valutati per la sierologia HBV: i soggetti risultati positivi per HBsAg o anti-HBc sono stati profilassati, nel post-trapianto, con immunoglobuline antiHBs e con analogo nucleosidico/nucleotidico (entecavir, lamivudina, telbivudina, tenofovir). Nei pazienti HIV sieropositivi è stata introdotta, ove non controindicato, terapia HAART contenente farmaci attivi sia per HIV che per HBV (Tenofovir, Emtricitabina, Lamivudina); altrimenti, in caso di controindicazione per tossicità o inefficacia degli stessi è stato utilizzato un analogo nucleosidico attivo solo contro HBV (Telbivudina, Entecavir), sempre in soggetti che avevano soppressione della replica di HIV. Il monitoraggio dei CD4+ e della viremia HIV è stato eseguito ogni mese nei primi 6 mesi e successivamente ogni 3 mesi nei pazienti con valori stabilizzati. La riattivazione del citomegalovirus nel sangue periferico è stata monitorata tramite quantificazione del CMV DNA ogni settimana per i primi 2 mesi e successivamente ogni 2 settimane. I pazienti con valori superiori alle 400 copie/mL, confermati ad un prelievo successivo, anche in assenza di sintomatologia riferibile a malattia da CMV, sono stati trattati con terapia preemptive con Valganciclovir 450 mg 2cp x 2 per almeno 2 settimane (o fino alla negativizzazione del CMV DNA). I pazienti HIV positivi sono stati controllati ogni 3 mesi per la riattivazione di EBV, HHV6 ed HHV8. Tutti i pazienti hanno ricevuto profilassi per Toxoplasma gondii e Pneumocistis jiroveci con Cotrimoxazolo 160 mg 1 cp 3 volte a settimana fino al 12° mese post-trapianto; nella popolazione con infezione da HIV, la profilassi veniva mantenuta fino al raggiungimento di un valore stabile di 200 CD4+ cell/mL. E’ stata eseguita una biopsia epatica ogni 12 mesi nei primi 3 anni ed ogni qual volta si sia presentata l’indicazione clinica (aumento degli indici di citolisi, sospetto rigetto, reinfezione HCV). 28 Il danno da rigetto è stato verificato istologicamente e quantificato tramite la classificazione RAI; il trattamento prevedeva o un potenziamento dell’immunosoppressore e/o eventuali boli di metilprednisolone da 1 gr die per 3 giorni consecutivi. La recidiva di epatite da HCV è stata valutata tramite biopsia utilizzando lo score di Metavir. I pazienti sono stati monitorati anche tramite metodiche non invasive: Fibroscan, ecografia, TC, RMN. L’HCV RNA quantitativo è stato monitorato ogni mese nel primo anno e poi ogni 6 mesi. I pazienti che presentavano un quadro di epatite cronica attiva (documentata istologicamente) sono stati sottoposti a terapia antivirale con Interferon (standard o pegilato) associato a Ribavirina, secondo i protocolli degli standard internazionali. L’analisi statistica utilizzata comprende curve di sopravvivenza di Kaplan-Mayer e test del 2. 2.3 RISULTATI Sono stati valutati 100 pazienti sottoposti a trapianto di fegato presso il Centro trapianti di Ancona, da Aprile 2005 a Dicembre 2011, per cirrosi epatica HCV correlata (+ HBV/HDV). 16 pazienti erano HIV positivi e 84 pazienti HIV negativi. In entrambe le popolazioni era nettamente prevalente il sesso maschile (93,3% e 82,14%), l’età media era inferiore nel gruppo di pazienti HIV positivi, con una differenza statisticamente significativa rispetto alla popolazione monoinfetta (47,69 anni vs 52,62; p= 0.0389). Per quanto riguarda il MELD non vi era alcuna differenza statisticamente significativa tra i due gruppi, né al momento dell’immissione in lista né al giorno del trapianto (14,67 vs 14,37 p=0.8630; 16,53 vs 14,99 p=0.3937). 7/16 pazienti (43.75%) del gruppo dei coinfetti presentavano HCC al momento dell’inserimento in lista contro 31/84 dei pazienti monoinfetti (36.9%) (p=0.8656). Non è stato possibile risalire ai fattori di rischio della totalità dei pazienti; anche se la maggior parte delle infezioni era da riferire ad uso di sostanze d’abuso o trasfusioni di sangue. 29 La prevalenza dell’infezione da HBV in tutti i trapiantati era così distribuita (fig.1): 47; 51% 43; 47% 2; 2% antiHBs/antiHBc HBsAg+ Negativi Figura 1. Prevalenza infezione HBV I genotipi del virus HCV erano così rappresentati: il 61% dei pazienti presentava il genotipo 1, il 12% il genotipo 2, il 21% il genotipo 3, il 6% il genotipo 4. I sottotipi di HCV erano così rappresentati (fig. 2): 5 pz; 6% 10 pz; 12% 18 pz; 12% 11 pz; 13% 31 pz; 36% 10 pz; 12% 1a 1b 1c 3a 2 a/c 4 a/b Figura 2. Sottotipi HCV La maggior parte dei pazienti di entrambe le popolazioni era arrivata al trapianto con viremia HCV rilevabile (66% degli HIV+ vs 86% degli HIV-). 30 L’attesa in lista trapianto è stata significativamente più lunga nella popolazione sieropositiva rispetto alla monoinfetta (243 gg vs 130.3, p=0.0140). La situazione viro-immunologica dei pazienti HIV positivi rientrava nei criteri previsti dal Programma Nazionale: nel pre-trapianto presentavano tutti CD4+>200/mmc con una media di 290 CD4/mmc e viremia HIV non rilevabile. Un solo paziente presentava una viremia HIV positiva (7088 copie/mL) perché non in terapia HAART fino al momento dell’inserimento in lista. Tutti i pazienti HIV positivi affetti anche da infezione da HBV mostravano HBV DNA soppresso. Solo 4 soggetti avevano una storia di AIDS in passato (una diagnosi di criptococcosi disseminata nel 1991 e una di micobatteriosi atipica nel 1997, due pazienti erano stati classificati in stadio C2 secondo la classificazione dei CDC di Atlanta per il nadir dei CD4). La terapia HAART post-trapianto era costituita da una triplice comprendente 2 NRTI (ABC/3TC, TDF/FTC), associati ad un PI o, in alternativa, ad inibitore delle integrasi. Nel post-trapianto tutti i pazienti hanno presentato viremia HIV non rilevabile e una media di CD4 di 280 cell/mm3. La HAART è stata ben tollerata e non sono stati necessari cambi terapeutici per effetti collaterali e/o tossicità epatica e renale. Cum survival 1.0 HIV+/HCV+ HIV-/HCV+ 0.8 0.6 0.4 0.2 0.0 0 500 1000 1500 2000 2500 Days to outcome Figura 3. Curva di sopravvivenza di entrambe le popolazioni (1:HIV+HCV+, 2:HCV+) Due pazienti hanno presentato nel post-trapianto riattivazione di EBV: una trattata con successo con cicli di Rituximab; un paziente (OLT 3.1.11) ha presentato una debole 31 positivizzazione sierica dell’EBV-DNA (<2500/mmc) in assenza di segni e/o sintomatologia d’organo, dapprima monitorata e, successivamente trattata con ganciclovir. La sopravvivenza al follow-up della popolazione HIV+/HCV+ è del 53,3% (8/15) mentre la sopravvivenza della corte HIV-/HCV+ è del 67,1% (53/79, p 0.257). I pazienti HIV positivi sono deceduti a distanza di 274,287 giorni in media dal trapianto (14-698); mentre i pazienti monoinfetti a 308,48 giorni in media (1-2159). La sopravvivenza ad 1 e 3 anni nella popolazione HIV-HCV positiva è, rispettivamente del 75% e 57,14% contro il 76,38% e 69,4% della popolazione HCV positiva (Figura 3). Dei 7 pazienti HIV positivi deceduti, 1 è morto per recidiva fulminante di epatite C (135 giorni post OLT), 1 per complicanze chirurgiche colestatiche ed emorragiche con insufficienza epatica progressiva (115 giorni), 1 sottoposto a ritrapianto per primary non function e deceduto per emorragia dell’albero bronchiale il giorno dopo il ritrapianto, 1 per trombosi tardiva dell’arteria epatica (416 giorni), 1 per sindrome emolitica-uremica (698 giorni), 1 per recidiva di epatocarcinoma (279 giorni) ed uno per complicanze colestatiche croniche (263 giorni). Nella popolazione monoinfetta HCV si sono verificati 26 decessi: 2 per complicanze legate alla cirrosi (a 1201 e a 1391 giorni post OLT), 3 per recidiva di HCC (a 795, 363 e 179 giorni), 4 per primary non function, 3 per insufficienza epatica tardiva da complicanze chirurgiche (a 1105, 97 e 51 giorni), 3 per shock settico (a 42, 62 e 386 giorni), 2 per insufficienza cardiaca (a 9 e 15 giorni), 1 per arresto cardiaco alla riperfusione, 2 per shock emorragico (a 70 e 51 giorni), 1 per emorragia cerebrale (a 4 giorni), 1 per neoplasia polmonare post-trapianto (2159); di quattro pazienti non si conoscono le cause di morte perché persi al follow-up. Per quanto riguarda la recidiva di HCV è stato possibile valutare l’istologia solo in 58 pazienti (12 HIV positivi e 46 HIV negativi). I pazienti HIV positivi hanno presentato una recidiva istologica più precoce rispetto ai pazienti monoinfetti (p=0.041), con una media di 142 giorni (CI 95% 68.027-217.700) rispetto ai 314 giorni dei monoinfetti (CI 95% 238.259-389.869). 32 Nei pazienti non deceduti la progressione verso F2 si è verificata solo in un paziente HIV-HCV positivo a distanza di 420 giorni dal trapianto contro 9 pazienti monoinfetti HCV con una media di 687 giorni dal trapianto. Figura 4. Curva di progressione della recidiva di epatite HCV di entrambe le popolazioni (1:HIV+HCV+, 2:HCV+) Dei pazienti HIV + tre sono stati trattati con interferone pegilato e ribavirina: uno è risultato non responder con una progressione rapida della epatopatia verso l’insufficienza epatica; due hanno sospeso rispettivamente dopo tre mesi e dopo un mese per l’insorgenza di effetti collaterali, il primo per anemia severa che ha richiesto l’impiego di eritropoietina ed il secondo per depressione del tono dell’umore. Otto dei pazienti monoinfetti HCV+ seguiti presso la Clinica Malattie Infettive sono stati sottoposti a terapia antivirale con interferone-pegilato e ribavirina per recidiva istologica di HCV nel post-trapianto: 2 pazienti hanno raggiunto la risposta virologica sostenuta (SVR) nonostante il trattamento fosse stato sospeso anticipatamente per effetti collaterali (anemia ed insufficienza renale il primo e stato depressivo nel secondo); 1 RVR con successivo relapser; 4 non responder; 1 paziente ha avuto una negativizzazione della viremia HCV al III mese di trattamento, la terapia è tuttora in corso. 33 I pazienti HIV+ che al momento del trapianto presentavano una viremia HCV non rilevabile, risultato di risposta virologica sostenuta a pregresso trattamento antivirale pre-OLT, hanno mantenuto una viremia negativa nel post-trapianto ed una fibrosi assente alla biopsie di controllo. Per quanto riguarda poi il rischio di recidiva di HCC post trapianto: 1 paziente HIV positivo ha avuto una documentata recidiva surrenalica di HCC, che è stata trattata con successo chirurgicamente, senza ulteriori recidive, mentre un paziente è deceduto. Fra i monoinfetti, 3 pazienti hanno avuto una recidiva di HCC che ne ha determinato il decesso. 2.4 DISCUSSIONE Questa analisi di coorte retrospettiva non evidenzia significative differenze in termini di sopravvivenza complessiva tra i pazienti HCV monoinfetti e i pazienti HIV ed HCV positivi. Ad un anno dal trapianto i risultati sono comparabili (76,38% vs 75%), anche se a 3 anni si rileva una sopravvivenza più elevata nei soggetti mono infetti (69,4% vs 57,1%). Questo risultato è parzialmente in controtendenza con i risultati riportati in letteratura e può essere spiegato con il numero esiguo di pazienti coinfetti (16) e la loro disparità numerica rispetto alla popolazione dei monoinfetti (84). Inoltre molti dei pazienti analizzati hanno effettuato il trapianto in tempi recenti, per cui non è ancora possibile valutare il follow-up tardivo in un numero significativo di pazienti (a 3 e 5 anni) e questo potrebbe concorrere alla mancata differenza statistica. Nei pazienti deceduti il tempo intercorso tra trapianto e decesso risulta significativamente inferiore nei soggetti HIV positivi, tuttavia c’è da considerare che la maggior parte dei decessi sono riconducibili a complicanze non correlabili sia con l’infezione da HIV che con la recidiva di epatite cronica da HCV. 34 Per quanto riguarda invece la recidiva istologica di malattia, i risultati ottenuti sono in linea con i dati riportati in letteratura; infatti i pazienti coinfetti hanno una recidiva più rapida rispetto ai monoinfetti. Il fatto che uno solo dei pazienti HIV positivi viventi abbia presentato una progressione della fibrosi epatica verso F2 può trovare spiegazione nella tempistica relativamente recente degli ultimi trapianti, che non ha ancora permesso di osservare longitudinalmente l’outcome di molti pazienti. Pertanto non è stato possibile effettuare un’analisi di significatività statistica tra i due gruppi. Un limite di questo studio è senz’altro la mancata esecuzione di biopsie seriate in alcuni pazienti, che ha impedito di avere una visione completa ed esaustiva della recidiva di infezione da HCV in entrambe le popolazioni. Infatti a fronte di una presenza di HCV RNA quantitativo rilevabile nella maggioranza dei pazienti al trapianto, solo di 58 è stato possibile ottenere dati bioptici. Il rischio di recidiva di HCC nella nostra casistica non sembra maggiore nei pazienti HIV positivi rispetto agli HIV negativi, anche questo risultato risulta in controtendenza rispetto ad altri report della letteratura. Soltanto tre pazienti HIV positivi sono stati sottoposti a terapia antivirale con interferon pegilato e ribavirina nel post-trapianto; uno è risultato non responder, progredendo poi rapidamente fino al decesso per insufficienza epatica e gli altri due hanno sospeso il trattamento precocemente per intolleranza. Pertanto non è stato possibile effettuare un confronto tra i 2 gruppi sulla responsività alla terapia antivirale per HCV. La possibilità di avere una terapia antivirale efficace e poterla impiegare a tempi congrui può ridurre il rischio di recidiva HCV nel post-trapianto e le sue complicanze; i pazienti HIV positivi, giunti al trapianto con viremia HCV negativa, responder a pregresso trattamento con antivirale, non hanno manifestato una recidiva istologica di malattia. Per quanto riguarda i parametri viro - immunologici della popolazione coinfetta è risultato come tutti i pazienti abbiamo mantenuto una carica di HIV RNA non rilevabile e con una media di 35 CD4 ridotta nell’immediato post trapianto ma tornata a livelli solo lievemente inferiori al pre trapianto, nei mesi successivi. Due pazienti nel post trapianto hanno sviluppato un’infezione opportunistica (infezione da EBV), mentre non vi sono state variazioni della HAART per intolleranza o tossicità epatica e/o renale. 2.5 CONCLUSIONI Questo studio, seppur limitato dallo scarso numero di pazienti, mostra come il trapianto di fegato nei pazienti coinfetti HIV positivi sia una strada percorribile. La recidiva di epatite da HCV è sicuramente correlata con la viremia HCV al trapianto. Il decorso dell’epatopatia negli HIV positivi non si presenta significativamente peggiore pur considerando una più rapida positivizzazione della viremia nel post trapianto. Si sottolinea l’importanza del monitoraggio della recidiva di epatite HCV, attraverso l’esecuzione seriata di biopsie, in modo da valutare tempestivamente la compromissione istologica e selezionare i pazienti da sottoporre a terapia antivirale. Riuscire ad ottimizzare la terapia antivirale, individuando il momento migliore per effettuarla rimane un punto cruciale nella gestione di questi pazienti. Naturalmente i risultati ottenuti sono limitati dal numero ristretto di pazienti e dal tipo di studio retrospettivo, per cui sarebbe necessario verificarli nel contesto di una più ampia casistica di tipo multicentrico che consentirebbe anche di valutare un follow-up più lungo. 36 BIBLIOGRAFIA 1. Eva A. Operskalski & Andrea Kovacs, HIV/HCV Co-infection: Pathogenesis, Clinical Complications, Treatment, and New Therapeutic Technologies. Curr HIV/AIDS Rep (2011) 8:12–22 2. Chen TY, Ding EL, Seage Iii GR, and Kim AY: Meta-analysis: increased mortality associated with hepatitis C in HIV-infected persons is unrelated to HIV disease progression. Clin Infect Dis 2009, 49(10):1605–15. 3. Kuntzen T, Tural C, Li B et al. Intraepathic mRNA expression in hepatitis C virus and HIV/hepatitis C virus coinfection; infiltrating cells, cytokines and influence of HAART. AIDS 2008; 22:203-10 4. Barreiro P, Pineda JA, Rallon N et al. Influence of Interleukin-28B Single-Nucleotide Polymorphism on progression to liver cirrosis in Human Immunodeficency Virus-Hepatitis C virus-coinfected patients receiving Antiretroviral Therapy. Journal of Infectious Diseases 2011; 203:1629-36 5. Tzakis A.G. et al . Transplantation in HIV+ patients. Transplantation 1990; 49:354-8 6. Buscarat F. et al. An observational study of 11 french liver transplant recipients infected with Human Immunodeficiency Virus type 1. Clinical Infectious Disease 1994;19: 854-9 7. Fung J et al. Liver transplantation in patient with HIV infection. Liver Transplantation 2004; 10:S39-53 8. Ragni M et al. Survival of Human Deficiency Virus-infected liver transplantation recipients. Journal of Infectious Disease 2003; 188:1412-20 37 9. Norris S. et al. Outcomes of liver transplantation in HIV-infected individuals: the impact of HCV and HBV infection. Liver Transplantation 2004; 10: 1271-78 10. Duclos-Vallèe JC et al. Hepatitis C virus recurrence and liver mitochondrial damage after liver transplantation in HIV-HCV co-infected patients. Journal of heaptology 2005; 42: 341-9 11. De Vera ME et al. Serviva of liver transplant patients coinfected with HIV and HCV is adversely imparte by reccurrent hepatitis C. American Journal of Transplantation 2006; 6:2983-93 12. Mindikoglu AL et al. Impact of Human Immunodeficiency virus on survival after liver transplantation: analisys of United Network of Organ sharing Database. Transplantation 2008; 85: 359-68 13. Berenger M et al Natural history of clinically compensated virus related graft cirrhosis after liver transplantation Hepatology 2000; 32:852-858 14. Forns X, et al Antiviral therapy of patients with decompensated cirrhosis to prevent recurrence of hepatitis C after liver transplantation J Hepatology 2003; 39: 389-396 15. Shergill AK, et al Applicability, tolerability and efficacy of preemptive antiviral therapy in hepatitis C infected patients undergoing liver transplantation Am J Transplatation 2005; 5:118-124 16. Abdelmalek MF, et al Sustained viral response to interferon and ribavirin in liver transplant recipients with recurrent hepatitis C Liver transplantation 2004; 10:199-207 17. Berenger M et al. The association between hepatitis C infection and survival after orthotopic liver transplantation. Gastroenterology 2002; 122:889-96 38 18. Duclos-Vallèe JC et al. Survival and recurrence of hepatitis C after liver transplantation in patient coinfected with Human Immunodeficiency virus and hepatitis C virus. Hepatology 2008; 2:401-17 19. Wojcik et al. Antiviral therapy for hepatitis C virus recurrence after liver transplantation in HIV-infected patients: out come in Bonn color. AIDS 2007; 21:1363-5 20. Thio C et al. HIV-1, hepatitis B virus and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet 2002; 360:1921-6 21. Terrault NA et al. Outcome of patients with hepatitis B virus and Human Immunodeficiency Virus referred for liver transplantation. Liver Trnasplantation 2006; 12:801-7 22. Tateo M et al.long-term follow-up of liver transplanted HIV/hepatitis B virus coinfected patients: perfect control of hepatitis B virus replication in absence of mitochondrial toxicity. AIDS 2009; 23:1069-76 23. Coffin CS et al. Virological and clinical out come of hepatitis B virus infection in HIV/HBV coinfected transplant recipients. American Journal of Transplantation 2010; 10:1268-75 24. Bruno R et al. Management of hepatocellular carcinoma in Human Immunodeficiency Virusinfected patients. Journal of Hepatology 2006; 44:S146-50 25. Bruno S et al. Hepatitis C Virus Genotypes and Risk of Hepatocellular Carcinoma in Cirrhosis: A Prospective Study. Hepatology 1997; 25:754-8 26. Davila JA et al. Hepatitis C infection and the increasing incidence of hepatocellular carcinoma: a population-based study. Gastroenterology 2004; 127:1372-80 27. Szabo E et al. Similarities and differences in hepatitis B and C virus induced hepatocarcinogenesis. Pathol Oncol Research 2004; 10:5-11 39 28. Rosenthal E et al. Mortality due to hepatitis C-related liver disease in HIV-infected patients in France (Mortavic 2011 study). AIDS 2003; 17:1803-9 29. McGinnis KA et al. Hepatocellular carcinoma and non-Hodgkin’s lynphoma: the role of HIV, hepatitis C infection and alchol abuse. Journal of clinical Oncology 2006; 24:5005-9 30. Puoti M et al. Hepatocellular carcinoma in HIV-infected patients: epidemiological features, clinical presentation and out come. AIDS 2004; 18: 2285-93 31. Brau N et al. Presentation and out come of hepatocellular carcinoma in HIV-infected patients: a US-Canadian multicenter study. Journal of Hepatology 2007; 47:527-37 32. Vibert E et al. Liver transplantation for hepatocellular carcinoma: the impact of Human Immundeficiency Virus infection. Hepatology 2011; 53:475-82 33. Jain AB et al. Effect of coadministered lopinavir and ritonavir (Kaletra) on tacrolimus blood concentration in liver transplantated patients. Liver Transplantation 2003; 9:954-60 34. Guaraldi G et al. Pharmacokinetics interaction between amprenavir/ritonavir and fosamprenavir on cyclosporine in two patients with Human Immunodeficiency Virus infection undergoing orthotopic liver transplantation. Transplantation Proceedings 2006; 38:1138-40 35. Frassetto LA et al. Immunosuppressant pharmacokinetics and dosing modifications in HIVinfected liver and kidney transplant recipients. Amrican Journal of Transplantation 2007; 7:2816-20 40 41
Scarica