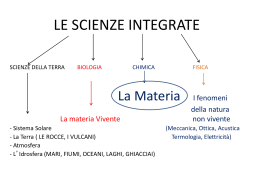
Corso di Chimica Medicina e Chirurgia Università degli Studi di Foggia Titolare Prof. Nazzareno Capitanio La Chimica studia la composizione, la struttura, le proprietà e le trasformazioni della materia. Cammino logico del corso Chimica generale: concetti fondamentali riguardanti la struttura dell’atomo, i legami, le soluzioni, gli equilibri, le reazioni, la termodinamica e la cinetica chimica, l’elettrochimica. LEZIONI ED ESERCITAZIONI Chimica organica: chimica del carbonio, principali gruppi funzionali e loro reattività. Propedeutica biochimica e biochimica: studio delle principali molecole di interesse biologico e loro ruolo nelle cellule viventi. G E N E R A L E O R G A N I C A Esaminare la storia della elaborazione di un modello è importante per rendersi conto di come avvenga lo sviluppo della conoscenza scientifica ed anche per capire che ogni modello non può essere considerato definitivo e perfetto: lo è solo fino a quando i dati sperimentali rientrano nel modello disegnato ed accettato; quando essi divergono, occorre modificarlo o, addirittura, cambiarlo totalmente. Schematizzazione dei processi che portano alla costruzione e al mantenimento di un modello scientifico. Lo schema rappresenta una elaborazione delle teorie di Popper: la realtà (cioè uno o più fenomeni reali), mediante processi di analogia, viene rappresentata in un modello; questo viene implementato (costruito razionalmente), generalizzato (anche ad altri fenomeni analoghi) e codificato (mediante strumenti e conoscenze matematiche viene espresso in modo "formale"); questa sequenza di processi porta ad una teoria. Ogni teoria deve essere poi falsificata (messa in crisi con nuove esperienze o utilizzando nuovi dati sperimentali), particolarizzata (applicata al fenomeno specifico) ed estesa (ad altri fenomeni). Se questa sequenza regge, il modello viene mantenuto; se non regge il modello deve essere adeguato (modificandolo) oppure può essere necessario anche cambiarlo totalmente. “La ricerca scientifica equivale a fare sesso … nel farla non si pensa alle ……conseguenze.” (J. Robert Oppenheimer) Leggi quantitative di base della chimica: 1. Conservazione delle masse (Lavoiser) 2. Proporzioni definite (Proust) 3. Proporzioni multiple (Dalton) Jackson Polok, Alchemy, 1947 Antoine Laurent Lavoiser (1743-1793) Legge di conservazione delle masse Durante una trasformazione chimica ordinaria non vi è guadagno né perdita apprezzabile di massa Nulla si crea nulla si distrugge tutto si trasforma M. ESCHER Legge delle proporzioni definite: Quando gli elementi si combinano per formare composti, essi lo fanno secondo proporzioni in peso definite. Proust Verifica delle leggi di Lavoisier e Proust CARBONIO + OSSIGENO ANIDRIDE CARBONICA + CARBONIO (grammi) OSSIGENO (grammi) ANIDRIDE CARBONICA (grammi) 0.818 2.727 12.00 2.182 7.273 32.00 3.00 10.00 44.00 CARBONIO + OSSIGENO ANIDRIDE CARBONICA + 32.0 12.0 + 15.0 44.0 32.0 + 44.0 3.0 carbonio residuo Legge delle proporzioni multiple: Quando due elementi si combinano per formare più di un composto, il loro rapporto in peso in un composto diviso per il rapporto in peso in uno qualsiasi degli altri composti, è dato da una frazione espressa numeri interi semplici. da John Dalton CARBONIO + OSSIGENO ANIDRIDE CARBONICA + 7.273 2.727 C/O 0.375 O/C 2.667 10 CARBONIO + OSSIGENO MONOSSIDO DI CARBONIO + 4.286 C/O 0.750 5.714 10 O/C 1.333 C/Oan.car. O/Can.car. C/Omon.car. O/Cmon.car. 1:2 2 :1 La legge delle proporzioni multiple è valida per quanto piccole siano le masse prese in considerazione. E’ quindi verosimile che andando a ritroso nell’infinitamente piccolo possiamo immaginare che le sostanze siano costituite da particelle elementari che si combinano secondo rapporti definiti. SE C/Oan.car. O/Can.car. C/Omon.car. O/Cmon.car. 1:2 2 :1 Se assumiamo che il monossido di carbonio sia la sostanza più semplice, con una particella di carbonio per ogni particella di ossigeno, vuol dire che nella anidride carbonica vi è una quantità di particelle di ossigeno doppia rispetto a quelle di carbonio ed è possibile definire per questa una formula chimica minima che sarà: CO2 Il monossido di carbonio avrà conseguentemente formula CO. C 1g + O 1.33 g O 1.33 g O 1.33 g C 1g O 1.33 g Anidride carbonica CO2 C 1g + O 1.33 g O 1.33 g C 1g Monossido di carbonio CO “Dividere un corpo significa separare gli esseri semplici, gli ‘ atomi’ che lo compongono; essi sono eterni, intrasformabili, indivisibili,impenetrabili. Gli atomi muovendosi in tutte le direzioni, possono urtarsi e rimbalzare mutando velocità; gli urti avvenuti di striscio originano i vortici che a loro volta sono capaci di generare corpi e mondi”. ………… “Secondo le convenzioni vi è un dolce ed un (Democrito di Abdera) amaro, un caldo ed un freddo, e secondo le convenzioni vi è un ordine. In verità vi sono atomi e vuoto.” Dal De Rerum Naturae di Lucrezio Teoria atomica di Dalton 1. Gli atomi degli elementi sono le particelle basilari della materia. Essi sono indivisibili e non possono essere né creati né distrutti. 2. Gli atomi di un dato elemento sono identici, avendo lo stesso peso e le stesse proprietà chimiche. 3. Gli atomi di elementi diversi si combinano tra di loro in rapporti di numeri interi semplici per formare le molecole di composti. 4. Gli atomi di elementi diversi possono combinarsi in più di un rapporto di numeri interi semplici per formare più di un composto. ELEMENTI, COMPOSTI , MISCELE Classificazione della materia : sostanze pure materia miscele elementi ( es. oro,ferro) composti(es. acqua,sale) di elementi(es. miscela Zn/Cu) di composti(es. miscela sale/acqua) di elementi e composti (es. miscela di azoto, ossigeno, ossido nitrico,anidride carbonica) Gli ELEMENTI sono sostanze formate da atomi dello stesso tipo. I COMPOSTI sono sostanze più complesse formate da atomi differenti che per mezzo di reazioni chimiche si decompongono in elementi. L’ ATOMO è la più piccola parte dell’elemento che conserva tutte le caratteristiche strutturali per l’identificazione dell’elemento a cui appartiene. Def. di FASE Per fase si deve intendere una porzione di materia che presenta una composizione omogenea e costante senza alcuna superficie di separazione. Una miscela in cui è presente una sola fase è detta omogenea. Tipico esempio sono le soluzioni (sale sciolto in acqua). Una miscela in cui è possibile evidenziare più di una fase è detta eterogenea o miscuglio. (Es. miscela di acqua e sabbia). Stati di aggregazione della materia e passaggi di stato gassoso brinamento ebollizione condensazione sublimazione solidificazione liquido fusione solido Stato gassoso : la materia è presente sotto forma di particelle in continuo movimento che occupano in modo omogeneo tutto il volume del recipiente di cui assumono la forma. diminuizione di T diminuizione di P Stato liquido : la materia è presente sotto forma di particelle tra le quali si esercitano forze di coesione che prevalgono su quelle di movimento che tendono ad allontanarle; pertanto i liquidi assumono la forma del recipiente ma hanno volume proprio. diminuizione di T diminuizione di P Stato solido : la materia è formata da particelle legate da forze attrattive o di coesione per cui le sostanze solide assumono una disposizione obbligata nello spazio avendo forma e volume propri. VISIONE SEMPLIFICATA DELL’ATOMO Un atomo può essere assimilato ad una minuscola sfera che occupa la parte centrale ( il nucleo), circondata da una nube di elettroni. p Protone : ha carica elettrica positiva (+) e presenta e n Neutrone : non ha carica elettrica ma presenta una massa pari a 1.674 x 10-24 grammi. e e e e una massa pari a 1.672 x 10-24 grammi. nucleo e e e e e Elettrone : ha carica elettrica con valore uguale a quella e n pn p p p p nn p p p n n n p nn p p npn e e e e e e e e ne del protone ma con segno negativo (-) e possiede una massa di circa 1840 volte inferiore rispetto a quella del protone. Un atomo neutro, chiaramente deve avere un uguale numero di protoni ed elettroni : p + e = carica elettrica netta uguale a zero e e e e e e Numero atomico (Z): n.ro dei protoni e e Ione positivo o catione e e e e e e e e e e e e e e e e e Ione negativo o anione Numero di massa (A): n.ro dei protoni + n.ro dei neutroni Le proprietà chimiche di un atomo e quindi il suo comportamento, dipendono dalla configurazione dello strato più esterno di elettroni appartenenti ad esso. Se questa figura fosse disegnata nella scala data da protoni e neutroni i quark e gli elettroni avrebbero le dimensioni di circa un millimetro e l’atomo di circa un chilometro 18 Settembre 2002 Recentemente antiatomi di anti-idrogeno (anti-H = anti-p + e+) sono stati prodotti al CERN, decelerando antiprotoni e antielettroni tenuti "imbottigliati" nel vuoto tramite campi magnetici. L'anti-idrogeno è più difficile da "imbottigliare" perché elettricamente neutro; la maggior parte degli antiidrogeni raggiunge una parete dove annichila con un atomo del mezzo. Oggi l'antimateria è usata ogni giorno in medicina per analizzare lo stato del cervello, tramite la tecnica chiamata Positron Emission Tomography (PET). La PET è un metodo di indagine che permette di misurare funzioni metaboliche e reazioni biochimiche in vivo ed ha larga applicazione nelle neuroscienze, in oncologia e cardiologia. Nella PET i positroni provengono dal decadimento di nuclei radioattivi che vengono incorporati in un fluido speciale, iniettato poi per via endovenosa al paziente. I positroni emessi annichilano con gli elettroni degli atomi vicini e danno luogo a due raggi gamma emessi in direzioni opposte. Essi vengono rivelati tramite opportuni rivelatori , disposti in "anelli" attorno al paziente, per individuare e registrare i punti in cui si sono verificate le annichilazioni e quindi ricostruire dove si è distribuito il radiofarmaco nel corpo. Tipica immagine di un esame PET che rappresenta l'attività metabolica cerebrale. La corteccia cerebrale e il cervelletto mostrano un'attività elevata (rosso), mentre le strutture profonde sono meno attive (verde e blu). Brain imaging with positron emission tomography (PET) reveals the different regions of the human brain active during various verbal tasks. Si definiscono ISOTOPI o NUCLIDI di un elemento, atomi che hanno lo stesso numero atomico Z, ma differiscono per il numero di massa A. numero di massa A X Z numero atomico ISOTOPI DEL CARBONIO e- n simbolo dell’elemento Alcuni isotopi sono stabili, altri ( i radioisotopi) sono instabili e tendono alla stabilità emettendo radiazioni (, o ) disintegrandosi in elementi stabili. + 12 6C p+ n = 12 - 6 = 6 sorgente radioattiva e- n p+ radioisotopo 14 6C n = 14 - 6 = 8 Deviazione delle radiazioni , e sotto l’azione di un campo elettrico. La stabilità o l’instabilità di un nuclide dipende dal rapporto n/p Grafico di stabilità e decadimento degli isotopi Curva di energia di legame per nucleone Fissione Gli isotopi in questa area emettono - Fusione Gli isotopi in questa area emettono + Regione di massima stabilità Difetto di massa Parte della massa (m) di un nucleo è stata convertita in energia (E) utilizzata come energia di legame nucleare : E = (m)c2 MASSA ATOMICA Nucleoni (protoni e neutroni) Ordine di grandezza : 10-24 g Si è convenuto di utilizzare la seguente grandezza come unità di riferimento: 1/12 della massa dell’isotopo 12C = 1.6605 x 10-24 g Tale massa è chiamata unità di massa atomica (u.m.a.) o equivalentemente Dalton (Da). Qualsiasi massa atomica quindi, è rapportata alla massa presa come riferimento (u.m.a.); pertanto la massa atomica è una grandezza relativa, e di conseguenza il valore numerico è puro, adimensionale. Massa atomica in g Riferimento : 1.66 x 10-24 g H : 1.673 x 10-24 g O : 2.656 x 10-23 g U : 3.951 x 10-22 g Massa atomica di riferimento Massa atomica relativa / / / / 1.66 x 10-24 g 1.66 x 10-24 g 1.66 x 10-24 g 1.66 x 10-24 g 1 1.008 15.99 238.03 Numero di massa massa espressa in Daltons contribuita dai protoni + neutroni presenti nel nucleo atomico A Z Numero atomico E numero dei protoni presenti nel nucleo Simbolo dell’elemento 10.811 B 5 Numero di massa 10.811 Numero atomico 5 B Simbolo dell’elemento Boro n: neutrone p: protone e: elettrone 10 B 5 : 10.0129 uma 19.91 % 11 B 5 % naurale degli Isotopi del BORO : 11.0093 uma 80.09 % Massa atomica del Boro in natura: 19.91x10.0129 + 80.09x11.0093 = 10.811 100 Per MOLECOLA si deve intendere la più piccola unità discreta, costituita da 2 o più atomi uguali o diversi, che mantiene le stesse caratteristiche chimiche del composto , ad es. H2O , NH3 , C6H12O6 . Peso Molecolare: somma dei pesi atomici di tutti gli atomi che costituiscono la molecola “discreta”. Per composti costituti da un insieme continuo di atomi si parla di formula empirica, che indica solo il tipo di atomi e in quale rapporto sono presenti, essendo per tali composti impossibile identificare una singola molecola, caso ad esempio dei composti ionici, ad es. NaCl , o delle strutture cristalline dei metalli. Peso Formula: somma dei pesi atomici di tutti gli atomi che costituiscono la formula empirica. Elementi e Allotropia Gli elementi sono sostanze formate da atomi dello stesso tipo; gli elementi possono essere formati da singoli atomi isolati (ad es. gas nobili come Ar o il Ne); oppure possono essere formati da un ben definito numero di atomi legati covalentemente (ad es. H2 , O2 , S8); inoltre possono essere costituiti da un insieme continuo di atomi sempre legati in maniera covalente (ad es. diamante, grafite), ed infine possono essere formati da un insieme continuo di atomi legati con legame metallico (ad es. Fe, Al). Si definiscono forme allotropiche quelle strutture molecolari che pur avendo lo stesso tipo di atomo differiscono per il numero di atomi e per il modo in cui sono legati tra loro. Es.: O2 (ossigeno molecolare) ; O3 (ozono) forme allotropiche dell’elemento ossigeno (O) grafite FORME ALLOTROPICHE DEL CARBONIO diamante fullerene MOLE MOLE: il chimico progetta operazioni per le quali deve misurare quantità di sostanza in base ad una espressione simbolica che rappresenta la reazione. Poiché non è pensabile che possa "contare" atomi o molecole, è utile definire una quantità di sostanza proporzionale al numero di entità (atomi, molecole, ioni...) che la costituiscono; si chiama mole una quantità di sostanza che contiene tante unità quanti atomi sono contenuti in 0,012 kg (12g) di 12C, cioè in una mole di isotopo 12 del carbonio, il consueto isotopo di riferimento. Il numero di unità contenute in una mole si chiama numero o costante di Avogadro (NA o N). Il suo valore si può ricavare dal rapporto fra 0,012 kg e 12 volte la massa unitaria: NA = 0,012 / (12 x 1,660531 x 10-27) = 6,022169 x 1023 mol-1 Il chimico usa questa costante non solo per misurare quantità di sostanza, ma anche per riferirsi a proprietà fisiche o chimiche; perciò normalmente una grandezza viene espressa rispetto ad una mole anziché ad un singolo atomo o molecola. Per esempio, l'E di ionizzazione E.I., che per un atomo di H è 21,8 x 10-19 J , viene generalmente espressa per una mole di H: E.I. = 21,8 x 10-19 J x 6,022 x 10-23 mol-1 = 131,28 x 104 J mol-1. Se si misura il volume di una mole di un elemento solido, questo volume, diviso per NA dà circa il volume di un atomo di quell'elemento. MOLE Quantità espressa in grammi pari alla massa della sostanza (atomo o molecola) espressa in unità di massa atomica. Es. NaCl (cloruro di sodio) P.A. Na : 22.99 d P.A. Cl : 35.45 d P.M. NaCl : 58.44 d 1 mole di NaCl 58.44 g Una mole di una qualsiasi sostanza contiene lo stesso numero di particelle , detto numero di Avogadro : N = 6.023 x 1023 Il numero di moli contenuto in una nota massa di una sostanza può essere calcolato dalla seguente relazione : Problema : dati 233.76 g di NaCl Risposta : n? n (moli) = numero di molecole ? n = 233.76 = 4 ; numero di molecole : 4 x N = 24 x1023 = 2.4 x1024 58.44 m (g) P.M. (g/mole) MA GLI ATOMI SI POSSONO VEDERE ? Scanning Tunneling Microscopy Scanning Tunneling Microscopy Ferro su Rame ATOMO IN GIAPPONESE Molecola di DNA a doppia elica Da " Pensieri " 1670 (72° pensiero) Blaise Pascal (1623-1662) ….. Io voglio fargli osservare ancora un nuovo abisso. Voglio dipingergli non solamente l'universo visibile, ma l'immensità che si può concepire nella natura, nel recinto di questo compendio di atomo. Ch'egli vi veda una infinità di universi, di cui ciascuno abbia il suo firmamento, i suoi pianeti, la sua terra, nella medesima proporzione del mondo visibile; …….. ……Perché infine, che cosa è l'uomo nella natura ? un nulla rispetto all'infinito, un tutto rispetto al nulla: una via di mezzo tra tutto e nulla. Infinitamente lontano dal comprendere gli estremi, per lui la fine e il principio delle cose sono invincibilmente nascosti in un segreto impenetrabile: egualmente incapace di vedere il nulla donde egli è tratto e l'infinito nel quale è inghiottito. Che farà egli dunque, se non percepire qualche apparenza dello stato medio delle cose in una disperazione eterna di non conoscere né il loro principio, né la loro fine ?
Scaricare