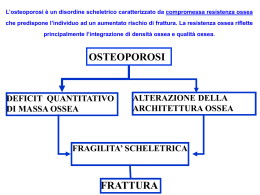
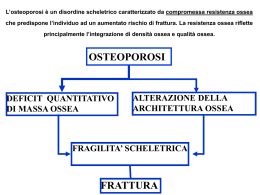
REGIONE LAZIO AZIENDA UNITA’ SANITARIA LOCALE FROSINONE Via A. Fabi, s.n.c. – 03100 FROSINONE – Tel. 0775 8821 Protocollo Clinico dell’Osteoporosi Definizione E’ una malattia sistemica dello scheletro caratterizzata dalla riduzione della massa ossea e da alterazioni qualitative strutturali della macro e microarchitettura dell’osso e delle sue proprietà materiali, che si accompagnano ad incremento del rischio di frattura. Come vedremo meglio in seguito, si distinguono due forme di osteoporosi: quella primitiva, che compare dopo la menopausa (postmenopausale) e/o nell’età avanzata ( senile ) e quella secondaria, determinata da un ampio numero di malattie croniche e dall’uso continuativo o prolungato di farmaci. (1) Epidemiologia L’osteoporosi è una malattia di rilevanza sociale e rappresenta un serio problema di salute pubblica in tutti quei Paesi, tra cui l’Italia , in cui si assiste ad un progressivo e crescente invecchiamento della popolazione. L’avanzare dell’età costituisce una essenziale condizione di perdita della massa ossea sia nei maschi che nelle femmine , ove le manifestazioni sono più precoci. In particolare, una donna trascorre oggi il 40% della propria esistenza in “postmenopausa” e questo stato di protratta carenza estrogenica induce cospicue perdite di massa ossea I risultati dello studio ESOPO (figura 1) , condotto nel 2001, su 16.000 soggetti , da 83 centri specialistici distribuiti in tutto il territorio nazionale, dimostrano che circa il 23% delle donne over 40 ed il 14% degli uomini over 60 è affetto da osteoporosi . Inoltre circa il 42% delle donne ed il 34% degli uomini in queste fasce di età presenta osteopenia e quindi un maggiore rischio di incorrere nella osteoporosi e nelle sue complicanze. Struttura Semplice di Staff di Direzione Generale Protocolli Assistenziali e Linee Guida Via A.Fabi, s.n.c. 03100 Frosinone Tel. 0775 882309 Lo sviluppo di questi dati porta a stimare che attualmente nel nostro Paese circa 3,5 milioni di donne e 1 milione di uomini siano portatori di osteoporosi, mentre oltre 6,5 milioni di femmine e 2 milioni di maschi siano affetti da osteopenia. (2) Figura 1. Prevalenza di osteopenia ed osteoporosi nella popolazione femminile Poiché , come i dati epidemiologici dimostrano , le femmine sono colpite dalla osteoporosi circa 4 volte di più dei maschi , anche i rischi e le complicanze fratturative sono diverse. Una ogni 2 donne e uno ogni 8 uomini over 50 avrà nei restanti anni di vita una frattura da fragilità del femore prossimale (F 17,5% ) (M 6% ) , della colonna vertebrale ( F15,6% ) (M 5%) e avambraccio distale (F 16% ) (M 2,5% ), ed i tassi di incidenza di frattura del femore crescono in modo esponenziale dal 65° anno di età , raddoppiandosi pressappoco ogni 5 anni e superando il valore di oltre 400/10.000 nelle donne over 85. ( 3 ) Le conseguenze delle fratture di femore, sia sotto l’aspetto della morbilità che sotto quello dell’impatto socio-economico, sono molto pesanti con una mortalità del 15-25% ed una disabilità motoria che colpisce più della metà dei pazienti nel corso dell’anno successivo all’intervento. ( 4 ) Tra gli anziani le fratture osteoporotiche costituiscono una delle maggiori cause di morte , con una incidenza pressoché sovrapponibile a quella degli ictus, del carcinoma mammario e quattro volte superiore a quella del carcinoma dell’endometrio. Il 50% delle donne con frattura del femore, invece , presenta un marcata riduzione del livello di autosufficienza che, nel 29% dei casi , richiede istituzionalizzazione a lungo termine.Inoltre si calcola che nel nostro Paese si verifichino , ogni anno , circa 80.000 fratture del femore , con un onere economico di oltre 800.000.OOO di euro per la sola assistenza ospedaliera. (tabella 1) ( 5 , 6 ) Tab.1 Incidenza e costi delle fratture di femore in Italia anno 2002 Sebbene le valutazioni sotto il profilo epidemiologico ed economico siano di netto appannaggio per le frattura del femore , in questi ultimi anni stanno emergendo anche le fratture vertebrali , che in due casi su tre , pari al 13%, non sono diagnosticate ( figure 2 e 3 ). In una donna che ha superato i 50 anni il rischio di avere nel corso della vita una frattura vertebrale è del 35%. Il 25% di tali soggetti possono incorrere in una nuova frattura nell’anno successivo ed il costo delle fratture ricorrenti è quattro volte superiore rispetto al costo medio della prima fattura.( 7 ) Figura 2 Incidenza fratture nelle donne Figura 3 Incidenza fratture nei maschi Appare pertanto evidente che, solo in tempi recenti, l’osteoporosi è stata collocata nella giusta dimensione assurgendo a malattia di rilevanza sociale e sanitaria, di cui si è iniziata la valutazione in termini di impatto socioeconomico, sia per gli aspetti legati alle fratture in fase acuta , sia per le complicanze, per la riabilitazione e per l’eventuale disabilità.( 8 ) Inoltre , visto che la terapia delle fratture varia da centro a centro , sia per un diverso approccio clinico che per l’utilizzo o l’accesso alla rete dei servizi postospedalaieri , si rende necessaria l’attivazione di un Registro Prospettico delle fratture di femore , già presente in altri Paesi , allo scopo di rendere omogeneo il profilo di cura di questi pazienti. ( 9 ) Anche in Provincia di Frosinone, l'impatto sociale della malattia Osteoporosi e' rappresentato dal grande numero di fratture di femore, rilevato nell’anno 2006 , attraverso le schede di dimissione ospedaliera registrate dal sistema SIS della nostra Azienda Sanitaria. Come indicatori della spesa sostenuta dal nostro SSN , limitatamente alle fratture femorali , possono essere rappresentativi tutti i DRG ( Diagnosis Related Groups ) di interesse ortopedico , relativi agli interventi ed alla degenza ospedaliera per questa tipologia di diagnosi principale: DRG 209, DRG 210, DRG 211, DRG 235 E DRG 236. Il totale di tutti questi DRG, nel solo anno 2006 , e' stato di 951 su una popolazione di circa 485.000 cittadini. Le fratture vertebrali , essendo nella maggioranza dei casi asintomatiche o paucisintomatiche, spesso sono misconosciute e non vengono ricoverate in ambiente ospedaliero. Pertanto , una indicazione dell'incidenza , potrebbe scaturire dall'analisi dei dati rilevabili dall'attivita' ambulatoriale dell'Ambulatorio di Metabolismo Osseo ed Osteoporosi del Polo C. Nel corso del secondo semestre dell'anno 2007 sono state eseguite 539 visite ortopediche per osteoporosi. E' stata applicata la nota AIFA 79 nella prescrizione della terapia, finalizzata alla riduzione del rischio di fratture da osteoporosi a n° 115 pazienti, cui l’esame radiografico del rachide evidenziava fratture atraumatiche di almeno un corpo vertebrale. Sono stati, tra l’altro, messi in trattamento farmacologico, a proprio carico, n° 308 pazienti che non rientravano nella nota 79, ma presentavano una bassa BMD e fattori di rischio fratturativo. Classificazione Così come accennato nella definizione distinguiamo osteoporosi primitiva e secondaria. L’osteoporosi primitiva e le fratture osteoporotiche riconoscono una multifattorialità patogenetica. Alcuni fattori accentuano il rischio di fratture essendo responsabili della riduzione di massa ossea , come il sesso femminile, ridotto apporto dietetico di calcio , attività fisica ridotta o scarsa e menopausa precoce. Altri fattori accrescono il rischio o rendono più severe le conseguenze di cadute come disabilità , abuso di benzodiazepine , fattori ambientali e abuso di sostanze alcoliche. Altri ancora hanno una azione sinergica sia sulla massa ossea che sui rischi di cadute accidentali come età , fumo , basso peso corporeo e carenza di vitamina D. I fattori di rischio di fratture osteoporotiche sono evidenziati nella tabella 2. Tab.2. Fattori di rischio di fratture osteoporotiche • • • • • • • • • • • • • • • • • • • Età Sesso femminile Menopausa prematura Amenorrea primaria e secondaria Ipogonadismo maschile primitivo e secondario Etnia europea o asiatica Storia di fratture atraumatiche Bassa densità minerale ossea Trattamento cortisonico Elevato turnover osseo Familiarità per frattura di femore Scarsa acuità visiva Basso peso corporeo Malattie neuromuscolari Fumo di sigaretta Eccessivo consumo di alcolici Immobilizzazione protratta Basso apporto di calcio Carenza di vitamina D Le forme secondarie di osteoporosi strettamente correlate a malattie croniche, ad abuso di sostanze come alcolici o droga o ad uso prolungato di farmaci, sono presentate nella tabella 3. In particolare, la terapia protratta con glucocorticoidi viene indicata come una delle principali cause di perdita della massa ossea, prevalentemente della componente trabecolare, con conseguente aumento del rischio di fratture, dopo appena pochi mesi di trattamento. Tab. 3. Condizioni associate ad osteoporosi • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • Ipogonadismo Ipercortisolismo Iperparatiroidismo Ipertiroidismo Iponatriemia Diabete mellito tipo 1 Acromegalia Deficit GH Malattie mielolinfoproliferative Mieloma multiplo Mastocitosi sistemica Talassemia Malattie croniche epatiche Celiachia Malattie infiammatorie croniche intestinali Gastrectomia Intolleranza al lattosio Malassorbimento intestinale Insufficienza pancreatica Artrite reumatoide LES Spondilite anchilosante Artrite psoriasica Sclerodermia Ipercalciuria idiopatica Acidosi tubulare renale Insufficienza renale cronica Broncopneumopatia cronica ostruttiva Anoressia nervosa Emocromatosi Fibrosi cistica Malattie metaboliche Trapianto d’organo Alcoolismo Fumo Tossicodipendenza Farmaci (cortisonici, diuretici, ciclosporina ,ormoni tiroidei ecc) Immobilizzazione prolungata Grave disabilità Clinica La perdita di sostanza ossea postmenopausale è assolutamente asintomatica e proprio per questo sottostimata. ( 10 ) La sintomatologia dell’osteoporosi è quindi “silente” e le uniche manifestazioni cliniche che evidenziano la presenza di osteoporosi sono le fratture vertebrali , femorali e del polso, generalmente conseguenza di traumi di lieve entità. Le fratture vertebrali da osteoporosi sono le più frequenti nelle donne in menopausa e, generalmente, si verificano alla giunzione dorso-lombare e meno frequentemente nel tratto medio-dorsale. In linea di massima si tratta di fratture non sintomatiche, diagnosticate incidentalmente, con l’esecuzione di indagini radiologiche effettuate per altri motivi. Uno studio recente evidenzia che circa il 50% delle deformazioni vertebrali, presenti sui radiogrammi, non sono refertate dai radiologi e in un alto numero di casi , anche se refertate sulla radiografia , non sono oggetto di alcuna terapia. (11) Queste fratture sono gravate da accresciute morbilità e mortalità ; circa il 20% di queste recidivano nell’anno successivo (12) ed il rischio di fratture in altre sedi , come femore e polso, è aumentato. (13,14) Le deformazioni vertebrali si associano poi a riduzione della statura , dolori acuti e recidivanti o cronici alla colonna vertebrale , deformazione della gabbia toracica, disabilità e riduzione della qualità della vita.(15,16,17) Infine le fratture vertebrali si accompagnano al elevata mortalità legata non solo alle complicanze polmonari da modificazioni della gabbia toracica , ma anche a cause diverse (18) e rappresentano un indice di cattivo stato di salute ( figura 4). Figura 4. Effetti delle fratture vertebrali osteoporotiche Diagnosi L’inquadramento clinico di pazienti affetti o con sospetto di osteoporosi deve necessariamente basarsi su una valutazione clinica completa, sulla identificazione dei fattori di rischio e sulla valutazione della densità ossea ( osteopenia/osteoporosi ). La valutazione anamnestica delle fratture da fragilità del femore e del polso è molto più semplice di quanto non lo siano quelle vertebrali , che spesso non sono clinicamente evidenti ma che hanno una notevole rilevanza diagnostica, prognostica e terapeutica . E’ indispensabile eseguire un attento esame obiettivo finalizzato ad escludere altre cause di osteopenia o ad individuare malattie croniche o fattori di rischio, capaci di causare o contribuire alla riduzione della massa ossea. Un recente studio ha infatti dimostrato che in circa il 30% delle donne affette da osteoporosi, la malattia veniva innescata da altre patologie non sospettate, di cui esse erano portatrici, come per esempio la Malattia Celiaca, sempre più facilmente identificabile dalla comparsa in commercio di tests colorimetrici e di metodiche EIA. (19) In condizioni sospette di frattura vertebrale, per presenza di sintomatologia tipica, per ridotta altezza >3cm , per ipercifosi , per deformità della gabbia toracica , per età avanzata o per marcata riduzione dei valori densitometrici dell’osso, si impone una radiografia della colonna dorso-lombare in proiezione laterale con esame morfometrico. La definizione di frattura vertebrale, fornita dal CUF nelle pubblicazioni sulla G.U. n.° 281 del 01/12/1998 e sulla G.U. n.° 7 del 10/01/2001, con la famosa “nota 79”, richiede, sia nelle donne che negli uomini, la misura dei corpi vertebrali ( Morfometria Vertebrale ), almeno nei casi di deformazioni lievi che sono, comunque, piuttosto frequenti nell’osteoporosi. Come precisato nella suddetta nota , “la frattura di un corpo vertebrale deve essere documentata da un esame radiologico” e, quindi, il Medico Radiologo deve verificare la presenza della frattura vertebrale con il proprio referto, ricorrendo, in presenza di lievi deformazioni dei corpi vertebrali, alla loro misurazione. L’accertamento delle fratture di grado lieve, infatti, è particolarmente importante in quanto, pur essendo asintomatiche, esse rappresentano comunque un fattore di rischio elevato, per la successiva insorgenza di fratture sintomatiche di grado più elevato. Per tale ragione, si ricorre alla Morfometria Vertebrale, metodica che, misurando le altezze dei corpi vertebrali, permette di definire in maniera oggettiva e riproducibile le fratture vertebrali. Tale metodica, diffusa nel Nord Europa e negli USA da ormai dieci anni, in Italia viene attualmente usata solo in alcuni Centri Specializzati per lo studio dell’osteoporosi. Si sottolinea, tuttavia, che la morfometria vertebrale è già stata inserita tra le “prestazioni di assistenza specialistica ambulatoriale erogabili nell’ambito del SSN e relative tariffe”, pubblicate nel supplemento della G.U. n.° 216 del 14/09/1996 alle voci 87.23 ed 87.24, relative alle radiografie delle colonna dorsale e lombosacrale. La morfometria vertebrale si esegue misurando le tre altezze, anteriore (Ha), centrale (Hm) e posteriore (Hp) del corpo vertebrale, sui radiogrammi del rachide dorsale e lombare, eseguiti in proiezione laterale. Per ottenere una misura precisa dei corpi vertebrali, è indispensabile che la proiezione sia perfettamente laterale: nei radiogrammi laterali devono apparire una sola limitante superiore ed una sola limitante inferiore, per cui il paziente deve essere attentamente posizionato, ricorrendo, nei casi necessari come nella scoliosi, all’uso di supporti correttivi. Dapprima si misura l’altezza posteriore della vertebra in esame: tale altezza non deve essere inferiore a mm. 4 (15%), rispetto alla media dell’altezza posteriore delle vertebre adiacenti superiore ed inferiore, ricordando che le altezze posteriori dei corpi vertebrali aumentano in senso cranio caudale fino ad L3. Una volta stabilita la normalità dell’altezza posteriore della vertebra in esame, si procede alla misura delle altezze centrale ed anteriore, che vanno confrontate con l’altezza posteriore stessa. I tipi di fratture vertebrali osteoporotiche vengono così definiti: - frattura a cuneo: riduzione di almeno 4 mm. o del 15% dell’altezza anteriore rispetto l’altezza posteriore (Ha/Hp<85%) - frattura mono-biconcava: riduzione di almeno 4mm. o del 15% dell’altezza centrale rispetto l’altezza posteriore (Hm/Hp<85%) - frattura da compressione (collasso): tutte le tre altezze vertebrali sono ridotte di 4 mm. o del 15% rispetto alla media delle corrispondenti altezze delle vertebre adiacenti superiori ed inferiori. La morfometria può essere effettuata manualmente misurando, con un righello, direttamente sulle radiografie, le altezze della vertebra sospetta di frattura. Esistono, comunque, in commercio dei software dedicati per eseguire la morfometria computerizzata di 14 corpi vertebrali, da D4 sino ad L5, sulle immagini radiologiche digitalizzate mediante scanner o tramite visualizzazione diretta con CR o DR. In conclusione, al Medico Radiologo possono giungere queste richieste dai Medici convenzionati con il SSN: - “Rx colonna dorsale e lombosacrale per osteoporosi” - “Rx colonna dorsale e lombosacrale per sospetta frattura vertebrale” - “Rx colonna dorsale e lombosacrale con morfometria vertebrale” - “Morfometria vertebrale” In tutti questi casi, nel referto dell’esame radiologico della colonna vertebrale dorsale e lombosacrale in proiezione laterale, il Medico Radiologo dovrebbe anche riferire sulle altezze vertebrali: ad esempio “altezze vertebrali normali”, oppure “frattura a cuneo di D8 per riduzione dell’altezza anteriore oltre 4 mm., rispetto l’altezza posteriore”. Ciò comporterà, ovviamente, la misura, manuale o computerizzata, delle altezze soltanto di quel corpo vertebrale che, “ad occhio”, appare lievemente “deformato”, ma che potrebbe risultare “fratturato”, secondo i criteri enunciati dalla CUF nella nota n.° 79. ( 20,21,22,23 ) La diagnosi di frattura vertebrale, quindi, si basa su una diminuzione > 4 mm o del 15% dell’altezza anteriore o centrale del corpo vertebrale , rispetto alla sua altezza posteriore. Il parametro rilevabile del 15%, è da riferire a soggetti con corpi vertebrali la cui altezza del muro posteriore è inferiore ai 2.5 cm. In caso di crollo anche del margine posteriore, il riferimento delle altezze va fatto con quello delle vertebre sovra e sottostanti integre, come indicato dall'analisi semiquantitativa proposta dal Genant. ( Figura 5) Figura 5. Analisi semiquantitativa secondo Genant. Il laboratorio è di scarsa utilità nell'osteoporosi primitiva, poiché tutti i parametri relativi al metabolismo fosfo-calcico sono nella norma, mentre è indispensabile nella diagnosi delle forme secondarie. La sua utilità risiede, quindi, nella diagnostica differenziale. In tutti i pazienti , al di là del quadro clinico , vanno richiesti esami semplici di laboratorio, definiti di 1° Livello ( tabella 4) poco costosi che, nella maggior parte dei casi, sono in grado di escludere le forme più comuni di osteoporosi secondaria, in quanto non esiste alcuna anomalia biochimica tipica dell’osteoporosi primitiva. Tab. 4. Esami di Laboratorio di primo livello • VES • Emocromo completo • Protidemia frazionata • Calcemia • Fosforemia • Fosfatasi alcalina (ALP) ed eventualmente l’isoenzima (IsoAlp) • Transaminasi • Creatininemia • Calciuria delle 24 ore • Calciuria a digiuno (Ca/creatinina sulle urine della seconda minzione) Emocromo, VES e profilo proteico servono ad escludere malattie ematologiche di tipo neoplastico. Calcemia e fosforemia servono ad escludere iperparatiroidismo, ipoparatiroidismo, ipercalcemie paraneoplastiche, osteomalacia. In presenza di alterazioni del quadro proteico la calcemia va corretta per l'albuminemia: Ca corretto (mg/dl) = Ca misurato (mg/dl) + 0,8 x [(4 - Albumina (gr/dl)] Le ALP sono utili nella diagnosi differenziale fra osteoporosi e osteomalacia, essendo più elevate in quest'ultima. La calciuria delle 24 ore è strettamente correlata all'assorbimento intestinale di calcio. L'assorbimento netto intestinale di calcio è uguale a Calcio alimentare assorbito - calcio secreto con le secrezioni intestinali Una riduzione della calciuria, deve fare sospettare un ridotto assorbimento intestinale di calcio e, prima ancora della modifica di un qualsiasi altro parametro biochimico, deve suggerire di ricercarne le cause. Un aumento della calciuria può essere dovuto o ad eccessivo introito di calcio e/o di vitamina D o ad elevata perdita renale. Per differenziare le due forme, è utile determinare la calciuria a digiuno (elevata nelle forme renali) e rideterminare la calciuria delle 24 ore, dopo una settimana di dieta priva di latte e latticini. Con una dieta ipocalcica, la supplementazione media alimentare di calcio viene ad essere di circa 400 - 500 mg al giorno. Se la calciuria si riduce al di sotto di 150 mg/die, è probabile che all'origine vi sia stato un eccessivo introito/assorbimento di calcio ; se la calciuria non si riduce o si riduce di poco è probabile si tratti, invece, di una forma renale, che dovrà essere corretta con l'assunzione di diuretici tiazidici. Se la storia clinica , l’esame obiettivo ed eventuali alterazioni degli esami biochimici di primo livello , suggeriscono altre cause di riduzione della massa ossea , è consigliabile l’esecuzione di esami più costosi e mirati , in rapporto al sospetto clinico, definiti di 2° livello (Tabella 5). Tab. 5. Esami di laboratorio di secondo livello TSH Paratormone sierico 25-OH-vitamina D sierica Cortisoluria Testosterone libero nei maschi Elettroforesi proteine urinarie Anticorpi anti gliadina Esami specifici per patologie associate Marker specifici di turnover osseo La misurazione del 25OHD, fornisce indicazioni sullo stato della vitamina D dell'individuo e sulla possibilità di ritrattarlo nel caso essa sia carente. • • • • • • • • • L'aumento del PTH può identificare un iperparatiroidismo primario, se associato ad ipercalcemia e ipofosforemia, o secondario, se associato a calcemia normale o tendenzialmente bassa. Un breve periodo di trattamento con calcitriolo, è in grado di normalizzare i livelli di PTH nel caso di iperparatiroidismo secondario. L'ipercalcemia, associata a bassi livelli di PTH, deve far sospettare la presenza di una neoplasia. Il dosaggio del TSH, nelle persone anziane, serve ad escludere un ipertiroidismo che spesso, in età avanzata, può manifestarsi con segni clinici molto sfumati e atipici (fibrillazione atriale, depressione, ecc.). I markers specifici del turnover osseo. Negli ultimi 20 anni si sono sviluppati numerosi metodi di dosaggio di prodotti del metabolismo del collagene o di sostanze secrete dalle cellule ossee, nel tentativo di valutare e monitorare modificazioni del metabolismo osseo, non facilmente individuabili con altre tecniche. Nonostante le numerose ricerche al riguardo, non è ancora stato possibile individuare un sicuro marker, in grado di apprezzare lievi modificazioni del turnover scheletrico, perché nella maggior parte dei casi, se non in tutti, i markers non riflettono esclusivamente il metabolismo osseo, ma anche quello di altri tessuti. Inoltre, nell'ambito di uno stesso processo di rimodellamento osseo, alcuni markers risultano più indicativi per le modificazioni che avvengono in una fase piuttosto che in un'altra. Anche se i processi di rimodellamento osseo sono strettamente accoppiati, e quindi, teoricamente, l'aumento di un marker di riassorbimento riflette anche un aumento dell'osteoformazione, i markers vengono clinicamente distinti in markers del riassorbimento e markers della neoformazione ossea. Markers del riassorbimento osseo. Ad eccezione della fosfatasi acida tartrato-resistente, enzima presente negli osteoclasti, gli altri markers del riassorbimento osseo sono rappresentati da prodotti di degradazione del collagene: Idrossiprolina Glucosidi dell’idrossilina Crosslinks dell'idrossipiridinolina ( piridinolino e desossipiridinolino ) Telopeptidicarbossi-terminali del collagene Telopeptidiamino-terminali del collagene Sialoproteina ossea Fosfatasi acida tartrato-resistente (TRAP) Markers della neoformazione ossea Fosfatasi alcalina totale e suo isoenzima osseo Osteocalcina Propeptidi del procollagene di tipo I Variabilità preanalitica dei markers di rimodellamento L'interpretazione dei dati fornitici dal dosaggio dei markers, deve tener conto di vari fattori che influenzano la riproducibilità dei risultati;essi possono essere suddivisi in due grandi categorie: • fattori non controllabili • fattori controllabili Fattori non controllabili Età. I markers di rimodellamento osseo sono più elevati nei bambini che negli adulti. Essi sono molto elevati nei primi anni di vita (fino a 5-10 volte) e incominciano a diminuire nell'epoca post-puberale. Il nadir viene raggiunto attorno ai 40 anni. In seguito, nell'uomo, non si modificano in maniera significativa o tendono lievemente ad aumentare. Nella donna aumentano bruscamente alla menopausa e rimangono elevati per il resto della vita. La riduzione della funzione renale che si verifica in tarda età giustifica l'aumento, nelle popolazioni molto anziane, dei markers che vengono metabolizzati dal rene. Sesso. I markers tendono ad essere più elevati nei giovani uomini che nelle giovani donne. Nella popolazione anziana, invece, sono più elevati nelle donne che negli uomini. Razza. I soggetti di razza nera presentano livelli di markers più bassi dei loro coetanei di razza bianca, in entrambi i sessi. Nelle donne, tuttavia, tale differenza può apparire evidente solo dopo la menopausa Fratture. Dopo una frattura, i markers aumentano del 20-50% e rimangono elevati fino a 6-12 mesi dopo la frattura. Un aumento ingiustificato dei markers, in un soggetto con bassa massa ossea, può essere indicativo di una frattura vertebrale asintomatica. Gravidanza e lattazione. Le richieste di calcio da parte del feto sono più evidenti nel terzo trimestre di gravidanza e, in genere, vengono soddisfatte da un aumento dell'assorbimento intestinale di calcio piuttosto che da un aumento dei processi di riassorbimento osseo. Tuttavia, già dal quarto mese, si assiste ad un lieve aumento dei markers di riassorbimento osseo, seguito, poche settimane dopo, da un aumento dei markers di osteoformazione. Al termine della gravidanza l'NTX può risultare aumentato di 3 volte rispetto ai valori basali, il PINP può mostrare valori del 60% maggiori di quelli osservati nelle donne non gravide. Al contrario degli altri markers, l'osteocalcina diminuisce e talora può risultare indosabile durante la gravidanza, suggerendo una clearance placentare della molecola. Dopo il parto i markers persistono elevati fino alla fine della lattazione, raggiungendo valori doppi di quelli osservati nelle donne che non allattano. Farmaci.I farmaci inibitori del riassorbimento osseo determinano una rapida caduta dei markers, fino al 70% in meno del valore iniziale. Tale caduta si verifica nel giro di poche settimane e può essere considerata un indice di efficacia della cura. Questo, anzi, sembra rappresentare l'unico utilizzo pratico dei markers nello studio dell'osteoporosi. I cortisonici riducono l'osteocalcina, ma non modificano sostanzialmente le fosfatasi alcaline. I marker del riassorbimento osseo possono invece risultare modestamente elevati. I farmaci anticonvulsivanti e gli analoghi del GnRH, aumentano i markers di turnover osseo, mentre i diuretici tiazidici li riducono. Contraccezione orale.La terapia contraccettiva orale determina una modesta riduzione dei markers di turnover osseo, solo nelle donne di oltre 35 anni. Immobilità. L'immobilità o la mancanza di gravità determinano un rapido e marcato incremento dei markers di riassorbimento osseo. I crosslinks del piridinolino aumentano dopo solo due giorni di riposo a letto, e raggiungono il massimo aumento (circa il 40% in più rispetto ai valori basali) dopo una settimana. Essi restano poi costanti fino a che dura lo stato di immobilità. Fattori Controllabili Ritmo circadiano.I markers di rimodellamento osseo sono più alti di notte che di giorno, raggiungendo uno zenith attorno alle ore 2.00 e un nadir attorno alle 13-23. Le variazioni circadiane sono maggiori per i markers di riassorbimento che per quelli di osteoformazione e tra lo zenith ed il nadir possono osservarsi differenze di oltre il 50%. La fosfatasi alcalina ossea sembra differenziarsi da questo ritmo circadiano, mostrando un picco massimo tra le 11.00 e le 14.00 e, forse, un altro modesto picco attorno alle 23.00. L'assunzione di calcio, specie se serale, o di bisfosfonati sopprime il ritmo circadiano dei markers di riassorbimento osseo. La presenza di ritmi circadiani così importanti rende essenziale programmare la raccolta delle urine o il prelievo di sangue in tempi ben definiti. Ciclo mestruale. Le variazioni dei markers nel corso del ciclo mestruale sono molto modeste e da taluni negate. Sembra che i markers di neoformazione ossea siano più sensibili dei markers di riassorbimento alle modificazioni ormonali del ciclo mestruale, essendo più elevati (15-20%) nella fase luteinica. Variazioni stagionali. L'osteocalcina è più elevata durante l'invermo che durante la primavera. Al contrario, le fosfatasi alcaline sono più alte in primavera e più basse in inverno. I markers di riassorbimento sembrano essere più elevati durante la stagione invernale, ma le variazioni sono modeste, dell'ordine del 10-15%. Attività fisica. L'attività fisica persistente e continuativa riduce i markers di osteoformazione (specie PICP) del 15-20% rispetto ai livelli osservati in soggetti sedentari della stessa età. Lo sforzo fisico acuto, al contrario, aumenta sia i markers di formazione che i markers di riassorbimento in misura variabile del 15-40%. Tale aumento persiste fino a 3 giorni dopo la cessazione dell'esercizio fisico. Dieta. Solo l'idrossiprolina è influenzata dal contenuto di collagene nella dieta; i più moderni markers di riassorbimento e di formazione ossea non lo sono. Markers di rimodellamento osseo e perdita ossea Un improvviso aumento del turnover scheletrico, come quello che si verifica dopo ovariectomia bilaterale, è seguito da un rapido aumento dei markers di riassorbimento e, dopo alcuni mesi, dall'aumento dei markers di osteoformazione. Dato che i processi di rimodellamento osseo seguono una stessa sequenza (attivazione - riassorbimento - formazione), l'inizio contemporaneo dell'attività delle BMU è accompagnato da una vistosa perdita ossea, dovuta al riassorbimento osseo che si verifica in numerosi siti scheletrici. Tanto maggiore è il numero delle BMU attivate, tanto maggiore è la perdita ossea. Poiché il numero di BMU attivate nell'unità di tempo esprime il turnover osseo, i markers di rimodellamento osseo, specie quelli di riassorbimento, sono correlati indirettamente all'entità della perdita ossea. Questa correlazione è valida solo per casistiche numerose e non può essere applicata ai singoli individui. Così non è possibile prevedere l'entità della perdita ossea in un singolo paziente di cui si conoscono i livelli dei vari markers. Markers di rimodellamento osseo e rischio di frattura Le fratture costituiscono, in pratica, l'unica complicanza dell'osteoporosi. Molti fattori concorrono a determinare il rischio di frattura, ma i più importanti sono quelli correlati alla densità ossea ed alla microarchitettura scheletrica. Per ogni deviazione standard di diminuzione della densità ossea, raddoppia il rischio di frattura. Le donne con bassa densità ossea e turnover scheletrico elevato hanno un rischio di frattura maggiore di quelle con pari densità ossea, ma turnover lento. Poiché i markers sono correlati al turnover osseo, un aumento dei loro livelli sierici o urinari consente di identificare con maggior precisione le donne maggiormente a rischio di frattura. Quest'affermazione è stata dimostrata in numerosi studi prospettici per i markers di riassorbimento osseo, mentre vi sono ancora molti dubbi sull'utilità dei markers di osteformazione. Monitoraggio della terapia dell’Osteoporosi I farmaci inibitori del riassorbimento osseo sono largamente impiegati nella terapia dell'osteoporosi. Alcuni di essi si sono dimostrati realmente efficaci nel prevenire le fratture e nell'aumentare la densità ossea. Questi effetti, tuttavia, sono evidenziabili solo dopo anni di cura e non sono uguali per tutti gli individui trattati. Il monitoraggio dei markers di riassorbimento osseo, invece, rappresenta un valido elemento per saggiare la risposta individuale alla terapia antiosteoporotica, in quanto una loro diminuzione testimonia l'efficacia dei farmaci nel ridurre l'attività osteoclastica. I bisfosfonati, specie l'alendronato, il pamidronato ed il risedronato, sono quelli più attivi e sono in grado di ridurre del 60-80% i livelli dei più sensibili markers di riassorbimento (ad esempio NTX e CTX), entro poche settimane dall'inizio della cura. Per alcuni mesi il livello di questi markers resta basso, ma, successivamente, tende ad aumentare, anche se non raggiunge mai i livelli precedenti alla terapia. Il raloxifene e la calcitonina determinano riduzioni più modeste, ma significative, dei markers di riassorbimento, dell'ordine del 20-40%. Sono stati sviluppati dei modelli matematici che, in base alla diminuzione dei markers di riassorbimento osseo, osservata dopo 3-6 mesi di cura, possono calcolare il recupero di massa ossea dopo due anni. Certamente, questi modelli possono avere un senso se applicati ad intere popolazione, e non al singolo paziente. Le variazioni dei markers di neoformazione ossea sono sempre molto più modeste e tardive ed iniziano ad essere evidenti solo dopo alcuni mesi di terapia. Nei pazienti con osteoporosi, il riscontro di un aumento notevole dei markers di rimodellamento osseo deve far sospettare la presenza di altre malattie metaboliche (osteomalacia, neoplasie, ecc.). Markers utilizzati nella pratica clinica Vanno considerati vari fattori, quali il costo del dosaggio, la variabilità intrinseca od estrinseca, la reale utilità nel valutare il metabolismo osseo. Nella malattia di Paget, il solo dosaggio della fosfatasi alcalina totale è sufficiente a monitorare l'andamento della malattia e a stabilire l'efficacia di una cura. In linea di massima, per lo studio del metabolismo osseo, valgono le seguenti indicazioni: -dosare un solo marker di riassorbimento e uno di formazione -tipo di marker riassorbimento U-DPD neoformazione ALP ossea, Osteocalcina -raccolta dei campioni siero dalle 7.00 alle 9.00 dopo una notte di digiuno urineprima o secondaima prima prima o seconda minzione del mattino, dopo una urine di digiuno (rapportanotte di notte digiuno (rapportare valore alla creatinina) -intervallo fra le misure riassorbimento prima della terapia poi a 3 e a 6 mesi formazione prima della terapia poi a 6 mesi Quando la riduzione può considerarsi significativa per predire un aumento della massa ossea > +3%? Crosslinks da - 20% a - 30% ALP e OC da - 20 a - 40% Attualmente questi marcatori non servono per la diagnosi di osteoporosi , né per stimare il bilancio osseo tra neoformazione e riassorbimento.Come indici complessivi di turnover osseo potrebbero invece rivelarsi utili nel monitoraggio della terapia e , secondo alcuni studi , nella valutazione del rischio di frattura. E’ stato infatti osservato che il grado di turnover osseo è correlato alla velocità di perdita di massa ossea ed è un predittore indipendente del rischio di frattura. Tuttavia , poiché si tratta di osservazioni ricavabili solo da ampie casistiche e considerati il costo e l’attuale grande variabilità biologica ed analitica di tali markers , il ruolo di questi ultimi nella gestione clinica del singolo paziente è ancora in discussione. Nella pratica clinica, come indice di laboratorio di turnover osseo, è spesso sufficiente il dosaggio della fosfatasemia alcalina totale nei pazienti senza concomitanti patologie epatiche o intestinali. L’utilità dei markers laboratoristici nel monitoraggio della terapia dell’osteoporosi nel singolo paziente è ancora in discussione, a causa della loro elevata variabilità biologica, analitica e dei costi. (24-40) DIAGNOSTICA STRUMENTALE La Diagnostica strumentale si basa sulla densitometria ossea che permette di misurare in modo accurato e preciso la massa ossea , consentendo la diagnosi strumentale, la valutazione del rischio di frattura, il monitoraggio della malattia ed il successo terapeutico. Le metodiche attualmente in uso sono principalmente tre : la DEXA, l'indagine ultrasonografica QUS e la tomografia computerizzata quantitativa QCT. La DEXA (Dual Energy X-ray Absorptiometry ) e' la metodica più diffusa per la valutazione della densita' ossea. E' un esame rapido che comporta una minima esposizione alle radiazioni ionizzanti ed è riconosciuto come “ gold standard” , per la determinazione della massa ossea. Consente di valutare sia la BMC che la BMD a livello dei primi 4 metameri vertebrali lombari, sul collo femore ed , in alcuni casi , al radio distale. L'accuratezza dell'esame, a livello vertebrale , potrebbe essere condizionata da alcuni parametri, che devono essere corretti dall'esecutore. Per tale motivo nei pazienti con età superiore ai 65 anni e' preferibile l'esecuzione dell'esame al collo femore. La valutazione “total body” non trova riscontro clinico di predittivita' del rischio di frattura. Esistono evidenze di I livello che la DEXA fornisce la migliore stima per il rischio di frattura nelle donne in postmenopausa. Il rischio relativo di frattura aumenta di 1,5-3 volte per ogni deviazione standard di riduzione del valore della densità minerale ossea (unità di T score). Le valutazioni densitometriche a radio, calcagno, colonna e femore prossimale sono in grado di predire il rischio di ogni tipo di frattura, anche se ogni sede densitometrica predice meglio il rischio di frattura per la sede misurata. La valutazione densitometrica “total body” non ha ancora sufficienti documentazioni in termini di predittività del rischio di frattura. Alcuni indici ultrasonografici dell’osso sono risultati predittivi del rischio di frattura in donne in menopausa in maniera non inferiore alla DEXA. Pertanto, nell’impossibilità di una documentazione DEXA, un basso valore ultrasonografico , in presenza di altri fattori di rischio clinico per frattura, è ritenuto adeguato per definire la soglia di intervento terapeutico. Il valore esprime l’aumento del rischio relativo (con intervallo di confidenza al 95%) per ogni calo del valore di una deviazione standard (T score) La valutazione delle variazioni della massa ossea nel tempo possono essere utili sia per monitorare l’efficacia di alcune terapie, sia per individuare soggetti che stanno perdendo osso ad una velocità eccessiva. L'esame ultrasonografico quantitativo (QUS), soprattutto quello calcaneare, fornisce oltre a indici indiretti riconducibili alla massa ossea , parametri della integrità ossea, che sicuramente, in un futuro prossimo, troveranno riscontri in clinica. L’indagine ultrasonografica quantitativa , fornisce due parametri (velocità ed attenuazione), che sono indici indiretti di massa e integrità strutturale ossea. Questi indici, talora combinati in uno cumulativo , sono predittivi del rischio di frattura in donne in menopausa , in maniera non inferiore alla DEXA. I dati relativi alla popolazione maschile , sono simili a quelli ottenuti nella popolazione femminile, ma non sono ancora conclusivi. L’impiego combinato degli ultrasuoni e della densitometria può migliorare la predizione del rischio di frattura. Dal momento che l’ultrasonografia non misura direttamente la densità o il contenuto minerale osseo, non può essere usata per la diagnosi dell’osteoporosi secondo i criteri OMS. Un ulteriore limite di questa indagine è la ampia eterogeneità di strumenti che danno valori non correlabili tra loro. L’indagine ultrasonografica, anche considerando i costi relativamente più bassi rispetto alla DEXA, può essere raccomandata per uno screening di primo livello. La tomografia computerizzata quantitativa (QCT), invece, consente la misurazione della densita' vera a livello di substrutture ossee , ma espone i pazienti alle radiazioni ionizzanti , che sono circa 300 volte superiori a quelle della DEXA. L'indagine strumentale densitometrica e' refertata esprimendo la distanza, misurata in deviazioni standard (distanza con il valore medio), rispetto ai controlli normali del giovane adulto con picco di massa osseo ottimale Tscore, oppure con la distanza dai valori medi rilevati in soggetti di stesso sesso ed età Z-score . Questo tipo di refertazione consente la diagnosi strumentale come stabilito dalla Organizzazione Mondiale della Sanita' come segue: • Normalità , T-score fino a -1,0 deviazioni standard • Osteopenia , T-score da – 1,0 a -2,5 deviazioni standard • Osteoporosi , valori superiori a – 2,5 deviazione standard. La tomografia computerizzata quantitativa o QCT ( Quantitative Computerized Tomography ) , consente di misurare oltre che BMC e BMD anche la densità vera (g/cm3 di tessuto) a livello di substrutture ossee , come ad esempio la componente trabecolare o corticale e l’area sezionale. La tecnica DEXA è stata , sinora , preferita alla QCT vertebrale per precisione , tempi di scansione più brevi, calibrazione più stabile, minore dose di radiazioni e per costi inferiori. Esiste anche una strumentazione QCT dedicata allo studio di segmenti ossei periferici (p-QCT) , ma la diffusione e le esperienze cliniche con questa metodica sono ancora limitate. (41-53) Criteri di Appropriatezza Prescrittiva Le difficoltà economiche attraversate dal nostro Paese impongono necessariamente di tenere sempre sotto controllo il governo clinico della gestione sanitaria . Lo sviluppo delle conoscenze in Medicina , i progressi della ricerca scientifica e la crescita della tecnologia applicata alla diagnosi e terapia , consentono alla classe medica, una vasta gamma di strumenti utili nella soluzione di tanti problemi. Muoversi in questa molteplicità di soluzioni, in assenza di chiare e valide raccomandazioni, comporta un elevato livello di variabilità che può produrre interventi inefficaci, con un inutile dispendio di risorse ed inutili rischi per i pazienti. La diffusione delle informazioni scientifiche, a volte non proprio corrette, da parte dei media e la crescita dell’attenzione, da parte del cittadino sui temi della salute, possono ingenerare false aspettative e la percezione di aver subito interventi inefficaci. Pertanto si impone alle Aziende Sanitarie e agli Operatori della salute l’esigenza di riferimenti basati sull’appropriatezza, sulla efficacia e sulla equità, garantendo così al cittadino, di fronte ai suoi bisogni di salute, lo stesso trattamento a qualsiasi latitudine si trovi. Proprio in relazione all’appropriatezza, sono stati definiti da 18 Regioni Italiane, tra cui il Lazio, e stabiliti nel 2005 dal Ministero della Salute ( 52 ), i criteri di accesso alla Densitometria. Tale esame, infatti, prescrivibile ma senza le caratteristiche di urgenza, ha come principale finalità la valutazione del rischio di frattura ed è indicato solo quando è rilevante nella gestione clinica del paziente. Attualmente non vi sono evidenze scientifiche né stime costo-beneficio tali da giustificare la Densitometria come screening di massa, ma l’indicazione al suo impiego è solo su base individuale e quando ricorrano specifiche condizioni di rischio clinico come: fratture da traumi minimi e nella conferma del dubbio diagnostico di osteoporosi. E’ certamente inappropriato, in assenza di fattori di rischio osteoporotico, nel caso in cui il paziente lamenti sintomatologia dolorosa e segni e sintomi attribuibili ad artrosi, rachialgie o lombosciatalgie. • • • • • • • • • Pertanto i criteri di accesso alla Densitometria Ossea sono: Pregresse fratture da fragilità Riscontro radiologico di osteoporosi Donne in menopausa con anamnesi familiare di frattura osteoporotica in età <75 anni Donne in menopausa in età <45 anni Donne in menopausa con indice di massa corporea inferiore a 19/Kg/m2 Donne in post-menopausa con presenza di uno dei seguenti fattori di rischio: inadeguato apporto di Vitamina D, fumo > 20 sigarette/die e abuso di alcool > 60 gr/die Donne in menopausa precoce o chirurgica Donne ed uomini in trattamento prolungato con farmaci, come: corticosteroidi, levotiroxina, antiepilettici, anticoagulanti (eparina), immunosoppressori, antiretrovirali, sali di litio, agonisti del GnRH, chemioterapia e radioterapia in età pediatrica Donne ed uomini in presenza di condizioni patologiche a rischio di osteoporosi, come: amenorrea primaria non trattata, amenorrea primaria da oltre un anno, ipogonadismi, iperparatiroidismi, S. di Cushing, acromegalia, deficit di GH, iperprolattinemia, diabete mellito di tipo 1, rachitismo/osteomalacia, sindromi da denutrizione, anoressia nervosa e sindromi collegate,celiachia, sindomi da malassorbimento, malattie infiammatorie croniche intestinali severe(MICI), epatopatie croniche colestatiche, fibrosi cistica, insufficienza renale cronica, sindrome nefrosica, tubulopatie croniche, ipercalcemia idiomatica, emopatie con rilevante coinvolgimento osseo(mielosa, linfoma, leucemia, thalassemia, drepanocitosi, mastocitosi), reumatismi infiammatori cronici (artrite reumatoide, e patologie reumatiche correlate) e connettiviti sistemiche, patologie genetiche con alterazioni metaboliche e displastiche dell’apparato scheletrico, trapianto d’organo, allattamento o immobilizzazioni >3 mesi, paralisi cerebrale, distrofia muscolare ed atrofia muscolare e spinale L’iter diagnostico della Osteoporosi nella AUSL Frosinone, è strettamente collegato alle risorse strutturali, professionali e soprattutto tecnologiche, che sono costituite da: • una apparecchiatura Densitometrica DEXA allocata al Polo C - Sora ● una apparecchiatura ad ultrasuoni calcaneare al Polo A - Ferentino ● un Ambulatorio per lo studio la diagnosi e la terapia , del “Metabolismo Osseo ed Osteoporosi”, allocato al Polo C - Sora Gli accessi alle prestazioni, erogabili dalla AUSL Frosinone, sono gestiti dal RECUP Regionale e quindi fruibili facilmente da tutti gli utenti. Il primo approccio al paziente prevede la valutazione dei fattori di rischio, familiari e personali, che, comparati ai valori densitometrici, consentono di esprimere un rischio fratturativo individuale. Nei pazienti, sottoposti per la prima volta a valutazione per Osteoporosi, in presenza di valori densitometrici bassi e fattori di rischio rilevanti, vengono richiesti esami bioumorali di 1 livello ( Tabella 4) allo scopo di consentire la diagnosi differenziale delle forme secondarie dalla più frequente osteoporosi post-menopausale, e vengono prescritte le radiografie del rachide dorsale e lombosacrale con esame morfometrico, anche per monitorizzare, nella maniera più congrua il soggetto. Per ulteriori approfondimenti, quando con gli esami di primo livello non sono sufficienti a dirimere i quesiti diagnostici, si passa agli esami di secondo livello. ( Tabella 5) Spesso può essere utile il ricorso ai marcatori specifici bioumorali, per la valutazione del metabolismo osseo. Attualmente i marcatori utilizzati sono la Desossipiridinolina, come marker di riassorbimento osseo, e l'isoenzima osseo della Fosfatasi alcalina, come marker di osteoformazione. E’ prevedibile, in un prossimo futuro, l'introduzione routinaria di altri marcatori che hanno dimostrato una valenza scientifica appropriata ( CTX, NTX) Di regola viene eseguito un controllo clinico a 6 mesi, soprattutto per valutare l'aderenza al trattamento farmacologico e non farmacologico e per evidenziare la presenza di eventuali effetti collaterali. I controlli strumentali densitometrici di regola vengono eseguiti a seconda della valutazione clinica, ma mai prima dei 12 mesi per i pazienti osteoporotici gravi, 18 mesi nei pazienti osteopenici e 24/36 mesi nei pazienti con fattori di rischio ma con massa ossea nella norma. Per i pazienti oncologici, in particolare quelli in trattamento con inibitori delle aromatasi, sono previste corsie preferenziali per consentire, in tempi certi, i controlli oncologici e gli aggiustamenti terapeutici. Trattamento farmacologico Per quanto riguarda la terapia è necessario rispettare l’appropriatezza prescrittiva ed il rapporto costo-beneficio, che sono affrontati nella Nota 79, riproposta integralmente, allo scopo di lasciare a chi legge l’onere di risolvere le differenze interpretative tra prescrittori ed autorità sanitarie. (54) Nota 79 AIFA (Agenzia Italiana del Farmaco). La prescrizione a carico del SSN è limitata alle seguenti condizioni a rischio: • soggetti di età superiore a 50 anni in cui sia previsto un trattamento > 3 mesi con dosi > 5 mg/die di prednisone o dosi equivalenti di altri cortisteroidi. Ac. Alendronico, ac risedronico, ac alendronico+vitamina D3. • Soggetti con pregresse fratture osteoporotiche vertebrali o di femore • Soggetti di età superiore a 50 anni con valori di T-score della BMD femorale o ultrasonografica del calcagno < - 4 ( o > - 5 per ultrasuoni delle falangi) • Soggetti di età superiore a 50 anni con valori di T- score della BMD femorale o ultrasonografica del calcagno < - 3 ( o < - 4 per ultrasuoni delle falangi) e con almeno uno dei seguenti fattori di rischio aggiuntivi: Storia familiare di fratture vertebrali Artrite reumatoide e altre connettiviti Pregressa frattura osteoporotica al polso Menopausa prima 45 anni di età Terapia cortisonica cronica Ac,alendronico, ac. Aendronico+vitamina D3, ac risedronico, ac. Ibandronico, raloxifene, anelato di stronzio. • Soggetti che incorrono in una nuova frattura vertebrale moderata-severa o in una frattura di femore in corso di trattamento con uno degli altri farmaci della nota 79 (alendronato, risedronato, raloxifene, ibandronato, ralenato di stronzio) da almeno un anno per una pregressa frattura vertebrale moderata-severa. Soggetti, anche se in precedenza mai trattati con gli altri farmaci della nota 79 (alendronato, risedronato, raloxifene, ibandronato, ranelato di stronzio ), che si presentano con 3 o più fratture vertebrali severe (diminuzione di una delle altezze dei corpi vertebrali > 50% rispetto alle equivalenti altezze di corpi vertebrali adiacenti integri) o con 2 fratture vertebrali severe ed una frattura femorale prossimale. La nota si applica su diagnosi e piano terapeutico, della durata di 6 mesi prolungabili di ulteriori periodi di 6 mesi per non più di altre due volte ( per un totale complessivo di 18 mesi), di Centri Specializzati, Universitari o delle Aziende Sanitarie, individuate dalle Regioni e dalle Province autonome di Trento e Bolzano. Teriparatide, ormone paratiroideo. Prima di avviare la terapia con i farmaci sopraindicati, in tutte le indicazioni è raccomandato un adeguato apporto di calcio e vitamina D, ricorrendo, ove dieta ed esposizione solare siano inadeguate, a supplementi con sali di calcio e vitamina D3 (e non ai suoi metabolici idrossilati). La prevenzione delle fratture osteoporotiche deve anche prevedere un adeguato esercizio fisico,la sospensione del fumo e la eliminazione di condizioni ambientali favorenti i traumi. Non deve essere dimenticato, infine, che tutti principi attivi non sono privi di effetti collaterali per cui va attentamente valutato il rapporto vantaggi e rischi terapeutici. Inoltre la loro associazione è potenzialmente pericolosa e va pertanto evitata. Per l’applicazione della Nota 79 la valutazione della massa ossea con tecnica DEXA o ad ultrasuoni deve essere fatta presso strutture pubbliche o convenzionate con il SSN. La prescrizione va fatta nel rispetto delle indicazioni e delle avvertenze della scheda tecnica dei singoli farmaci Legge 94/03 art.3). Background Il trattamento dell’osteoporosi deve essere finalizzato alla riduzione del rischio di frattura. I provvedimenti non farmacologici ( adeguato apporto di calcio e vitamina D, attività fisica) o la eliminazione di fattori di rischio modificabili ( fumo, rischi ambientali di cadute), non hanno controindicazioni e possono essere raccomandati a chiunque. L’uso di farmaci è sempre associato a potenziali rischi per cui il loro utilizzo deve essere riservato ai pazienti a rischio più elevato di frattura, che sono poi gli unici per i quali esiste una adeguata documentazione di efficacia. L’utilizzo di farmaci è anche condizionato dal rapporto tra vantaggi e svantaggi la cui stima individuale è spesso complessa e deve tener conto di aspetti di farmaco-economia. Ciò appare particolarmente rilevante per l’utilizzo di teriparatide da riservare ai pazienti più gravi e quindi a maggior rischio di nuove fratture. La Nota 79 prevede il trattamento farmacologico dell’osteoporosi, a carico del SSN, per pazienti con rischio di frattura sufficientemente elevato da giustificare gli inevitabili rischi connessi a trattamenti di lungo termine. I pazienti con pregresse fratture osteoporotiche sono quelli più a rischio di ulteriori fratture ( < 20% a 10 anni). Va anche sottolineato che l’efficacia anti-fratturativa di tutti i prodotti in nota è stata prevalentemente dimostrata in pazienti con una storia pregressa di frattura vertebrale (studi FIT.VERT. BONE e SOTI). Una condizione di rischio analoga è stata anche documentata per i pazienti ultra-cinquantenni in trattamento cortisonico cronico. La documentazione di efficacia nell’osteoporosi cortisonica per alcuni farmaci, giustifica l’estensione della Nota 79 a donne e uomini in trattamento con dosi medio-elevate di corticosteroidi. In altre condizioni ( ad esempio bassa massa ossea ) la definizione di una soglia di intervento, è complicata dall’interagire di più fattori di rischio oltre che dalla minor documentazione di efficacia dei farmaci disponibili. Dall’analisi di studi epidemiologici di grandi dimensioni, condotti in NordEuropa e negli USA, è stato possibile sviluppare algoritmi per una stima del rischio di frattura a 10 anni, basata sulla valutazione densitometrica (DEXA) del femore o ultrasonografica delle falangi, in combinazione con altri fattori di rischio. Una ragionevole semplificazione dei suddetti algoritmi consente di identificare due soglie densitometriche ossee a femore o falangi, al di sotto delle quali il rischio di frattura clinica vertebrale a 10 anni sia < - 4.0 o – 3.0 di T score, in relazione alla presenza o meno di ulteriori importanti fattori di rischio. La teriparatide per il suo profilo di sicurezza va riservato a pazienti con una osteoporosi severa e ad altissimo rischio di nuove fratture da fragilità. Questo livello di rischio è identificato dalla presenza di multiple fratture vertebrali severe o dalla comparsa di nuove fratture dopo un congruo periodo di terapia con altri farmaci. La nota prevede che una paziente può essere in nota 79 per teriparatide se ha una delle seguenti condizioni (a) 3 fratture vertebrali severe, (b) 2 fratture severe e storia di una frattura femorale, (c) 2 fratture vertebrali moderate-severe se una delle due fratture è insorta in corso di terapia con altri farmaci della Nota 79, frattura moderata-severa e storia di frattura di femore se una delle due fratture è insorta in corso di terapia con altri farmaci della Nota 79. La definizione di severità di frattura è quella descritta da Genant ( Figura 5). Evidenze disponibili. Per tutti i farmaci della Nota 79 è stata documentata l’efficacia sul rischio di fratture vertebrali post-menopausali con percentuali di riduzione del rischio comprese tra 30 e 60 % e con un numero di donne da trattare per 3 anni per evitare una frattura vertebrale (Number Needel to Treat, NNT), compresa fra 10 e 20, tra i soggetti a più elevato rischio. In soggetti a minor rischio il NNT a 3 anni è superiore a 200. L’effetto della frattura di femore manca del tutto o risulta da sub-analisi o è marginale. Va ricordato che in soggetti anziani, per la prevenzione delle fratture di femore, sono disponibili più solide documentazioni di efficacia con la correzione dell’apporto di vitamina D. L’alendronato è disponibile in Nota 79, anche in associazione con vitamina D. L’unico studio comparativo condotto con questa associazione in soggetti non vitamino D-carenti, non dimostra alcun vantaggio rispetto alla formulazione standard. Nel maschio l’efficacia terapeutica è stata valutata in un trial controllato e randomizzato per il solo alendronato, al quale pertanto si riferisce la nota. Il numero dei pazienti del trial (N-241) non era calcolato per valutare gli effetti del trattamento sulle fratture osteoporotiche, L’efficacia per la prevenzione delle fratture è quindi in parte surrogata dai dati sulla massa ossea. In soggetti in trattamento cortisonico, effetti favorevoli dei bifosfonati sulla densità minerale ossea sono stati rilevati in più trials randomizzati. L’efficacia per la prevenzione delle fratture vertebrali ( ma non delle fratture non vertebrali) è stata dimostrata in trials randomizzati per risedronato e l’alendronato. In questi studi, l’esposizione ai corticosteroidi in grado di aumentare in maniera clinicamente rilevante il rischio di fratture osteoporotiche, è generalmente stimata in 7,5 mg/die o più di prednisone o equivalenti. E’ importante l’osservazione che gli effetti favorevoli dei bifosfonati sulle fratture e sulla densità minerale ossea, sono più evidenti in uomini ultra-cinquantenni ed in donne in post-menopausa. Il trattamento con teriparatide riduce il rischio di frattura vertebrale a valori inferiori al 10%, in 10 anni, in soggetti ad alto rischio. Il suo utilizzo è limitato a questi ultimi pazienti per il suo ancora incerto profilo di sicurezza. Tra le forme severe di osteoporosi va inclusa anche la Osteogenesi Imperfetta. Il neridronato è l’unico farmaco con indicazioni e prescrivibilità a carico del SSN per questa patologia. Particolari avvertenze. Alendronato, risedronato ed ibandronato appartengono alla classe dei bifosfonati. I tre farmaci non sono privi di effetti indesiderati. Tra questi il più comune è la comparsa o accentuazione di esofagite particolarmente in persone con reflusso gastro-esofageo o alterata motilità esofagea o che assumono FANS o che sono incapaci di eseguire le raccomandazioni del foglietto illustrativo (compressa presa a digiuno con abbondante acqua, rimanendo in posizione eretta o seduta per almeno trenta minuti). Questo effetto collaterale è apparentemente meno frequente con le formulazioni intermittenti ( settimanale o mensile). La terapia con bisfofonati è stata associata alla comparsa di osteoporosi della mandibola. Questo grave effetto collaterale è stato osservato, quasi esclusivamente tra pazienti che assumono dosi elevate di bisfosfonati per via venosa, per il trattamento della ipercalcemia neoplastica e delle metastasi ossee. Le osservazioni tra pazienti che assumono le dosi indicate per l’osteoporosi rimangono sporadiche. Il raloxifene è un modulatore dei recettori estrogenici. I suoi effetti sono simil-estrogenici su osso (riduzione del turnover) o fegato ( riduzione di colesterolo e lipoproteine LDL) e anti-estrogenici su endometrio e mammella. Da studi specifici è emerso che il raloxifene ha un effetto neutro sul rischio cardio-vascolare, mentre si associa ad un significativo aumento del rischio di ictus e trombo-embolismo venoso. Il meccanismo d’azione del ranelato di stronzio è per il momento sconosciuto.Va ricordato che circa il 50-70% delle variazioni densitometriche sono legate ad un artefatto, l’elevato peso atomico dello stronzio che si deposita nel tessuto osseo. La teriparatide stimola la neoformazione di osso soprattutto a livello della colonna. Il trattamento cronico provoca nei ratti la comparsa di osteosarcomi. Ciò giustifica sia la limitata durata dei trattamenti, sia la necessità di limitare la prescrivibilità a centri specialisti particolarmente qualificati. (55-77) Le norme contenute nella nota AIFA 79 risultano piuttosto complesse e di non univoca interpretazione, ma sicuramente rappresentano un ampliamento delle possibilità terapeutiche, erogabili a carico del SSN per la prevenzione e la cura dell'osteoporosi. La previsione di trattamenti con corticosteroidi, a dosi superiori ai 5 mg die di prednisone o dosi equivalenti di altri cortisonici per periodi superiori ai 3 mesi, consente finalmente di attuare una efficace prevenzione primaria in questa condizione terapeutica, che e' la principale causa di osteoporosi secondaria da farmaci. La Nota introduce, per la prima volta, soglie di trattamento per prevenzione primaria, basate sulla comparazione di dati densitometrici e fattori clinici di rischio, con alcune difficoltà, generate prevalentemente dalla interpretazione delle tecniche densitometriche. Nell'intento di offrire alcuni chiarimenti, si precisa che nella Nota non si fa riferimento ad apparecchiature specifiche, per questo motivo possono essere accettati i dati densitometrici correttamente eseguiti di BMD femorale, ricavati con metodica DEXA o dati ultrasonografici calcaneali e/o falangei. Il T-score femorale e' inteso esclusivamente delle regioni collo del femore o del femore prossimale totale, ricavati con tecnica DEXA (non con metodica total body). Per il T-score ultrasonografico calcaneale i parametri da considerare sono i dati clinici più importanti, ottenuti con lo Stifness: • SOS è il parametro con migliore precisione e più elevata correlazione con la densità. • BUA presenta una precisione inferiore e l’uso di apparecchi, che misurano solo il BUA, non sembra al momento raccomandabile. Pertanto, per la diagnostica densitometrica ultrasonografica calcaneale, si deve considerare il valore di T-score dei parametri di combinazione che includono il SOS (Stiffness per Achilles-GE e QUI per Sahara-Hologic). La valutazione degli esami ultrasonografici delle falangi deve essere limitata ai parametri che misurano la velocità di propagrazione degli ultrasuoni ed espressi in T-score; l’uso di altri parametri come quelli ottenuti dall’analisi della traccia grafica, non è al momento raccomandabile. L’AD-SOS è l’unico parametro ultrasonografico della falange con dimostrata predittività del rischio di frattura a 10 anni. Si ricorda che, anche se nella Nota 79 si parla di “ soggetti”, non si deve prescindere dal rispetto delle indicazioni di ogni singolo farmaco. (Legge 94/03, art 3) Infatti, ad oggi, alcuni farmaci prescrivibili con nota 79 mantengono le indicazioni solo per le donne. Per i soggetti con pregresse fratture osteoporotiche vertebrali o di femore, la nota non fornisce alcuna indicazione quantitativa per la diagnosi di frattura vertebrale in prevenzione secondaria, pertanto, qualsiasi deformità vertebrale secondo Genant, garantisce la prescrivibilità dei farmaci in Nota. Soprattutto, in assenza di esplicite indicazioni dei referti radiologici, e' legittimo utilizzare l'indice semiquantitativo secondo Genant, per l'applicazione della nota. Ma è altrettanto doveroso, in fase di prescrizione di esame radiologico del rachide, ricordare il sospetto diagnostico di frattura vertebrale o la diagnosi di osteoporosi, per consentire un corretto esame morfometrico dei metameri vertebrali da parte del radiologo. Il metodo di Genant è definito semiquantitativo e contempla una valutazione soggettiva. In generale una frattura lieve si caratterizza per una diminuzione dell’altezza del 20-25% dei corpi vertebrali, rispetto alle dimensioni originarie. Questi valori aumentano a >25%-40% per le fratture moderate e >40% per le fratture severe. Con il metodo di Genant le diminuzioni dell’altezza non sono stimate rispetto a vertebre adiacenti. Ciò invece viene chiaramente richiesto nella Nota 79, senza peraltro indicare se la vertebra di riferimento sia quella sovra o sottostante. In mancanza di indicazioni è autorizzato l’utilizzo o del muro posteriore della stessa vertebra o della prima vertebra integra sottostante. In quest’ultimo caso i valori soglia sopraindicati possono essere ragionevolmente stabiliti a 25%-35% per fratture lievi, >35-50% per fratture moderate e >50% per fratture severe. Questa interpretazione della Nota, qualifica la diminuzione in altezza > 50% come deformità vertebrale severa. Per quanto riguarda la prescrizione di teriparatide e ormone paratiroideo, la Nota 79 può indurre delle difficoltà interpretative nei seguenti due punti: • “Soggetti che incorrono in una nuova frattura vertebrale moderatasevera ……” Analogamente alla precedente versione, la nuova Nota fa riferimento, per la terapia con PTH, a pazienti che incorrono in una nuova frattura dopo un anno di terapia con farmaci della Nota 79. Nella nuova versione, tuttavia, i pazienti dovevano avere “ab initio” una frattura vertebrale moderata-severa. Una interpretazione letteraria della Nota farebbe quindi escludere pazienti, messi in Nota 79, per una pregressa frattura di femore. Appare tuttavia legittima anche una lettura meno conservativa, ed in linea con il razionale della Nota (ultimo capoverso del Background). Sarebbe comunque auspicabile una modifica che preveda esplicitamente “ ... in corso di trattamento con uno degli altri farmaci della Nota 79 ... da almeno un anno per una pregressa frattura vertebrale moderatasevera o una frattura di femore ... ”. La nota fa specifico riferimento a “soggetti che incorrono in una nuova frattura vertebrale………”. Una lettura conservativa sembrerebbe quindi escludere peggioramenti di pregresse deformità, anche se non è riportato espressamente “frattura di un corpo vertebrale precedentemente integro”. Va anche sottolineato che per la Nota, la nuova frattura deve essere moderata-severa e che deve preesistere una frattura moderata-severa. Si ritiene che possa essere preso in considerazione anche un peggioramento di una pregressa deformità vertebrale lieve, se la stessa non era stata utilizzata per accendere la Nota 79, con farmaci antiriassorbitivi. • “Soggetti che si presentano con 3 o più fratture vertebrali severe, con diminuzione di una delle altezze dei corpi vertebrali>50% rispetto alle equivalenti altezze di corpi vertebrali adiacenti integri …”, vanno inseriti in nota sulla base di fratture pregresse. La definizione di frattura severa, riportata in nota (>50% rispetto alle equivalenti altezze dei corpi vertebrali adiacenti integri), sembra in disaccordo con la definizione di Genant, cui si fa riferimento nel Background della nota (>40% di una delle altezze vertebrali ) . (78 ) Per una corretta applicazione della Nota, appare legittimo far riferimento ad un calo di una delle altezze vertebrali >50%, rispetto alla prima vertebra integra sottostante. Qualora fossero presenti moltissime deformità vertebrali o fosse comunque difficile riconoscere un corpo vertebrale integro, appare ragionevole considerare come riferimento l’altezza media posteriore di L4 (3,3 cm) . (79 ) TERAPIA Sulla base di quanto previsto dalla nota AIFA n° 79 e alla luce delle sue interpretazioni, l’osteoporosi va affrontata sia con misure preventive, allo scopo di impedire o rallentare la progressione della malattia, sia con terapie specifiche rivolte a soggetti già osteoporotici, con o senza fratture preesistenti, ad elevato rischio di prima o ulteriore frattura. La prevenzione si pone quindi i seguenti obiettivi: • Favorire la crescita scheletrica per consentire il raggiungimento del massimo sviluppo osseo alla maturità • Prevenire la perdita ossea nel corso dell’invecchiamento • Prevenire il deterioramento microstrutturale dello scheletro • Prevenire le frattura I mezzi attraverso cui attuare la prevenzione sono: • Misure non farmacologiche (dieta, attività fisica, igiene di vita) • Misure farmacologiche in soggetti selezionati ad alto rischio di sviluppo di osteoporosi Candidati alla prevenzione sono: • Misure non farmacologiche: tutti i pazienti • Misure farmacologiche: soggetti con riduzione della densità ossea compatibile con osteopenia (T-score tra -1 e -2,5) La Terapia specifica ha alla base le seguenti finalità: • Prevenire le fratture • Stabilizzare o aumentare la massa ossea • Limitare le conseguenze cliniche delle fratture e delle deformità ossee • • • • • • Ottimizzare le capacità funzionali e la qualità della vita Ridurre la frequenza e l’impatto della cadute I mezzi mediante i quali attivare la terapia sono: Misure farmacologiche (calcio e vitamina D, terapia ormonale sostitutiva, modulatori selettivi dei recettori estrogenici, bifosfonati). Misure non farmacologiche per ridurre frequenza ed impatto delle cadute (hip protetors) I candidati al trattamento sono: Uomini e donne con precedenti fratture da fragilità (in particolare vertebre, femore, radio e omero dovuti a traumi a bassa energia) Donne con riduzione della densità ossea (T-score <-2,5) Misure non farmacologiche • Dieta con adeguato apporto di calcio. Numerosi studi epidemiologici sia in soggetti giovani che in anziani hanno dimostrato che un corretto apporto di calcio con la dieta, svolge un ruolo critico nel controllo della perdita ossea senile e rappresenta la premessa a qualsiasi trattamento farmacologico. • Se l’apporto di calcio dietetico è incongruo, sono raccomandate supplementazioni con sali di calcio. La dose giornaliera raccomandata varia a seconda dell’età, ma generalmente è compresa tra 1000 e 1500 mg (non sono consigliabili dosaggi superiori a 2500 mg/die) • Mantenimento di un adeguato status di vitamina D. La carenza di tale vitamina favorisce lo sviluppo di osteoporosi attraverso la riduzione dell’assorbimento intestinale di calcio con conseguente iperparatiroidismo secondario. La vitamina D può essere sintetizzata a livello cutaneo con l’irraggiamento solare o introdotta con la dieta, anche se non è largamente disponibile negli alimenti. Per mantenerne un adeguato apporto è raccomandata una supplementazione di 400ui/die nei giovani adulti e da 400 ad 800 ui/die negli anziani, in rapporto al grado di esposizione solare, alla capacità di sintesi cutanea, allo stato nutrizionale e alle terapie potenzialmente dannose(Anticonvulsivanti, glucocorticoidi). La somministrazione di dosi di vitamina D sino a 2000 ui/die ( anche in dosi depot, ogni 1-4 mesi), è priva di effetti collaterali ed ha costi molto contenuti. • Attività fisica regolare. L’esercizio fisico sotto carico favorisce lo sviluppo osseo nei giovani e può rallentare la perdita ossea nei soggetti anziani, anche con attività a basso impatto come il cammino,che possono avere effetti benefici in generale sulla salute e sulle capacità funzionali. Inoltre, l’esercizio regolare, migliorando forza muscolare, agilità e mobilità, può prevenire le cadute. • Limitazione o cessazione del fumo. Il fumo ha vari effetti dannosi sull’osso (aumenta la degradazione degli ormoni sessuali, accelera la menopausa, i fumatori sono più magri) e rappresenta un fattore di rischio per le fratture osteoporotiche. • Riduzione del rischio di cadute. La maggior parte delle fratture deriva da una caduta. Trials clinici randomizzati e controllati dimostrano che un intervento multidisciplinare ( medico, infermieristico, fisioterapico, terapia occupazionale) sui fattori di rischio per caduta, può ridurre la frequenza di cadute in soggetti anziani dal 30% al 60%.Il numero limitato di soggetti osservati in questi studi, non consente tuttavia di mostrare un effetto significativo sull’incidenza di fratture. • Riduzione dell’impatto delle cadute. La maggior parte delle fratture del femore dipende da una caduta laterale. Un possibile mezzo per attenuare l’impatto di questo tipo di caduta, è l’uso di protettori esterni dell’anca (hip protetors). Un recente trial randomizzato e controllato ha evidenziato l’efficacia di questi dispositivi nel ridurre l’incidenza di fratture del femore in soggetti anziani di circa il 60%. Il limite principale dei protettori esterni è legato alla scarsa accettazione da parte degli anziani. Pertanto, il loro uso è limitato a soggetti selezionati. Misure Farmacologiche • Calcio e vitamina D. L’effetto di calcio e di vitamina D sulle fratture, se somministrati singolarmente, ne riduce il rischio in tutti i pazienti. Questa terapia è caratterizzata da un favorevole rapporto costi/benefici. • Selective Estrogen Receptor Modulators (SERM). I composti di questa classe hanno un effetto estrogeno-simile a livello di alcuni tessuti-bersaglio (osso in particolare) ed effetti antagonisti su altri (utero, mammella). Presentano i benefici della terapia ormonale sostitutiva, riducendo nel contempo i rischi associati agli estrogeni, come lesioni neoplastiche invasive mammarie. Il Raloxifene è attualmente indicato nella prevenzione della perdita ossea postmenopausale. Per la prevenzione delle fratture, il farmaco si è dimostrato in grado di ridurre, già entro un anno, del 30-50% le fratture vertebrali nelle donne sia con precedenti fratture, sia con osteoporosi densitometrica. Non sono stati però osservati effetti significativi sulle fratture extravertebrali, compresa la frattura di femore. Di contro, è emerso che il raloxifene ha aumentato i rischi relativi di troboembolia venosa del 44% e di ictus fatale del 49%. • Bisfosfonati. Si tratta di una classe di farmaci attualmente più usata e più efficace nella cura dell’osteoporosi. Sono sostanze che si fissano all’osso evitando il riassorbimento da parte degli osteoclasti, provocando la riduzione della fratture vertebrali del 60-70% e delle fratture dell’anca del 50% ed aumentando la densità ossea. Inoltre i bifosfonati vengono usati nella cura di altre malattie dello scheletro, quali Morbo di Paget ed Osteogenesi Imperfetta. • Ranelato di stronzio. Nuovo farmaco per il trattamento dell’osteoporosi, agisce sul metabolismo osseo impedendo il riassorbimento, con conseguente diminuzione del turnover osseo, senza modificare il processo di mineralizzazione. • Calcitonina. La terapia con calcitonina ha modesti effetti sugli indici laboratoristici di turnover osseo e sulla densità minerale. Per la prevenzione delle fratture mancano a tutt’oggi documentazioni convincenti di utilità. Nell’unico trial clinico adeguato per casistica, condotto con calcitonina somministrata per spray nasale, è stata osservata una riduzione dell’incidenza di fratture vertebrali solo dopo 5 anni di trattamento ed al dosaggio di 200 ui/die. Prescrivibilità Farmaci Osteoporosi L’impiego dei farmaci prescrivibili per l’osteoporosi, in regime di SSN in classe “A”, secondo le indicazioni autorizzate e con le limitazioni rappresentate dalla NOTA AIFA 79, è segnalato nella Tabella 6. Tab.6. Farmaci prescrivibili in regime SSN secondo la nota 79 Bifosfonati: acido alendronico acido risedronico acido ibandronico acido alendronico+vitamina D3 raloxifene ranelato di stronzio teriparatide ormone paratiroideo La prescrizione a carico del SSN è limitata alle seguenti condizioni di rischio: soggetti di età superiore a 50 anni, in cui sia previsto un trattamento > 3 mesi con dosi > 5 mg/die di prednisone o dosi equivalenti di altri corticosteroidi: ac. alendronico, ac. risedronico, ac. alendronico + vitamina D3. soggetti con pregresse fratture osteoporotiche vertebrali o di femore soggetti di età superiore a 50 anni, con valori di T-score della BMD femorale o ultrasonografica del calcagno < - 4 (o < -5 per ultrasuoni falangi) soggetti di età superiore a 50 anni, con valori di T-score della BMD femorale o ultrasonografica del calcagno < -3 (o < - 4 per ultrasuoni falangi) e con almeno uno dei seguenti fattori di rischio aggiuntivi: - storia familiare di fratture vertebrali - artrite reumatoide e altre connettiviti - pregressa frattura osteoporotica al polso - menopausa prima 45 anni di età - terapia cortisonica cronica ac. alendronico, ac. alendronico + vitamina ibandronico, raloxifene, ranelato di stronzio. D3, ac. risedronico, ac. soggetti che incorrono in una nuova frattura vertebrale moderata-severa o in una frattura di femore in corso di trattamento con uno degli altri farmaci della nota 79 (alendronato, risedronato, raloxifene, ibandronato, ranelato di stronzio), da almeno un anno per una pregressa frattura vertebrale moderata-severa. soggetti, anche se in precedenza mai trattati con gli altri farmaci della Nota 79 (alendronato, risedronato, raloxifene, ibandronato, ranelato di stronzio), che si presentano con 3 o più fratture vertebrali severe (diminuzione di una delle altezze dei corpi vertebrali > 50% rispetto alle equivalenti altezze di corpi vertebrali adiacenti integri) o con 2 fratture vertebrali severe ed una frattura femorale prossimale. La nota si applica su diagnosi e Piano Terapeutico, della durata di 6 mesi prolungabile di ulteriori periodi di 6 mesi per non più di altre due volte (per un totale complessivo di 18 mesi), redatto da Centri Specializzati, Universitari o delle Aziende Sanitarie, individuate dalle Regioni e dalle Province autonome di Trento e Bolzano teriparatide, ormone paratiroideo Prima di avviare la terapia con i farmaci sopraindicati, in tutte le indicazioni autorizzate è raccomandato un adeguato apporto di calcio e vitamina D, ricorrendo, ove dieta ed esposizione solari siano inadeguati, a supplementi con sali di calcio e vitamina D3 (e non ai suoi metaboliti idrossilati). La prevenzione delle fratture osteoporotiche deve anche prevedere un adeguato esercizio fisico, la sospensione del fumo e la eliminazione di condizioni ambientali ed individuali favorenti i traumi. Non deve essere dimenticato, infine, che tutti principi attivi non sono privi di effetti collaterali, per cui va attentamente valutato il rapporto vantaggi e rischi terapeutici. Inoltre la loro associazione è potenzialmente pericolosa e va pertanto evitata. Per l' applicazione della Nota 79 la valutazione della massa ossea con tecnica DEXA o ad ultrasuoni deve essere fatta presso strutture pubbliche o convenzionate con il SSN. La prescrizione va fatta nel rispetto delle indicazioni e delle avvertenze della scheda tecnica dei singoli farmaci. Dati per valutazioni farmacoeconomiche di costo terapia, aggiornati al mese di gennaio 2008, per i farmaci prescrivibili con Nota AIFA 79, sono presentati nella Tabella 7. Tab. 7 . Dati per la valutazione farmacoeconomica di costo-terapia . PRINCIPIO ATTIVO Acido Alendronico SPECIALITÀ CONFEZIONE Ac.Alendronico 70 mg 4 cpr equivalente 10 mg 14 cpr Alendros 70 mg 4 cpr Adronat 10 mg 14 cpr Dronal Fosamax 70 mg 4 cpr Genalen 22,51 5,63 11,79 22,51 0,84 5,63 17,22 1,23 24,05 6,01 70 mg 4 cpr 25,31 6,33 Actonel Optinate 5 mg 28 cpr 35 mg 14 cpr 32,00 36,34 1,15 9,08 Bonviva 150 mg 1 cpr 43,70 43,70 Evista Optruma Osseor Protelos 60 mg 14 cpr 60 mg 28 cpr 17,93 34,64 1,28 1,24 50 mg 60 mg 2 g 28 bs 50,96 1,82 Forsteo 1 penna 3 ml 570,71 20,38 Ac. Alendronico+ Fosavance colecalciferolo Adrovance Ac. Risedronico Ac. ibandronico Raloxifene Ranelato di stronzio Teriparatide* Ormone pratiroideo* COSTO COSTO DDD COSTO COSTO CONFEZIONE UNITÀ DDD SETTIMANA 100 mcg iniet. 1,61 mg 2 cart. 500,47 (14 dosi) *su diagnosi e piano terapeutico Preotact 35,74 10 mg 0,80 5,63 0,84 0,80 5,90 5,63 1,23 8,61 0,86 6,01 6,33 1.15 2.06 8,00 9,08 14.56 10,92 1,28 1,24 8,96 8,66 2g 1,82 12,74 20 mcg 20,38 142,67 5 mg 250,23 • Si ricorda inoltre che prima di iniziare la terapia con i farmaci sopraindicati, in tutte le indicazioni, è raccomandato un adeguato apporto di calcio e vitamina D. I farmaci a base di sali di calcio e Vitamina D3 sono prescrivibili in fascia A. PRINCIPIO ATTIVO Sali di calcio (A12AA) Calcio + Vit.D3 (A12AX) COSTO MEDIO CONFEZIONE 5,74 COSTO MEDIO UNITÀ 0,19 COSTO MEDIO SETTIMANA 1,33 6,63 0,22 1,54 • I farmaci a base di acido clodronico, presentano come indicazione in scheda tecnica: Prevenzione e Trattamento dell’osteoporosi post menopausale, ma non sono inseriti nella Nota 79, per questo possono essere prescritti per tale evenienza in fascia C, a totale carico dell’assistito. • I farmaci a base di calcitonina presentano come indicazione in scheda tecnica: Osteoporosi di varia origine, ma non sono inseriti nella Nota 79, per questo possono essere prescritti per tale evenienza in fascia C, a totale carico dell’assistito. Considerazioni Le linee guida correntemente in uso, raccomandano di sottoporsi alla misurazione della densità minerale ossea all'età di 65 anni. In realtà esistono indicatori di rischio di fratture, come la precedente fragilità ossea, che possono consigliare l'esame prima dei 65 anni, quindi non soltanto tra le donne, che hanno già superato la menopausa, ma anche tra gli uomini, che comunque non sono esenti da osteoporosi. La stessa regola vale quando si osservano riduzioni improvvise del peso e dell'altezza, probabilmente dovuta, quest'ultima, a fratture vertebrali. Osservare queste raccomandazioni contribuirebbe a trasformare il controllo della densità minerale ossea in un esame di routine, ma condensato nel tempo, che non dovrebbe interessare solo le donne ultrasessantacinquenni, ma anche uomini e donne più giovani. Una volta riscontrata osteoporosi, intesa come perdita di massa ossea e deterioramento dell'architettura microscopica dello scheletro, il test va ripetuto ogni due anni, ogni cinque se il parametro risulta essere nella norma. ( 80-92) FLOW CHART OSTEOPOROSI MMG o altro SPECIALISTA Individuazione fattori di rischio anamnestici e valutazione criteri LEA Prescrizione VISITA ORTOPEDICA PER OSTEOPOROSI Prescrizione esame DEXA Prescrizione esame DEXA e VISITA ORTOPEDICA PER OSTEOPOROSI RECUP VISITA ESAME CLINICO VALUTAZIONE FATTORI DI RISCHIO OSTEOPOROSI ESAME DEXA, VERTEBRALE E COLLO FEMORE ( OVER 65) PRESCRIZIONE ULTERIORI ACCERTAMENTI: • EMATOCHIMICI di 1° LIVELLO • RX RACHIDE DORSALE ED RX RACHIDE LOMBOSACRALE CON MORFOMETRIA VERTEBRALE DIAGNOSI STRUMENTALE Controllo DEXA 12/18 mesi OSTEOPENIA DIAGNOSI STRUMENTALE VALORI NORMALI Controllo DEXA 18/24 mesi DIAGNOSI CLINICA OSTEOPOROSI PRIMITIVA OSTEOPOROSI SECONDARIA FLOW CHART OSTEOPOROSI OSTEOPOROSI PRIMITIVA OSTEOPOROSI SEVERA OSTEOPOROSI OSTEOPENIA Presenza di fattori di rischio Trattamento farmacologico Assenza di fattori di rischio Supplementazione di calcio e vitamina D + Consigli di igiene di vita ( attività fisica, alimentazione, fumo, esposizione al sole ….) Controllo clinico a 6 mesi con markers metabolismo osseo. FLOW CHART OSTEOPOROSI OSTEOPOROSI SECONDARIA ESAMI BIOUMORALI di 2° LIVELLO e VIDEAT SPECIALISTICI TRATTAMENTO PATOLOGIE EMERSE DALLO SCREENING TRATTAMENTO FARMACOLOGICO PER RIDURRE IL RISCHIO RELATIVO di FRATTURE E MIGLIORARE LA MASSA OSSEA. Controllo clinico e DEXA a 12 mesi. Bibliografia 1) Linee Guida per la diagnosi, prevenzione e terapia dell’Osteoporosi. Sinossi – 2006. 2) Crepaldi G. Le proiezioni future delle principali patologie cronico degenerative dell’anziano. http://www.sigg.it/attivita_cnr.html,15/3/1991. 3) Maggi S., Kelsey J.L., Litvak J., Heyse S. Incidence of hip fracture in the elderly : a cross-national analysis. Osteoporosis International 1: 232-241, 1991. 4) European Commission. Report on osteoporosis in the European community. Action for prevention. Luxembourg: Office for Official Publications of the Europen Communities . 1998. 5) Maggi S., Farchi G., Crepaldi G. Le malattie muscolo-scheletriche. In rapporto Stato Salute della popolazione 2001. Ministero della Salute. 2002 6) Rossini M, Piscitelli P, Fitto f, Camboa P, Angeli A, Guida G, Adami S Incidenza e costi delle fratture di femore in Italia Reumatismo 57 (2):97-102.2005 7) Lindsay R., Burge RT, Strass DM. The clinical and economical aspects of vertebral fractures: new fractures in the following year. Third International Meering on Clinical and Economic Aspects of Osteoporosis and Osteoarthritis. Barcelona. November 7-9. 2002. 8) Langlois JA, Maggi S., Crepaldi G. Workshop on Hip Fracture Registries in Europe. Aging 12(5) : 398-401. 2000 9) Thorngren KG. Fractures in older persons. Disabil Rehabil Jul-Sep; 16 (3) : 119-26. 1994. 10)Genant H.K., Cooper C., Poor G. et al. Interim report and recommendation of the World Health Organization Task-Force for Osteoporosis. Osteoporos Int ; 10-259-64. 1999 11) Gehlbach S.H., Bigelow C., Heimisdottir M., et al. Recognition of vertebral fracture in a clinical setting. Osteoporos Int.; 11:577-82. 2001 12) Lindsay R., Silverman S.L., Cooper C., et al. Risk of new vertebral fracture in the year following a fracture. JAMA 285:320-3. 2001 14) Black D.M., Arden N.K., Palermo L., et al. Prevalent vertebral deformities predict hip fractures and new vertebral but not wrist fractures. Study of Osteoporotic Fractures Research Group. J Bone Miner Res ;14:821-8. 1999 15) Klotzbuecher C.M., Ross P.D., Landsman P.B., et al. Patients with prior fractures have an increased risk of fractures: a summary of the literature and statistical synthesis. J Bone Miner Res; 15-721-39. 2000 16) Greendale G.A., De Amicis T.A., Bucur A., et al. A prospective study of the effect of fracture on measured physical performance: results from the Mac Arthur Study-MAC. J Am Geriatr Soc; 48:546-9. 2000 16) Huang C., Ross P.D., Wasnich R.D. Vertebral fracture and other predictors of physical impairment and health care utilization . Arch Intern Med; 156:2469-75. 1996 17) Truumees E. Medical consequences of osteoporotic vertebral compression fractures. Instr Course Lect: 52:551-8. 2003 18) Schlaich C., Minne H.W., Bruckner T. et al. Reduced pulmonary function in patients with spinal osteoporotic fracture. Osteoporos Int; 8:261-7. 1998 19) Tannenbaum C., Clark J., Schwartzman K., et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab; 87:4431-7. 2002 20) Diacinti D, Acca M, Tomei E; Metodica di radiologia digitale per la valutazione dell’osteoporosi vertebrale. Radiologia Medica, 91: 1-5, 1995 21) Diacinti D, Acca M, D’Erasmo E, Tomei E, Mazzuoli GF; Aging changes in vertebral morphometry. Calcif Tissue Int, 57: 426-429, 1995 22) Minne HW, Leidig G, Wuster et al; A newly developed spine deformity index (SDI) to quentitate vertebral crush fractures in patients with osteoporosis. Bone Miner, 3: 335-349, 1988 23) Genant HK, Wu C, Van Kuijk C, Newitt MC; Vertebral fracture assessment using a semi-quantitative approach. J Bone Miner Res, 8: 1137-1148, 1993 24) Delmas PD,: Markers of bone turnover for monitoring treatment of osteoporosis with antiresorptive drugs. Osteoporos.Int. 11 Suppl 6:S66S76 (2000) 25) Garnero P: Markers of bone turnover for the prediction of fracture risk. Osteoporos.Int. 11 Suppl 6:S55-S65 (2000) 26) Stepan JJ: Prediction of bone loss in postmenopausal women. Osteoporos.Int. 11 Suppl 6:S45-S54 (2000) 27) Hannon R, Eastell R,: Preanalytical variability of biochemical markers of bone turnover. Osteoporos.Int. 11 Suppl 6:S30-S44 (2000) 28) Delmas PD, Eastell R, Garnero P, Seibel MJ, Stepan J,: The use of biochemical markers of bone turnover in osteoporosis. Committee of Scientific Advisors of the International Osteoporosis Foundation. Osteoporos.Int. 11 Suppl 6:S2-17 (2000) 29) Seibel MJ,: Molecular markers of bone turnover: biochemical, technical and analytical aspects. Osteoporos.Int. 11 Suppl 6:S18-S29 (2000 30) Palicka V, Jabor A, Friedecky B, Zivny P,: Selected markers of bone biochemistry. Adv.Clin.Chem. 35:255-294 (2000) 31) Clowes JA, Eastell R,:The role of bone turnover markers and risk factors in the assessment of osteoporosis and fracture risk. Baillieres Best.Pract.Res.Clin.Endocrinol.Metab 14:213-232 (2000) 32) Woitge HW, Seibel MJ,: Risk assessment for osteoporosis. II. Biochemical markers of bone turnover: bone resorption indices. Clin.Lab Med. 20:503-525 (2000) 33) Gundberg CM,: Biochemical markers of bone formation. Clin.Lab Med. 20:489-501 (2000) 34) Looker AC, Bauer DC, Chesnut CH III, Gundberg CM,Hochberg MC, Klee G, Kleerekoper M, Watts NB, Bell NH,:Clinical use of biochemical markers of bone remodeling: current status and future directions. Osteoporos.Int.11:467-480 (2000) 35) Ferreira A, Drueke TB,: Biological markers in the diagnosis of the different forms of renal osteodystrophy. Am.J.Med.Sci.320:85-89 (2000) 36) Garnero P,: Biochemical markers of bone turnover: recent data and avenues for the future. Rev.Rhum.Engl.Ed 66:538-542 (1999) 37) Cantatore FP, Pipitone V,: Markers of bone turnover: consideration on their clinical application in osteoporosis. Panminerva Med. 41:247-251 (1999) 38) Miller PD, Baran DT, Bilezikian JP, Greenspan SL, Lindsay R, Riggs BL, Watts NB,:Practical clinical application of biochemical markers of bone turnover: Consensus of an expert panel. J.Clin.Densitom. 2:323-342 (1999) 39) Seibel MJ, Woitge HW ,: Basic principles and clinical applications of biochemical markers of bone metabolism: biochemical and technical aspects. J.Clin.Densitom. 2:299-321 (1999) 40) Ross PD,: Predicting bone loss and fracture risk with biochemical markers: A review. J.Clin.Densitom. 2:285-294 (1999) 41) Gluer CC ( for the International Quantitative Ultrasound Consensus Group): Quantitative ultrasound techniques for the assessment of osteoporosis: Expert agreement on current status. J Bone Miner Res 12:1280 – 1288 (1997) 42) Hans D., Njeh CF, Genant HK, et al. : Quantitative ultrasound in bone status Assessment . Rev Rhum (Engl Ed) 65 (7-9) : 489-498 (1998) 43) Kleerekoper M., Nelson DA, Flynn MJ et al.: Comparison of radiographic absorptiometry with dual-energy X-ray absorptiometry and quantitative computed tomography in normal older white and black women. J Bone Min. Res. 9 (II): 1745-1749 (1994) 44) Duboeuf F., Hans D., Schott AM., et al.: Ultrasound velocity measuredat the Proximal phalanges: precision and age-related changesin normal females. Rev Rhum (Engl. Ed.) 63 (6): 427-434 (1996) 45) Sili Scavalli A., Marini M., Spadaio A., et al.: Ultrasound transmission Velocity of the proximal phalanxes of the non-dominant hand in the study of osteoporosis. Clin Rheumatol 16:396-403 (1997) 46) Alenfeld FE, Wuster C, Funck C, et al.: Ultrasound measurements at the proximal phalanges in healthy women and patients with hip fractures. Osteop Int 8: 393-398 (1998) 47) Reginster JY, Dethor M, Pirenne H et al.: Reproducibility and diagnostic sensitivity of the phalanges to assess osteoporosis. Int J Gynecol Obstet 63:21-28 (1998) 48) Soballa T, Schlegel J, Cadossi R et al.: Osteosonographie der Phalangen bei Maennem. Mediz Klinik 93: 131-136 (1998) 49) Mele R., Masci G., Ventura V, et al.: Three-year longitudinal study with quantitative ultrasound at the hand phalanx in a female population. Osteop Int 7:550-557 (1997) 50) De Aloysio D, Rovati Lc, Cadossi R. et al.: Bone effects of transdermal hormone replacement therapy in postmenopausal women as evaluated by means of ultrasound: an open one-year prospective study. Maturitas 27: 61-68 (1997) 51) Pluskiewicz W, Nowakowska J: Bone status after long-term anticonvulsivant therapy in epileptic patients: evaluation using quantitative ultrasound of calcaneus and phalanges. Ultrasound Med Biol 23 (4): 553-558 (1997) 52) Machado ABC, Ingle BM, Eastell R: Monitoring alendronade therapy With quantitative ultrasound (QUS) and dual X-ray absorptiometry (DXA). J Bone Miner Res 14 S1:SU377 (1999) 53) Njeh Cf., Boivin CM., Gough A, et al.: Evaluation of finger ultrasound in In the assessment of bone status with application of rheumatoid Arthritis. Osteop Int 9:82-90 (1999) 54) Ministero della salute-Dipartmento della Qualità: Individuazione dei criteri di accesso alla Densitometria Ossea. Febbraio 2005. 55) Supplemento alla Gazzetta Ufficiale. Serie generale n°7 del 20/01/2007 56) Adachi JD et al.., Two-year effect of alendronate on bone mineral density and fracture in patients on glucocorticoids. Arthritis and Rheum: 44:202-11. 2001 57) Adami S et al., Fracture incidence and Chacterization in Patients on Osteoporosis Treatment: The ICARO Study J. Bone Min Res :21:1565-1570 – 2006 58) Barrett-Connor E et al.. Raloxifene Use for The Heart (RUTH) Trial Investigators. Effects of Raloxifene on cardiovascular events and breast cancer in postmenopausal women. N Engl J Med. 355:125-37. 2006 59) Bischoff_Ferrari HA et al. Fracture prevention with vitamin D supplementation: a metaanalysis of randomised controlled trials. JAMA 293:2257-64. 2005 60) Black DM et al.. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 348:1535-41. 1996 61) Chesnut CH et al. Effects of oral ibandronate administered daily on intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 19.1241-49.2004 62) Cummings SR et al. Effect of alendronate on risk fracture in women bone density but without vertebral fracture: results from the Fracture Intervention Trial. JAMA 280: 2077-82. 1998 63) De Groen PC et al. Esophagitis associated with the use of alendronate. N Engl J Med. 335:1016-21. 1996 64) Ettinger B. et al. Reduction of vertebral fracture risk in postmenopausal women with Osteoporosis treated with raloxifene: result from a 3 – year randomised clinical trial. JAMA , 282: 637 – 45 . 1999. 65) Harris ST et al: Effects of risedronate treatment on vertebral and non vertebral fractures in women with postmenopausal osteoporosis. JAMA; 282: 1344 – 52. 1999. 66) Kanis JA et al. Ten-year probabilities of clinical vertebral fractures according to phalangeal quantitative ultrasonography. Osteoporos Int 16:1065-70 . 2005 67) Lenchik I., Rogers LF, Delmas PD, Genant HK. Diagnosis of osteoporotic vertebral fractures: importance of Recognition and description by radiologists. Am J Roentgenol 183:94958. 2004 68) Lindsay R et al. Risk of new vertebral fracture in the year following a fracture. JAMA 285:320-3. 2001 69) McClung M. et al. Effect of risedronate on hip fracture risk in elderly women. Hip Intervention Program Study Group. N Engl J Med 344:333-40. 2001 70) Meunier PJ et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med. 350:459-68. 2004 71) Migliorati CA et al. Bisphosphonate-associated osteonecrosis a long-term complication of bisphosphonate treatment. Lancet Onco. 7:508-14. 2006 72) Neer RM et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 344:1434-41. 2001 73) Orwoll E et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 343: 604-10. 2000. 74) Reginster J et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Osteopor Intern 11:83-9. 2000 75) Reginster JY et al. Strontium ranelate reduces the risk of non vertebral fractures in post- Menopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 90:2816-22. 2005. 76) Società Italiana di Reumatologia et al. Linee Guida per la diagnosi, prevenzione e terapia dell’osteoporosi. Sinossi. Edimes. Pavia 2006 77) Van Staa TP et al. The epidemiology of corticosteroid-induced osteoporosis: a metaanalysis. Osteoporos Int 13:777-87. 2002 78) Genant HK, Jergas M, Palermo L, e Coll: Comparison of semiquantitative visual and quantitative morphometric assessment of prevalent and incident vertebral fractures in osteoporosis. J Bone Miner Res 11: 984-996, 1996. 79) Black DM, Palermo L, Nevitt MC e Coll: Comparison of methods for defining prevalent vertebral deformities: the study of osteoporotic fractures. J Bone Miner Res 10: 890-902, 1995. 80) Wallach S et al. Effects risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Cale Tissue Int.67:277-85. 2000 81) WHO Study Group. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis:Report of a WHO Study Group. WHO Technical Report Series 843, Geneva: World Health Organization, 1994 82) Consensus Development Statement. Who are candidates for prevention and treatment for osteoporosis?. Osteop Int. 7: 1-6. 1997 83) National Osteoporosis Foundation. Osteoporosis: Review of the evidence for prevention, diagnosis, and treatment and costeffectiveness analysis. Study Report. Osteop Int .8: (Suppl4) 1998 84) Am Acad Orthop Surg/ Am Coll Obstet Gynecol/Am Geriatr Soc/ Am Coll Radiol/ Am Coll Rheumatol/ Am Acad Phys Med Rehab/ Am Assoc Clin Endocrinol/ Nat Osteoporosis Found/ Endocr Soc/ Am Soc Bone Mineral Res: Physician’s guide to prevention and treatment of osteoporosis. 1999 85) Società Italiana dell’Osteoporosi e delle Malattie Metaboliche dell’Osso: Linee guida diagnostiche e terapeutiche dell’osteoporosi postmenopausale e senile. Bollettino 1999 86) International Committee for Osteoporosis Clinical Guidelines: Diagnosis and management of osteoporosis in postmenopausal women: clinical guidelines. Clin Therap Excepta Med. 21:1025-44. 1999. 87) Committee of Scientific Advisors, International Osteoporosis Foundation: An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporosis Int. 11:192-202. 2000. 88) National Institutes of Health. Consensus Development Conference Statement: Osteoporosis prevention, diagnosis, and therapy. NIH Consens Statement .17(1):1-36. 2000 89) Consensus Development Conference. Osteoporosis: prevention, diagnosis, and therapy. JAMA. 285:785-95. 2001 90) American College of Rheumatology ad hoc Committee on Glucocorticoid-Induced Osteoporosis: Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthrit & Rheum. 44:1496-503. 2001 91) American Association of Clinical Endocrinologists: Medical guidelines for clinical practice for the prevention and management of postmenopausal osteoporosis. Endocr Pract. 7:294-312. 2001 92) National Osteoporosis Society: Position statement on the use of quantitative ultrasound in the management of osteoporosis. 2001.
Scaricare