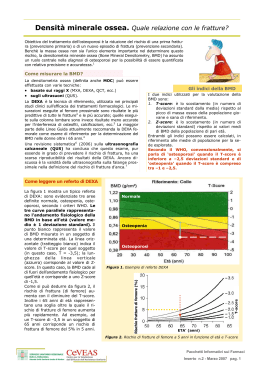
La densitometria ossea è la metodica di riferimento per la valutazione dell'entità della mineralizzazione ed è significativamente associata al rischio di frattura. Le diversità fra i vari densitometri e le sedi densitometriche non hanno un gran peso negli studi di popolazione al fine di quantificare il rischio di frattura, ma indubbiamente possono averlo a livello del singolo paziente . Comunque è notorio che la densitometria è più predittiva della frattura nella sede in cui viene eseguita, soprattutto sotto i 60 anni per la sede lombare e sopra i 65 anni per la sede femorale. Alcuni dati in letteratura dimostrano che la capacità diagnostica densitometrica migliora se si valutano due sedi scheletriche anche se ciò pone problemi organizzativi e di costi, che però i modelli dell'ultima generazione (DXA-"fan-beam") possono superare grazie alla loroestrema velocità di scansione. L'ultrasonometria, soprattutto del calcagno, si sta dimostrando una buona indagine per lo screening ed offre una predizione delle fratture sovrapponibile alla DXA, ma, allo stesso tempo complementare; in sostanza i due tipi di densitometria possono coadiuvarsi per ridurre il numero dei falsi negativi presenti in ciascuna delle due metodiche. La densitometria predice le fratture anche nei soggetti molto anziani. L'importante in questo caso è che si tenga conto che: la affidabilità della previsione densitometrica non va oltre i dieci anni; che esistono altri fattori di rischio di frattura sia ossei, sia extraossei del paziente, sia ambientali. Pertanto, se la diagnosi di osteoporosi non può essere schematizzabile in base a stratificazioni densitometriche basate solo sul T-score, anche la valutazione del rischio di frattura individuale, che a dette stratificazioni fa riferimento, deve tener conto di tutte le componenti quantitative e qualitative dell'osso e ad altri fattori clinici (qualità della vita, comorbilità, rischio ambientale) che, solo in parte sono correlate alla massa ossea soprattutto nel paziente ultra settantenne. Parole chiave: densità ossea, osteoporosi, rischio di frattura, fattori di rischio, screening densitometrico, follow-up densitometrico CENNI SULLE METODICHE DENSITOMETRICHE Fin dall'introduzione della misurazione dell'assorbimetria a singolo raggio fotonico (SPA) a livello del radio distale avvenuta nel 1963 (1), si è avuta una rapida evoluzione delle nuove tecniche radiologiche per quantizzare l'integrità dello scheletro (2). Gli sviluppi più importanti comprendono la misurazione dell'assorbimento a doppio raggio fotonico (DPA) della colonna vertebrale e dell'anca (3) e la tomografica computerizzata quantitativa (QCT) dell'osso trabecolare nei corpi delle vertebre lombari (4). Tuttavia la tecnica che più di ogni altra è stata responsabile della recente rapida crescita delle applicazioni cliniche della densitometria ossea è l'assorbimetria a doppio raggio X (DXA) (5). Rispetto alla DPA, la DXA consente una migliore precisione, tempi di scansioni più brevi e una calibrazione più stabile (6). Rispetto alla QCT essa ha una precisione migliore comporta una minore dose di radiazioni per il paziente ed ha un costo inferiore (7). Il principio fondamentale che è alla base della DXA è la misurazione della trasmissione attraverso l'organismo dei raggio X provenienti da due diverse fonti di energia fotonica e ciò permette di quantizzare le masse di due tipi di tessuto (in questo caso l'osso e il tessuto molle). Nella tecnica della DPA, usata inizialmente, si usava una fonte di radionuclidi Gd/153, perché le sue due emissioni a 44 e 103 keW erano vicini al valore ideale per la misurazione della colonna vertebrale lombare. Ad energie fotoniche superiori a 100 keW, si hanno poche differenze nell'attenuazione da parte del tessuto osseo e dei tessuti molli e le misurazioni della trasmissione rispecchiano la massa totale di tessuto nel fascio. Energie fotoniche di circa 40 keW sono ideali per il fascio a bassa energia, perché vi è un buon contrasto fra osso e tessuto molle senza eccessiva attenuazione per limitare il segnale che raggiunge il rilevatore. La sostituzione della fonte di Gd-153 con un tubo a raggi X ha migliorato le prestazioni dei densitometri ossei a doppio raggio fotonico combinando un elevato flusso con le piccole dimensioni della focale del tubo a raggi X. La disponibilità di un fascio di radiazione intenso, ristretto, ha migliorato il tempo dio scansione e la definizione dell'immagine e ha permesso un concomitante incremento di precisione. I produttori più importanti di apparecchiature di DXA sono: Hologic (Waltham,MA, Stati Uniti), Lunar (Madison, WI, Stati Uniti)e Norland (Fort Alkinson, WI, Stati Uniti). Gli scanner della Lunar e della Norland utilizzano l'assorbimento in un filtro di terre rare per dividere il fascio di raggi X in componenti a bassa e ad alta energia che imitano le emissioni provenienti da Gd-153. I sistemi di DPX della Lunar hanno un filtro di cerio e usano l'analisi dell'altezza pulsata per distinguere i raggi X a bassa e ad alta energia. I sistemi Norland utiliazzano un filtro di samario e separano i rilevatori di energia alta e bassa. Negli scanner da QDR Hologic il fascio di raggi X a doppia energia è generato commutando il generatore HV fra 70 e 140 kvp durante mezzi cicli alternati dell'alimentazione di corrente, una ruota girevole che contiene filtri equivalenti all'osso e ai tessuti molli calibra la scansione pixel per pixel. La prima generazione di scanner DXA utilizzava un fascio sottile accoppiato ad un solo rilevatore nel braccio di scansione. Un importante sviluppo della tecnologia della DXA è stata l'introduzione di scanner con un fascio a ventaglio accoppiato ad un rilevatore lineare. Gli esami con fasci a ventaglio vengono acquisiti dal braccio di scansione che esegue un solo passaggio attraverso il paziente invece della scansione bidimensionale necessaria per la geometria a fascio sottile. Di conseguenza, i tempi di scansione sono significativamente abbreviati. Una serie di studi ha dimostrato l'equivalenza delle misurazioni della BMD mediante fascio sottile e a ventaglio (8). Tuttavia, a causa della geometria del fascio a ventaglio, le misurazioni dell'area proiettata e del contenuto minerale osseo (BMC) sono sensibili all'altezza delle sedi di misurazione al di sopra del tavolo di scansione. Quando si usava la scansione con DPA, una sola scansione richiedeva 20-30 minuti e un esame completo della colonna vertebrale e dell'anca richiedeva un'ora. I primi sistemi di DXA a fascio sottile riducevano i tempi di scansione a 5-10 minuti e aumentavano la resa a due pazienti l'ora. Oggi l'ultima generazione di sistemi a fascio a ventaglio, come i sistemi Expert della Lunar e QDR-4500 della Hologic, eseguono singole scansioni in 15-30 secondi e permettono di studiare fino a quattro pazienti all'ora. Un esame più rapido dei pazienti è uno dei principali vantaggio dei nuovi sviluppi della tecnologia DXA. Un altro significativo miglioramento è costituito da una migliore definizione dell'immagine che consente un'identificazione più facile della struttura vertebrale unitamente agli artefatti dovuti a malattia degenerativa che sono un limite significativo della DXA convenzionale. Una ulteriore motivazione alla base dell'introduzione dei sistemi più recenti è quella degli scanner con elevata risoluzione a brevi tempi di scansione, in grado di produrre immagini laterali della colonna vertebrale che facilitano l'identificazione delle fratture vertebrale (morfometria vertebrale): La DXA consente le seguenti scansioni standardizzate: total body, lombare, femore, avambraccio, analisi periprotesica dell'anca , calcagno, mano totale. DEFINIZIONE "DENSITOMETRICA" DELL'OSTEOPOROSI La definizione di osteoporosi si basa su quattro punti (9,10,11) 1. 2. 3. 4. Riduzione della massa ossea. Normale mineralizzazione della massa ossea residua (assenza dei bordi osteoidi che distingue l'osteoporosi dall'OM e dall'OPM). Deterioramento della microarchitettura (diminuzione del numero di interconnessioni trabecolari). Aumento della fragilità con maggior rischio di frattura. Questa definizione include il concetto importante che il paziente con maggior rischio di frattura può essere identificato sulla base di indagini non invasive che valutino la massa ossea, l'integrità dell'architettura dell'osso, la sua mineralizzazione. L'altro concetto è quello che la frattura da osteoporosi va intesa solo come una complicazione di questa malattia, che può esistere indipendentemente dalle fratture che determina, esattamente come l'ipertensione esiste come malattia indipendentemente dall'ictus che ne è forse la più importante, ma non l'unica, complicazione. Negli studi clinici, quando si vogliono comparare popolazioni sane e popolazioni sicuramente osteoporotiche, è invalsa l'abitudine di considerare soggetti con buona massa ossea senza fratture vs soggetti con bassa massa ossea e fratture spontanee. Lo stesso dicasi quando si vogliono valutare gli effetti di farmaci in una popolazione sicuramente osteoporotica: è preferibile che alla ridotta massa ossea si associ la frattura. Questa necessità di studio, non deve però indurre nell'errore di ritenere che l'osteoporosi non esista in assenza di fratture. A riguardo esistono studi che dimostrano che la fragilità ossea, anche in assenza di fratture, si associa ad una peggiore qualità di vita e ad una minore attesa di vita, a conferma che l'osteoporosi è una malattia metabolica. E' pertanto evidente che, per fare diagnosi di osteoporosi, non si può prescindere da una valutazione quantitativa e qualitativa dell'osso. Di fatto la possibilità di una valutazione specificamente qualitativa dell'osso è al momento solo oggetto di ricerca (TAC, RMN con valutazione frattalica). Anche gli ultrasuoni e gli indici che da essi si ricavano (BUA: Broadband Ultrasound Attenuation, SOS: Speed of Sound, Stiffness: correlazione di SOS e BUA) pur essendo correlati alla qualità dell'osso sono correlati in modo soddisfaciente anche alla massa ossea. Questo è ovvio se si tiene conto che la densità ossea si correla all'architettura trabecolare: più si assottigliano le trabecole e più facilmente le stesse si frammentano riducendosi il numero delle interconnessioni. Una bassa massa ossea viene pertanto riconosciuta correntemente come il più importante fattore predittivo del rischio di frattura (12). La classificazione della mineralizzazione scheletrica, pertanto, si basa sul rapporto fra demineralizzazione e rischio di frattura e consta di tre fasce di appartenenza in cui la popolazione può essere stratificata (12,13). 1. 2. 3. Popolazione normale: la densità ossea è non più di 1 SD al di sotto del valore medio dei giovani adulti (20-30 anni). Popolazione con osteopenia: la BMD è compresa fra 1 e 2,5 SD al di sotto della densità ossea media dei giovani adulti. Popolazione con osteoporosi: la BMD è inferiore a 2,5 SD. RAPPORTI FRA MASSA OSSEA E FRATTURE La valutazione della densità ossea, come ho già detto, ha consentito di considerare l'osteoporosi non in termini di evenienza di fratture da fragilità, bensì in termini di aumentato rischio di fratture associate ad una massa ossea ridotta. E' pertanto evidente che occorre individuare la relazione fra queste due variabili e stabilire se esiste un valore soglia della BMD al di sotto del quale il rischio di frattura sia alto. Una demineralizzazione superiore a 2,5 SD rispetto alla media dei giovani adulti determina una impennata del rischio di frattura a tal punto che, in modo eccessivamente schematico ma efficace, tale demineralizzazione è stata identificata con la malattia osteoporosi, è stata distinta dall'osteopenia che non è un'entità nosologica riconosciuta, ed ha determinato la definizione altrettanto schematica della soglia di frattura, che corrisponde ad una BMD di -2,5 SD (12,13). Le basi di tutto ciò risalgono a prime valutazioni istomorfometriche (14) e cliniche in soggetti fratturati e non (15-17). Una limitazione nel definire una soglia per l'osteoporosi e per le fratture sta nel fatto che esiste un gradiente continuo fra aumento del rischio di frattura e decremento della massa ossea, ma è altrettanto evidente che la relazione non è rettilinea bensì esponenziale (18). In particolare oltre una perdita di massa ossea di 2-2,5 SD si verifica che per ulteriori piccole perdite di minerale si hanno ampi incrementi del rischio di frattura (fig 1). Ciò è determinato ovviamente dal subentrare di alterazioni qualitative dell'osso legate alla frammentazione trabecolare. E' ovvio che, anche per una accuratezza delle metodiche densitometriche che oscilla tra il 3 e il 5%, la densitometria perda in termini di potere predittivo. Se si tiene conto della relazione stretta e diretta fra perdita di massa ossea ed età, si può considerare una curva molto simile a quella precedente che correla età e rischio di frattura (19) (fig.2). Nel paziente anziano subentrano fattori non ossei individuali e fattori ambientali che aumentano il rischio di frattura e che riducono ulteriormente la predittività della densitometria nei riguardi delle fratture soprattutto se sono già presenti altre fratture (20) (tab. 1). Uno dei problemi più importanti è quello della scelta della sede di misurazione della BMD al fine della migliore predizione del rischio di frattura. Un modo per valutare la validità di differenti sedi scheletriche consiste nel calcolare per una riduzione della BMD di 1SD il risk-ratio (RR) o l' Odd ratio (OR) basato sulla regressione logistica. Più in particolare in uno studio eseguito da Cummings (21) su 8134 donne ultra 65enni i soggetti nel quartile a più bassa BMD avevano una probabilità di fratture femorali 8,5 volte superiore rispetto ai soggetti del quartile meglio mineralizzato. In altri termini una perdita di BMD corrispondente a 1SD (circa il 10%) corrisponde ad un RR di frattura femorale di 2,6; è interessante notare che il calcagno risultava altrettanto predittivo del femore mentre meno predittive risultavano la sede lombare e quella radiale. Nella stessa casistica, considerando globalmente le fratture, non esisteva differenza tra la predittività delle diverse sedi densitometriche. In questo studio il follow-up era relativamente breve, 1,8 anni, per cui esso si può considerare non definitivo. Solamente gli studi sul radio si protraggono oltre 10 anni (22, 23) e in un caso oltre 20 anni (24), ma non consentono la comparazione con le altre sedi. Per quanto concerne le fratture vertebrali bisogna fare una breve considerazione. Mentre nel 99% dei casi non esistono dubbi sui criteri di identificazione della frattura del femore, che sono pertanto gli stessi nei vari studi, la frattura vertebrale necessita di essere definita in base all'entità della riduzione di altezza del corpo vertebrale (15, 20 o 25 %), alla sede di riduzione (anteriore media o posteriore), al parametro di riferimento (vertebra sovrastante e/o altezza media degli "age-matched"), ed all'estrinsecazione clinica; ciò determina frequentemente l'impossibilità di comparare i vari studi eseguiti a livello vertebrale. E' evidente che, soprattutto per la presenza di fattori che rendono meno sensibile l'esame a livello lombare (artrosi, calcificazioni vascolari), in alcuni studi la predizione delle fratture vertebrali è migliore utilizzando la BMD del calcagno o del polso, che la BMD vertebrale (25, 26). Anche un nostro studio recente conferma questi dati sfavorevoli per il tratto lombare (27). Abbiamo comunque rilevato un miglioramento della sensibilità diagnostica escludendo le vertebre artrosiche dalla classica analisi lombare (L2-L4); una valida alternativa è costituita dalla valutazione della BMD del rachide in toto ricavato dalla scansione total-body eseguita con DXA "fanbeam" (Lunar-Expert) (27). La presenza di un vasto numero di studi retrospettivi o comunque trasversali pone la questione della loro validità al fine di stabilire il potere predittivo di diverse sedi densitometriche nei riguardi delle fratture. Una metanalisi su studi trasversali e prospettici condotta da Stegman (24) non ha riscontrato importanti differenza nell'OR (81,87 vs 1,67 rispettivamente). E' probabile però che per gli altri fattori di rischio le conclusioni possano non essere le stesse. Come è ovvio, il potere predittivo della BMD diminuisce man mano che passano gli anni dall'effettuazione dell'esame densitometrico (una BMD eseguita a 50 anni è più affidabile per il decennio fra 50 e 60 anni piuttosto che per il decennio fra 70 e 80 anni) e col subentrare di altri fattori di rischio come l'età e la presenza di una o più fratture. Pertanto, se si discute sulla durata della previsione densitometrica, si discute molto di più sul valore predittivo della densitometria eseguita nei pazienti più anziani. Alcuni studi, peraltro non concordi nei risultati, hanno comunque evidenziato la scarsa predittività della BMD o per le fratture non vertebrali (22), o per alcuni tipi di fratture femorali come quelle del collo (28). Il fatto che in un unico studio, peraltro da confermare, la massa ossea risulti predittiva per quasi un quarto di secolo (24) pone l'accento sull'importanza del picco di massa ossea, ossia sul ruolo del patrimonio scheletrico, che si raggiunge a 20-30 anni. Il fatto che il potere predittivo del dato densitometrico sia inferiore per le fratture vertebrali rispetto a quelle femorali (29), fa ritenere che in questo tipo di frattura esistano altri fattori, oltre alla BMD, che incidono in particolare sulla struttura trabecolare di cui la vertebra è in gran parte composta. Uno di questi fattori è la velocità di perdita di massa ossea. Poter valutare l'entità e la velocità della perdita di massa ossea, oltre al dato statico della BMD, aumenta sicuramente la predittività delle fratture come confermano gli studi sui markers di rimodellamento combinati alla densitometria (30). Alcuni studi (31, 32, 33) confermano comunque che, fino ai 70 anni, l'influenza del picco di massa ossea nelle fratture in genere sarebbe preponderante rispetto alla perdita di massa ossea, che spiegherebbe non più del 30% (dato comunque assolutamente non trascurabile) della variabilità della massa ossea della popolazione. RUOLO DELL'ULTRASONOGRAFIA QUANTITATIVA (QUS) La QUS fornisce due parametri ricavati dall'attraversamento del fascio ultrasonografico di una qualsiasi struttura solida: la Speed of Sound (SOS) la Broadband Ultrasound Attenuation (BUA) che hanno da decenni applicazioni nei test su alcuni materiali metallici (ad esempio il test di sicurezza per valutare la robustezza delle strutture metalliche degli aerei).Proprio da questo uso industriale è derivata la certezza che la ultrasonografia valuta non solo la densità, ma anche la qualità del materiale ( ad es. iniziali discontinuità dei metalli, indice di fatica da uso prolungato). Alcuni studi clinici confermano infatti che la QUS correla non così bene come altre metodiche solo quantitative con la BMD (34). Nostre valutazioni però attribuiscono questo riscontro al fatto che la QUS viene eseguita in sedi in cui la densitometria a RX non viene praticata in modo se non altro standardizzato. Abbiamo infatti dimostrato un'ottima correlazione ( r= 0,62) fra la QUS del calcagno e la densitometria DXA "fan-beam" (lunar-Expert) o "pencil-beam" (linar-PIXI) del calcagno (27). Per quanto riguarda la presenza di falsi positivi o falsi negativi della QUS rispetto alla DXA, questi non risultano percentualmente più numerosi di quanto non accada nel confronto fra la DXA eseguita in sedi diverse. E' indubbio però che il confronto più importante con la DXA si pone in tema di predizione delle fratture. Pochi sono gli studi longitudinali eseguiti, che stanno comunque confermando che le capacità predittive della QUS del calcagno non sono inferiori a quelle della densitometria DXA (35, 36, 37). I rari studi trasversali sono in linea con gli studi prospettici (38, 39, 40). Occorre precisare che in alcuni studi l'RR o l'OR rimangano nettamente superiori a 1 una volta effettuato l'aggiustamento dei dati per la BMD. In altri studi, combinando i dati della QUS con quelli della DXA si ottengono RR o OR più alti, quindi più predittivi della frattura, oppure si ottiene l' aumento dell'area "receiver operating characteristics" (ROC), che indica la migliore combinazione di sensibilità e specificità (38). Anche questi dati sono stati interpretati come un indice della specificità del dato qualitativo apportato in aggiunta al dato quantitativo. Va però detto che gli stessi risultati si ottengono se correggiamo i dati della BMD calcaneale DXA per la BMD lombare o femorale o se si combinano le BMD di due sedi qualsiasi soprattutto se una di queste è il calcagno. Pertanto il tutto potrebbe ricondursi alla specificità del dato quantitativo ricavato dalla sede calcaneale che, come abbiamo detto, sembra essere molto sensibile perché costituita in larga parte da osso trabecolare e perché non affetta, come la sede lombare, da patologia degenerativa. INTERPRETAZIONE DEI DATI DENSITOMETRICI Il proliferare dei modelli di densitometro, oltre che delle sedi scheletriche esplorabili, ha accentuato alcuni problemi: l'interpretazione dei dati forniti, l'individuazione del riferimento di normalità, come effettuare il monitoraggio densitometrico. I diversi modelli hanno una capacità di lettura diversa legata alla tecnologia utilizzata: la lettura di un "fan beam" non può essere la stessa di un "pencil-beam"; esiste però anche una diversità degli strumenti legata ai software, che, indipendentemente dalla lettura del singolo pixel, hanno diversi livello di separazione fra osso e non osso e quindi individuano aree ossee diverse. Si può infatti dimostrare che uniformando le aree, la BMD di un Lunar-DXA non è poi così diversa da quella di un Hologic-DXA. Esiste poi una differenza legata ai valori di riferimento utilizzati dai diversi produttori che fanno riferimento a diverse popolazioni normali, per cui occorrerebbe che ogni centro costruisse una propria curva di normalità. Al di là di tutto questo c'è un problema intrinseco alla stessa valutazione del dato: con cosa si deve confrontare la densità ossea? Con la media dei soggetti di pari età o con la media dei giovani adulti? Oppure occorre confrontare il dato con un range di normalità e rapportarmi al valore inferiore del range. Inoltre come dobbiamo quantificare la differenza tra il dato del paziente ed il riferimento: in percentuale del valore di densità o in fasce di gravità basate sulla deviazione standard? Per questo sono stati creati il T-score e il Z-score. Il T-score rapporta il dato di BMD alla media di giovani adulti ma anche al range di normalità espresso dalla SD, esso infatti si ricava dalla differenza della BMD/SD. Il Z-score si ricava nello stesso modo ma la BMD di riferimento è quella dei soggetti di pari età. E'ovvio pertanto che in un giovane adulto T-score e Z-score coincideranno, mentre con il passare degli anni il Z-score sarà sempre più piccolo del T-score e quindi darà una indicazione di minore gravità della demineralizzazione rispetto al T-score. Il fatto che la soglia di frattura sia stata riferita ai giovani adulti e che non cambi con l'età, ed il desiderio e la necessità di correlare il dato densitometrico con il rischio di frattura ha fatto sì che il Tscore prendesse il sopravvento nella refertazione densitometrica rispetto allo Z-score a tal punto che come abbiamo già visto, lo stato della mineralizzazione e quindi l'osteoporosi sono stati classificati in base al T-score (normalità: T-score > -1; osteopenia T-score < -1 e > 2.5; osteoporosi < 2.5). Il T-score ha consentito una certa uniformità, anche se non assoluta, di valutazione tra centri modelli ed apparecchi diversi aiutando le procedure di screening, non però il follow-up del paziente. Ma il T-score ha posto anche una serie di problematiche. Accenno appena al fatto che il T-score risente del modo con cui è stato costituito il range di riferimento, come è stato evidenziato dallo studio NHANES (41, 42, 43),che ha dimostrato l'erroneo riferimento dei giovani adulti dei densitometri della Hologic, che portava ad una "overdiagnosis" di osteoporosi. E'ovvio che il problema di costituire bene il range di riferimento non è specifico del T-score, si pone infatti anche con la BMD, però ogni piccolo errore nella determinazione della media della BMD di riferimento e della SD viene amplificato dalla formula da cui si ricava il Tscore, poiché la divisione per un decimale (quale è sempre la SD) diviene una moltiplicazione. Un altro problema consiste nello stabilire, essendo la soglia dell'osteoporosi pari ad un T-score di -2.5, in quale sede valutare il T-score, dal momento che esso è diverso a seconda del distretto scheletrico esaminato (44). In particolare le differenze fra distretti sono amplificate nel T-score rispetto alla BMD espressa in %: C'è poi da chiedersi se la soglia di -2,5 sia uguale per tutte le sedi. Ad esempio il T-score del wards femorale è sempre estremamente severo rispetto ad altre sedi femorali e non: è questo un indice di migliore sensibilità di questa minuscola regione oppure è indice esclusivamente di una maggiore perdita anche fisiologica che potrebbe per esempio mostrare la soglia fra osteopenia ed osteoporosi oltre -2,5? Questo ultimo quesito introduce finalmente al problema più attuale: occorre valutare solo il T-score oppure una integrazione di T-score e Z-score? Ossia: è proprio opportuno escludere completamente dalla valutazione densitometrica il riferimento agli age-matched? E' ovvio che tentare l'integrazione di due parametri comporti almeno tre problemi: 1. 2. 3. se è già difficile stabilire il range di normalità dei giovani adulti e altrettanto difficile, forse impossibile, stabilire un range di normalità dopo la menopausa ed in particolare nella senilità a meno che non si vogliano considerare normali tutti coloro che non hanno fratture; bisognerebbe stabilire in che misura rapportare T e Z score, ossia quale debba essere il peso di ognuno di essi. il rapporto fra i due indici deve essere o no diverso a seconda dei distretti esaminati, essendo diversa la velocità di perdita ossea negli stessi? Un' altra questione riguarda il valore da dare al T-score ( ed allo Z-score) nella QUS alla luce anche della classificazione della WHO. E' chiaro che la relazione fra età, modificazioni legate alla menopausa e all'osteoporosi e la stessa SD della popolazione di riferimento devono essere valutati per la QUS, così come la stessa classificazione della WHO. DENSITOMETRIA E DECISIONE TERAPEUTICA In base alla classificazione della WHO è ovvio che bisogna distinguere due situazioni: 1. soggetti con T-score <-2,5: occorre tendenzialmente trattarli tutti, ma devono esse re poste due limitazioni. a)se l'attesa di vita è breve: non ha molto senso trattare un paziente che ha un'attesa di vita di sei mesi o un anno, a meno che non si vogliano sfruttare gli effetti antalgici di certi farmaci mineralizzanti. b. in soggetti prima dei 60 anni occorrono i presupposti per una buona compliance ad una terapia che dovrebbe prolungarsi per almeno 20 anni. E' dimostrato che l'interruzione di una terapia estrogenica intorno ai 55 anni innalza nuovamente e rapidamente il rischio di frattura proprio a 60 anni (45), allorchè di norma le fratture iniziano a manifestarsi. A riguardo i bisfosfonati sembrerebbero comportarsi diversamente dagli estrogeni per un "effetto coda", ma resta da stabilire quanto questo duri in termini di BMD e se esista anche in termini di prevenzione delle fratture. 2. I soggetti con T-score tra -1e -2,5 vanno trattati solo in presenza di fattori di rischio ( uso di cortisonici immobilizzazione, artrite reumatoide, markers ossei alterati, presenza di fratture, Z-score<-1). Ovviamente valgona le stesse considerazioni dei punti a) e b). Da un punto di vista del rapporto costo beneficio la soglia densitometrica di trattamento può variare per i vari farmaci come proposto da Eddy (46) ed in base alla presenza di fratture ed altri fattori di rischio che ne determinano ovviamente l'innalzamento. DENSITOMETRIA E MONITORAGGIO DELLA TERAPIA La sensibilità della densitometria nel follow up è limitata dall'entità delle modificazioni in più o in meno della massa ossea, che sono in genere piccole (1-5 % annuo) e dall'errore di precisione a lungo termine dei densitometri, che oscilla, secondo la sede scheletrica, il tipo e il modello di apparecchio, tra l'1% e il 3 %. Esistono formule che consentono di calcolare la minima variazione densitometrica significativa in un singolo soggetto sottoposto a trattamento. Molto semplicemente occorre conoscere il coefficiente di variazione (CV%) del proprio densitometro che esprime la misura della precisione e moltiplicare per tre per individuare la variazione per cento che si deve raggiungere affinché la si possa ritenere la stessa attribuibile non all'apparecchio bensì alla terapia e alla patologia che si sta studiando (44). Quindi per una CV% di 1,5 un farmaco dovrà determinare una variazione del 4,5% annua perché questa si possa ritenerla significativa. Questa procedura però, se valida nel singolo soggetto, può essere modificata negli studi su gruppi di pazienti a seconda della numerosità del campione. Inoltre, ripetendo più volte la misurazione si può evitare l'effetto della imprecisione istantanea anche se permane quello della imprecisione a lungo termine . E' ovvio inoltre che quando si fanno follow up terapeutici con popolazioni di controllo, la minima variazione densitometrica perde molta della sua importanza. Comunque nella valutazione sul singolo soggetto non si dovrebbe prescindere da essa (cosa che invece accade sistematicamente) e dovrebbe determinare la programmazione della frequenza dei controlli densitometrici. Un apparecchio con una buona precisione (es.1,5%) è in grado di riscontrare in quella stessa sede variazioni significative se esse superano il 4,5%. Una terapia molto efficace in genere dà tali risultati in 1-2 anni, raramente dopo sei mesi, per cui la densitometria per il monitoraggio dovrebbe essere eseguita non prima di un anno. L'effetto di terapie più blande potrà essere riscontrato come significativo solo dopo 2-3 anni. Anche un lieve peggioramento della performance del densitometro ad esempio del 1,5-2%, richiede controlli meno ravvicinati. E' ovvio che la risposta individuale ad un farmaco non è prevedibile per cui inizialmente necessita un monitoraggio più attaento e frequente :consigliabili controlli annui per 2-3 anni che potranno successivamente diradarsi solo in caso di risposta positiva alla terapia. C'è chi ha posto il problema del rapporto costo-beneficio di un monitoraggio così impegnativo soprattutto alla luce degli ottimi risultati ottenuti con i bisfosfonati dell'ultima generazione come l'alendronato riguardo ad incremento di BMD e prevenzione delle fratture. In merito occorre dire che mentre il monitoraggio con le fratture è accettabile in un gruppo di popolazione, appare poco applicabile da solo senza la valutazione della BMD, anche considerando il fatto che comunque esistono soggetti non responders e che nei responders e nei non-responders esiste una stretta correlazione tra entità dell'incremento della massa ossea e entità della riduzione delle fratture (47). L'effettuazione della densitometria è inoltre essenziale per determinare la compliance del paziente che si è abituato a valutare il dato numerico della BMD nel tempo esattamente come fa il diabetico con la glicemia e l'iperteso con la pressione arteriosa. Un'altra questione che porrebbe in seria discussione il ruolo della densitometria nel monitoraggio, è la presenza di discrepanza riscontrata nello studio PROOF sulla calcitonina tra prevenzione delle fratture ed incremento di BMD (48). Il fatto che alcuni studi come il PROOF abbiano evidenziata una maggiore efficacia nella prevenzione delle fratture che nell'incremento di massa ossea, potrebbe essere visto con qualche dubbio sulla buona conduzione dello studio o in tema di densitometria o in tema di valutazione delle fratture e comunque non può significare, anche in presenza di eventuali future conferme, che il monitoraggio dell'OP si debba condurre solo con la morfometria vertebrale, ma solo che questa è estremamente utile al fianco della BMD. QUANDO E A CHI FARE LA DENSITOMETRIA Attualmente prevale il seguente orientamento: 1. 2. dopo i 60-65 anni la densitometria è sempre indicata poiché da quell'età aumenta rapidamente il rischio di frattura indipendentemente dalla presenza di fattori di rischio: A questa età inoltre i trattamenti si sono rivelati comunque efficaci nel prevenire la prima e le ulteriori fratture (47,49). l'argomento più dibattuto riguarda la densitometria prima dei 60 anni. La European Foundation for Osteoporosis ha elencato i fattori che indipendentemente dall'età pongono una forte indicazione alla densitometria (50) Bisogna innanzitutto integrare l'elenco con l'artrite reumatoide e probabilmente inserire la terapia cortisonica indipendentemente dalla dose somministrata (tab.2). Ma il problema più importante è che il 70% della variabilità della BMD è dovuta al picco di massa ossea e che l'80% di questa è determinato geneticamente. Non solo, ma è certo che la perdita di massa ossea legata all'età è determinata geneticamente (ruolo ad es. del recettore della vit.D) ed inizia ben prima dell'inizio della menopausa. Anche la perdita di massa ossea legata alla menopausa subisce una forte modulazione genetica, (ruolo di molti recettori tra cui quelli degli estrogeni). Purtroppo il fattore di rischio più importante, quello genetico, non è al momento individuabile routinariamente per cui non si possono ben selezionare i pazienti candidati a sottoporsi alla densitometria. Pertanto eseguire la densitometria a soggetti con fattori di rischio classici esclude almeno il 50% di pazienti osteoporotici che comunque si frattureranno. E' ovvio che buona parte di questi soggetti avranno le fratture dopo i 60 anni ma è altrettanto ovvio che l'intervento farmacologico a quell'età,anche se efficace rispetto a un gruppo di controllo non trattato di pari età, sarà comunque nettamente inferiore rispetto ad un gruppo selezionato per tempo con la densitometria e messo subito in terapia. Purtroppo seguire a tutti i cinquantenni una densitometria aumenta i costi anche perché obbliga a mettere in terapia preventiva e curativa un maggior numero di persone. E' stato comunque calcolato che una piccola riduzione delle fratture ( 5%) consentirebbe un risparmio sufficiente a garantire la densitometria a ogni donna cinquantenne. Al momento non esistono studi su dati reali, e non estrapolati, che mettano al confronto i due approcci, quello più restrittivo e quello meno restrittivo, sull'uso della densitometria, anche perché non si può prevedere la compliance terapeutica di una popolazione di fronte a un massiccio intervento terapeutico o preventivo iniziato a 50 anni, né l'entità della riduzione delle fratture che ne possa conseguire. Occorrerebbe tra l'altro stabilire se intervenire solo sugli osteoporotici oppure anche sui soggetti osteopenici. QUALE SEDE PER LO SCREENING E PER IL MONITORAGGIO DELLA TERAPIA Abbiamo già in parte trattato questo argomento. Per lo screening a 50 anni pare indicata qualsiasi densitometria regionale, ma soprattutto quelle eseguite sui siti con prevalenza di sostanza trabecolare: vertebre, calcagno, polso distale. Per lo screening a 65 anni ed oltre, il femore ed il calcagno sono i più sensibili. Interessante la estrema sensibilità del rachide estrapolato dal "total-body" fan-beam, indipendentemente dall'età. Per il monitoraggio occorre ripetere ovviamente l'esame nella stessa sede in cui è stato effettuato l'esame basale; per questo quando si esegue la prima densitometria bisogna scegliere l'esame in funzione anche del monitoraggio successivo. Per chi possiede apparecchi con tecnologia "fam-beam", quindi estremamente rapidi, è proponibile un'esame in due sedi: a 50 anni, lombare +total-body ; dopo 65 anni, femore o calcagno+ total-body oppure total-body con valutazione mirata sul rachide totale estrapolato dal total-body stesso. POTENZIALITA' DELLE DXA DELL' ULTIMA GENERAZIONE La densitometria DXA "fan-beam" ha aperto il campo ad applicazioni di estrema utilità clinica. La più importante e già consolidata, anche se non tanto diffusa, è la morfometria vertebrale, di cui tratto diffusamente in un altro capitolo di questo numero. Vorrei solo accennare che la possibilità di misurare le altezze dei corpi vertebrali in poco più di 30 secondi consente un monitoraggio più accurato ed evita in gran parte dei casi una radiografia o la indica comunque in modo più preciso e misurato. L'aspetto ancora non noto è la potenzialità della morfometria nello studio e nella pratica clinica delle rachialgie laddove essa consente di valutare deformità vertebrali o alterazioni degli spazi intervertebrali legati a patologia artrosica. La tecnologia fan-beam offre, in campo reumatologico, la possibilità di quantificare un'artropatia delle mani con dettagli sulla densità periarticolare e sugli spazi interossei che potrebbero rivelarsi estremamente utili nella diagnosi precoce (51). Altro aspetto di estremo interesse è la possibilità di monitorare la massa ossea periprotesica femorale innanzitutto, ma anche di altre sedi (52). Rimane aperto il quesito se è la massa periprotesica realmente sia predittiva del loosening protesico oppure se possa essere solo utile in fase diagnostica precoce. Fra le valutazioni regionali non classiche potrebbe avere un futuro la densitometria del cranio, in particolare della mascella e della mandibola, per la applicazioni in campo odontostomatologico in cui si pongono le stesse problematiche di prevenzione primitiva e secondaria e di diagnosi precoce cui abbiamo appena accennato nel campo ortopedico. Un'altra possibilità, al momento più oggetto di studio che di applicazione clinica, è la valutazione della "body composition"(53) che il densitometro realizza sistematicamente in ogni pixel nel momento in cui deve distinguere l'osso dal non osso e , all'interno di questo, il grasso dal non grasso. A questi tre tessuti corrispondono infatti tre indici (Rvalue) specifici dati dal rapporto di attenuazione tra il raggio più energetico e quello meno energetico che sono l'essenza della DPA e della DXA. A parte le applicazioni nel campo metabolico e dietologico, la valutazione della composizione corporea è comunque fondamentale, quando si verifichino variazioni della massa ossea, per stabilire se esse siano dovute o meno ad una variazione del peso corporeo o della body composition che, notoriamente, interferiscono sul metabolismo osseo ma anche sulla capacità di "lettura" del raggio X densitometrico. BIBLIOGRAFIA 1. Cameron JR, Sorenson J. Measurement of bone mineral in-vivo: an improved method. Science 1963; 142: 2302. 3. 4. 5. 6. 7. 8. 6. Grampp S, Jergas M, Gluer C-C, Lang P.Braslow P, Genant HK. Radiological diagnosis of osteoporosis: current methods and perspectives. Radiol Clin North Arn 1993; 31: 1133-45. Wilson CR, Madsen M, Dichromatic adsorptiometry of vertebral bone mineral content. Invest Radiol 1977; 112: 180-4. Cann CE. Quantitative CT for determination of bone mineral density : a riew: Radiology 1988; 168: 509-22. Mazess R, Collick B, Tremple J, Barden H, Hanson J. Performance evaluation of a dual-energy X ray bone densitometer: Calcif Tissue Int 1989; 44: 228-32. Nuti R, Martini G, Righi G, Frediani B, Turchetti V.. Comparison of total body measurements by dual-energy x-ray absorptiometry and dual-photon absorptiometry. J. Bone Min. Res. 1991; 6: 681-687. Kalender WA. Effective dose values in bone mineral measurements by photon absorptiometry and computed tomography. Osteoporosis Int 1992; 2: 82-7. Faukner KG, Gluer C-C, Estillo M, Genant HK. Crosscalibration of DXA equipment: upgrading from a Hologic QDR-1000/W to a QDR -2000. Calcif Tissue Int 1993; 52:79-84. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. Caniggia A, Frediani B. Absorptiometry in metabolic bone disease: basal values and long-time treatment with calcitriol (osteoporosis vs osteomalacia). Scanning Microscopy, Cells and Materials, Food Structure Meeting. Houston Maggio 1995; 6: 11-14. Consensus Development conference: diagnosis, prophylaxis and tretment of osteoporosis. Am j Med (1991) 90: 107-10. Consensus development conference: diagnosis, prophylaxis and treatment of osteoporosis Am J med (1993) 94: 646-50. Kanis JA, Melton LJ, Christiansen C et al. The diagnosis of osteoporosis . J Bone Miner Res (1994) 9: 113741. Word Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: WHO Technical Report Series 843 (WHO: Geneva, 1994). Meunier PJ, Sellami S, Briancon D et al: Histological heterogeneity of apparently idiopathic osteoporosis . In: DeLuca H, Frosy J, jee WSS et al., eds, Osteoporosis (University park Press: Baltimore, 1981), 321. Riggs BL, Wahner HW, Seeman E et al. Changes in bone mineral density of the proximal femur and spine whit aging. Differences between the postmenopausal and senile osteoporotic syndromes. J Clin Invest (1982) 70: 716-23. Mazess RB. Bone density in diagnosis of osteoporosis : thresholds and breakpoints. Calcif Tissue Int (1987) 41:117-18. Ryan PJ, Blake GM, Herd R et al. Spine and femur BMD by DXA in patients whit varying severity of spinal osteoporosis . Calcif Tissue Int (1993) 52: 263-8. Melton LJ, Kan SH , Wahner HW et al. Lifetime fracture risk: an approach to hip fracture risk assessment based on bone mineral density and age. J Clin Epidemiol (1988) 41: 1804-9. Cooper C.,Melton LJ III. Epidemiology of osteoporosis.Trends Endocrinol Metab 1992; 314: 224-9. Cummings SR, Nevitt MC, Browner WS et al. Risk factors for hip fractures in white women. N Engl J Med (1995) 332: 767-73. Cummings SR, Back DM, Nevitt MC et al. Bone density at various sites for prediction of hip fractures. Lancet 1993; 341(8837):72-5. Gardsell P, Johnell O, Nilsson Be, Gullberg B. Predicting various fragility fractures in women by forearm bone densitometry : a follow-up study. Calcif Tissue Int 1993;52: 348-53. Gardsell P, Johnell O, Nilsson BE. The predictive value of forearm bone mineral content measurement in men. Bone 1990; 11: 229-32. Stegman MR, Recker RR, Davies KM, Ryan RA, Heaney RP. Fracture risk as determined by prospective and retrospective study designs. Osteoporosis Int 1992; 2: 290-7 Wasnich RD, Ross PD, Davis JW, Vogel JM. A comparison og single and multi-site BMC measurement for assessment of spine fracture probability. J Nucl Med 1989; 30:1166-71. Ross PD, Davis JW, Epstein RS, Wasnich RD. Pre-existing fractures and bone mass predisct vertebral incidence in women. Ann Intern med 1991; 114: 919-23. Frediani B, Allegri A, Storri L, Falsetti P, Baldi F, Bisogno S, Marcolongo R. Prediction of Morphometric XRay Deformities by Dual-Energy X-Ray Absorptiometry of Os Calcis: Comparison with Ultrasound Bone Measurement of Os Calcis and Total Body Absorptiometry. J Bone Min Res, ASBMR 1998 Nevitt M, Johnell O, Black DM, Ensrud K, Genant HK, Cummings SR. Bone mineral density predicts nonspine fractures in very elderly women.Osteoporosis Int 1994; 4: 325-31. Hansen MA, Overgaard K, Riis BJ, Christiansen C. Role of peak bone mass and bone loss in post-menopausal osteoporosis: 12 year study. BMJ 1991; 303:961-4. Garnero P, Hausher E, Chapuy MC et al. Markers of bone resorption predict fractures in elderly women: the Epidos prospective . I Bone Miner Res 1996; 11 (10): 1531-8. Hui SL, Slemenda CW, Johnston CC., Baseline measurement of bone mass predict fracture in white women. Ann intern Med 1989; 111: 355-61. Gardsell P, Johnell O, Nilsson BE. The predictive value of bone loss for fragility fractures in women: a longitudinal study over 15 years. Calcif tissue Int 1991; 49:90-4: Hui Sl, Slemenda CW, Johnston CC. The contribution of bone loss to postmenopausal osteoporosis . Osteoporosis Int 1990; 1: 30-4. Gluer C-C, Vahlensieck M, Faulkner KG et al. Site -matched calcaneal measurements of broadband ultrasound attenuation and single X-ray absorptiometry: do they measure different skeletal properties. J Bone Miner Res (1992)7: 1071-9. Porter R, Miller C, Grainger D, Palmer S. Prediction of hip fracture in elderly women: a prospective study. BMJ 1990; 301:638-41. 36. Heaney RP, Avioli LV, Chesnut CH III, Lappe J, Recker RR, Brandenburger GH. Ultrasound velocity through bone predicts incident vertebral deformity. J Bone Miner Res 1995; 10: 341-5. 37. Hans D, Dangent-Molina P, Schott Am et al. Ultrasonographic heel measurement to predict hip fracture in the elderly . Lancet 1996; 348: 511-14. 38. Gluer CC, Cummings SR, Bauer DC et al. Osteoporosis: association of recent fractures with quantitative ultrasound findings. Radiology 1996; 199:725-32. 39. Stegman MR, Heaney RP, Recker RR. Comparison of speed of sound ultrasound with single photon absorptiometry for determining fracture odds ratios. J Bone Miner Res 1995; 10: 346-52 40. Stegman MR, Davies KM, Heaney RP, Recker RR, Lappe JM. The association of patellar ultrasound trasmission and forearm densitometry with vertebral fracture, number and severity: The Saunders county bone quality study. Osteoporosis Int 1996; 6: 130-5. 41. Looker AC, Wahner HW, dunn WL et al. Proximal femur bone mineral levels of US adults. Osteoporosis Int (1995) 5: 389-409. 42. Looker AC, Orwoll ES, Johnston CC et al. Prevallenceog low femoral bone density in older US adults from NHANES III. J Bone Miner Res (1997) 12: 1961-8. 43. Looker AC, Wahner HW, Dunn WL et al. Updated data on proximal femur bone mineral levels of US adults. Osteoporos Int (1998) (in press). 44. Blake GM, Wahner HW, Fogelman I. Clinical interpretation of bone density scans. The evalution of osteoporosis: dual energy x-ray absorptiometry and ultrasound in clinical practice. Martin Dunitz 1999:361386. 45. Stevenson JC. Postmenopausal bone loss and osteoporosis. In: The climateric and beyond(Zichella L et al., eds). Carnforth: Parthenon Publishing, 1988: 125-35. 46. Eddy DM, Johnston CC, Cummings SR, et al. Osteoporosis: cost effectiveness analysis and review of the evidence for prevention, diagnosis and treatment: the basis for a guideline for the medical management of osteoporosis. Osteoporos Int (1998) (in press). 47. Black DM, Cummings SR, Karpf DB et al. Randomised trial of the effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 1996; 348: 1535-41. 48. Stock JL, Avioli LV, Baylink DA et al. Calcitonin-salmon nasal spray reduces the incidence of new vertebral fractures in postmenopausal women: three-year interim results of the Proof study. JBMR,ASBMR 1997. 49. Cummings SR, Black DM, Thompson DE et al. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fracture.JAMA 1998, 280(24): 2077-82. 50. Kanis JA, Delamas P, Burckhardt P et al. Guidelines for the diagnosis and management of osteoporosis. Osteoporos Int (1997) 7: 390-406. 51. Frediani B, Allegri A, Storri L , Falsetti P, Bisogno S, Baldi F, Cataldi V, Fioravanti A, Marcolongo R . L'osteoprosi iuxartirticolare nelle artriti e nell'artrosi: Valutazione con densitometria a raggi x "fan-beam". 52. Caniggia M, Frediani B, Osti L Hip prosthesis and bone mineral absorptiometry: effect of short-term administration of calcitriol. Scanning Microscopy, Cells and Materials, Food Structure Meeting. Houston Maggio 1995; 6-11. 53. Martini G., Frediani B., Nuti R. Metodi di misura del tessuto adiposo nel corpo intero: utilita' della densitometria "total body" a raggi X. Min. Med. 1992; 83:181-185. 54. Nuti R., Martini G., Frediani B.,Valenti R., Giovani S. Relationships between body composition and bone density in healthy and osteoporotic women. Bone Min Res 1994; 9: S1, S257.
Scaricare