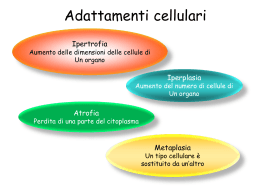
STRESS AUMENTATA RICHIESTA FUNZIONALE DANNO CELLULARE REVERSIBILE STRESS PERSISTENTE ADATTAMENTO IPERTROFIA IPERPLASIA ATROFIA METAPLASIA DEPOSITI LIEVE GRAVE DANNO CELLULARE IRREVERSIBILE RIMOZIONE DELLO STRESS CELLULA NORMALE MORTE DELLA CELLULA In risposta a stimolazioni esterne (sia fisiologiche che patologiche) le cellule sono in grado di rispondere andando incontro a quelli che vengono definiti adattamenti cellulari. Le cellule infatti possono: - Aumentare di numero (IPERPLASIA) - Diventare più grandi (IPERTROFIA) - Diventare più piccole (ATROFIA) - Proliferare per rimpiazzare le perdite (RIGENERAZIONE) - Modificare il loro fenotipo in modo reversibile (MODULAZIONE) - Essere sostituite da altri tipi cellulari (METAPLASIA) - Adattare i loro organuli (ADATTAMENTI SUBCELLULARI) IPERTROFIA: aumento delle dimensioni delle cellule (con un conseguente aumento delle dimensioni dell’organo). IPERPLASIA: aumento del numero delle cellule di un organo o di un tessuto determinato da un aumento delle divisioni cellulari. La capacità di un tessuto di adattarsi ad un aumentato carico funzionale andando incontro ad ipertrofia o ad iperplasia dipende dal tipo di cellule che lo compongono. Giulio Bizzozzero (1846-1901) L’appartenenza delle cellule ai tre tipi principali di tessuti (a cellule labili, stabili e perenni) comporta una diversa regolazione a livello del ciclo cellulare. IL MANTENIMENTO NUMERO DEL FISIOLOGICO DI CELLULE IN UN TESSUTO E’ LA CONSEGUENZA DI UN EQUILIBRIO FRA PROCESSI DI PROLIFERAZIONE, DIFFERENZIAMENTO E MORTE CELLULARE. I FATTORI DI CRESCITA SONO IN GRADO DI CONTROLLARE LA PROGRESSIONE DELLE CELLULE LUNGO LE DIVERSE FASI DEL CICLO CELLULARE. CAUSA Aumentata richiesta funzionale ESEMPIO P. sanguigna elevata ipertrofia miocardio Stimolazione endocrina Estrogeni iperplasia endometrio Ormoni locali o sostanze mitogene Linfochine ipertrofia/iperplasia macrofagi Aumentata nutrizione Eccesso calorico ipertrofia muscolo e t. adiposo Aumentata irrorazione Fistole artero-venose accelerata crescita arti Fattori meccanici Trazione sulla cute ipertrofia/iperplasia cutanea Squilibrio catabolismo/anabolismo Osso osteopetrosi Agenti farmacologici Isoproterenolo ipertrofia ghiandole salivari DA AUMENTATO ESERCIZIO DA MUTAZIONE DEL GENE PER LA MIOSTATINA normale ipertrofico NORMALE IPERTROFICO IPERTROFIA DEL VENTRICOLO SINISTRO DEL CUORE DA VALVULOPATIA (STENOSI DELLA VALVOLA AORTICA). IPERTROFIA E IPERPLASIA DEL MIOMETRIO (MUSCOLO LISCIO DELLA PARETE DELL’UTERO) IN GRAVIDANZA. IPERPLASIA DELL’ENDOMETRIO IN RISPOSTA A STIMOLAZIONE DA ESTROGENI . RISPOSTE ADATTATIVE CHE PORTANO AD UN AUMENTO DELLA MASSA CELLULARE: IPERTROFIA E IPERPLASIA. ATROFIA = riduzione acquisita nelle dimensioni delle cellule, dei tessuti o degli organi. IPOPLASIA = situazione congenita di deficitario sviluppo di un organo o tessuto APLASIA = mancato sviluppo di un organo o tessuto INVOLUZIONE = riduzione fisiologica del volume di organi ATRESIA = imperforazione congenita CAUSE DI ATROFIA - Ridotta funzione (atrofia da disuso) - Iponutrizione (atrofia da digiuno) - Ridotta irrorazione (da ischemia cronica) - Pressione locale (atrofia da compressione) - Occlusione dei dotti escretori - Effetti ormonali - Invecchiamento (atrofia senile) - Denervazione Diminuzione del numero delle cellule Apoptosi ATROFIA Autofagocitosi Diminuzione del volume delle cellule Proteasi non lisosomiali AUTOFAGOCITOSI DI MITOCONDRI DEGRADAZIONE DELLE PROTEINE CELLULARI DA PARTE DELLE PROTEASI NON LISOSOMIALI: IL SISTEMA DELL’UBIQUITINA. ATROFIA SENILE DEL CERVELLO ATROFIA DEL CERVELLO NELLA MALATTIA DI ALZHEIMER GRAVE ATROFIA RENALE RISPOSTE ADATTATIVE CHE PORTANO AD UNA RIDUZIONE DELLA MASSA CELLULARE: L’ATROFIA. METAPLASIA = sostituzione di un tessuto differenziato di un certo tipo con un tessuto differenziato di tipo diverso. In teoria ogni cellula possiede un patrimonio genetico completo per cui potrebbe trasformarsi in qualsiasi altro tipo di cellula In pratica nei mammiferi adulti la metaplasia può avvenire soltanto fra tessuti epiteliali oppure soltanto fra tessuti mesenchimali METAPLASIA EPITELIALE (frequente negli epiteli di rivestimento) - metaplasia squamosa - leucoplachia - metaplasia ghiandolare METAPLASIA CONNETTIVALE - m. ossea del tessuto connettivo - m. condroide - m. mixoide - m. del tessuto adiposo EPITELIO BRONCHIALE NORMALE METAPLASIA SQUAMOSA DELL’EPITELIO BRONCHIALE EPITELIO DELLA VESCICA Leucoplachia RIGENERAZIONE = sostituzione delle cellule andate perdute con cellule dello stesso tipo. TESSUTO CONNETTIVO tutte le varietà di tessuto connettivo sono capaci di rigenerare, sebbene in misura variabile. EPITELI rigenerano molto bene, con alcune eccezioni (cellule del cristallino, podociti) TESSUTO MUSCOLARE mentre il muscolo liscio rigenera molto bene, per lo striato, sebbene abbia un certo potenziale rigenerativo, i tentativi di rigenerazione in genere falliscono perché i monconi si retraggono troppo e la perdita di sostanza viene colmata prima da un coagulo di sangue e poi, con il passare del tempo, da una cicatrice. TESSUTO NERVOSO nell’uomo i neuroni andati perduti non vengono sostituiti e gli assoni del SNC, una volta recisi, non ricrescono in maniera efficiente. Esistono circa 40 malattie da accumulo lisosomiale, rare se prese singolarmente, ma abbastanza comuni nel loro insieme. Sono generalmente trasmesse come carattere autosomico recessivo. Spesso sono fatali. Schema generale: DEFICIT ENZIMATICO infarcimento dei lisosomi con il substrato dell’enzima interessato le cellule si rigonfiano le cellule possono morire A D A T T A M E N T O D A N N O SE I LIMITI ADATTATIVA DELLA RISPOSTA CELLULARE VENGONO SUPERATI SI VERIFICANO UNA SERIE DI EVENTI GENERICAMENTE NOTI COME DANNO CELLULARE. FINO AD UN CERTO PUNTO IL DANNO CELLULARE PUO’ ESSERE REVERSIBILE, MA SE LO STIMOLO PERSISTE O E’ GRAVE FIN DALL’INIZIO, LA CELLULA RAGGIUNGE UN PUNTO DI NON RITORNO E VA INCONTRO AL DANNO IRREVERSIBILE E ALLA MORTE CELLULARE. RISPOSTA CELLULARE AL DANNO A seconda della natura e della intensità del danno le cellule possono rispondere con l’aumento o con la riduzione del livello della loro attività. A fronte di una miriade di agenti lesivi l’elenco delle risposte cellulari è molto più breve perché le cellule possiedono un numero limitato di possibilità di risposta. DANNO CELLULARE REVERSIBILE CARATTERISTICHE GENERALI 1) La risposta cellulare ad uno stimolo lesivo dipende dalla natura dello stimolo, dalla sua durata e dalla sua intensità. 2) Le conseguenze di un danno cellulare dipendono dal tipo, dallo stato e dalle capacità adattative delle cellule. 3) Sebbene i precisi siti di azione a livello biochimico di molti stimoli lesivi siano difficili da individuare con precisione, si può dire, da un punto di vista generale, che quattro sistemi intracellulari risultano particolarmente sensibili: - mantenimento dell’integrità della membrana cellulare - respirazione aerobia - sintesi proteica - preservazione dell’integrità del materiale genetico DANNO CELLULARE REVERSIBILE CARATTERISTICHE GENERALI 4) Gli elementi strutturali e biochimici della cellula sono fra loro in relazione così stretta che qualunque sia il punto preciso di attacco iniziale, una lesione in una sede comporta sempre effetti secondari a largo raggio. 5) Le alterazioni morfologiche del danno cellulare si manifestano solo dopo che sia stato danneggiato qualche sistema biochimico cruciale. MECCANISMI DI DANNO DANNO DA IPOSSIA IPOSSIA = carenza di ossigeno a livello dei tessuti. - Ipossia IPOSSICA dovuta ad una bassa pO2 nel sangue arterioso, che contiene però una quantità normale di emoglobina. - Ipossia ANEMICA dovuta a mancanza di una quantità di emoglobina sufficiente per il trasporto dell’O2 necessario ai tessuti. - Ipossia STAGNANTE o CIRCOLATORIA dovuta ad un difetto dei vasi, per cui i tessuti non possono ricevere l’O2 presente in quantità normale nel sangue arterioso (ISCHEMIA). - Ipossia ISTOTOSSICA la pO2 nel sangue arterioso, la quantità di emoglobina e le condizioni dei vasi sono normali, ma le cellule sono danneggiate e non sono capaci di utilizzare l’ossigeno che ad esse arriva normalmente. (classificazione sec. Barcroft, Peters & Van Slyke) L’ipossia è la forma più comune di danno cellulare in medicina clinica. IPOSSIA la produzione di energia mediante glicolisi anaerobia può proseguire ISCHEMIA compromette anche l’apporto di substrati per la glicolisi la produzione di energia per via anaerobia cessa dopo che i substrati sono esauriti o perché viene inibita dall’accumulo di metaboliti. IL DANNO TESSUTALE INDOTTO DALL’ISCHEMIA E’ PIU’ RAPIDO DI QUELLO CONSEGUENTE AD IPOSSIA DANNO DA ISCHEMIA: L’INFARTO DEL MIOCARDIO MIOCARDIO NORMALE DANNO REVERSIBILE DANNO IRREVERSIBILE ISCHEMIA RIPERFUSIONE ATP Ca ADP attivazione proteasi AMP conversione proteolitica IPOXANTINA + XANTINA OSSIDASI + O2 URATO + H2O2 + O2- della XANTINA DEIDROGENASI ADENOSINA in Fe3+ XANTINA OSSIDASI O2 + OH- + OH• INOSINA IPOXANTINA (nessuna reazione in assenza di ossigeno) DANNO CELLULARE DANNO MITOCONDRIALE AUMENTO DEI LIVELLI DEL Ca++ NEL CITOSOL. DIFETTI DELLA PERMIABILITA’ DI MEMBRANA L’evento finale del danno cellulare è la MORTE CELLULARE La morte cellulare può avvenire secondo due diverse modalità: - morte accidentale NECROSI (con rigonfiamento cellulare) - morte programmata APOPTOSI (contrazione volume cellulare) Le alterazioni morfologiche che si manifestano in un tessuto cha va incontro a morte accidentale (necrosi) sono relativamente lente e difficili da osservare al microscopio ottico. In un primo tempo sono indistinguibili da quelle che caratterizzano il danno cellulare reversibile. In entrambi i casi le alterazioni principali consistono in: - rigonfiamento cellulare - comparsa di piccoli vacuoli chiari nel citoplasma (degenerazione idropica o vacuolare) - aumentata eosinofilia del citoplasma A livello ultrastrutturale possiamo avere: - alterazioni della membrana plasmatica - modificazioni dei mitocondri - dilatazione del reticolo endoplasmatico - alterazioni del nucleo - CARIOLISI (scomparsa della basofilia della cromatina) - PICNOSI (contrazione, rimpicciolimento del nucleo) - CARIORESSI (frammentazione del nucleo) Dopo che è avvenuta la morte cellulare, il tessuto necrotico può andare incontro a due tipi diversi di alterazione: - il tessuto morto diventa duro e biancastro necrosi coagulativa - il tessuto morto si disintegra e si liquefa necrosi colliquativa Questi due modelli opposti di evoluzione del tessuto necrotico sono determinati principalmente dal destino cui vanno incontro le proteine cellulari: - le proteine possono denaturarsi necrosi coagulativa - le proteine possono andare incontro a digestione enzimatica (autolisi o eterolisi) necrosi colliquativa UN ESEMPIO TIPICO NECROSI COAGULATIVA: L’INFARTO DEL MIOCARDIO DI NECROSI COAGULATIVA: INFARTO DEL RENE NECROSI COLLIQUATIVA CERVELLO POLMONE Un tipo particolare di necrosi coagulativa è la necrosi caseosa, che si incontra spesso nel granuloma tubercolare. Deve il suo nome all’aspetto macroscopico del tessuto (bianco e simile al formaggio). Si distingue dalla normale necrosi coagulativa perché in essa la normale architettura del tessuto appare completamente scomparsa. NECROSI CASEOSA DEL FEGATO NECROSI CASEOSA DEL POLMONE Un altro tipo particolare di necrosi è la gangrena che si verifica in un arto con interruzione completa dell’irrorazione sanguigna e conseguente necrosi coagulativa. Se si sovrappone un’infezione batterica con conseguente colliquazione gangrena umida. APOPTOSI L’apoptosi o morte cellulare programmata è una varietà specifica di morte cellulare caratterizzata dalla sua morfologia e dalle modalità di degradazione del DNA. L’APOPTOSI E’ UNA FORMA DI MORTE CELLULARE CHE HA LO SCOPO DI ELIMINARE CELLULE NON DESIDERATE ATTRAVERSO L’ATTIVAZIONE DI UNA SERIE DI EVENTI COORDINATI E INTERNAMENTE PROGRAMMATI PORTATI AVANTI DA UN INSIEME SPECIFICO DI PRODOTTI GENICI. CAUSE DI APOPTOSI In situazioni fisiologiche: •Distruzione programmata delle cellule nel corso dell’embriogenesi •Involuzione di tessuti ormone dipendenti •Perdita di cellule nelle popolazioni cellulari proliferanti •Eliminazione di linfociti autoreattivi potenzialmente pericolosi •Eliminazione cellule che hanno esaurito la loro utilità CAUSE DI APOPTOSI In condizioni patologiche: • Danno del DNA • Accumulo di proteine ripiegate in modo anomalo • Morte cellulare in determinati processi infettivi • Atrofia patologica negli organi parenchimatosi in seguito a ostruzione dei dotti. Durante l’apoptosi si possono distinguere quattro fasi, distinte ma parzialmente sovrapposte: - FASE DI INNESCO durante la quale la cellula riceve i segnali che scatenano l’apoptosi. - CONTROLLO E INTEGRAZIONE: i segnali di morte applicati nella fase precedente vengono connessi da una serie di proteine specifiche (con ruolo sia positivo che negativo) al programma esecutivo comune - FASE COMUNE DI ESECUZIONE: consiste nell’attivazione di una cascata di proteasi specifiche, le caspasi, a loro volta distinte in iniziatrici ed esecutrici in base all’ordine con il quale vengono attivate. - RIMOZIONE DELLE CELLULE MORTE: le cellule apoptotiche e i loro frammenti esprimono dei marcatori di membrana che facilitano il loro precoce riconoscimento da parte di cellule adiacenti o di fagociti. Le cellule morte vengono così completamente distrutte senza indurre una reazione infiammatoria. NELL’AMBITO DEI PROCESSI DI CONTROLLO E INTEGRAZIONE DELL’APOPTOSI UN PUNTO CRITICO SI REALIZZA A LIVELLO DEI MITOCONDRI, A LIVELLO DEI QUALI NASCE IL SEGNALE DEFINITIVO CHE INNESCA LA FASE DI ESECUZIONE. La funzione mitocondriale può essere influenzata in due modi: - Provocando una transizione di permeabilità mitocondriale (MPT): apertura di pori nella membrana interna riduzione potenziale di membrana arresto fosforilazioni ossidative rigonfiamento. - Provocando un aumento della permeabilità della membrana esterna e il rilascio del citocromo C nel citosol. La via finale di tutti i tipi di apoptosi consiste nell’attivazione di una cascata proteolitica. Le relative proteasi sono proteine altamente conservate e appartengono alla famiglia delle caspasi (che comprende più di 10 membri). C cisteino-proteasi CASPASI Asp taglia dopo un residuo di ac. aspartico Le caspasi, oltre a degradare direttamente le proteine del citoscheletro, attivano una DNasi citoplasmatica che produce una caratteristica frammentazione del DNA: PROFILO A SCALETTA
Scaricare