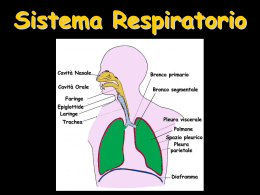
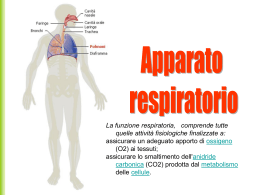
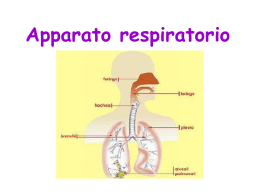
Apparato respiratorio L’apparato respiratorio è costituito dai polmoni e dalle vie aeree che li mettono in comunicazione con l’ambiente esterno; la sua funzione è quella di fornire ossigeno (O2) alle cellule dell’organismo e raccogliere l’anidride carbonica (CO2 ) prodotta da queste. Lo svolgimento di questa funzione richiede la realizzazione dei seguenti quattro distinti eventi, noti collettivamente come respirazione: ■ ■ ■ ■ movimento dell’aria dentro e fuori i polmoni (respiro o ventilazione) scambio di O2 contenuto nell’aria inspirata con anidride carbonica contenuta nel sangue (respirazione esterna) trasferimento di O2 e CO2 alle e dalle cellule (trasporto dei gas) scambio di O2 e CO2 in prossimità delle cellule (respirazione interna) I primi due eventi, ventilazione e respirazione esterna, hanno luogo all’interno dell’apparato respiratorio, mentre è il sistema circolatorio a provvedere al trasporto dei gas e la respirazione interna avviene invece a livello dei tessuti dell’organismo. L’apparato respiratorio è suddiviso in due parti principali: la parte conduttrice e quella respiratoria (Tabella 151). La parte conduttrice, situata sia all’esterno che all’interno dei polmoni, convoglia aria dall’ambiente esterno ai polmoni. La parte respiratoria, situata rigorosamente all’interno dei polmoni, provvede allo scambio dell’ossigeno con l’anidride carbonica (respirazione esterna). LA PORZIONE CONDUTTRICE DELL’APPARATO RESPIRATORIO La porzione conduttrice dell’apparato respiratorio convoglia l’aria verso e dalla porzione respiratoria dell’apparato respiratorio. La porzione conduttrice dell’apparato respiratorio, partendo dall’esterno per arrivare all’interno del polmo- 15 ■■■ ne, è composta da cavità nasale, bocca, nasofaringe, faringe, laringe, trachea, bronchi primari, bronchi secondari (bronchi lobari), bronchi terziari (bronchi segmentali), bronchioli e bronchioli terminali. Queste strutture non solo trasportano l’aria inspirata, ma la filtrano, la umidificano e la riscaldano prima che raggiunga la porzione respiratoria dei polmoni. La proprietà di conduzione delle vie respiratorie è dovuta ad una combinazione di osso, cartilagine ed elementi fibrosi. Mentre l’aria passa attraverso le vie aeree durante l’inspirazione, incontra un sistema di tubuli ramificati. Sebbene il diametro luminale di ciascun tubulo susseguente continui a diminuire, il diametro totale delle varie ramificazioni aumenta ad ogni livello successivo di ramificazione. In questo modo la velocità del flusso per un dato volume di aria inspirato diminuisce man mano che l’aria si avvicina alla porzione respiratoria. Cavità nasale La cavità nasale è divisa nelle due fosse nasali, destra e sinistra, da un setto nasale cartilagineo ed osseo. Ciascuna metà della cavità presenta lateralmente una parete ossea e un’ala cartilaginea e comunica anteriormente, attraverso la narice, con l’esterno e per mezzo della coana con il nasofaringe. Dalla parete ossea laterale sporgono tre sottili proiezioni ossee a forma di conchiglia, una sopra l’altra, le conche nasali superiore, mediana ed inferiore. Porzione anteriore della cavità nasale In prossimità delle narici, la porzione anteriore della cavità nasale si dilata nel vestibolo. È ricoperta da cute sottile ed è provvista di vibrisse – corti peli rigidi che bloccano le particelle di maggiori dimensioni impedendone la penetrazione nella cavità nasale. Il derma del vestibolo contiene numerose ghiandole 345 346 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Tabella 15-1 Suddivisione e aspetti caratteristici dell’apparato repiratorio Regione Sostegno Ghiandole Epitelio Tipi cellulari Caratteristiche aggiuntive Divisione conduttrice extrapolmonare Vestibolo nasale Cartilagine ialina Ghiandole sebacee e sudoripare Squamoso stratificato cheratinizzato Epidermiche Vibrisse Cavità nasale respiratoria Cartilagine ialina e osso Ghiandole sieromucose Respiratorio Basali, caliciformi, ciliate, a spazzola, sierose, DNES Tessuto simil-erettile Cavità nasale olfattiva Osso Ghiandole di Olfattivo Bowman (sierose) Olfattive, di sostegno, basali Vescicole olfattive Nasofaringe Muscoli scheletrici Ghiandole siero- Respiratorio mucose Basali, caliciformi, a spazzola, ciliate, sierose, DNES Tonsille faringee e tube di Eustachio Laringe Cartilagine ialina ed elastica Ghiandole mucose e sieromucose Basali, caliciformi, a spazzola, ciliate, sierose, DNES Epiglottide, corde vocali, pieghe vestibolari Trachea e bronchi primari Cartilagine ialina Ghiandole Respiratorio e tessuto connettivo mucose e sierofibrillare denso mucose irregolare Basali, caliciformi, a spazzola, ciliate, sierose, DNES Anelli a C, muscoli tracheali (lisci) nell’avventizia Respiratorio squamoso, stratificato, non cheratinizzato Divisione conduttrice intrapolmonare Bronchi secondari Cartilagine ialina (intrapolmonari) e muscoli lisci Ghiandole siero- Respiratorio mucose Basali, caliciformi, a spazzola, ciliate, sierose, DNES Piastre di cartilagine ialina e due strati di muscolatura liscia disposti a elica Bronchioli (primari) Muscoli lisci Non sono presenti Da cubico semplice a cilindrico semplice Ciliate, di Clara (occasionalmente caliciformi nei bronchioli più grandi) Diametro < 1 mm; porta aria ai lobuli; due strati di muscolatura liscia disposti a elica Bronchioli terminali Muscoli lisci Non sono presenti Cubico semplice Alcune cellule ciliate, Diametro < 0,5 mm; molte cellule di Clara, porta aria agli acini no cellule caliciformi polmonari; alcuni muscoli lisci Non sono presenti Cubico semplice e squamoso semplice molto appiattito Alcune cellule cubiche ciliate, cellule di Clara, pneumociti di tipo I e II Alveoli nelle pareti; gli alveoli hanno sfinteri muscolari lisci al loro imbocco Squamoso semplice molto appiattito Pneumociti di tipo I e II degli alveoli Non hanno parete propria; solo una sequenza lineare di alveoli Divisione respiratoria Bronchioli respiratori Alcuni muscoli lisci e fibre collagene Dotti alveolari Collagene di Non sono tipo III (fibre presenti reticolari) e muscoli lisci degli sfinteri alveolari Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 347 Tabella 15-1 Suddivisione e aspetti caratteristici dell’apparato repiratorio (continua) Regione Sostegno Ghiandole Sacchi alveolari Collagene di tipo Non sono III, fibre elastiche presenti Alveoli Collagene di tipo Non sono III, fibre elastiche presenti Tipi cellulari Caratteristiche aggiuntive Squamoso semplice molto appiattito Pneumociti di tipo I e II Gruppi di alveoli Squamoso semplice molto appiattito Pneumociti di tipo I e II Diametro 200 μm; vi sono macrofagi alveolari Epitelio DNES (diffuse neuroendocrine system), sistema neuroendocrino diffuso. sebacee e sudoripare ed è ancorato da numerosi fasci di fibre collagene al pericondrio della cartilagine dell’ala. Ci Porzione posteriore della cavità nasale OC BC La cavità nasale è ricoperta da un epitelio di tipo cilindrico pseudostratificato ciliato, detto anche epitelio respiratorio (verrà descritto più avanti, nella parte dedicata alla trachea), ad eccezione del vestibolo e della regione olfattiva. Questo epitelio presenta cellule caliciformi soprattutto nella regione più profonda della cavità. Il tessuto connettivo subepiteliale (lamina propria) è riccamente vascolarizzato, specie nella regione delle conche e nella porzione anteriore del setto nasale, ospitando estesi plessi arteriosi e seni venosi. La lamina propria contiene molte ghiandole sieromucose e abbondanti elementi linfoidi, quali occasionali noduli linfatici, mastociti e plasmacellule. Gli anticorpi prodotti dalle plasmacellule (IgA, IgE, IgG) proteggono la mucosa nasale dagli antigeni inalati e dall’invasione microbica. CORRELAZIONI CLINICHE Il sanguinamento nasale ha origine nella regione antero-inferiore del setto nasale, o area di Kiesselbach, dove sono presenti anastomosi arteriose che irrorano la mucosa nasale. Il sanguinamento può essere arrestato esercitando una pressione sulla regione o inserendo del cotone nella cavità nasale. Regione olfattiva della cavità nasale La regione olfattiva comprende l’epitelio olfattivo e la sottostante lamina propria, dove sono presenti le ghiandole di Bowman ed un ricco plesso vascolare. LP Figura 15–1 Microfotografia ottica della mucosa olfattiva umana (×540). Si osservi che le ciglia olfattive (Ci) sono ben rappresentate e che nel tessuto connettivo sono presenti ghiandole di Bowman. BC, cellule basali; OC, cellule olfattive; LP, lamina propria. Il tetto della cavità nasale, la parte superiore del setto e la conca superiore sono rivestiti da un epitelio olfattivo spesso circa 60 μm. Nella lamina propria sottostante sono presenti le ghiandole sierose di Bowman, un plesso vascolare e una serie di assoni provenienti dalle cellule olfattive dell’epitelio olfattivo. L’epitelio olfattivo, che appare giallo nel vivente, è composto di tre tipi di cellule: olfattive, di sostegno e basali (Fig. 15–1). CELLULE OLFATTIVE Le cellule olfattive sono neuroni bipolari con la terminazione dendritica modificata a bulbo, conosciuta come 348 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Ghiandola di Bowman Cellula di Schwann Tessuto connettivo Cellula basale Cellula olfattiva Cellula di sostegno Dendrite Vescicola olfattiva Ciglia olfattive Microvilli Dotto della ghiandola di Bowman Figura 15–2 Schema dell’epitelio olfattivo che mostra cellule basali, olfattive e di sostegno. (Da comparare con la Fig. 15-1.) vescicola olfattiva, che si mette in contatto con le cellule di sostegno (Figg. 15–2 e 15–3). Il nucleo cellulare è sferico ed è posto più vicino alla membrana basale che alla vescicola olfattiva. La maggior parte degli organuli cellulari è in prossimità del nucleo. Le immagini di microscopia elettronica a scansione mostrano che dalla vescicola olfattiva hanno origine da 5 a 8 lunghe ciglia fisse che tappezzano la superficie libera dell’epitelio. Al microscopio elettronico a trasmissione le ciglia mostrano un insolito assonema, che all’origine mostra il tipico anello periferico di nove coppie di microtubuli intorno a due microtubuli centrali singoli (configurazione 9 + 2), ma senza le caratteristiche braccia di dineina. Distalmente l’assonema cambia ed è costituito da 9 microtubuli singoli attorno ai due centrali, e in prossimità degli apici delle ciglia sono presenti solo quelli centrali. Dalla regione basale della cellula si origina l’assone che, dopo aver perforato la membrana basale, si unisce agli assoni di altre cellule olfattive per formare fasci di fibre nervose. Ciascun assone, anche se non mielinizzato, possiede un rivestimento di cellule simili a quelle di Schwann. Le fibre nervose passano attraverso la placca cribrosa del tetto osseo della cavità nasale e formano quindi sinapsi con neuroni secondari nel bulbo olfattivo. CELLULE DI SOSTEGNO E BASALI Le cellule di sostegno sono cellule cilindriche, alte 50–60 μm, provviste di microvilli nella zona apicale. Il nucleo ovale si trova nel terzo superiore della cellula, al di sopra dei nuclei delle vicine cellule olfattive; il citoplasma apicale presenta granuli secretori contenenti un pigmento giallo che conferisce il caratteristico colore alla mucosa olfattiva. L’osservazione al microscopio elettronico a trasmissione evidenzia la presenza di complessi giunzionali formati da queste cellule con zone della vescicola olfattiva delle vicine cellule sensoriali così come con le cellule di sostegno contigue. La morfologia delle cellule di sostegno non presenta particolarità, sebbene esse siano provviste di un’estesa rete di microfilamenti di actina. Si suppone che queste cellule abbiano una funzione di supporto, di nutrimento e di isolamento elettrico delle cellule olfattive. Le cellule basali sono di due tipi, orizzontali e globose. Le cellule orizzontali sono schiacciate e poggiano sulla membrana basale, mentre quelle globose sono piccole cellule basofile a forma di piramide che non raggiungono la superficie libera. Poiché sono particolarmente basse, il loro nucleo centrale viene a trovarsi a livello del terzo inferiore dell’epitelio. Le cellule globose possiedono un’alta capacità proliferativa e sono in Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 349 Figura 15–3 Microfotografia elettronica a trasmissione della regione apicale dell’epitelio olfattivo di ratto (×8.260). Si notino le vescicole olfattive e le ciglia che si dipartono da queste. (Da comparare con Figg. 15-1 e 15-2). (Da Mendoza AS, Kühnel W: Postnatal changes in the ultrastructure of the rat olfactory epithelium: The supranuclear region of supporting cells. Cell Tissue Res 265:193–196, 1991). grado di sostituire sia le cellule olfattive che quelle di sostegno. In condizioni normali, le cellule olfattive hanno una durata di vita inferiore ad un anno. Le cellule basali orizzontali possono dividersi e sostituire quelle globose. LAMINA PROPRIA La lamina propria della mucosa olfattiva è costituita da tessuto connettivo ricco di fibre collagene, a tratti denso e a tratti lasso, riccamente vascolarizzato e saldamente adeso al periostio sottostante. Contiene numerosi elementi linfoidi e raccoglie gli assoni delle cellule olfattive in fasci di fibre nervose amieliniche. Le ghiandole di Bowman (ghiandole olfattive) sono tipiche di questa mucosa e producono un secreto sieroso. Queste ghiandole rilasciano IgA, lattoferrina, lisozima e proteine leganti sostanze odorose, molecole che impediscono alle sostanze odorose di allontanarsi dalla regione dell’epitelio olfattivo, intensificando la capacità dell’individuo di percepire gli odori. Istofisiologia della cavità nasale La mucosa nasale filtra, riscalda ed umidifica l’aria inalata ed è anche responsabile della percezione degli odori. La mucosa nasale umida filtra l’aria inalata. Materiale particolato, come la polvere, rimane intrappolato nel muco prodotto dalle cellule caliciformi dell’epitelio respiratorio e dalle ghiandole sieromucose della lamina propria. Il fluido sieroso prodotto da queste ghiandole viene a trovarsi tra il muco ed il plasmalemma apicale delle cellule epiteliali respiratorie. Dato che le ciglia dell’epitelio cilindrico non arrivano fino allo strato mucoso, il loro movimento si limita allo strato fluido sieroso. In seguito al movimento delle ciglia entro il fluido acquoso, il muco è trascinato via (con effetto “idrovolante”) dall’interfaccia dei due fluidi. Il materiale particolato intrappolato nel muco è così trasportato, per azione delle ciglia, verso la faringe, per essere deglutito o espettorato. Oltre ad essere filtrata, l’aria inspirata è anche riscaldata e umidificata con il passaggio sulla mucosa, la quale è mantenuta calda e umida grazie ad una estesa vascolarizzazione. Il riscaldamento dell’aria inspirata è facilitato dalla presenza di una rete estesa di vasi arcuati disposti antero-posteriormente. I capillari che originano da questi vasi si trovano subito al di sotto dell’epitelio e il flusso di sangue in questa rete vascolare è diretto postero-anteriormente, in direzione opposta al flusso dell’aria; in questo modo il calore è continuamente trasferito all’aria inspirata con un meccanismo controcorrente. Gli antigeni e gli allergeni trasportati dall’aria sono attaccati da elementi linfoidi della lamina propria. Le immunoglobuline secretorie (IgA), prodotte dalle plasmacellule, sono trasportate attraverso l’epitelio alla cavità nasale ad opera delle cellule cilindriche ciliate e delle cellule acinose delle ghiandole sieromucose. Le IgE, anch’esse prodotte dalle plasmacellule, si legano ai 350 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio recettori per le IgE (FcεRI) presenti sulla membrana dei mastociti e dei basofili. Il successivo legame di specifici antigeni o allergeni alle IgE provoca il rilascio di diversi mediatori dell’infiammazione da parte dei mastociti (e dei basofili). Tali mediatori, subito dopo, agiscono sulla mucosa nasale, provocando i sintomi associati al raffreddore e alla febbre da fieno. CORRELAZIONI CLINICHE La mucosa nasale è protetta dalla disidratazione dall’alternanza del flusso sanguigno ai seni venosi della lamina propria che sovrasta le conche delle cavità nasali. La regione presenta un tessuto simil–erettile (corpi rigonfi) che si espande quando i seni venosi sono pieni di sangue, riducendo così il flusso di aria in quel lato. L’infiltrazione di plasma dai seni e le secrezioni sieromucose delle ghiandole quindi reidratano la mucosa circa ogni mezz’ora. Il riflesso dello starnuto rimuove gli agenti chimici irritanti e il materiale corpuscolato dalla cavità nasale. L’espulsione improvvisa ed esplosiva dell’aria generalmente elimina le sostanze penetrate nel naso. L’epitelio olfattivo è responsabile della percezione degli odori e contribuisce al senso del gusto. Il meccanismo della percezione degli odori è poco conosciuto, anche se si sa che il plasmalemma delle ciglia olfattive di alcune cellule contiene numerose copie di un particolare recettore dell’odore. Le molecole di una data sostanza odorifera si dissolvono nel fluido sieroso e si legano ai recettori; quando un certo numero di recettori è occupato raggiungendo una soglia limite, le cellule olfattive sono stimolate e generano un potenziale d’azione mediante il quale l’informazione viene trasmessa, attraverso i loro assoni, al bulbo olfattivo, una protuberanza del sistema nervoso centrale, dove viene elaborata. Gli assoni delle cellule olfattive contraggono sinapsi con i dendriti di una delle 30 cellule mitrali nel contesto di piccole regioni sferoidali del bulbo olfattivo note come glomeruli. Quando una cellula mitrale viene raggiunta da impulsi che hanno raggiunto il livello di soglia, si depolarizza e invia un segnale alla corteccia olfattiva, che provvederà alla sua elaborazione. Ogni glomerulo riceve input, cioè informazioni, da circa 2000 neuroni olfattivi, ciascuno specifico per una data sostanza odorosa. Come gli antigeni possono avere parecchi epitopi, ognuno dei quali si lega ad un anticorpo specifico, le sostanze odorose possiedono parecchie piccole regioni molecolari, ciascuna delle quali si lega ad una specifica molecola di recettore dell’odore. Una particolare sostanza odorosa può quindi legarsi a diversi recettori dell’odore, attivando diversi neuroni olfattivi, che a loro volta passeranno l’informazione ad alcuni glomeruli. Sebbene ci siano solamente circa un migliaio di glomeruli, ciascuno dei quali riceve informazioni da un singolo recettore dell’odore, la corteccia olfattiva possiede la capacità di distinguere circa 10000 odori differenti. Questo è possibile in quanto le informazioni provenienti da particolari combinazioni dei glomeruli vengono riconosciute come un solo odore. Un singolo glomerulo, quindi, partecipa al riconoscimento di diversi odori. Grazie al flusso continuo del fluido sieroso prodotto dalle ghiandole di Bowman, le ciglia olfattive vengono continuamente deterse per assicurare che un singolo stimolo non produca risposte ripetute. Seni paranasali Le ossa mascellare, frontale, sfenoide ed etmoide del cranio presentano grandi spazi mucoperiostali, i seni paranasali (così chiamati per la loro posizione), comunicanti con la cavità nasale. La mucosa di ciascun seno è composta da una lamina propria di tessuto connettivo vascolare fusa con il periostio. La sottile lamina propria ricorda quella della cavità nasale, per il fatto che contiene sia ghiandole sieromucose che elementi linfoidi. L’epitelio respiratorio che riveste i seni paranasali possiede, come quello della cavità nasale, numerose cellule cilindriche ciliate le cui ciglia provvedono a far avanzare il muco verso la cavità nasale. Nasofaringe La faringe inizia dalla coana e si estende fino alla laringe. È una cavità continua suddivisa in tre regioni: (1) il nasofaringe superiore, (2) la faringe orale mediana e (3) la faringe laringea inferiore. Il nasofaringe è rivestito da un epitelio respiratorio, mentre le regioni orale e laringea sono rivestite da un epitelio squamoso stratificato. La lamina propria è costituita da tessuto connettivo vascolarizzato, da denso a lasso, contenente ghiandole sieromucose ed elementi linfoidi, che si fonde con l’epimisio dei muscoli scheletrici della faringe. La lamina propria della parte posteriore del nasofaringe contiene la tonsilla faringea, costituita da infiltrazioni di tessuto linfoide descritte nel Capitolo 12. Laringe La laringe, o scatola della voce, è responsabile della fonazione e previene l’entrata di cibo o fluidi nell’apparato respiratorio. La laringe, situata tra la faringe e la trachea, è un tubo cilindrico corto e rigido, lungo 4 cm e con un diametro di circa 4 cm. È responsabile della fonazione e previene l’entrata di materiale solido o liquido nell’apparato respiratorio durante la deglutizione. La sua parete è Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 351 rinforzata da diverse cartilagini ialine (le cartilagini tiroidea e cricoidea e la parte inferiore delle aritenoidi) e da cartilagine elastica (l’epiglottide, le cartilagini corniculate e cuneiformi e la porzione superiore delle aritenoidi). Queste cartilagini sono articolate tra loro tramite legamenti e il loro movimento reciproco è controllato da muscoli scheletrici intrinseci ed estrinseci. Le cartilagini tiroidea e cricoidea formano il supporto cilindrico per la laringe, mentre l’epiglottide costituisce una copertura sopra l’apertura laringea (adito). Durante la respirazione, l’epiglottide è in posizione verticale, per permettere il flusso dell’aria. Durante la deglutizione di cibo, fluidi o saliva, si pone invece orizzontalmente e chiude così l’adito della laringe. È abbastanza normale che, anche in assenza di epiglottide, il materiale inghiottito superi l’apertura della laringe. Alcune volte le cartilagini aritenoidee e corniculate si trovano fuse tra loro; la gran parte dei muscoli intrinseci della laringe serve a muovere le due aritenoidi fra loro e rispetto alla cartilagine cricoidea. Il lume della laringe presenta due paia di pieghe sporgenti, le pieghe vestibolari superiormente e le pieghe vocali inferiormente. Le pieghe vestibolari sono immobili. La loro lamina propria è costituita da tessuto connettivo lasso che contiene ghiandole sieromucose, cellule adipose ed elementi linfoidi. Il margine libero di ogni piega vocale (corda vocale) è rinforzato da fasci di tessuto connettivo denso ed elastico che formano il legamento vocale. Attaccato al legamento vi è il muscolo vocale che, con gli altri muscoli intrinseci della laringe, controlla la tensione delle pieghe vocali e l’ampiezza dello spazio tra le pieghe vocali (la rima della glottide), permettendo così una regolazione precisa delle vibrazioni dei loro margini liberi in seguito al passaggio dell’aria espirata. Durante la sola respirazione (senza emissione di suoni) le pieghe vocali sono parzialmente abdotte (spostate di lato), e durante l’inspirazione forzata lo sono completamente; durante la fonazione, invece, sono fortemente addotte o riunite in posizione mediana e tra di loro si forma un sottile intervallo. Il movimento dell’aria sui margini delle pieghe vocali produce e modula i suoni (non la parola, che viene formata dai movimenti della faringe, del palato molle, della lingua e delle labbra). Più la piega vocale è lunga e rilasciata, più il timbro del suono è profondo. La laringe dei maschi postpuberali è più larga di quella delle femmine e per questo gli uomini hanno una voce più profonda di quella delle donne. La laringe è rivestita da un epitelio cilindrico pseudostratificato ciliato, eccetto che nella parte superiore dell’epiglottide e delle pieghe vocali, dove si trova un epitelio squamoso stratificato non cheratinizzato. Il battito delle ciglia della laringe è diretto verso la faringe e favorisce il trasporto del muco e del materiale corpuscolato verso la bocca, dove verrà espettorato o deglutito. CORRELAZIONI CLINICHE La laringite (infiammazione dei tessuti laringei e delle corde vocali) impedisce la libera vibrazione delle corde vocali. Le persone che soffrono di questo disturbo emettono suoni rauchi o possono solamente bisbigliare. La presenza di agenti irritanti o materiale corpuscolato nelle vie aeree superiori, inclusi trachea e bronchi, provoca il riflesso della tosse, che porta alla violenta fuoriuscita di aria nel tentativo di rimuovere gli agenti irritanti. Il riflesso della tosse inizia con l’inalazione di una gran quantità d’aria e con la chiusura dell’epiglottide e della glottide (abduzione delle corde vocali), seguita da una contrazione dei muscoli responsabili dell’espirazione forzata (muscoli intercostali e addominali). L’apertura improvvisa della glottide e dell’epiglottide genera una fuoriuscita d’aria, la cui velocità può essere superiore a 100 miglia all’ora, che rimuove le sostanze irritanti con grande energia. Trachea La trachea è composta da tre strati: la mucosa, la sottomucosa e l’avventizia; gli anelli a C sono localizzati nell’avventizia. La trachea è un tubo lungo 12 cm e con un diametro di 2 cm; inizia a livello della cartilagine cricoidea della laringe e termina quando l’organo si biforca a formare i bronchi primari. La parete della trachea è rinforzata da 10–12 anelli incompleti di cartilagine ialina, a forma di ferro di cavallo (anelli a C). Le aperture degli anelli cartilaginei sono situate posteriormente e sono connesse le une con le altre da muscolatura liscia, il cosiddetto muscolo tracheale. A causa di questa disposizione degli anelli a C, la trachea risulta quindi arrotondata anteriormente e schiacciata posteriormente. Il pericondrio di ogni anello a C è connesso a quello sopra e sotto di esso da tessuto connettivo fibroelastico, che dà flessibilità alla trachea e permette il suo allungamento durante l’inspirazione. La contrazione del muscolo tracheale riduce il diametro del lume e, di conseguenza, la velocità del flusso d’aria aumenta, mentre con la tosse viene favorita la fuoriuscita del materiale estraneo (o del muco o di sostanze irritanti) dalla laringe. La trachea presenta tre strati: la mucosa, la sottomucosa e l’avventizia (Fig. 15–4). Mucosa La mucosa che riveste la trachea è composta da un epitelio cilindrico pseudostratificato ciliato (epitelio respiratorio), un tessuto connettivo subepiteliale (lamina pro- 352 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Ci MG HC GC PC L Figura 15–4 M i c r o f o t o g r a f i a ottica della trachea di scimmia (×270). Nell’epitelio sono presenti sia numerose ciglia (Ci) che cellule caliciformi (GC). Si osservino anche le ghiandole mucose (MG) nel connettivo subepiteliale e l’anello di cartilagine ialina (HC) nell’avventizia. L, lume; PC, pericondrio. pria) e un fascio relativamente grosso di fibre elastiche che separa la mucosa dalla sottomucosa. Epitelio respiratorio L’epitelio respiratorio è un epitelio cilindrico pseudostratificato ciliato composto da sei tipi di cellule; cellule caliciformi, cellule cilindriche ciliate e cellule basali costituiscono il 90% della popolazione cellulare. L’epitelio respiratorio è un epitelio cilindrico pseudostratificato ciliato, separato dalla lamina propria da una spessa membrana basale. È composto da sei tipi cellulari: cellule caliciformi, cellule cilindriche ciliate, cellule basali, cellule a spazzola, cellule sierose e cellule del sistema neuroendocrino diffuso (DNES). Tutte queste cellule sono a contatto con la membrana basale, ma non tutte raggiungono il lume tracheale (Fig. 15–5). Le cellule caliciformi costituiscono circa il 30% della popolazione cellulare dell’epitelio respiratorio. Producono mucinogeno che, una volta rilasciato in un ambiente acquoso, si idrata e diviene mucina. Come le cellule caliciformi presenti in altre parti del corpo, quelle dell’epitelio respiratorio hanno inferiormente uno stelo stretto e superiormente una teca espansa, che contiene granuli di secreto. Al microscopio elettronico si osserva come il nucleo e la gran parte degli organuli siano localizzati nello stelo. Questa regione mostra anche un esteso reticolo endoplasmatico rugoso (RER), un complesso di Golgi ben sviluppato, numerosi mitocondri e abbondanti ribosomi. La teca è piena di granuli secre- Figura 15–5 Microfotografia elettronica a trasmissione dell’epitelio respiratorio del setto nasale anteriore di scimmia. Si noti la presenza di cellule caliciformi (gc), cellule ciliate (c), cellule basali (bc) e cellule mucose a piccoli granuli (smg). (Da Harkema JR, Plopper CG, Hyde DM et al: Nonolfactory surface epithelium of the nasal cavity of the bonnet monkey: A morphologic and morphometric study of the transitional and respiratory epithelium. Am J Anat 180:266–279, 1987). tori, di diametro variabile, contenenti mucinogeno. Il plasmalemma apicale presenta pochi e corti microvilli smussati (Fig. 15–5). Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 353 Figura 15–6 Microfotografia elettronica a scansione di trachea fetale umana in cui sono visibili cellule ciliate e non ciliate (×5500). (Da Montgomery PQ, Stafford ND, Stolinski C: Ultrastructure of the human fetal trachea. A morphologic study of the luminal and glandular epithelia at the mid–trimester. J Anat 173:43–59, 1990). Le cellule cilindriche ciliate rappresentano il 30% circa delle cellule; sono alte e sottili, con un nucleo basale, e presentano ciglia e microvilli sulla porzione apicale della membrana plasmatica (Fig. 15–6). Il citoplasma apicale è ricco di mitocondri e contiene il complesso del Golgi. Il resto del citoplasma presenta poco RER e pochi ribosomi. Queste cellule spostano il muco e il materiale corpuscolato inglobato in esso, mediante il movimento delle ciglia, verso il nasofaringe per la loro eliminazione. Le cellule basali costituiscono il 30% della popolazione cellulare; poggiano sulla membrana basale e la loro superficie apicale non raggiunge il lume dell’organo (vedi Fig. 15–5). Sono poco differenziate e considerate perciò cellule staminali, capaci di proliferare per sostituire le cellule cilindriche ciliate, a spazzola e caliciformi morte. Le cellule a spazzola (piccole cellule mucose) rappresentano il 3% della popolazione cellulare totale; sono cellule strette, di tipo cilindrico, con alti microvilli. La loro funzione è sconosciuta ma, dato che sono in relazione con le terminazioni nervose, alcuni autori hanno suggerito un loro ruolo nell’attività sensoriale; altri ricercatori ipotizzano che siano semplicemente cellule caliciformi che hanno già rilasciato il loro mucinogeno. Le cellule sierose sono cellule cilindriche che rappresentano il 3% circa delle cellule totali dell’epitelio respiratorio. All’apice presentano microvilli e granuli contenenti un prodotto di secrezione sieroso elettrondenso. Le cellule DNES, conosciute anche come cellule a piccoli granuli o cellule di Kulchitsky, rappresentano il 3–4% della popolazione cellulare. Molte di queste cellule possiedono dei lunghi e sottili prolungamenti che si estendono fino al lume, e si crede che possiedano la capacità di monitorare i livelli di ossigeno e anidride carbonica nel lume delle vie aeree. Queste cellule sono strettamente associate con terminazioni nervose nude, con le quali stabiliscono contatti sinaptici, e insieme a queste fibre nervose costituiscono i corpi neuroepiteliali polmonari. Le cellule DNES contengono numerosi granuli nel loro citoplasma basale, in cui è possibile trovare sostanze farmacologicamente attive, come ammine, peptidi, acetilcolina e adenosina trifosfato. In condizioni di ipossia queste sostanze sono rilasciate non solo nella fessura sinaptica, ma anche negli spazi del tessuto connettivo della lamina propria, ove agiscono come ormoni paracrini oppure passano in circolo agendo come veri e propri ormoni. Perciò, è stato suggerito che questi corpi neuroepiteliali possano avere effetti locali per limitare condizioni di ipossia localizzata regolando la perfusione e la ventilazione nelle zone limitrofe, oppure che possano avere effetti sistemici attraverso l’innervazione efferente che ritrasmette l’informazione di condizioni ipossiche ai centri regolatori della respirazione situati a livello del midollo allungato. Lamina propria e fibre elastiche La lamina propria della trachea è composta da tessuto connettivo lasso di tipo fibroelastico. Contiene elementi linfoidi (noduli linfatici, linfociti, neutrofili) e ghiandole sieromucose e mucose, i cui dotti si aprono sulla superficie epiteliale. Un denso strato di fibre elastiche, la lamina elastica, separa la lamina propria dalla sottostante sottomucosa. Sottomucosa La sottomucosa tracheale è costituita da tessuto connettivo denso, irregolare, di tipo fibroelastico, contenente numerose ghiandole mucose e sieromucose. I corti dotti di queste ghiandole perforano la lamina elastica e la lamina propria per aprirsi sulla superficie epiteliale. Nella sottomucosa sono presenti elementi linfoidi; questa regione è inoltre ricca di vasi sanguigni e linfatici, i cui rami più piccoli raggiungono la lamina propria. 354 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Avventizia L’avventizia della trachea è composta da tessuto connettivo fibroelastico (vedi Fig. 15–4). Le caratteristiche principali di quest’area sono gli anelli a C di cartilagine ialina e il tessuto connettivo fibroso. L’avventizia è anche responsabile dell’ancoraggio della trachea alle strutture adiacenti (esofago e tessuto connettivo del collo). CORRELAZIONI CLINICHE L’epitelio respiratorio delle persone esposte cronicamente ad agenti irritanti, come il fumo di sigaretta e la polvere di carbone, subisce alterazioni reversibili conosciute come metaplasia, associate ad un aumento del numero delle cellule caliciformi rispetto a quello delle cellule ciliate. Tale aumento provoca uno strato di muco più spesso per la rimozione degli agenti irritanti, ma il ridotto numero di ciglia ritarda l’eliminazione del muco provocando congestione. Inoltre, le ghiandole sieromucose della lamina propria e della sottomucosa aumentano di dimensioni e, di conseguenza, è maggiore la secrezione. Dopo pochi mesi dalla cessata esposizione agli agenti inquinanti, la percentuale cellulare ritorna alla normalità (1 : 1) e le ghiandole sieromucose ritornano alle loro normali dimensioni. Albero bronchiale L’albero bronchiale inizia alla biforcazione della trachea, con i bronchi primari destro e sinistro, che si arborizzano (formano rami che diminuiscono progressivamente di dimensioni). L’albero bronchiale è costituito dalle vie aeree esterne ai polmoni (bronchi primari, bronchi extrapolmonari) e dalle vie aeree interne ai polmoni: bronchi intrapolmonari (bronchi secondari e terziari), bronchioli, bronchioli terminali e bronchioli respiratori (Fig. 15–7). L’albero bronchiale si divide 15-20 volte prima di raggiungere il livello dei bronchioli terminali. Mano a mano che le vie aeree diminuiscono di calibro, si possono osservare una diminuzione della quantità di cartilagine, del numero di ghiandole e cellule caliciformi e dell’altezza delle cellule epiteliali, ed un aumento del tessuto muscolare liscio e del tessuto elastico (rispetto allo spessore della parete). Bronchi primari (extrapolmonari) La struttura dei bronchi primari è identica a quella della trachea, ma questi hanno un diametro più piccolo e pareti più sottili. Ogni bronco primario si accompagna alle arterie polmonari, vene e vasi linfatici che penetra- no nel polmone a livello dell’ilo. Il bronco di destra è più dritto di quello di sinistra e si divide in tre bronchi, che penetrano nei tre lobi del polmone destro; il bronco di sinistra si biforca in due rami, che entrano nei due lobi del polmone sinistro. Queste ramificazioni lobari rappresentano i bronchi intrapolmonari. Bronchi secondari e terziari (intrapolmonari) Ogni bronco intrapolmonare serve un lobo dei polmoni; i bronchi terziari servono i segmenti broncopolmonari. Ogni bronco intrapolmonare rappresenta la via aerea di un lobo del polmone. Tali vie sono simili ai bronchi primari, con alcune eccezioni: gli anelli a C cartilaginei sono sostituiti da placche irregolari di cartilagine ialina che circondano completamente il lume del bronco intrapolmonare; in questo modo queste vie aeree non presentano una parte schiacciata, ma sono del tutto rotondeggianti. Lo strato muscolare liscio è localizzato all’interfaccia tra la lamina propria fibroelastica e la sottomucosa, ed è costituito da due strati ad andamento spiraliforme orientati in direzioni opposte. Le fibre elastiche, che si irradiano dall’avventizia, si connettono con le fibre elastiche provenienti dalla avventizia di una regione diversa dell’albero bronchiale. Come nei bronchi primari e nella trachea, le ghiandole sieromucose e gli elementi linfoidi sono presenti nella lamina propria e nella sottomucosa dei bronchi intrapolmonari. I dotti di queste ghiandole trasportano i prodotti di secrezione alla superficie dell’epitelio ciliato pseudostratificato che delimita il lume. I noduli linfatici sono particolarmente evidenti nei punti in cui le vie aeree si ramificano per formare bronchi di diametro sempre più piccolo. I bronchi intrapolmonari più piccoli hanno pareti sempre più sottili, con una quantità inferiore di placche di tessuto cartilagineo, e presentano cellule epiteliali più basse. I bronchi secondari, derivanti da quelli primari, entrano nei lobi del polmone e sono conosciuti anche come bronchi lobari. Il polmone di sinistra è suddiviso in due lobi e quindi possiede due bronchi secondari, mentre quello di destra ha tre lobi e contiene perciò tre bronchi secondari. Appena penetrati nei lobi polmonari, i bronchi secondari si suddividono in rami più piccoli, i bronchi terziari (o segmentali). Ciascun bronco terziario si ramifica, ma si dirige verso una sezione distinta del tessuto polmonare conosciuta come segmento broncopolmonare. Ogni polmone ha 10 segmenti broncopolmonari, che sono completamente separati gli uni dagli altri da tessuto connettivo e sono importanti da un punto di vista clinico negli interventi chirurgici che interessano i polmoni. Poiché le ramificazioni dei bronchi intrapolmonari diminuiscono di calibro, alla fine portano ai bronchioli. Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 355 Fibra muscolare liscia Setto interalveolare Arteria polmonare (porta sangue deossigenato) Bronchiolo respiratorio Bronchiolo respiratorio Vena polmonare (porta sangue ossigenato) Poro alveolare Figura 15–7 Schema dell’apparato respiratorio, con bronchioli, bronchioli terminali, bronchioli respiratori, dotti alveolari, pori alveolari e alveoli. Bronchioli I bronchioli non contengono cartilagine nelle loro pareti, hanno un diametro inferiore ad 1 mm e contengono cellule di Clara nel loro rivestimento epiteliale. Ogni bronchiolo (o bronchiolo primario) rifornisce d’aria un lobulo polmonare. I bronchioli rappresentano la 10ª-15ª ramificazione dicotomica dell’albero bronchiale. Comunemente si ritiene che il diametro sia inferiore ad 1 mm, anche se alcuni autori indicano dimensioni varianti tra 5 e 0,3 mm. Questo disaccordo sul diametro dei bronchioli può portare ad una certa confusione nella descrizione della loro struttura (ma non dovrebbe Alveoli Dotto alveolare Rete alveolare di elastina Rete capillare alveolare essere considerato un motivo per complicare la vita degli studenti). L’epitelio che riveste i bronchioli varia da cilindrico semplice ciliato, con qualche cellula caliciforme nei bronchioli più larghi, a cubico semplice (spesso ciliato), con qualche cellula di Clara ma senza cellule caliciformi nei bronchioli più stretti. Le cellule di Clara sono cilindriche, con una superficie apicale arrotondata a cupola, e presentano corti e tozzi microvilli (Fig. 15–8). Il citoplasma apicale presenta numerosi granuli secretori contenenti glicoproteine, prodotte dal loro abbondante RER. Si pensa che la funzione di queste cellule sia quella di proteggere l’epitelio bronchiale ricoprendolo con il loro prodotto di secrezio- 356 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Figura 15–8 M i c r o f o t o g r a f i a elettronica a scansione delle cellule di Clara e delle cubiche ciliate dei bronchioli terminali di ratto (×1817). (Da Peao MND, Aguas AP, De Sa CM, Grande NR: Anatomy of Clara cell secretion: Surface changes observed by scanning electron microscopy. J Anat 183:377–388, 1993). ne. Queste cellule provvedono inoltre a degradare le tossine contenute nell’aria inalata per mezzo degli enzimi del citocromo P–450 presenti nel reticolo endoplasmatico liscio. Alcuni autori hanno suggerito che le cellule di Clara producano un materiale, simile al surfattante, che riduce la tensione superficiale dei bronchioli e facilita quindi il mantenimento della loro pervietà. Pare inoltre che queste cellule, proliferando, rigenerino l’epitelio dei bronchioli. La lamina propria dei bronchioli è sprovvista di ghiandole ed è circondata da una lassa rete di fasci muscolari lisci ad andamento elicoidale (Fig. 15–9). Le pareti dei bronchioli e delle loro diramazioni sono prive di cartilagine. Fibre elastiche si irradiano dal tessuto connettivo fibroelastico che circonda il rivestimento muscolare dei bronchioli. Durante l’inspirazione, quando i polmoni si espandono, tali fibre esercitano una tensione sulle pareti bronchiolari; tirando in maniera uniforme in tutte le direzioni, le fibre elastiche contribuiscono a mantenere pervii i bronchioli. CORRELAZIONI CLINICHE La muscolatura liscia dei bronchioli è controllata dal sistema nervoso parasimpatico. In condizioni normali la muscolatura liscia si contrae al termine dell’espirazione e si rilascia durante l’inspirazione. Nelle persone sofferenti di asma, comunque, gli strati muscolari vanno incontro a contrazioni prolungate durante l’espirazione, con conseguente difficoltà nell’espulsione dell’aria dai polmoni. Steroidi e β2–agonisti rilasciano la muscolatura liscia bronchiale e sono di solito utilizzati per alleviare gli attacchi asmatici. A E SM L Figura 15–9 Microfotografia ottica di un bronchiolo (×117). Si noti la presenza di muscolatura liscia (SM) e l’assenza di cartilagine nella parete. Si osservi che l’intera struttura è intrapolmonare ed è circondata da tessuto polmonare. A, alveolo; E, epitelio; L, lume. Bronchioli terminali I bronchioli terminali formano le parti più piccole e più lontane della porzione conduttrice dell’apparato respiratorio. Ogni bronchiolo si suddivide a formare parecchi bronchioli terminali più piccoli, di diametro inferiore a 0,5 mm, che costituiscono la parte terminale del sistema di Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 357 conduzione dell’apparato respiratorio. Queste strutture riforniscono d’aria gli acini polmonari, le ultime porzioni del lobulo polmonare. L’epitelio dei bronchioli terminali è costituito da cellule di Clara e cellule cubiche, alcune delle quali provviste di ciglia. La sottile lamina propria è costituita da tessuto connettivo fibroelastico ed è circondata da uno o due strati di muscolatura liscia. Le fibre elastiche partono dall’avventizia e, come nei bronchioli, si legano alle fibre elastiche che si irradiano dagli altri componenti dell’albero bronchiale. I bronchioli terminali si ramificano per formare i bronchioli respiratori. R LA PORZIONE RESPIRATORIA DELL’APPARATO RESPIRATORIO A La porzione respiratoria dell’apparato respiratorio è costituita dai bronchioli respiratori, dai dotti alveolari, dai sacchi alveolari e dagli alveoli. Bronchioli respiratori I bronchioli respiratori sono la prima parte dell’apparato respiratorio in cui avvengono gli scambi gassosi. I bronchioli respiratori hanno una struttura simile ai bronchioli terminali, ma la loro parete è interrotta da strutture a parete sottile a forma di sacco, conosciute come alveoli, all’interno delle quali avvengono gli scambi respiratori (O2 per CO2). Mano a mano che i bronchioli respiratori si ramificano, il loro diametro si restringe e il numero di alveoli aumenta. Dopo alcune biforcazioni, ogni bronchiolo respiratorio termina in un dotto alveolare (Fig. 15–10). Dotti alveolari, atri e sacchi alveolari I dotti alveolari, gli atri e gli alveoli sono riforniti da una ricca rete di capillari. I dotti alveolari sono privi di pareti proprie e sono semplici arrangiamenti lineari di alveoli (Figg. 15–11 e 15–12). Un dotto alveolare, che origina da un bronchiolo respiratorio, si ramifica, e ciascun dotto alveolare che si foma normalmente termina con un rigonfiamento a fondo cieco costituito da due o più piccoli gruppi di alveoli, detti sacchi alveolari. Ogni sacco si apre così in uno spazio comune, che alcuni ricercatori indicano con il nome di atrio. Elementi sottili di tessuto connettivo tra gli alveoli, i setti interalveolari, rinforzano i dotti alveolari e in qualche modo li stabilizzano. Inoltre, l’imbocco di ogni alveolo nel dotto alveolare presenta fibre collagene di tipo III ed è controllato da una singola cellula muscolare liscia (“manopola” di muscolo liscio) che forma un delicato sfintere capace di regolare il diametro dell’apertura. Figura 15–10 Microfotografia ottica di un bronchiolo respiratorio umano (R) da cui prende origine un dotto alveolare (A). I bronchioli respiratori hanno pareti definite con gli alveoli inframmezzati. I dotti alveolari non hanno parete propria; i dotti sono creati da alveoli adiacenti. Sottili fibre elastiche si ramificano dalla periferia dei dotti alveolari e dei sacchi e si mescolano alle fibre elastiche provenienti da altri elementi intrapolmonari. Questa rete di fibre elastiche non solo mantiene la pervietà di queste delicate strutture durante l’inspirazione, ma le protegge anche dal danneggiamento che si può avere con la distensione ed è responsabile dell’espirazione spontanea. Alveoli Gli alveoli sono piccoli sacchi aerei composti da pneumociti di tipo I, molto appiattiti, e da numerosi pneumociti di tipo II. Gli alveoli sono piccoli diverticoli di circa 200 μm di diametro derivanti dai bronchioli respiratori, dai dotti e dai sacchi alveolari (Fig. 15–13; vedi anche Figg. 15–11A e B e 15–12). Gli alveoli formano la struttura funzionale primaria dell’apparato respiratorio, in quanto le loro sottili pareti permettono lo scambio di CO2 per O2, tra l’a- 358 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Poro alveolare Interno dell’alveolo Bronchiolo respiratorio Cellula alveolare O2 Plasma CO2 Eritrocita Dotto alveolare Sangue povero di ossigeno dal cuore Capillare alveolare B Sangue ricco di ossigeno al cuore Alveolo A Diffusione di CO2 nel sangue e conversione in HCO3– Diffusione di CO2 dal sangue agli alveoli CO2 Prodotta dalle cellule dei tessuti Cl– CO2 HCO3–+H+ Hb CO2+H2O HCO3–+H+ Anidrasi carbonica Hb CO2+H2O H2CO3 HCO3– Alveolo H2CO3 Anidrasi carbonica Cl– CO2 CO2 Tessuto corporeo Capillare C D Capillare Alveolo del polmone Figura 15–11 A, bronchiolo respiratorio, sacco alveolare, poro alveolare e alveoli. B, setto interalveolare. C, assunzione di anidride carbonica da parte di eritrociti e plasma dai tessuti corporei. D, rilascio di anidride carbonica da parte di eritrociti e plasma nel polmone (Da confrontare A con il dotto alveolare mostrato in Fig.15-10). Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 359 Figura 15–12 Microfotografia elettronica a scansione di un polmone di ratto che mostra un bronchiolo (b), una piccola arteria (v) e alveoli (d), alcuni dei quali presentano pori. (Da Leeson TS, Leeson CR, Paparo AA: Text/Atlas of Histology. Philadelphia, WB Saunders, 1988). Figura 15–13 Microfotografia elettronica a trasmissione di un setto interalveolare di scimmia. Si noti la presenza di alveoli (a), eritrociti (e) dentro i capillari (c), e macrofagi alveolari (m). Si notino filopodi (frecce) e pori alveolari (asterischi). (Da Maina JN: Morphology and morphometry of the normal lung of the adult vervet monkey (Cercopithecus aethiops). Am J Anat 183:258–267, 1988). 360 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio ria nel loro lume e il sangue nei capillari adiacenti. Sebbene ogni alveolo sia una piccola struttura di circa 0,002 mm3, il loro numero totale è di circa 300 milioni e questo conferisce al polmone una struttura spugnosa. Si calcola che l’area totale degli alveoli utile per gli scambi gassosi superi i 140 m2 (circa lo spazio di un appartamento con due stanze da letto oppure le dimensioni di un campo da tennis). A causa del loro elevato numero, gli alveoli sono spesso addossati gli uni agli altri, con la scomparsa dell’interstizio di tessuto connettivo tra loro. In tali aree di contatto gli spazi aerei di due alveoli possono comunicare tra loro per mezzo di un poro alveolare (poro di Kohn), il cui diametro varia dagli 8 ai 60 μm (vedi Fig. 15–12). Questi pori probabilmente hanno lo scopo di equilibrare la pressione dell’aria all’interno dei segmenti polmonari. La regione tra due alveoli adiacenti è conosciuta come setto interalveolare. Essa è occupata da un vasto letto capillare costituito da capillari continui che ricevono il sangue dall’arteria polmonare e sono drenati dalla vena polmonare. Il tessuto connettivo del setto interalveolare è ricco di fibre elastiche e di fibre collagene di tipo III (fibre reticolari). Poiché sia gli alveoli che i capillari sono costituiti da tessuto epiteliale, entrambi presentano una discreta membrana basale. Le aperture degli alveoli associati con i sacchi alveolari, a differenza di quelli dei bronchioli respiratori e dei dotti alveolari, sono prive di cellule muscolari lisce. Il loro orifizio è circondato da fibre elastiche e soprattutto da fibre reticolari. Le pareti alveolari sono costituite da due tipi cellulari: pneumociti di tipo I e di tipo II. Pneumociti di tipo I Il 95% circa della superficie alveolare è costituito da epitelio squamoso semplice, le cui cellule sono note come pneumociti di tipo I (detti anche cellule alveolari di tipo I o cellule alveolari squamose). Le cellule di questo epitelio sono fortemente appiattite e così il loro citoplasma può raggiungere lo spessore di soli 80 nm r (Fig. 15–14; vedi anche Fig. 15–12). La regione del nucleo è più ampia e ospita la maggior parte degli organelli cellulari, costituita da pochi mitocondri, un RER ed un apparato del Golgi scarsi. Gli pneumociti di tipo I sono uniti fra loro da giunzioni occludenti che prevengono l’infiltrazione del fluido extracellulare (fluido tissutale) nel lume dell’alveolo. Alla base di queste cellule vi è una membrana basale ben sviluppata, che si estende quasi al bordo dei pori alveolari. Il bordo di ogni poro alveolare è formato dalla fusione delle membrane cellulari di due pneumociti di tipo I a stretto contatto di due alveoli diversi. La faccia prospiciente il lume degli pneumociti di tipo I è rivestita di surfattante, come descritto più avanti. Pneumociti di tipo II Sebbene gli pneumociti di tipo II (conosciuti anche come grandi cellule alveolari, cellule settali e cellule alveolari di tipo II) siano più numerosi degli pneumociti di tipo I, di fatto occupano solo il 5% della superficie alveolare. Sono cellule cubiche sparse tra gli pneumociti di tipo I, con i quali formano giunzioni occludenti. La loro superficie apicale è a forma di cupola e sporge nel lume degli alveoli (Figg. 15–15 e 15–16). Si trovano spesso in regioni dove alveoli adiacenti sono separati gli uni dagli altri da un setto (da cui il nome di cellule settali) e sotto la superficie opposta al lume vi è una membrana basale. Le fotografie al microscopio elettronico degli pneumociti di tipo II mostrano corti microvilli apicali, un nucleo centrale, abbondante RER, un apparato del Golgi ben sviluppato e numerosi mitocondri. La caratteristica principale di queste cellule è la presenza di corpi lamellari, delimitati da membrana, che contengono il surfattante polmonare, un prodotto di secrezione di queste cellule. Questo surfattante è sintetizzato a livello del RER degli pneumociti di tipo II ed è costituito principalmente da due fosfolipidi, la dipalmitoil fosfatidilcolina e il fosfatidilglicerolo, da lipidi neutri e da quattro tipiche proteine, le apoproteine surfattanti SP-A, SP-B, SP-C p en b ep a Figura 15–14 Microfotografia elettronica a trasmissione della barriera sangue–gas (×71.250). Si noti la presenza dell’alveolo (a), di pneumociti di tipo I assottigliati (ep), membrane basali fuse (b), cellule endoteliali appiattite dei capillari (en) con vescicole pinocitotiche (frecce), plasma (p) ed un eritrocita (r) nel lume capillare. (Da Maina JN: Morphology and morphometry of the normal lung of the adult vervet monkey (Cercopithecus aethiops). Am. J Anat 183:258–267, 1988). Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 361 Surfattante liberato dalla vescicola lipoproteica Strato acquoso sottostante Piccolo corpo lamellare (fosfolipidi) Surfattante Monostrato lipidico Piccolo corpo lamellare che si fonde con la vescicola lipoproteica Corpo multivescicolare Sintesi proteica Golgi Il surfattante viene rilasciato mediante esocitosi nel lume alveolare. Qui forma una rete larga simile al lattice, nota come mielina tubulare, che successivamente si separa nelle sue componenti lipidica e proteica. I lipidi sono inseriti in un film monomolecolare di fosfolipidi, costituendo l’interfaccia con l’aria, mentre le proteine entrano nello strato acquoso tra gli pneumociti e il film di fosfolipidi. Il surfattante riduce la tensione superficiale, prevenendo così il collasso degli alveoli, l’atelettasia. Esso viene continuamente prodotto dagli pneumociti di tipo II ed è poi fagocitato dagli pneumociti di tipo II e più raramente dai macrofagi alveolari. Oltre a produrre e fagocitare surfattante, gli pneumociti di tipo II vanno incontro a mitosi per rigenerarsi, come gli pneumociti di tipo I. Macrofagi alveolari (cellule pazzine) I macrofagi alveolari fagocitano materiale corpuscolato nel lume degli alveoli e negli spazi interalveolari. Sintesi di fosfatidilcolina Colina Aminoacidi Figura 15–15 Schema di pneumocita di tipo II. (Da confrontare con lo pneumocita di tipo II mostrato in Fig. 15-16). e SP-D. Il surfattante è modificato a livello dell’apparato del Golgi ed è rilasciato dalla rete trans del Golgi in vescicole secretorie conosciute come corpi compositi, che rappresentano i precursori dei corpi lamellari. I monociti raggiungono l’interstizio polmonare, divengono macrofagi alveolari (o cellule spazzine), migrano tra gli pneumociti di tipo I e quindi entrano nel lume alveolare. Queste cellule fagocitano il materiale corpuscolato, come la polvere e i batteri, ed in questo modo mantengono un ambiente intrapolmonare sterile (Fig. 15–17; vedi anche Fig. 15–13). Le cellule spazzine, inoltre, cooperano con gli pneumociti di tipo II nel recupero del surfattante. Circa 100 milioni di macrofagi migrano nei bronchi ogni giorno e da qui vengono trasportati, per azione delle ciglia, alla faringe per essere eliminati mediante la deglutizione o l’espettorazione. Alcuni macrofagi alveolari, comunque, rientrano nell’interstizio polmonare e passano nei vasi linfatici per abbandonare i polmoni. CORRELAZIONI CLINICHE CORRELAZIONI CLINICHE Alla nascita, i polmoni del neonato si espandono fin dal primo atto respiratorio e la presenza del surfattante permette agli alveoli di rimanere pervii. I neonati immaturi (nati prima del settimo mese di gestazione), che non hanno ancora prodotto il surfattante (o che ne hanno prodotto una quantità inadeguata), possono subire lo stress respiratorio del neonato, che può essere fatale. Questi neonati sono trattati con una terapia combinata di surfattante sintetico e glucocorticoidi. Il primo agisce immediatamente per ridurre la tensione superficiale, i secondi stimolano la sua produzione da parte degli pneumociti di tipo II. I macrofagi alveolari in soggetti con congestione polmonare e insufficienza cardiaca congestizia fagocitano globuli rossi travasati. Questi macrofagi sono generalmente denominati cellule dell’insufficienza cardiaca. L’enfisema è una patologia associata di solito ad una sequela di esposizioni a lungo termine al fumo di sigaretta o ad altri inibitori della proteina α1–antitripsina. Questa proteina salvaguarda i polmoni dall’azione dell’elastasi sintetizzata dalle cellule spazzine, che distrugge le fibre elastiche. In tali pazienti l’elasticità del tessuto polmonare è ridotta e sono presenti grosse sacche piene di fluido, che fanno diminuire la capacità di scambio gassoso della porzione respiratoria dell’apparato respiratorio. 362 䡲 䡲 䡲 Capitolo 15 ■ Apparato respiratorio Figura 15–16 Microfotografia elettronica a trasmissione di uno pneumocita di tipo II. Si osservi il nucleo centrale (N) fiancheggiato da alcuni corpi lamellari. a, alveolo; c, capillari; e, fibre elastiche; En, nucleo della cellula endoteliale; f, fibre collagene; le frecce indicano la barriera sangue–gas; l’asterisco indica una piastrina. (Da Leeson TS, Leeson CR, Paparo AA: Text/Atlas of Histology. Philadelphia, WB Saunders, 1988). A DC Figura 15–17 Macrofagi alveolari (cellule spazzine) in polmone umano (×270). Le cellule spazzine (DC) appaiono come punti neri sull’immagine, poiché hanno fagocitato particelle di polvere che erano presenti nello spazio aereo del polmone. A, alveolo. Capitolo 15 ■ Apparato respiratorio 䡲 䡲 䡲 363 Setto interalveolare La regione tra due alveoli adiacenti, conosciuta come setto interalveolare, è rivestita su entrambi i lati da epitelio alveolare (vedi Fig. 15–13). Il setto interalveolare può essere estremamente stretto e ospitare solo un capillare continuo e la sua membrana basale, oppure talvolta può essere più ampio e includere elementi di tessuto connettivo, come fibre collagene di tipo III e fibre elastiche, macrofagi, fibroblasti (e miofibroblasti), mastociti ed elementi linfoidi. Barriera sangue–gas La barriera sangue–gas è la regione del setto interalveolare che è attraversata da O2 e da CO2 quando questi gas vanno dal vaso sanguigno al lume degli alveoli, e viceversa. Le regioni più sottili del setto interalveolare, in cui i gas possono essere scambiati, sono definite come barriera sangue–gas (vedi Fig. 15–14). La barriera sangue-gas più stretta, dove gli pneumociti di tipi I sono in stretto contatto con l’endotelio dei capillari e dove le membrane basali dei due epiteli si fondono, è la più efficiente per lo scambio di O2 (nel lume alveolare) e CO2 (nel sangue). Queste regioni sono costituite dalle seguenti strutture: ■ ■ ■ surfattante e pneumociti di tipo I membrane basali fuse di pneumociti di tipo I e di cellule endoteliali dei capillari cellule endoteliali dei capillari continui Scambi gassosi tra tessuti e polmoni Nei polmoni, l’O2 viene scambiato con la CO2 trasportata dal sangue; nei tessuti del corpo, la CO2 viene scambiata con l’O2 trasportato dal sangue. Durante l’inspirazione, l’ossigeno dell’aria entra negli spazi alveolari dei polmoni. Poiché l’area totale degli alveoli supera i 140 m2 ed il volume totale del sangue in tutti i capillari polmonari in qualsiasi momento non supera i 140 ml, lo spazio disponibile per la diffusione dei gas è enorme. Inoltre, il diametro dei capillari è sufficientemente stretto da far passare i globuli rossi in singola fila; in questa maniera l’ossigeno può raggiungere ciascun eritrocita da ogni parte, utilizzando l’intera superficie del globulo rosso disponibile allo scambio di gas. L’ossigeno diffonde attraverso la barriera sangue–gas, entra nel lume dei capillari e si lega all’eme dell’emoglobina degli eritrociti formando l’ossiemoglobina. La CO2 lascia il sangue e diffonde, attraverso la barriera sangue–gas, nel lume degli alveoli e lascia gli spazi alveolari quando l’aria ricca di CO2 è espirata. Il passaggio di O2 e CO2 attraverso la barriera sangue-gas è dovuto alla diffusione passiva in risposta alla pressione parziale di questi gas nel sangue e negli alveoli. Le cellule del corpo formano ogni minuto circa 200 ml di CO2; questa entra in circolo ed è trasportata in tre modi: (1) come gas disciolto nel plasma (20 ml), (2) legata all’emoglobina (40 ml) oppure (3) sotto forma di ioni bicarbonato nel plasma (140 ml). La sequenza di eventi che si susseguono negli scambi gassosi è qui brevemente riassunta (vedi Fig. 15–11C): 1 Una gran parte della CO2 sciolta nel plasma diffonde nel citosol degli eritrociti. 2 Una parte della CO2 si lega alla porzione globulare dell’emoglobina. Sebbene la CO2 sia trasportata in punti diversi della molecola di emoglobina, la sua capacità di legame è maggiore in assenza di O2 nell’eme. 3 La gran parte della CO2 che si trova all’interno del citosol degli eritrociti, si combina con l’acqua in una reazione catalizzata dalla anidrasi carbonica e forma l’acido carbonico, che si dissocia in ione idrogeno (H+) e ione bicarbonato (HCO3–). Gli ioni idrogeno si legano all’emoglobina e quelli bicarbonato lasciano gli eritrociti per entrare nel plasma. Per il mantenimento dell’equilibrio ionico, lo ione cloruro (Cl–) passa dal plasma agli eritrociti; questo scambio di bicarbonato contro cloruro è detto “shift” del cloruro. Il sangue ricco di bicarbonato raggiunge i polmoni attraverso le arterie polmonari. Poiché il livello di CO2 è maggiore nel sangue rispetto a quello del lume alveolare, la CO2 è liberata (secondo il gradiente di concentrazione). Il meccanismo di rilascio è l’inverso della precedente reazione. Gli eventi che si verificano sono i seguenti (vedi Fig. 15–11D): 1 Gli ioni bicarbonato entrano negli eritrociti (con conseguente rilascio di Cl– dai globuli rossi nel plasma, shift del cloruro). 2 Gli ioni bicarbonato e idrogeno nel citosol degli eritrociti si combinano, con conseguente formazione di acido carbonico. 3 Nel polmone, il legame dell’O2 con l’emoglobina rende quest’ultima più acida e riduce la sua capacità di legare CO2. Inoltre, l’eccesso di ioni idrogeno liberati a causa dell’alta acidità dell’emoglobina si lega agli ioni bicarbonato, formando acido carbonico. 4 L’anidrasi carbonica catalizza la rottura del legame dell’acido carbonico, con formazione di acqua e CO2. 5 La CO2 sciolta nel plasma, legata all’emoglobina e rilasciata dall’acido carbonico, segue il gradiente di concentrazione, per diffondere attraverso la barriera sangue–gas ed entrare quindi nel lume alveolare. L’emoglobina possiede anche due siti di legame per l’ossido nitrico (NO), un neurotrasmettitore che, quando viene liberato dalle cellule endoteliali dei vasi sanguigni, induce un rilasciamento della muscolatura liscia vascolare, con conseguente dilatazione dei vasi
Scaricare