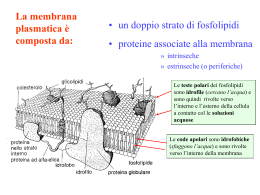
Corso di Fisiologia dei Canali Ionici Docente: Prof. Mauro Toselli [email protected] Potrete scaricare gli argomenti trattati a lezione al seguente indirizzo web: www.unipv.it/tslmra22 Presentazione Questo ciclo di lezioni sarà una rapida carrellata su uno dei temi più fertili della Biofisica: I CANALI IONICI Tenterò di convincervi della straordinaria importanza di queste proteine nello svolgimento di tutte le funzioni corporee. Non a caso, gran parte dei veleni di cui alcuni serpenti, ragni, scorpioni, pesci, ecc. si servono per difendersi dai predatori o per immobilizzare le prede (per non parlare dei “veleni” vegetali come il curaro) impediscono la funzione di qualche canale ionico. --> La millionaria selezione naturale dei genomi non ha solo escogitato molte “macchine intelligen-ti”, ma anche molte armi altrettanto intelligenti per distruggerle. Le mutazioni genetiche che portano ad un disordine nel funzionamento di qualche canale ionico hanno conseguenze dannose e spesso disastrose per l’organismo (canalopatìe). Molti scommettono che i canali ionici siano il bersaglio molecolare più promettente per lo sviluppo di nuovi farmaci. 1. Ricostruzione di un bilayer lipidico Un buon punto di partenza è considerare che la struttura portante della membrana cellulare è un doppio strato di (fosfo)lipidi strettamente giustapposti, praticamente impermeabile agli ioni (es. Na+, Cl-) ed alle molecole polari (es. zuccheri, aminoacidi) [Perchè ?] + H2O Una membrana costituita da un puro bilayer fosfolipidico è impermeabile alle proteine e alla maggior parte delle piccole molecole Gas Piccole molecole polari non cariche Etanolo Acqua Urea Grosse molecole polari non cariche Glucosio Ioni Molecole Aminoacidi polari cariche ATP Glc-6-P Ioni e molecole polari possono attraversare la membrana solo con la mediazione di speciali proteine transmembranarie, chiamate proteine di trasporto. 2. Queste sono: A) le proteine transmembranarie che agiscono da “carriers” per gli ioni e per molte molecole organiche. Tra queste, alcune trasportano le particelle contro-gradiente elettrochimico (trasporti attivi, primari o secondari). Argomento di enorme interesse biotecnologico, degno di essere approfondito in un altro corso specialistico… Basti pensare che uno dei farmaci più diffusi (il “Prozac”) inibisce un trasportatore (della serotonina) B) i nostri canali ionici, che consentono un rapido flusso transmembranario (sempre secondo gradiente elettrochimico) degli ioni inorganici. Associazione di proteine di membrana con un bilayer lipidico Transmembrana -elica Periferche ancorate a lipidi attaccate a proteine foglietto- SPAZIO EXTRACELLULARE Bilayer lipidico CITOSOL Legame covalente a molecola lipidica Legame debole, non-covalente, ad un’altra proteina di membrana Come può un legame peptidico polare essere inserito nel core idrofobico di un bilayer fosfolipidico? estremità amino (N-) terminale estremità carbossi (C-) terminale Le - eliche transmembrana tipicamente sono costituite da 20-25 aminoacidi la maggior parte dei quali idrofobici. triptofano fenilalanina prolina isoleucina I canali ionici permettono dei flussi molto rapidi e intensi Tipo di trasportatore Velocità di turnover Pompe ioniche 2-5·102/sec Glucoso-permeasi 103-104/sec Canale del Na+ ~108/sec Struttura di base di un canale ionico bilayer lipidico Lato extracellulare Filtro di selettività Residui di zuccheri Lato citoplasmatico Poro acquoso Canale ionico in 3D – Porina Unica subunità Canale ionico in 3D – Shaker K+ Quattro subunità Canale ionico in 3D – Nicotinico Cinque subunità Ogni canale ionico è costituito3.da un certo numero di subunità proteiche (o domini della stessa proteina, come si vedrà meglio in seguito), disposte “in cerchio” in modo da delimitare un poro transmembranario contenente acqua. La struttura dei canali ionici e le proprietà funzionali che ne derivano sono molto diversificate. Due aspetti (riconducibili a parti distinte della loro molecola) sono però particolarmente importanti: -la selettività -il gating SELETTIVITA’: ● La selettività indica lo ione (o gli ioni) che possono attraversare la membrana quando il canale si trova nello stato aperto. alcuni canali sono selettivi (≈) per un’unica specie ionica (es. Na+, K+, Ca2+, Cl-). alcuni sono selettivi per un gruppo di specie ioniche, tipicamente per i cationi (o per gli anioni) Alcuni canali ionici sono estremamente selettivi nei confronti dei vari ioni La selettività può essere conferita da una combinazione dei seguenti fattori: - presenza di cariche elettriche fisse sulla parete interna del canale di intensità e densità specifiche - raggio anidro dello ione - grado di idratazione dello ione Gli ioni formano dei temporanei legami di coordinazione con residui aminoacidici della parete del poro La selettività ionica dei canali del K+ I canali del K+ hanno pori più ampi degli ioni Na+ e tuttavia favoriscono il passaggio di ioni del K+ ma non di ioni Na+ Come sono disegnati questi canali per essere selettivamente permeabili a K+ ma non a Na+? Basi molecolari di selettività di un canale K+ nei confronti dello ione K+ rispetto al Na+ K+ in H2O Na+ in H2O Gli ioni K+, idrati in soluzione, perdono le molecole di H2O quando passano attraverso il filtro di selettività e formano dei legami di coordinazione con quattro O- di gruppi carbonilici. K+ nel poro Na+ nel poro Gli ioni Na+, essendo più piccoli, non possono coordinarsi perfettamente con questi O- e quindi attraversano il canale solo raramente. Sezione frontale (sinistra) e vista dall’alto (destra) di un canale selettivo per lo ione K+. Si possono osservare tre ioni K+ che stanno attraversando il poro del canale per diffusione ristretta in singola fila. Le molecole rappresentate da atomi rossi e bianchi sono molecole di H2O, alcune delle quali sono ancora legate agli ioni K+ a costituire l’alone di solvatazione. Passaggio in singola file di ioni K+ attraverso il poro del canale I flussi attraverso canali ionici sono saturanti Evidenze per la presenza di siti di legame: Conduttanza di singolo canale (pS) Una dipendenza della permeabilità allo ione dalla composizione e dalla concentrazione dello ione implica la presenza di siti di legame nel canale i Fi max 1 Ka /[i ] Concentr. di Na+ o K+ (mM) Nei canali cationici il filtro è meno stringente: nel recettore-canale nicotinico, ad esempio, 3 anelli di leucina sbarrano la strada agli anioni, ma i cationi non vengono selezionati GATING: Il poro interno al canale, per effetto delle vibrazioni (“variazioni conformazionali spontanee”) della proteina, può passare ciclicamente da uno stato chiuso (impermeabile agli ioni) ad uno stato aperto in cui gli ioni passano mediamente ad una velocità di 106/sec NB. Si vedrà che la corrente di singolo canale (dell’ordine dei pA) può essere misurata con tecniche opportune ( “patch clamp”). Si tratta della prima registrazione di un segnale fisico generato da una singola molecola ! ● Il termine gating (“gate” = porta, cancello) indica il processo per cui un fattore (o più fattori) privilegia la permanenza di una certa classe di canali nello stato aperto (o nello stato chiuso). La casistica è molto complessa: alcuni canali (canali di “leakage”) restano sempre aperti (“canali senza gating”). Fisiologia → potenziale di membrana in condizioni di riposo alcuni vengono aperti dalla distensione della membrana (stretchchannels o mechanosensitive-channels). Fisiologia → meccano-recettori, es. corpuscoli di Pacini, cellule ciliate dell’orecchio interno, …. GATING: alcuni (A) vengono aperti (o chiusi) da una variazione del potenziale transmembranario. Si tratta dei voltage-operated channels o VOC) Fisiologia → es. potenziale d’azione (nervoso, muscolare, cardiaco. ..) alcuni (B e C) vengono aperti (o chiusi) dal legame di “mediatori” extracellulari coi rispettivi recettori membranali. Si tratta dei (receptor-operated [o ligand-operated] channels o ROC) In questo caso il “gating” del canale può essere: • diretto (B), quando il “sito” recettoriale fa parte del canale (“receptor-channels” o “ionotropic-receptors”) Fisiologia → es. il recettore “nicotinico” per l’acetilcolina della placca neuromuscolare. • indiretto (C), quando il “sito” recettoriale per il messaggero extracellulare è situato altrove nella membrana. In questo caso il canale viene aperto (o chiuso) dall’azione di un secondo messaggero (o da altri eventi biochimici da esaminare caso per caso) che agisce sul versante intracellulare del canale. Fisiologia → es. i fotorecettori retinici o i recettori olfattori. NB: queste vignette hanno un puro valore didattico e non sono aderenti alla realtà dei fatti. Ad es. la “gate” è solitamente disposta al versante intracellulare (e non a quello extracellulare) del canale Canali Ionici: classificazione in base alle modalità di apertura extracell. intracell. Sempre aperti Voltaggio-dipendenti: rispondono a variazioni di Vm Chemio-dipendenti: rispondono a un messaggero extracellulare neurotrasmettitore Chemio-dipendenti: rispondono a un secondo messaggero (intracellulare) cAMP, cGMP, Ca2+, IP3, proteine G COOPERATIVITA’ TRA CA NALI IONICI Spesso due o più tipi di canali ionici cooperano per svolgere una determinata funzione .. Un ottimo esempio di “funzione integrata” svolta da canali ionici è la regolazione della secrezione di insulina (ormone ipoglicemizzante) da parte delle cellule β del pancreas. Sono implicati due tipi di canali: a) un canale al K+ operato dall’ATP intracellulare. Quando la glicemia è normale, questi canali sono aperti e la fuga di K+ che essi consentono mantiene il p.di m. a valori negativi. Quando il livello intracellulare di ATP aumenta per un aumento della glicemia, i canali si chiudono e la membrana si depolarizza. b) un canale al Ca2+ voltaggio dipendente. Quando la membrana viene depolarizzata, questi canali si aprono consentendo un ingresso di ioni Ca2+, che promuovono la fusione con la membrana di vescicole contenenti insulina. La glicemia diminuisce. La conoscenza di questo meccanismo ha aiutato a curare il diabete, una malattia in cui il sistema di controllo della secrezione di insulina non lavora nel modo corretto. Un approccio terapeutico (adatto per alcuni pazienti, ma non per altri) è quello di bloccare i canali del K+ ATP-dipendenti nello stato chiuso (usando farmaci del gruppo della sulfonil-urea), in tal modo facilitando o promuovendo (depolarizzando la membrana delle cellule β) il rilascio dell’insulina. Problemi clinici correlati ai sistemi di trasporto Fibrosi cistica – canali del cloro epiteliali Aritmie cardiache – canali del sodio e del potassio cardiaci
Scaricare