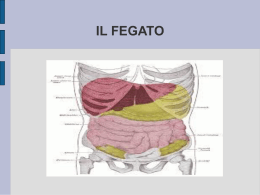
FISIOPATOLOGIA DELL’ APPARATO DIGERENTE Il sistema alimentare è un tubo lungo e complesso che varia nella sua funzione e struttura nelle varie specie animali. Per esempio, gli erbivori necessitano di camere di fermentazione per la digestione della cellulosa. Sebbene una grande varietà di patologie gastrointestinali siano clinicamente importanti in tutte le specie animali, esse variano da specie a specie. I carnivori domestici per le profilassi vaccinali, e uno stile di vita ed alimentare molto simile all’ uomo sviluppano neoplasie del tratto alimentare più frequenti rispetto agli erbivori. Ruminati e suini mostrano una notevole varietà di patologie infettive. La resistenza alla malattia avviene perché il sistema alimentare è ben strutturato per proteggersi contro la maggior parte degli insulti patogeni. MECCANISMI DI DIFESA - secrezione salivare - Flora batterica residente - pH gastrico - il vomito - Le secrezioni extraintestinali come epato-pancreatiche - gli enzimi proteolitici intestinali - l’ elevata velocità di ricambio delle cellule epiteliali - l’ aumentata peristalsi - il sistema immunitario CAVO ORALE I meccanismi di difesa sono rappresentati: . dalle papille gustative che respingono il materiale potenzialmente tossico in base al gusto e alla sensazione sulla lingua. - Flora batterica residente che occupa i siti di attacco dei patogeni -- saliva che forma un mantello protettivo sulla mucosa e contiene lisozima antibatterico ed immunoglobuline. L’ epitelio di rivestimento della cavità orale è continuamente bersagliato una varietà di insulti che si rendono responsabili di infiammazioni ( stomatiti e gengiviti), erosioni, ulcerazioni e necrosi. Le lesioni sono classificate come macule, papule, vescicole, erosioni, ed ulcere. Possono essere causate da: - Agenti infettivi, virus - sostanze chimiche - traumi, - sostanze tossiche - malattie autoimmuni - patologie sistemiche Tali patologie determinano difficoltà nella masticazione che risulta dolorosa con conseguente anoressia. Si osserva un’ aumentata salivazione per aumentata produzione o per mancata deglutizione. PRESTOMACI L’attività dei prestomaci è condizionata: - dal tipo e qualità degli alimenti introdotti, - dalla quantità di saliva prodotta. - dalla motilità riflessa (che uniforma ed accelera l’attività fermentativa con il rimescolamento dell’alimento, governa la ruminazione, allontana i gas con l’eruttazione ed assicura la funzionalità della doccia esofagea). Secrezione salivare - pH 8 -prodotta abbondantemente (100- 150 litri /die); Funzione: - tampona gli H+ che derivano dalla dissociazione sia degli AGV (Acidi Grassi Volatili) sia da quella dell’acido carbonico; - mantiene un pH di 5,6 – 6,8 necessario per la sopravvivenza della flora batterica ruminale e per l’assorbimento degli AGV. Papille o villosità del rumine Lo sviluppo delle papille dipende dal tipo di alimentazione. E’ quasi nullo fino a quando l’ animale riceve solo latte. Un corretto sviluppo si ha con razioni che contengono adeguate quantità di fibra grezza. Alterazioni metaboliche: - razioni con elevato tenore di concentrrati e ridotta quantità di fibra grezza(inferiore al 15%) comportano modificazioni distrofiche iperplastiche 1. Le papille diventano scure, si ipertrofizzano e tendono ad agglomerarsi 2. l’ epitelio di rivestimento che è un epitelio stratificato cheratinizzato va incontro a fenomeni di iperplasia: ipercheratosi paracheratosica. • Queste lesioni hanno il significato di adattamento a mutate condizioni metaboliche e dipendono da cambiamenti nella quantità, nel tipo e proporzione degli acidi grassi volatili sviluppati dalla fermentazione (aumento degli acidi propionico e butirrico, diminuzione dell’acido acetico, dall’ abbassamento del pH del liquido ruminale (valore normale ,5,5 -7,5) . PATOLOGIA DEI PRESTOMACI Ruminopatie infiammatorie sono dell’ espressioni morfologiche di quel complesso di affezioni che non permettono l’ evacuazione dei gas di fermentazione o di una anomalia biochimica del contenuto dovuto a fermentazioni anomale TIMPANISMO • Timpanismo: dilatazione per accumulo di gas della fermentazione. La mancata espulsione dei gas di fermentazione causa aumento della pressione intraddominale e intratoracica, che può portare a morte l’ animale per soffocamento. • Il primario può dipendere da: un’ eccessiva schiumosità del contenuto ruminale. La schiuma non è eruttabile . • Il secondario da: non eruttazione per cause fisiche es. stenosi o compressioni esofagee o della doccia , lesioni peritoneali croniche con aderenze • Per cause dinamiche: disturbi del vago , sovraccarico alimentare del rumine , acidosi ruminale cronica TIMPANISMO SCHIUMOSO , più frequente causato dal consumo di leguminose verdi o affienate o di concentrati. TIMPANISMO GASSOSO. TIMPANISMO SCHIUMOSO RUMINALE Frothy bloat Causa: alimentazione con leguminose. Le leguminse hanno una spiccata attività schiumogena soprattutto quando sono presenti nelle erbe pascolate in percentuali superiori al 50%. Tra le leguminose sono particolarmente schiumogene: -Trifoglio bianco, il trifoglio rosso, erba medica. -I vegetali schiumogeni sono più attivi nel periodo di maggior accrescimento prima della fioritura, soprattuttote se bagnati o trattati con fertilizzanti. La produzione di schiuma nel contenuto ruminale è normalmente su livelli bassi ed esiste un delicato equilibrio tra i fattori pro e antischiumogeni Proteine solubili fogliari, liberate dai cloroplasti sono le sostanze schiumogene più efficaci. In particolare è efficace la frazione I di tali proteine contenuta in percentuali elevate (2-6%) nei foraggi schiumogeni. Questa ha la funzione di stabilizzare la schiuma formano uno strato insolubile di proteine denaturate che intrappola le bolle di gas. TIMPANISMO GASSOSO RUMINALE e’ legato a un disturbo dei meccanismi dell’ eruttazione. ERUTTAZIONE, processo complesso al quale contribuiscono diversi fattori : - stimolazione dei recettori del rumine - contrazione caudo craniale del sacco dorsale del rumine, - rilassamento dello sfintere cardiale e della porzione caudale dell’ esofago, contrazioni antiperistaltiche dell’ esofago. Per un regolare svolgimento di questo meccanismo sono necessari: - una muscolatura ruminale efficiente - una mucosa ruminale indenne - un esofago regolarmente funzionante - presenza di un bolla di gas dorsale. La fuoriuscita di gas dal rumine può essere ostacolata da: - stenosi o compressioni dell’ esofago da parte di neoplasie, corpi estranei, ascessi nella zona di biforcazione tracheale. - o da cause anatomiche che interferiscono con le contrazioni ruminali, disturbi della motilità esofago-gastrica. RUMINOPATIE DA SOVRALIMENTAZIONE CON CARBOIDRATI E’ una patologia dei bovini e dei piccoli ruminanti sottoposti ad allevamento intensivo in seguito all’ingestione di quantità eccessive o non gradualmente somministrate di alimenti molto fermentescibili (cereali, bietole, sottoprodotti della lavorazione industriale) e ricchi di carboidrati. . FATTORI CAUSALI cereali (Frumento ,orzo, mais) somministrati in quantità elevate e non controbilanciate da una quota proteica adeguata. - assenza di un periodo di adattamento e brusco passaggio da un’ alimentazione da ingrasso troppo povera di foraggio La sovralimentazione con carboidrati comporta un aumento degli AGV nel rumine. Il pH del liquido ruminale si abbassa notevolmente (4-4.5) a causa di un’ eccessiva produzione di acido lattico. L’ acido lattico è normalmente un metabolita della microflora ruminale ma è presente in quantità esigue. Viene rimosso da vari batteri che lo metabolizzano e per le attività dei quali è necessario un pH di 6,6.5. Quando il pH scende al di sotto di 5 la maggior parte di questi batteri vengono distrutti mentre resistono quelli che producono acido lattico come Streptococcus bovis, e lattobacilli. Di conseguenza la produzione di acido lattico risulta superiore alle possibilità di tamponamento dei bicarbonati e fosfati introdotti con la saliva 1.L’ aumento degli AGV nel rumine attiva i recettori che mediano l’ arresto della motilità reticolo-ruminale attraverso un riflesso vagale. Ne consegue atonia ruminale. 2. l’ aumento degli AGV fa salire il valore della pressione osmotica ruminale con conseguente richiamo di acqua nel rumine. Fa seguito disidratazione, ipovolemia, emoconcentrazione, che conducono al collasso cardiocircolatorio. - il rene viene danneggiato dall’ ipovolemia (necrosi ischemica corticale). - diarrea, in quanto l’ aumento della pressione osmotica comporta un aumento della quantità di liquidi nel contenuto intestinale. Lo stato acidosico non rimane confinato nel rumine ma l’ acido lattico aumenta in circolo anche perché il fegato leso dall’ anossia non è in grado di metabolizzarlo adeguatamente. Il rene non è a sua volta in grado di provvedere ad una sufficiente escrezione del lattato di sodio che si forma nel sangue dalla combinazione di acido lattico con bicarbonato di sodio. La microflora ruminale, composta prevalentemente da Gram–negativi, in poche ore muta in una microflora composta da Gram-positivi (streptococchi, lattobacilli, produttori di acido lattico). Dalla disintegrazione dei Gram-negativi si liberano elevate quantità di endotossine che vengono riassorbite in circolo (endotossiemia/endotossicosi). Il riassorbimento è favorito dalle microlesioni delle papille e dalla ruminite. LESIONI - Dilatazione abnorme dell’addome. - Sangue scuro poco coagulato fuoriuscente dalle aperture naturali. - Emorragie diffuse - Stasi negli organi addominali - Linea di meterorizzazione esofagea - Enfisema polmonare Lesioni ruminali Contenuto liquido poltiglioso con odore di fermentazione PATOLOGIE METABOLICHE E NUTRIZIONALI DEL FEGATO Funzioni: - metabolismo della bilirubina - metabolismo degli acidi biliari - metabolismo dei carboidrati - metabolismo dei lipidi - sintesi delle proteine - funzione immunitaria Il fegato è esposto alle infezioni o all’ azione di qualsiasi sostanza dannosa attraverso tre vie: ematogena, biliare e diretta Esso viene protetto dagli agenti patogeni provenienti dal sangue attraverso le cellule del Kupffer, macrofagi fissi disseminati nel lume dei sinusoidi e posti al di sopra delle cellule endoteliali. Questi ingeriscono attivamente e degradano batteri e altri microrganismi ,cellule senescenti. Sono particolarmente importanti nella rimozione di endotossine dal sangue portale Un aspetto caratteristico del fegato è la sua capacità di rigenerare il tessuto epatico in maniera rapida e efficace. Solo le lesioni che coinvolgono la maggior parte del parenchima epatico son in grado di produrre i segni di una sofferenza funzionale, poiché le lesioni focali non distruggono una quantità di parenchima sufficiente a ridurre significativamente la funzionalità dell’ organo e in grado di annullare la riserva funzionale. INSUFFICIENZA EPATICA Perdita di un’ adeguata funzionalità del fegato come conseguenza di danni acuti e cronici. Essa può manifestarsi con vari disturbi metabolici come: -Tendenza al sanguinamento. Diminuzione della sintesi dei fattori della coagulazione. Inoltre l’ insufficienza epatica può coinvolgere la funzione piastrinica e portare alla sintesi di fibrinogeno anomalo. -- ipoalbuminemia. -- alterazioni vascolari ed emodinamiche. Il danno epatico cronico si accompagna a grave e diffusa fibrosi dell’ organo che determina un aumento delle resistenze al flusso ematico. EPATOSI ACUTA DIETETICA DEL SUINO L’ epatosi dietetica è un’ unità morbosa conosciuta in Scandinavia fin dal 1953. La malattia si può osservare, soprattutto nei mesi di ottobre e novembre, in soggetti cha hanno dalle 3 alle 15 settimane di vita. La mortalità è elevata. Il decorso è in genere breve ed i sintomi possono comparire in qualche giorno anche solo qualche ora prima dell’ exitus. Gli animali presentano debolezza, inappetenza e rimangono di solito raggomitolati nella lettiera. Possono manifestare vomito, diarrea, dispnea e temperatura febbrile. All’ esame anatomopatologico - nella forma acuta, il fegato appare ridotto di volume, flaccido, con la sierosa raggrinzita ed i bordi assottigliati. Al colorito giallo-bruno e giallo-ocra uniforme (atrofia gialla) si sovrappongono piccole macchie rossastre, sporgenti alla superficie esterna, che corrispondono a lobuli ripieni di sangue a causa di ectasie capillari e di emorragie. - nella forma iperacuta, che ha un decorso di poche ore, si hanno alcune caratteristiche distintive. Il fegato esternamente ha un aspetto a mosaico multicolore per la presenza di focolai giallo-opachi, grigio-rossastri, grigio-brunastri, in mezzo a focolai lobulari necrotico-emorragici (atrofia rossa). L’ esame istologico - nella forma acuta, il fegato presenta diffusi fenomeni degenerativi (rigonfiamento torbido, steatosi) e necrotici che interessano un numero limitato di lobuli. - nella forma iperacuta è presente ogni forma di processo regressivo. Attivazione delle cellule del kupffer, infiltrazioni neutro-granulocitarie e linfocitarie, calcificazioni distrofiche, degenerazione fibrinoide di piccole e medie arterie, sono altri aspetti del quadro istologico. Negli animali sopravvissuti si ammette l’ evoluzione delle lesioni epatiche in forme di cirrosi postnecrotica. I reperti extraepatici: - peritonite siero-fibrinosa - processi erosivi ed ulcerativi della mucosa gastrica - enterite catarrale con edema sottomucoso - emorragie subendocardiche e intramuscolari - necrosi cerea del miocardio e dei muscoli scheletrici. L’ alimentazione integrata con acidi grassi insaturi contenuti nell’ olio di fegato di merluzzo e rancido, in carenza di proteine animali e vit. E e/o di selenio è risultata la causa più frequente di malattia. Sperimentalmente si è osservato che per la comparsa delle lesioni epatiche è necessario che la carenza di vit. E e selenio sia combinata con quelli di aminoacidi solforati. Si pensa che la formazione di perossidi dagli acidi grassi, non contrastata dall’ azione antiossidante della vit. E e/o di selenio provochi un danno ai sistemi enzimatici, che sarebbe responsabili di una parte delle lesioni extraepatiche e delle lesioni regressive iniziali del fegato. Successivamente, l’ assorbimento dall’ intestino di prodotti tossici di varia natura, determinerebbe un aggravamento delle lesioni nel fegato, in quanto l’ organo per la carenza aminoacidica e di vit. E non sarebbe in grado di neutralizzare l’ azione dei tossici. Epatosi dietetica. Suino Lesioni necrotico-emorragiche disseminate. Epatosi dietetica. Suino Particolare in sezione : numerosissimi lobuli con necrosi emorragica acuta. Epatosi dietetica. Suino. Necrosi ed emorragie prevalentemente centrolobulari. EE. STEATOSI EPATICA POST-PARTUM chetosi Nella bovina da latte ad alta produzione (BLAP) la steatosi epatica occorre spesso nelle prime settimane dopo il parto, per effetto della lipomobilizzazione conseguente alla montata lattea, ed è totalmente reversibile in 4-8 settimane. Nelle biopsie epatiche l’ infiltrazione lipidica degli epatociti si considera normale se inferiore al 20% del volume epatocitario (circa 50 mg di trigliceridi per gr di fegato fresco), di media gravità se oscilla dal 20% al 40%, grave se supera il 40%. Quando tale epatopatia si configura al massimo della sua gravità rientra nel quadro della chetosi primaria puerperale o sindrome chetosica, con turbe di tipo digestivo o neurologiche, che si può manifestare anche in una forma preclinica con un aumento dei corpi chetonici nel latte, nelle urine, nel sangue. Alla base della patologia metabolica post-partum vi sono: - un bilancio energetico negativo attribuibile all’ inizio della lattazione. - la somministrazione di razioni troppo energetiche rispetto ai fabbisogni nel periodo di asciutta che determinano un eccessivo ingrassamento dell’ animale predisponendolo ad un’ abbondante lipolisi con lipomobilizzazione dopo il parto. - squilibri ormonali derivanti da situazioni stressanti (parto, inizio della montata lattea, cambiamento di gruppo) Si stabilisce una situazione di concorrenza tra l’ intensa lipomobilizzazione dei grassi di deposito, che vengono scissi in glicerolo e NEFA, e l’intensa gliconeogenesi necessaria al fabbisogno di lattosio della mammella. La maggior parte dei NEFA captati dal fegato viene di norma esterificata a TG ed immessa in circolo sotto forma di lipoproteine a bassissima intensità (VLDL). Quando esiste una carente sintesi di apoproteine come l’ apoproteina-100, importante proteina di trasporto dei TG), si formano poche lipoproteine e i TG non possono essere sufficientemente smaltiti dal fegato, che pertanto ne accumula in eccesso. Lo squilibrio ormonale che si vierifica dopo il parto con ridotta sintesi di estradiolo sierico (E2) contribuisce alla steatosi epatica, in quanto l’ E2 influisce sul metabolismo lipidico agendo sulla concentrazione sierica dell’ apoB-100. Nella sindrome chetosica, l’ acetil-CoA, derivante dall’ ossidazione dei NEFA nel fegato, ha una ridotta utilizzazione attraverso il ciclo di Krebs per deficit di ossalacetato, e ciò porta alla formazione di un eccesso di corpi chetonici (acido idrosibutirrico, ac. Acetacetico, acetone) nel sangue (iperchetonemia) e nei tessuti, compresa la pelle che emana odore di acetone. Nella forma digestiva : - la sindrome si può manifestare con atonia ruminale e diarrea, - nella forma nervosa con atassia locomotoria, movimenti di maneggio, incrocio degli arti anteriori, cadute, tendenza a spingere la testa contro il muro, contratture e fibrillazioni della muscolatura degli arti, del collo. La chetosi in forma nervosa va differenziata da altre sindromi neurologiche: -Tetania da ipomagnesemia - ipovitaminosi A - intossicazione da Pb - BSE Oltre alla chetosi primaria puerperale si possono distinguere altri tipi di chetosi: - Chetosi gravidica (7-8 mese di gravidanza), - chetosi secondaria a steatosi epatica, a ritenzione placentare….. - chetosi alimentare (foraggi chetogenetici), - chetosi da malnutrizione (alimenti a scarso contenuto energetico). LIPODISTROFIA EPATICA DEI VITELLI Nel Sud Ovest della Scozia è segnalata nei vitelli una forma grave a sfondo eredofamiliare di epatopatia con encefalopatia epatica. Il fegato presenta steatosi epatocitaria, fibrosi portale e proliferazione biliare. Un’ alimentazione (sostituti del latte o latte artificiale) contenente grassi impropri (ossidati ed iperossidati) può causare nei vitelli steatosi epatica, alopecie, sindromi diarroiche ed emorragiche. MALATTIA DEL FEGATO BIANCO DEGLI OVINI La c.d. malattia del fegato bianco degli ovini (Ovine white liver disease), talvolta anche delle capre, è un prototipo di steatosi epatica da carenza dietetica. Segnalata in Nuova Zelanda, Australia ed Europa, colpisce prevalentemente gli agnelli, i quali mostrano anoressia, dimagrimento, lacrimazione, alopecia, dermatiti da fotosensibilizzazione. Si manifesta per carenza di Cobalto nel terreno su cui pascolano. I vegetali poveri di cobalto causano un carenza di vitmanina B 12. La steatosi è effetto sia della ridotta sintesiescrezione di lipoproteine dal fegato per deficit di vit B 12, sia dell’ aumentato apporto di propionati dalla vegetazione lussureggiante dei pascoli. Dal punto di vista ultrastrutturale sono evidenti le alterazioni dei mitocondri e del reticolo endoplasmatico. Il fegato aumento di volume, pallido giallastro, mostra istologicamente steatosi, accentuata nelle zone periacinose, presenza di lipopigmenti negli epatociti, nelle cellule del Kupffer e nei macrofagi dello stroma, modesta proliferazione dei dotti biliari, sparse infiltrazioni di mononucleati. STEATOSI EPATICA DEL SUINO La steatosi epatica si riscontra nel suino lasciati a digiuno per oltre 46 ore dalla macellazione. Inoltre il digiuno abbinato allo strapazzo determina contemporaneamente steatosi epatica, riduzione del glicogeno epatico e comparsa delle carni DFD (dry, firm, dark). In suinetti di poche giorni si segnala una sindrome carenziale (deficit di aminoacidi essenziali, fattori lipotropi), caratterizzata da steatosi epatica, morte a due settimane di vita (fatty liver syndrome). Alcuni animali mostrano anche steatosi renale e miocardica EPATOTOSSICOSI ACUTE IL RAME ha un effetto tossico selettivo sul fegato che deriva dalla stimolazione della perossidazione lipidica mitocondriale, dalla riduzione della sintesi proteica, dalla riduzione della sintesi ed escrezione di lipoproteine con conseguente steatosi, dall’ aumento della fragilità dei lisosomi con versamento di enzimi nel citosol e necrosi cellulare. Svolge inoltre un effetto, diretto o indiretto (tramite la necrosi cellulare), di stimolazione della fibrillogenesi. Nell’ avvelenamento acuto da rame dei ruminanti è in causa l’ingestione accidentale in una sola volta di una dose elevata di sali di rame solubili (ad esempio contaminazione di piante con spray fungicidi contenenti rame, iniezioni di dosi troppe elevate di composti contenenti rame usati per prevenire carenze nei ruminanti, ingestione di acqua di un contenente solfato di rame). La dose tossica per una pecora è di 20-110 mg/Kg. L’ avvelenamento da rame segnalato anche in pecore su pascoli con normale contenuto di rame, ma con basso contenuto di molibdeno. Il rame (Cu) è il terzo più abbondante elemento traccia nell’ organismo, insieme al ferro e allo zinco, ed ha una parte importante nel metabolismo dei tessuti come componente di numerosi metalloenzimi. Ma come tutti i metalli pesanti può essere tossico. La più elevata concentrazione di Cu è nel fegato, seguita dal cervello, dai reni, dal cuore. Il fegato ha una funzione importante nel regolare il tasso organico del rame in quanto l’ eccesso di rame viene escreto con la bile. Il fegato è l’ organo d’ elezione per l’ immagazzinamento ed è anche sede delle principali reazioni metaboliche e cataboliche del metallo. A livello dell’ epatocita il rame viene infatti legato da ligandi specifici a basso peso molecolare ed è impiegato per le richieste metaboliche delle cellula, in particolare per la sintesi di alcuni enzimi (ossidasi, dismutasi). Un altro fattore che contribuisce all’ omeostasi è la secrezione nel plasma della ceruloplasmina, una proteina di colore blu contenente Cu sintetizzata nel fegato. La tossicità del rame - PRIMARIA quando risulta da un difetto ereditario, - SECONDARIA, quando è la diretta conseguenza di un assunzione o di una assorbimento elevato, o di una escrezione diminuita, causata da patologie intercorrenti. L’ accumulo di Cu è gravemente tossico e conduce a modificazioni del metabolismo che spiegano i loro effetti dannosi in maniera differente a seconda della specie e della razza dell’ animale. L’ intossicazione cronica di rame (cuprismo) si manifesta nei ruminanti, soprattutto nelle pecore, talvolta nei suini. Il fegato della pecora ha una particolare avidità di rame ed una relativa incapacità di eliminarlo con la bile. Nelle pecore occorrono intossicazioni di rame secondarie all’ ingestione di piante (Senecio, Echium) contenenti alcaloidi epatotossici, o di piante (Lupinus) contaminate da funghi produttori di micotossine che accelerano gli effetti della ritenzione epatica cronica di Cu, oppure di piante che provocano uno squilibrio minerale inducendo una forte ritenzione di Cu. Se una razione ricca di proteine, di zinco, di ferro hanno un’ azione protettiva, invece una dieta povera di molibdeno e zolfo favorisce la comparsa dell’ intossicazione. Nelle cellule il Cu viene immagazzinato nei lisosomi, che aumentano di numero di dimensioni e di densità. L’ accumulo del rame si realizza inizialmente nella zona 3 e poi si estende alle zone 2 ed 1 dell’ acino. Il rame, oltre una determinata concentrazione epatica (800-900 ppm di sosotanza secca), determina la lisi perossidativa delle membrane dei lisosomi, cosicchè la liberazione delle idrolasi lisosomiali e del Cu danneggia gravemente gli epatociti. L’ aumento delle mitosi controbilancia entro certi limiti l’ aumento degli epatociti distrutti. Tuttavia la distruzione di queste cellule aumenta il tasso plasmatico di rame fino al punto di causare un’ emolisi intravascolare, che a sua volta creando condizione ipossiemiche favorisce la necrosi degli epatociti. All’ esame necroscopico: - colorazione itterica della carcassa, con sfumatura rossiccia (emoglobina libera) o bruna ( emoglobina ossidata). - reni sono di colore cioccolato, rosso-bruno scuro (nefrosi emoglobinurica), l’ urina nella vescica ha un colore bruno scuro. - fegato lievemente ingrossato e di consistenza molle, colorito giallastro, talvolta arancio intenso. Il quadro istologico: - necrosi e dalla ritenzione biliare conseguente all’ emolisi; - macrofagi farciti di granuli (lisosomi contenenti un eccesso di lipofuscina e rame). Nei bovini si rivelano quadri istologici analoghi, ma attenuati, mentre appaiono aspetti di fibrocolangiomatosi portale. Nei suini, il Cu viene comunemente impiegato nelle razione da ingrasso come solfato di rame (50-175 ppm) il metabolismo del reme del ferro e dello zinco sono correlati, ed elevati tassi di Zn e/o di Fe riducono il Cu nel fegato. L’intossicazione si ha con 500 ppm o più nella razione e a distanza di mesi. Si manifesta con sete, ittero, emoglobinuria cachessia, talvolta morte improvvisa senza sintomi premonitori. Alla necroscopia: - anemia, - ittero, - gastrorragia per ulcera gastroesofagea, - focolai grigiastri centrolobulari nel fegato. L’ esame istologico del fegato: - necrosi e steatosi in prevalenza centrolobulare.
Scaricare