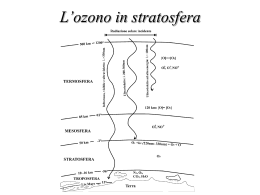
DISPERSIONE, RIMOZIONE Dispersione: da fenomeni di diffusione turbolenta di trasporto delle masse d’aria. Rimozione: è deposizione. determinata dai vari processi di Dispersione e rimozione processi meteorologici che regolano il comportamento delle masse d’aria nella troposfera. Microinquinanti organici in fase gassosa Il ciclo vitale delle sostanze troposfera è determinato: chimiche nella • dalla distribuzione territoriale • dall’intensità emissiva delle sorgenti primarie, • dai processi di veicolazione attraverso i venti, e delle acque superficiali e sotterranee, • dall’intervento dell’uomo • dai meccanismi di conversione chimica e rimozione. … Microinquinanti organici in fase gassosa… •il radicale ossidrile (OH.) • la sorgente primaria: il processo di fotolisi dell’ozono troposferico • altre importanti specie ossidanti • radicale ossidrile • all’ozono • l’ossigeno atomico (O), • il radicale idroperossile (HO2) • il radicale nitrato (NO3). … Microinquinanti organici in fase gassosa… Le possibili vie di rimozione atmosferica: • la fotolisi diretta • la reazione con ozono • l’attacco diurno da parte del radicale OH • quello notturno da parte del radicale nitrato. Chimica della Stratosfera Lo strato di ozono è una regione dell’atmosfera che rappresenta il naturale schermo della terra alle radiazioni solari essendo in grado di filtrare le radiazioni UV. La quantità totale di ozono che ci sovrasta in qualsiasi punto dell’atmosfera è espressa in unità Dobson (DU). Una unità Dobson (DU) equivale ad uno strato di ozono puro dello spessore di 0.01 mm alla densità che questo gas possiede pressione esistente all’altezza del suolo (1 atm). I processi chimici alla base della diminuzione dello strato di ozono e di altri processi che si verificano nella stratosfera sono alimentati dall’energia contenuta nella luce solare. Assorbimento della luce Attivazione delle molecole Reattività chimica Le sostanze differiscono moltissimo fra loro per la propensione ad assorbire luce di una data lunghezza d’onda differenze dei livelli energetici degli elettroni. Lunghezza d’onda (nm) <50 Intervallo principale Raggi X Lunghezza d’onda (nm) Subintervallo 50 200 Ultavioletto 280 320 400 400 UV-C UV-B UV-A Violetto Visibile Rosso 750 750 4000 Radiazioni IR termiche Infrarosso 10000 Spettro di assorbimento Rappresentazione grafica della frazione di luce che può essere assorbita da una data molecola. O2 125-175 nm O3 220-320 nm PRINCIPI DI FOTOCHIMICA … L’energia E di un fotone è in relazione con la frequenza e la lunghezza d’onda della luce: E = h E = hc/ h = costante di Planck = 6,626x10-34 J s c = velocità della luce nel vuoto = 2,998x108 ms-1 PRINCIPI DI FOTOCHIMICA … nm kJ/moli 220 544 290 413 320 374 400 299 750 160 Energie dei fotoni della luce di differenti lunghezze d’onda. PRINCIPI DI FOTOCHIMICA … Nel caso della luce UV-Vis, le energie fotoniche sono dello stesso ordine di grandezza dell’entalpia della reazioni chimiche comprese quelle che dissociano atomi dalle molecole. Una reazione innescata da un imput di energia sotto forma di energia luminosa viene detta reazione fotochimica PRINCIPI DI FOTOCHIMICA … Molecole che assorbono luce in genere non trattengono molto a lungo l’eccesso di energia. In una piccola frazione di secondo le molecole * devono utilizzare l’energia acquisita per reagire fotochimicamente * dissiparla come energia termica per collisione con le molecole vicine * aumentare la loro energia cinetica. FORMAZIONE E DISTRUZIONE NON CATALITICA DELL’OZONO La reazione di formazione dell’ozono nella stratosfera genera calore sufficiente per influenzare la temperatura in questa regione dell’atmosfera. Al disopra della stratosfera l’aria è assai sottile La concentrazione delle molecole di O2è così bassa che gran parte dell’O2, esiste in forma atomica O in seguito a fotodissociazione di molecole di O2 O2 + h (200-280 nm) 2 O Gli atomi di ossigeno formati finiscono per collidere e riformare O2 2 O O2 che va ancora incontro a fotodissociazione. Nella stratosfera L’intensità della luce UV-C è assai minore: gran parte di essa è filtrata da parte dell’O2 sovrastante. L’aria è più densa con maggiore concentrazione di O 2. Gran parte dell’ossigeno stratosferico: è in forma di O2 piuttosto che di ossigeno atomico. O + O2 O3 + calore Fonte di tutto l’ozono presente nella stratosfera Nella parte inferiore della stratosfera La concentrazione di O2 è maggiore che nella parte superiore. La radiazione UV sono filtrate prima: è poca la quantità di ossigeno dissociata e poca la quantità di O3 formata. La densità dell’O3 raggiunge il massimo dove è più alto è il prodotto tra l’intensità della radiazione UV-C e la concentrazione di O2. Gran parte dell’O3 è localizzato tra 15 e 35 Km di altezza cioè si situa nella parte inferiore e intermedia della stratosfera, regione nota come strato di ozono. Il massimo di densità dell’ozono si trova: a circa 25 Km di altezza al disopra delle aree tropicali, a 21 km di altezza alle latitudini intermedie, a 18 Km a livello delle regioni subartiche. Per dissipare l’energia termica generata nelle collisioni tra ossigeno atomico (O) e quello molecolare (O2) che producono O3 è necessaria una terza molecola M (quale l’N2): O + O2 + M O3 + M + calore Tale liberazione di calore è la causa della maggiore temperatura della stratosfera rispetto a quella dell’aria sovrastante e sottostante. La stratosfera è quindi definita come la regione dell’atmosfera compresa tra questi due confini di temperatura in cui si ha un’inversione termica. Nella stratosfera l’aria è stratificata perché il mescolamento verticale è lento per il fatto che l’aria fredda con maggiore densità non sale spontaneamente per effetto della forza di gravità. La distruzione dell’O3 ad opera della radiazione UV di lunghezza d’onda minore di 320 nm: O3 + h ( < 320nm) O2 + O* L’atomo O* si trova in uno stato eccitato a più alta energia e, se non reagisce con altri atomi tale energia viene persa. Le reazioni possibili di O* O* + O2 O3 O* + O3 2 O2 reazione molto lenta RIASSUMENDO… L’O3 della stratosfera viene continuamente formato, decomposto e riformato durante le ore diurne. Viene prodotto in virtù della presenza delle radiazioni UV-C (200-280 nm) viene provvisoriamente distrutto: quando filtra gli UV-B e UV-C: quando reagisce con atomi di ossigeno …RIASSUMENDO L’O3 non si forma al di sotto della stratosfera per la mancanza degli UV-C al di sopra dove predominano atomi di ossigeno che si ricombinano a formare O2 . … quindi … stratosfera troposfera Distruzione dello strato di ozono L’equilibrio fotochimico relativo alla produzionedistruzione dell’ozono stratosferico è soggetto ad oscillazioni naturali legate all’attività della parte più esterna del sole , al flusso di radiazione solare che raggiunge la stratosfera, Chimica dell'ambiente REACH & CLP Distruzione dello strato di ozono Oltre al fenomeno naturale dovuto all’assorbimento delle radiazioni solari avviene attraverso un ciclo catalitico …. Chimica dell'ambiente REACH & CLP ALTRI MECCANISMI ALLA BASE DELLA DISTRUZIONE DELL’OZONO: PROCESSI CATALITICI Esistono alcune specie atomiche e molecolari di tipo X (catalizzatori) che reagiscono efficacemente con O3 sottraendo un atomo di ossigeno. X + O3 XO +O2 XO + O X +O2 ________________ O3 + O 2O2 Chimica dell'ambiente REACH & CLP Chimicamente, tutti i catalizzatori di tipo X sono radicali liberi cioè atomi o molecole contenenti un numero dispari di elettroni. La distruzione catalitica di ozono si manifesta anche in atmosfera non inquinata poiché tali catalizzatori sono sempre presenti nell’atmosfera. La specie chimica responsabile della maggior parte della distruzione dell’ozono in un’atmosfera non inquinata è la molecola dell’ossido di azoto NO·. Chimica dell'ambiente REACH & CLP OH· OH· catalizzatore tipo X che svolge un ruolo fondamentale alla distruzione dell’O3 a quote superiori. E’ prodotto dalla reazione di atomi di ossigeno eccitati con molecole di acqua o metano: O* + CH4 OH· + CH3 O* + H2O 2 OH· Chimica dell'ambiente REACH & CLP L’ossido di azoto NO· NO· catalizzatore tipo X più importante nella parte centrale della stratosfera. E’ prodotto quando l’ossido nitroso N2O che sale dalla troposfera alla stratosfera reagisce con atomi di ossigeno eccitati prodotti dalla decomposizione fotochimica dell’O3: O* + N2O 2 NO· NO· + O3 NO2 · + O2 NO2 · + O NO· + O2 _______________________________________ _______ O3 + O 2O2 Chimica dell'ambiente REACH & CLP La decomposizione fotochimica dell’O3 da parte degli UV-B o dei catalizzatori di tipo X dipende • dalla concentrazione dell’ozono • dall’intensità della radiazione solare • o dalla concentrazione del catalizzatore. Chimica dell'ambiente REACH & CLP a parità di luce solare, la concentrazione O3 aumenta fino a che la velocità di distruzione eguaglia quella di formazione: condizioni di STATO STAZIONARIO. Chimica dell'ambiente REACH & CLP CLORO E BROMO ATOMICI COME CATALIZZATORI DI TIPO X La decomposizione, nella stratosfera dei gas contenenti cloro, genera un continuo rifornimento di cloro con conseguente aumento del potenziale di distruzione dell’ozono in questa regione. Chimica dell'ambiente REACH & CLP CLORO E BROMO ATOMICI COME CATALIZZATORI DI TIPO X Le molecole di CH3Cl nella stratosfera: o decomposte dagli UV-C o attaccate dai radicali OH·, per produrre in entrambi i casi cloro atomico Cl· CH3Cl + h (UV-C) Cl· + CH3· OH· + CH3Cl Cl· + altri prodotti Chimica dell'ambiente REACH & CLP Gli atomi di cloro atomico Cl· Sono efficienti catalizzatori di tipo X nella distruzione dell’ozono: Cl· + O3 ClO· + O2 ClO· + O Cl· + O2 ____________________ O3 + O 2 O2 Chimica dell'ambiente REACH & CLP … … in ogni momento, tuttavia, il cloro presente (circa 99%) nella stratosfera si trova: • ClONO2 (gas cloronitrato): ClO· + NO2 · ClONO2 ClONO2 + h (pochi giorni o ore) ClO· + NO2· • HCl Cl· + CH4 HCl + CH3· OH· + HCl H2O+ Cl· forme attive Chimica dell'ambiente REACH & CLP In natura vengono prodotte anche rilevanti quantità di metilbromuro CH3Br. Una parte di CH3Br può finire per raggiungere la stratosfera e decomporre fotochimicamente liberando bromo atomico Br . CH3Br + h (UV-C) Br· + CH3 · Br· + O3 BrO · + O2 Br· forma attiva Chimica dell'ambiente REACH & CLP Quasi tutto il bromo presente nella stratosfera rimane nella forma attiva!!! • perché la reazione di formazione della forma inattiva HBr da bromo atomico Br· e il metano CH4 è molto lenta (endotermica) • perché HBr è decomposto fotochimicamente. Chimica dell'ambiente REACH & CLP In un confronto tra atomi Il bromo nella stratosfera è più efficiente del cloro nel distruggere l’ozono ma la sua concentrazione è nettamente minore!!! Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Ogni anno l'ozono della stratosfera al di sopra dell'Antartide si riduce fino al 50% per alcuni mesi soprattutto per azione del cloro: – si forma un buco nello strato dell'ozono(dal 1979 ). • può verificarsi da settembre all'inizio di novembre, i mesi che, al Polo sud, corrispondono alla primavera. • le intense ricerche condotte alla fine degli anni '80 hanno permesso di chiarire la chimica di questo fenomeno. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Il buco dell'ozono compare come effetto di particolari condizioni climatiche invernali nella bassa stratosfera, – là dove di solito è maggiore la concentrazione dell'ozono; • queste condizioni trasformano temporaneamente tutto il cloro presente nelle forme cataliticamente inattive HCl e CIONO2, – nelle forme attive Cl. e CIO. con provvisorio aumento delle specie chimiche attive – con un'estesa, seppure temporanea, diminuzione dell'ozono. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • La conversione delle forme inattive del cloro in quelle attive avviene alla superficie di cristalli: – formati da una soluzione di acqua e acido nitrico: da OH. e NO2. gassosi. • la condensazione di questi gas in goccioline liquide o in cristalli solidi di solito non si verifica nella stratosfera, dove la concentrazione dell'acqua è considerevolmente ridotta. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Durante la notte polare – Il consueto meccanismo di riscaldamento della stratosfera dovuto alla liberazione di calore nella reazione tra O2 e O – viene a mancare in conseguenza della mancata produzione di ossigeno atomico dall'O2. • Poiché la stratosfera al di sopra del Polo Sud diviene così fredda durante la notte polare della parte centrale dell'inverno, – la pressione atmosferica cala nettamente come previsto dalla legge dei gas ideali, secondo cui essa è proporzionale alla temperatura espressa in gradi Kelvin. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • L’ effetto sulla pressione, • la rotazione terrestre, • producono un vortice: – una massa di aria che ruota su sé stessa e in cui i venti possono superare la velocità di 300 km l'ora. • Poiché in questo vortice non può entrare materia, – l'aria contenuta al suo interno viene ad essere isolata e rimane molto fredda per mesi. • Al Polo sud, il vortice si mantiene nella primavera (ottobre). • Il vortice attorno al Polo nord di solito si interrompe a febbraio o all'inizio di marzo prima che in questa zona torni la massima luce solare. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • I cristalli prodotti dalla condensazione dei gas all'interno del vortice: – formano le nubi polari stratosferiche, o PSC (polar stratospheric clouds). • Quando la temperatura scende: – i primi cristalli che si formano sono quelli del triidrato dell'acido nitrico, HNO3 x 3H2O. • Quando la temperatura dell'aria scende di poco sotto i - 80°C: – si forma anche un altro tipo di cristalli, in cui il rapporto acqua/acido nitrico e le dimensioni sono maggiori. Chimica dell'ambiente REACH & CLP I buchi dell’ozono Schema illustrante la produzione di cloro molecolare dalle forme inattive, nella stratosfera, durante la primavera antartica. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Durante i bui mesi invernali – il cloro elementare si accumula diventando la specie chimica gassosa contenente cloro più abbondante. • Quando ricompare il primo sole, all'inizio della primavera antartica, – le molecole di Cl2 vengono decomposte in doro atomico ad opera della componente UV della luce: Cl2 + luce UV → 2 Cl. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Allo stesso modo, la reazione di altre molecole di ClONO2 con l'acqua contenuta nel tipo di cristalli di dimensioni maggiori produce HOCI – che, per effetto della luce solare, si decompone in Cl.. e OH.: H2O (s)+ ClONO2 (g) → HOCl (g)+ HNO3(s) HOCl + luce UV → OH. + Cl. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • i cristalli permangono mesi. • gli atomi di cloro trasformati in HCl per reazione con molecole di metano vengono – riconvertiti in Cl2 sui cristalli – in Cl. ad opera della luce solare. • l'inattivazione del monossido di cloro per trasformazione in cloronitrato – non si verifica fintantoché tutti i radicali NO., necessari per questa reazione non sono stati provvisoriamente legati ai cristalli in forma di acido nitrico. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Molti dei cristalli di tipo più grande si spostano verso il basso, – diretti nella parte superiore della troposfera, per effetto della gravità; • durante questo spostamento, essi raccolgono i radicali NO2. presenti nella parte inferiore della stratosfera al di sopra del Polo sud – impedendo ulteriormente la disattivazione del cloro. • Solo quando le PSC e il vortice si sono estinti – il cloro può tornare prevalentemente nella forma inattiva. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • La liberazione di acido nitrico dai cristalli nella fase gassosa causa la trasformazione di questo acido in NO2 . per azione della luce solare: HNO3 + luce UV → NO2. + OH. • Inoltre quando, nella tarda primavera, il vortice si estingue, – l'aria contenente NO2 . si mescola con quella polare. – Il biossido di azoto si combina rapidamente con il monossido di cloro a formare il cloronitrato, cataliticamente inattivo. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Poche settimane dopo che le PSC e il vortice sono scomparsi, – i cicli di distruzione catalitica si arrestano e la concentrazione dell'ozono sale nuovamente fino ai normali livelli. • L'effetto di tutto questo è che il buco dell'ozono si chiude per un altro anno. – Prima che tutto questo accada, una parte della massa di aria povera di ozono può spostarsi dall'Antartide mescolandosi con l'aria limitrofa, – causando una temporanea diminuzione della concentrazione di ozono nella stratosfera in regioni geografiche vicine, quali l'Australia, la Nuova Zelanda e le regioni più meridionali del Sud America. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Il meccanismo chimico attraverso cui il cloro atomico catalizza la decomposizione dell'ozono negli strati inferiori della stratosfera sopra il Polo Sud – inizia con la consueta reazione tra cloro e ozono: • Tappa 1: Chimica dell'ambiente Cl. + O3 → ClO. + O2 REACH & CLP I buchi dell’ozono Concentrazione di ozono in funzione della latitudine in prossimità del polo Sud. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • A distanze sufficientemente grandi dal Polo sud (900 S), la concentrazione dell'ozono è relativamente elevata e quella del CIO. bassa, – poiché il cloro si trova legato soprattutto nelle forme inattive. • Avvicinandosi al Polo, – la concentrazione di CIO. diviene improvvisamente alta • si registra una netta riduzione di quella dell'O3: – gran parte del doro è stato attivato mentre la maggior parte dell'ozono è stato conseguentemente decomposto. • La latitudine a cui cambiano nettamente entrambe le concentrazioni segna il confine del buco dell'ozono, che si estende attraverso il Polo sud. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Nella parte inferiore della stratosfera – la regione in cui si formano le PSC e le specie attivate del doro • la concentrazione degli atomi liberi di ossigeno è modesta; – pochi atomi vengono prodotti in tale regione in conseguenza della scarsità delle radiazioni UV-C necessarie per dissociare l'O2 • gli atomi di ossigeno prodotti in questo modo collidono immediatamente con molecole di O2 presenti in gran quantità, formando O3. • i meccanismi della distruzione dell'ozono basati sulla reazione O 3 + O 2 O2 non appaiono importanti anche quando la reazione è catalizzata. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • le molecole di ClO. invece di reagire con l'ossigeno atomico: – si combinano tra loro per formare dicloroperossido, ClOOCl (o Cl2O2): Tappa 2: 2ClO. → ClOOCl • La velocità di questa reazione diviene importante ai fini della perdita dell'ozono poiché la concentrazione del monossido di cloro aumenta gradualmente in conseguenza dell'attivazione del doro. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Durante la primavera antartica, l'intensità della luce solare aumenta fino a raggiungere un'intensità apprezzabile, – le molecole del dicloroperossido, ClOOCl assorbono le radiazioni UV liberando un atomo di cloro. • Il radicale ClOO. risultante, instabile, – si decompone (in una reazione che ha un tempo di dimezzamento di un giorno) liberando l'altro atomo di doro: • Tappa 3: ClOOCl + luce UV → ClOO. + Cl. • Tappa 4: ClOO. → O2 + Cl. Chimica dell'ambiente REACH & CLP I buchi dell’ozono •Sommando tra loro le tappe 2, 3 e 4: •Tappa 2: •Tappa 3: •Tappa 4: 2ClO. → ClOOCl ClOOCl + luce UV → ClOO. + Cl. ClOO. → O2 + Cl. 2 ClO. → …UV… → 2 Cl. + O2 Così, attraverso queste reazioni, le molecole di CIO. tornano nella forma di Cl. capace di distruggere l'ozono anche senza l'intervento dell'ossigeno atomico. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • che, sommata con la tappa 1: 2 O3 → 3 O2 Quindi, un ciclo completo di distruzione catalitica dell'ozono: * può verificarsi nella parte inferiore della stratosfera * in presenza di condizioni meteorologiche particolari, cioè di un vortice. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Circa i tre quarti della distruzione dell'ozono responsabile della formazione del buco dell'ozono sull'Antartide – si verifica attraverso il meccanismo consistente nella sequenza delle tappe da 1 a 4. • La tappa più lenta del processo è quella numero 2: • Tappa 2: 2ClO. → ClOOCl • Questa reazione segue una cinetica del secondo ordine in ClO. e procede quindi con una cinetica apprezzabile • la velocità di distruzione dell’ozono diviene significativa solo quando la concentrazione di ClO. è elevata. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • La formazione del buco dell’ozono è dovuta anche ad una via di distruzione di questo elemento di minore importanza – che implica la partecipazione del bromo. • Nella prima tappa di questo meccanismo vengono distrutte due molecole di ozono, – una ad opera di un atomo di cloro e l’altra ad opera di un atomo di bromo. – le molecole ClO. e BrO. prodotte in queste reazioni collidono quindi tra loro ridisponendo i loro atomi in modo da generare O2 insieme a cloro e bromo atomici. • Anche in questo caso la reazione netta mostra la trasformazione di due molecole di ozono in tre molecole di ossigeno, senza che alla reazione partecipi ossigeno atomico. Chimica dell'ambiente REACH & CLP I buchi dell’ozono • Riassumendo: • Ogni mese di settembre, a causa degli effetti combinati della sequenza di reazioni catalizzate principale e secondaria, • si registra una velocità di distruzione dell’ozono nella parte inferiore della stratosfera al di sopra dell’Antartide pari a circa il 2% al giorno. • In conseguenza di questo, all’inizio di ottobre è scomparso quasi tutto l’ozono presente a quote comprese tra 15 e 20 Km, – le regioni in cui normalmente esso è presente in concentrazione maggiore sopra al Polo. Chimica dell'ambiente REACH & CLP I buchi dell’ozono L'evoluzione nel tempo della chimica del cloro nella stratosfera al di sopra dell'artico durante l'inverno e la primavera. Chimica dell'ambiente REACH & CLP I buchi dell’ozono Riassunto schematico del ciclo di reazioni di decomposizione dell'ozono cui partecipa il cloro. Chimica dell'ambiente REACH & CLP Il ruolo degli agenti chimici nella distruzione dell’ozono • Il continuo e graduale impoverimento dell’ozono della stratosfera – può essere senz’altro essere ricondotto alla presenza in atmosfera di un gran numero di composti chimici in grado di attaccare l’ozono. • Queste sostanze vengono anche definite ODS: – Ozone Depleting Substances (sostanze che distruggono l’ozono). – sono generalmente molto stabili nella troposfera e si degradano solamente per l’intensa azione della luce ultravioletta nella stratosfera; – quando si spezzano, rilasciano atomi di cloro e di bromo che danneggiano l’ozono. Chimica dell'ambiente REACH & CLP Il ruolo degli agenti chimici nella distruzione dell’ozono • Il continuo e graduale impoverimento dell’ozono della stratosfera – può essere senz’altro essere ricondotto alla presenza in atmosfera di un gran numero di composti chimici in grado di attaccare l’ozono. • Queste sostanze vengono anche definite ODS: – Ozone Depleting Substances (sostanze che distruggono l’ozono). – sono generalmente molto stabili nella troposfera e si degradano solamente per l’intensa azione della luce ultravioletta nella stratosfera; – quando si spezzano, rilasciano atomi di cloro e di bromo che danneggiano l’ozono. Chimica dell'ambiente REACH & CLP I Clorofluorocarburi CFC Le sostanze più implicate nel fenomeno del buco dell’ozono e più in generale nella riduzione dell’ozono stratosferico. I CFC sono la causa principale del recente aumento di cloro nella stratosfera. Tali composti contengono esclusivamente cloro, fluoro e carbonio. Questi composti sono comunemente utilizzati come refrigeranti, solventi ed agenti propellenti. I più comuni CFC sono i CFC-11, CFC-12, CFC-113, CFC-114 e il CFC115. Il potenziale di danno all’ozono (ODP) per ognuno dei CFC è: 1; 1; 0,8; 1 e 0,6. Chimica dell'ambiente REACH & CLP I CLOROFLUOROCARBURI I nomi: CFC 11 90 + 11 = C 101 H F Il numero di atomi di cloro è dedotto per differenza tenuto conto della valenza del carbonio. Chimica dell'ambiente REACH & CLP CFC-11 CFC-12 CFC-113 CFC forti (non contengono idrogeno) Sono forti in quanto per essi non esiste alcun pozzo nella troposfera cioè non è noto alcun processo naturale di rimozione come ad esempio la dissoluzione nelle gocce di pioggia. Chimica dell'ambiente REACH & CLP Dopo pochi anni i CFC finiscono per salire nella stratosfera e, nel giro di decenni (moto verticale molto lento), nella parte superiore, dove subiscono decomposizione fotochimica ad opera delle radiazioni UV-C della luce solare con liberazione di atomi di cloro Chimica dell'ambiente REACH & CLP CF2Cl2 + h (UV-C) CF2Cl · + Cl· Devono quindi salire fino alla parte centrale della stratosfera prima di decomporsi: gli UV-C penetrano scarsamente a quote inferiori. Chimica dell'ambiente REACH & CLP Il CFC-11 decompone fotochimicamente a quote più basse del CFC-12 ed è quindi responsabile della distruzione dell’ozono alle quote inferiori laddove la concentrazione di ozono è maggiore. Attualmente i CFC-11 e 12 sono i maggiori responsabili della distruzione di ozono ad opera dei CFC. Chimica dell'ambiente REACH & CLP Il tetracloruro di carbonio CCl4 è utilizzato come solvente (in passato nel lavaggio a secco) come intermedio nella produzione di CFC-11 e 12, durante la quale si perde nell’atmosfera. Anche per il CCl4 non esiste pozzo nella troposfera ma viene decomposto fotochimicamente nella stratosfera è responsabile della deplezione dell’ozono da cloro. Chimica dell'ambiente REACH & CLP Il metil-cloroformio CH3CCl3 è prodotto in grande quantità e viene utilizzato nella pulitura dei metalli: una grande quantità finisce nell’atmosfera: una parte di esso è allontanato dalla troposfera per reazione con i radicali OH· la quota residua è sufficiente a partecipare in modo significativo alla deplezione dell’ozono dopo essere migrata nella stratosfera. Chimica dell'ambiente REACH & CLP I CFC forti e il CCl4 non hanno quindi sistemi di smaltimento nella troposfera: non solubili in H2O non vengono allontanati dall’aria con la pioggia non sono attaccati dai radicali OH· né da altri composti gassosi presenti nell’atmosfera, né vengono quindi decomposti fotochimicamente dalla luce UV-VIS. Chimica dell'ambiente REACH & CLP I possibili sostituti dei CFC contengono tutti atomi di H legati ad atomi di carbonio. La maggior parte delle molecole di questi possono così essere allontanate dalla troposfera: per reazione con i radicali OH· attraverso una sequenza di reazioni che inizia con sottrazione di H ad opera OH·. Chimica dell'ambiente REACH & CLP la di Composti contenenti bromo: Halon • I gas Halon: Bromofluorocarburi, – sono composti costituiti da bromo, fluoro e carbonio. – sono utilizzati come agenti estinguenti del fuoco sia in sistemi fissi che in estintori portatili. – causano la riduzione della fascia di ozono • Il potenziale di eliminazione dell’ozono del halon 1301 e del 1211 sono rispettivamente 13 e 4. • Dato che nella troposfera non esistono sistemi di smaltimento di questi composti, – essi finiscono per raggiungere la stratosfera, ove vengono decomposti fotochimicamente rilasciando bromo (e cIoro) atomico Chimica dell'ambiente REACH & CLP Composti contenenti bromo: Halon • Anche altre sostanze degradazione dell’ozono: sono implicate nella • il metilcloroformio ed il tetracloruro di carbonio (comuni solventi industriali) ed in definitiva tutti quei composti volatili che comprendono nella loro struttura atomi di cloro o bromo. • In natura vengono prodotte anche rilevanti quantità di metilbromuro, CH3Br. – Il metilbromuro viene usato commercialmente come fumigante del suolo per eliminare i parassiti. e per tale motivo la sua liberazione nell’atmosfera è in aumento. • Tutte queste molecole finiscono per raggiungere la stratosfera, dove vengono foto dissociate liberando bromo atomico, in grado di distruggere l’ozono. Chimica dell'ambiente REACH & CLP ALTRI PROCESSI CHIMICI NELLA PARTE INFERIORE DELLA STRATOSFERA (15-25 Km) La concentrazione degli atomi di ossigeno O è modesta i meccanismi di distruzione dell’O3 basati sulla reazione O3 + O 2O2 anche in presenza di catalizzatori, non sono significativi. Gran parte della perdita di O3 in questa regione si verifica attraverso la reazione complessiva: 2O3 3O2 Chimica dell'ambiente REACH & CLP Il medesimo processo complessivo è catalizzato dai radicali OH· e HOO· ognuno dei quali reagisce con l’ozono in una sequenza a due stadi: OH· + O3 HOO· + O2 HOO· + O3 OH· + 2O2 _____________________ 2O3 3O2 Il radicale HOO· può però reagire reversibilmente con l’NO2 · per produrre una molecola di HOONO2: HOO· + NO2 · HOONO2 Chimica dell'ambiente REACH & CLP Al contrario, nella parte centrale e superiore della stratosfera NO· riduce la concentrazione dell’ozono: poiché reagisce a tale livello con l’ossigeno come una specie chimica di tipo X per completare il meccanismo di distruzione catalitico a due stadi. Chimica dell'ambiente REACH & CLP In ogni momento gran parte degli ossidi di azoto presenti nella stratosfera si trovano in forma inattiva come HNO3 in conseguenza della reazione: OH· + NO2 · HNO3 L’HNO3 nelle fotochimica ore diurne subisce decomposizione che inverte questa reazione e produce specie chimiche cataliticamente attive nella distruzione dell’ozono. Chimica dell'ambiente REACH & CLP Alla diminuzione di O3 può contribuire un meccanismo indiretto che implica la partecipazione delle goccioline di H2SO4 e deriva da una velocità di denitrificazione dell’aria stratosferica insolitamente elevata. Chimica dell'ambiente REACH & CLP L’ozono trasforma parte del biossido di azoto NO2· in triossido NO3· che insieme formano il pentossido di diazoto N2O5 : NO2· + O3 NO3· + O2 Processo reversibile NO2· + NO3· N2O5 In presenza di goccioline liquide di H2SO4 nella stratosfera si verifica una conversione ad HNO3 : N2O5 + H2O 2HNO3 Chimica dell'ambiente In goccioline di H2SO4 da SO2 immesso dai vulcani nella stratosfera dopo ossidazione. REACH & CLP Con questo meccanismo, gran parte di NO2·, normalmente disponibile per legare ClONO2, diviene non disponibile a tale scopo con una maggiore cataliticamente attiva. Chimica dell'ambiente presenza REACH & CLP di Cl· nella forma
Scarica