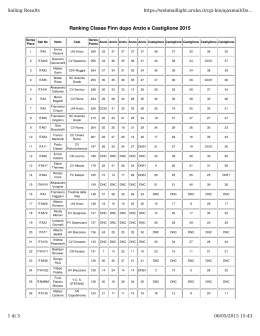
La condizione di spontaneità per un processo a P e T costante è dG 0 G G( P, T ) dG VdP SdT Sembrerebbe che a P e T costante sia sempre dG=0! In realtà G è una grandezza estensiva e dipende anche dal numero di moli di ciascun componente. G G ( P, T , n1 , n2 ,...) G G G G dG dP dT dn1 dn2 ... P n1,n2 ,T T n1,n2 , p n1 n2 , p ,T n2 n1, p ,T È proprio nei casi in cui varia la composizione del sistema, a P e T costante (reazioni chimiche, transizioni di fase), che la condizione dG<0 è utile per determinare la direzione di un processo. A P e T costante i termini in dP e dT scompaiono: G G dG dn1 n1 p ,T ,n2 n2 dn2 ... p ,T ,n1 La derivata parziale di G rispetto al numero di moli di un componente si dice potenziale chimico: G i ni P ,T , n j dG 1dn1 2 dn2 ... i dni i A P e T costante: dG i dni 0 PROCESSO SPONTANEO i dG i dni 0 i EQUILIBRIO Potenziale chimico per un componente puro: d ( nGm dG dn dn p ,T ) Gm p ,T Il potenziale chimico del componente puro coincide con la sua energia libera molare. Dipendenza del potenziale chimico dalla pressione: d dp dGm Vm T dp T I volumi molari sono grandezze necessariamente positive, quindi il potenziale chimico aumenta sempre all’aumentare della pressione. Dipendenza del potenziale chimico dalla temperatura: dGm d Sm dT p dT p Le entropie molari molari sono grandezze necessariamente positive, quindi il potenziale chimico diminuisce sempre all’aumentare della temperatura. Fase = una porzione di sostanza uniforme per composizione chimica e stato di aggregazione. A p e T costanti e in presenza di due fasi e β : dG dn dn All’equilibrio: dG = 0 dn dn 0 Poiché: dn dn ( )dn 0 E quindi: All’equilibrio, i potenziali chimici di ogni componente nelle diverse fasi devono essere uguali. Gm Sm T p T p Per un componente: Generalmente: S msolido S mliquido S mgas Gm p costante -Sm(solido) -Sm(liquido) solido liquido Tf gas Tb -Sm(gas) T Nei punti di transizione di fase (intersezione delle rette): liquido Fusione: Gmsolido Gm liquido Ebollizione: Gm Gmgas Gm p T p Per un componente: Vm T Vmsolido Vmliquido Vmgas Generalmente: T costante Gm Vm(gas) gas Vm(liquido) solido liquido pcond Vm(solido) psol p p Gmsolido Gmliquido liquido Gmliquido Gmgas solido solido m G G gas m vapore T Vm(solido)<Vm(liquido) P(atm) liquido solido Punto critico Punto triplo vapore 273.16 T(K) Punto triplo = condizioni uniche di pressione e temperatura alle quali coesistono la fase liquida, solida e gassosa. Punto critico = condizioni di temperatura e pressione al di sopra delle quali esiste solo la fase vapore. Per una generica reazione (p, T costanti): 2A + 3B C + 2D dG A dnA B dnB C dnC D dnD La variazione del numero di moli di ciascuna specie non è arbitraria, ma è fissata dalla stechiometria della reazione: 1 1 1 dnC dnD dn A dnB 2 2 3 dG (2 A 3 B C 2 D )dnC i i dnC i dG ( C 2 D 2 A 3 B )dnC La reazione procede spontaneamente nella direzione dG<0 1) i i 0 dn c 0 i La reazione procede spontaneamente verso i reagenti 2) i i 0 dn c 0 i La reazione procede spontaneamente verso i prodotti 3) i i 0 dG 0 i La reazione è all’equilibrio C 2 D 2 A 3 B All’equilibrio la somma dei potenziali chimici dei reagenti deve essere uguale alla somma dei potenziali chimici dei prodotti (ciascuno moltiplicato per il proprio coefficiente stechiometrico). d Vm dp T p p p RT d Vm dp p dp p0 p0 p0 p ( p, T ) ( p0 , T ) RT ln p0 Stato standard: stato della sostanza pura alla pressione di 1 bar e alla temperatura T (p0=1). p ( p, T ) ( p0 1, T ) RT ln p0 0 Per un gas reale al posto della pressione si introduce la fugacità, f: f ( p, T ) ( p0 1, T ) RT ln p0 0 f=p p ( p, T ) ( p0 1, T ) RT ln RT ln p0 0 ( p, T ) id ( p, T ) RT ln Tutti i gas reali hanno lo stesso stato standard di riferimento. Consideriamo un gas ad una certa temperatura T e pressione totale p Se è puro: pi=p p ( p, T ) ( p0 1, T ) RT ln p0 * 0 Nel caso di una miscela di gas ideali: pi=xip i ( p, T , xi ) * i ( p, T , xi pi 1) RT ln p i* ( p, T , xi 1) RT ln xi
Scaricare