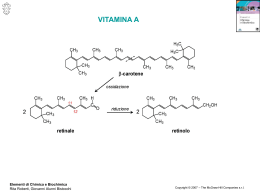
Vitamine: generalità Vitamine liposolubili A, D, E, K Meccanismo della visione Calcio Coagulazione del sangue VITAMINE Micronutrienti organici, richiesti in quantità pari a milligrammi o microgrammi Per la maggior parte dovono essere introdotte con la dieta (non sintetizzate o sintetizzate in parte dall’organismo) Non vengono usate per produrre energia né per usi strutturali • • • • fanno parte di coenzimi, sono precursori di ormoni, agiscono da antiossidanti, partecipano come substrati a reazioni specifiche Le VITAMINE sono classificate in LIPOSOLUBILI ed IDROSOLUBILI sulla base della loro insolubilità o solubilità in acqua La denominazione con le lettere dell’alfabeto ha origini storiche 1910-20 - isolate sostanze che in piccola quantità erano necessarie per prevenire malattie e denominate sostanza liposolubile - fattore A sostanza idrosolubile - fattore B fattore A suddiviso in A - fattore della crescita - visione notturna D - antirachitica fattore B suddiviso in B - fattore anti beri beri C - fattore antiscorbuto fattore B ulteriormente suddiviso in B1 - fattore anti beri beri B2 - altre vitamine del complesso B 13 vitamine sono essenziali per l’uomo LIPOSOLUBILI Vitamina A - retinolo Vitamina D - colecalciferolo (malattia da carenza: rachitismo) Vitamina E - tocoferolo Vitamina K - fillochinone IDROSOLUBILI Vitamina C - acido ascorbico (malattia da carenza: scorbuto) Vitamina B1 - tiamina (malattia da carenza: beri-beri) Vitamina B2 - riboflavina Vitamina B3 - niacina (acido nicotinico ed ammide) (carenza: pellagra) Vitamina B5 - acido pantotenico Vitamina B6 - piridossina, piridossale, piridossammina Vitamina B7 - biotina Folati Vitamina B12 - cobalammina (malattia da carenza: anemia perniciosa) Vitamine del complesso B: sintetizzate dai vegetali tranne la B12 sintetizzata solo da batteri Vitamina A VITAMINA A o retinolo (costituito da 4 unità isopreniche) Si trova negli alimenti di origine animale (fegato, olio di pesce, pesce, latte non scremato, burro, tuorlo) CAROTENOIDI (costituiti da 8 unità isopreniche) I carotenoidi sono presenti nelle piante; alcuni hanno attività vitaminica e sono denominati provitamina A Si trovano negli alimenti di origine vegetale (frutta, verdura, olio d’oliva) CH3 C C CH3 CH3 CH3 CH3 principale provitamina: beta carotene Struttura chimica: dimero della vitamina A ma da un punto di vista metabolico la bioconversione si assume di 1:12 CH2OH Le linee rosse evidenziano le 4 unità isopreniche anello -iononico essenziale per l’attività; è presente nei carotenoidi con attività provitaminica tutto-trans retinolo (forma alcolica) Vitamina Il gruppo alcolico è esterificato da acidi grassi (in genere acido palmitico) nella forma di riserva della vitamina retinolo deidrogenasi + NAD (reazione reversibile di ossidazione ad aldeide) CHO retinale (forma aldeidica) Ruolo nella visione retinale deidrogenasi + NAD (reazione irreversibile di ossidazione ad acido) COOH acido retinoico Ligando di fattori di trascrizione FUNZIONI I. PERCEZIONE VISIVA Fotoisomerizzazione 11cis retinale -> tutto trans retinale molto veloce: 10-12 s assorbe luce di 500 nm RODOPSINA (pigmento dei bastoncelli deputati alla visione notturna ) opsina (apoproteina) + fotorecettore legato tramite base di Schiff con lisina (Lys 296) praticamente non vi è isomerizzazione spontanea e quindi il rumore di fondo è molto basso; ciò permette di percepire anche pochi fotoni Sintesi delle rodopsina a partire dalla vitamina A Ciclo retinoide: via enzimatica che rigenera 11cis retinale Rodopsina luce trasportatore opsina 11 cis retinale trans retinale Deidrogenasi NAD+ 11 cis retinolo trasportatore La rigenerazione avviene al buio, nelle cellule epiteliali adiacenti ai fotorecettori Per esportare il retinale dal bastoncello alle cellule epiteliali MUTAZIONE: degenerazione maculare di Stargardt Reduttasi NADPH trans retinolo Isomerasi Lecitina retinol acil transferasi trans retinolo estere MUTAZIONE : retinite pigmentosa II. FUNZIONE TRASCRIZIONALE Lega fattori di trascrizione: Recettori dell’ Acido Retinoico (RXR) RXR forma eterodimeri con i recettori per - ormoni steroidei - Vit D - ormoni tiroidei . Anche questi recettori sono fattori trascrizionali attivati dal legame con l’ormone e dalla dimerizzazione con RXR, con conseguente inibizione o attivazione di specifici geni Questo spiega i numerosi fenomeni biologici in cui è coinvolta la vitamina A Base molecolare per il ruolo fisiologico nel differenziamento, proliferazione, sviluppo embrionale. vitamina D VITAMINA D FONTI - sintesi endogena: esposizione alla luce solare - dieta (necessita di lipidi e sali biliari per l’assorbimento) PRECURSORE dell’ormone steroideo 1,25-diidrossi colecalciferolo FUNZIONI dell’ormone: agisce a livello trascrizionale • omeostasi del calcio, in particolare assorbimento a livello intestinale: geni codificanti per il trasportatore del calcio e per la “proteina legante il calcio“ • mineralizzazione ossea • secrezione dell’insulina • crescita, differenziamento • sistema immunitario PELLE I. HO 7-deidrocolesterolo LUCE SOLARE fotolisi da raggi UV 280-315 nm 7 2HC 6 temp corporea 37° C cambio conformazionale 4 1 3 HO 2 HO Pre-vitamina D3 CH2 5 vitamina D3 colecalciferolo biosintesi dell’ormone 1,25-diidrossi colecalciferolo 1,25 (OH)2 D3 Vit D3 II. FEGATO 25 idrossilasi (mitocondriale o microsomiale) non regolata 25 OH D3 III. RENE 24,25 (OH)2 D3 se è presente ipercalcemia forma non attiva Enzima: 1 idrossilasi (mitocondriale) punto di controllo della biosintesi 1,25 (OH)2 D3 paratormone se è presente ipocalcemia Alcune funzioni del CALCIO Struttura (osso e denti) Coagulazione del sangue (vedi vitamina K) Contrazione muscolare Attivazione di enzimi -amilasi pancreatica, protein chinasi C, fosfofruttochinasi Rilascio di ormoni e neurotrasmettitori Le funzioni regolatorie prevalgono sulle funzioni scheletriche perturbazioni nell’omeostasi sono tamponate da tessuto osseo Adulto: Calcio corporeo (1000 - 1200 g ) Livello plasmatico = 10 (9-11) mg/dL (2,4 mM) 50% ione non complessato - fisiologicamente attivo 40% legato a proteine (albumina) 10% sale fosfato, citrato, bicarbonato Scarsa tolleranza alle deviazioni di [Ca++]: Ipocalcemia: ipereccitabilità, convulsioni tetaniche Ipercalcemia: paralisi muscolare, coma Ormoni di controllo di [Ca++]: Ormone paratiroideo (PTH) Vitamina D REGOLAZIONE DEL METABOLISMO DEL CALCIO azione concertata a livello intestinale, renale, osseo. Azione sinergica ipercalcemizzante di - Vitamina D - Ormone paratiroideo (PTH) Vita D ++ Fluido extracellulare PTH++ PTH ++ IN CIRCOLO 1,25 (OH)2 D 1,25 (OH)2 D Legata a Vit D binding protein VDRi + Acido retinoico eterodimero VDR- RXR NUCLEO VDRa VDRa RXR Il legame della vit D induce cambio conformazionale ed attivazione del “recettore per la vit D” che quindi trasloca nel nucleo dove si lega a specifiche sequenze del promotore CITOPLASMA ____VDRE_____ gene bersaglio mRNA Proteine leganti calcio VDR - Recettore Vit D VDRE - Vitamin D Response Elements RXR - Recettore Acido Retinoico (derivato vitamina A) ASSORBIMENTO DEL CALCIO A livello del duodeno, digiuno, ileo, colon (4%) Assorbito il 20-30% del calcio assunto - nei bambini fino al 70% trasporto dal lume intestinale all’eneterocita ATTIVO transcellulare, saturabile (sotto il controllo di 1,25(OH)2D) . transito nell’enterocita (è la tappa limitante). tramite Calcium Binding Protein (CBP) (sotto il controllo di 1,25(OH)2D) • estrusione dalla cellula intestinale tramite Ca ATPasi e scambio Ca/Na CARENZA di Vit D RACHITISMO: bambino Deficiente mineralizzazione con deformità delle ossa sconosciuto nei paesi tropicali, scandinavi, esquimesi nell’ 800 trattato con olio di fegato di pesce e esposizione al sole, nel 1930 identificata la vitamina OSTEOMALACIA: adulto osteopenia con aumentato rischio di frattura ed un diffuso dolore osseo anche per mancata sintesi dell’ormone o mancata risposta ormonale - Vitamina E VITAMINA E -tocoferolo STRUTTURA CHIMICA anello funzionale fenolico con una catena laterale isoprenica scoperta nel 1922 nei vegetali verdi (è sintetizzata solo dalle piante fotosintetiche) e denominata vit E quindi messa in relazione con la fertilità e chiamata tocoferolo: tokos (nascita) phero (porto) olo (alcol) FONTI: soprattutto in alimenti di origine vegetale, olio di oliva, noci, mandorle, vegetali verdi LOCALIZZAZIONE: zone ricche in lipidi quali membrane cellulari, lipoproteine, depositi di grasso FUNZIONE protezione da auto-ossidazione degli acidi grassi polinsaturi. previene ossidazione lipoproteine (LDL) MECCANISMO: antiossidante che interrompe la catena di radicali che reagiscono più velocemente con la vi tE che con acidi grassi ROO• + Vit E-OH Vit E-O• + ROOH Vi E-O• reagisce con vitamina C o altro donatore di di idrogeno e ridiventa Vit E-OH Vitamina K VITAMINA K: naftochinone con una catena laterale poli-isoprenica fillochinone, sintetizzata dalle piante menachinone, sintetizzato dai batteri della flora intestinale 6-11 menadione forma sintetica farmacologica, non attiva come tale, ma viene isoprenilata dall’organismo Dicumarolo: antivitamina presente in alcune piante; inibitore della reduttasi che rigenera la forma atttiva della vitamina (vedi diapositiva successiva) Dicumarolo FUNZIONE BIOCHIMICA cofattore di carbossilasi per la sintesi dell'acido -carbossiglutammico (Gla) a partire dall’acido glutammico di proteine proteina-HN-CH- CO-proteina I CH2 I CH-COO– I COO– Gla Modificazione post-sintetica di proteine La forma funzionale è l’idrochinone che nell’attività catalitica è ossidato a chinone, e quindi rigenerato da reduttasi NADPH dipendente. Inibitori della reduttasi sono anticoagulanti. Farmaci con azione antivitaminica • anticoagulanti: warfarina • antibiotici: cefalosporina inibitore della vit k-epossido reduttasi L’amminoacido Gla, avendo due cariche negative, lega bene il calcio ionizzato (Ca2+) con 2 cariche positive La vitamina K interviene come fattore antiemorragico nella coagulazione del sangue. La coagulazione implica una attivazione a cascata di enzimi proteolitici già presenti nel plasma come precursori inattivi: la specifica proteolisi rende attivo il fattore (reazione finale: fibrinogeno fibrina) In tale processo le proteine che hanno Gla legano il Ca2+ che si lega anche ai fosfolipidi negativi della superficie delle piastrine attivate; tale legame è indispensabile per subire l’attivazione I fattori della coagulazione vit K-dipendenti sono: Protrombina Fattore VII Fattore IX Fattore X In assenza di Ca2+ non si legano alle piastrine attive e non vengono trasformati nella forma attiva dall’enzima proteolitico di cui sono substrato Ca2+ fattore IV FL: fosfolipidi delle piastrine attivate VIA INTRINSECA Fattore XII XIIa In rosso: enzimi proteolitici In verde: fattori attivanti Fattore XI (Ca2+, FL) XIa VIA ESTRINSECA Fattore IX (Ca2+, FL) IXa VIIa (Ca2+, FL) Fattore VII Fattore VIII VIIIa Fattore X (Ca2+, FL) Xa Fattore V Va Protrombina (Ca2+, FL) trombina monomero di fibrina fibrinogeno XIIIa Fattore XIII polimero di fibrina (insolubile) Gla protrombina La TROMBINA è una proteasi specifica che idrolizza il legame Arg-Gly 1 La trombina ha un ruolo centrale agendo su diversi fattori ed amplificando il processo Il fattore Xa scinde i due legami 274 Arg-Thr A 323 Arg -Ile Fibrinogeno XIII VIII V VII fibrina XIIIa (fattore regolatorio) VIIIa(fattore regolatorio) Va(fattore regolatorio) VIIa (proteasi) S B S e forma la trombina, costituita dalle due subunità A e B legate da ponte disolfuro 582 La scissione avviene in presenza di legame della protrombina a Ca2+ e fosfolipidi di membrana di piastrine attivate, tramite i residui di GLA, presenti nella parte Nterminale che viene persa nella trombina Il fibrinogeno (AB)2 ha carica negativa che impedisce interazione con altre molecole di fibrinogeno. La trombina elimina i fibrinopeptidi altamente negativi, creando un centro positivo che permette l’interazione tra i monomeri di fibrina ()2 - - - - + - - + fibrinogeno + - + + - fibrina Il legame ionico viene quindi stabilizzato dalla formazione di legami covalenti fra le catene laterali per azione del fattore XIIIa ANTITROMBINA Proteina plasmatica: inibisce la trombina legandosi con un complesso 1:1 EPARINA: si lega alla antitrombina e ne aumenta l’attività di centinaia di volte
Scaricare