LE LEGGI DELLA FISICA E LE FUNZIONI FISIOLOGICHE: -la respirazione -la diffusione -la pressione osmotica (parte delle diapo provengono da P. Montagna, Fisica delle Membrane, sul web) Modulo 1: respirazione La respirazione è il processo mediante il quale gli organismi si procurano ossigeno ed eliminano anidride carbonica. A livello cellulare, la funzione della respirazione è quella di apportare alle cellule l'ossigeno che, attraverso le reazioni della respirazione cellulare, permette la produzione di energia; mediante tale processo, l'organismo si libera di anidride carbonica, il prodotto di rifiuto derivato dalla respirazione cellulare. Nei mammiferi compaiono due polmoni capaci di espandersi e di contrarsi, seguendo i movimenti della gabbia toracica, grazie alla loro struttura spugnosa. L'aspetto spugnoso è dovuto agli alveoli che formano il tessuto polmonare. A livello degli alveoli polmonari avviene lo scambio dei gas respiratori. RICHIAMI SUL GAS PERFETTO: (molecole puntiformi e non interagenti :con buona approssimazione TUTTI I GAS RAREFATTI!) Studi sperimentali : 1) relazione PRESSIONE-VOLUME a temperatura ambiente (T fissata): rubinetto Volume di aria Vo Pressione atmosferica Po Versando altro mercurio (per un’altezza h) la nuova pressione sarà P1=dgh +Po E si osserverà una leggera risalita del mercurio nel secondo braccio, con relativa riduzione del volume d’aria da Vo a V1. Ripetendo più volte l’esperimento si vede che: p (a T= cost) P V = cost P1 Po (legge di Boyle) V1 Vo V Diamo i numeri... Una bombola di ossigeno alla pressione di 5 atm contiene 10 l di gas. Quale sarà il volume disponibile per il paziente? Si noti innanzitutto che il paziente respira l’ ossigeno a pressione atmosferica ( p’ = 1 atm). Il gas subisce una trasformazione ISOTERMA, dunque: p’ V’ = p V V’ = p V / p’ = 5 atm 10 l / 1 atm = 50 l 2) Al variare della temperatura la legge resta valida, ma i valori numerici si modificano: la ‘costante’ dipende dalla temperatura. Se anziché tenere fissa la temperatura si tiene FISSA la PRESSIONE, lavorando ad esempio alla pressione atmosferica, è possibile studiare la relazione tra VOLUME e TEMPERATURA: Righello graduato termometro Palloncino in vetro riempito d’aria Leggendo lo spostamento della goccia sul righello graduato si stima il volume V corrispondente alle diverse temperature t. Detto Vo il volume misurato a t=0 °C, si ricava la legge: V = Vo ( 1 + a t) (prima legge di Guy-Lussac) NB: a) a risulta esser la stessa per TUTTI i gas, purchè sufficientemente diluiti da essere ‘perfetti’: a = 1/273.15 °C-1 b) Rappresentando su un grafico la legge: V -1/a 0 t (°C) Alla temperatura t = -1/ a = -273.15 ° C il volume ‘sparisce’! Ciò descrive sicuramente una situazione non-fisica. 3) Studiamo infine una trasformazione isocora (a volume costante): t p La relazione tra PRESSIONE e TEMPERATURA risulta espressa dalla legge: P= Po ( 1 + a t) (seconda legge di Guy-Lussac) dove ancora Po è la pressione corrispondente a t=0 °C, a è la costante comune a tutti i gas e alla temperatura t = - 1/ a la pressione ‘scompare’. L’insieme di queste leggi permette di pervenire alla equazione di stato dei gas perfetti. Siano A (Po, Vo, to) e B (P, V, t) due configurazioni del gas: A P I: V(I)= Vo( 1 + a t) I A B I V B: P V = P(I) V(I) = PoVo (1+ a t) Con qualche manipolazione algebrica: P V = Po Vo ( t + 273.15) /273.15 osservando ora che: 1) Vo si può esprimere come il prodotto nel numero n di moli del gas e del volume vo occupato da una mole di gas a t=0 oC e p= 1 atm ( vo = 22.4 l), 2) si può introdurre una nuova scala termometrica, detta di Kelvin, per cui: T (°K) = t(°C) + 273.15 (detta temperatura assoluta, in quanto T=0 °K non è raggiungibile). La quantità Po vo /273.15 = R = 8.31 J /mol °K viene definita come costante universale dei gas, e l’equazione di stato viene scritta nella forma: PV=nRT EQUAZIONE DI STATO DEI GAS PERFETTI Questa legge vale naturalmente nell’approssimazione di ‘gas perfetto’, e non può descrivere i cambiamenti di stato di un gas reale pressurizzato: per fare questo occorre considerare una relazione più complicata (legge di Van der Waals). Diamo i numeri Un gas perfetto alla temperatura di 20 oC e alla pressione di 15 *104 Pa, occupa un volume di 10 m3. Si determini il volume che occupa alla temperatura di 0 oC e alla pressione di 9*104 Pa. L’ eq di stato ci dice che: p V / T = cost, dunque: p’ V’ / T’ = p V / T V’ = p V T’ / p’ T = = 15 *104 Pa 10 m3 273 K / 9*104 Pa 293 K = 15.52 m3. MISCUGLI DI GAS e GAS IN SOLUZIONE NEI LIQUIDI In caso di miscugli di gas, per valutare la pressione totale p occorre considerare le diverse componenti. Ammettiamo di avere ni moli del gas iesimo, con i=1,..N. La pressione totale del gas del miscuglio sarà data dalla somma delle pressioni parziali pi: pi = ni R T / V. Naturalmente, essendo V, R e T gas del miscuglio: uguali per tutti i p i / p = ni / n Se nel miscuglio gassoso è contenuto un vapore saturo, alla somma delle pressioni parziali va aggiunta quella del vapore saturo. ESEMPIO L'aria secca è costituita da un miscuglio di O2 ( 20% ) e N2 ( 80% ). Calcolare le pressioni parziali. Fare lo stesso calcolo nel caso di aria con unmidità relativa del 100% alla temperatura di 24 °C ( pressione di vapore = 22.4 mmHg ). aria secca: essendo p=760 mmHg PO2 = 760 x 0.2 = 152 mmHg PN2 = 760 x 0.8 = 608 mmHg aria umida: i conti vanno rifatti con p= 760-22.4=737.6 mmHg Definizione dell'umidità (vapore acqueo). http://www.naturmed.unimi.it/meteolab_igro.html L'umidità dell'aria può essere classificata in umidità assoluta, corrispondente alla quantità di vapore acqueo in grammi contenuta in un metro cubo d'aria. Più l'aria è calda, maggiore è la quantità in grammi che essa può contenere. Ecco perché nei paesi tropicali ed equatoriali o alle nostre latitudini nei mesi estivi, le precipitazioni possono anche essere molto intense. L’umidità assoluta indica direttamente il contenuto di vapore acqueo nell ‘aria in kg/m3.Es: UA = 15 g /m3 L'umidità relativa si esprime invece in percentuale. Essa corrisponde al rapporto tra la tensione di vapore effettiva e la tensione massima moltiplicato per 100. Il rapporto di mescolanza (mixing ratio) è il rapporto tra la quantità di vapore acqueo contenuto in una massa d’aria e la parte di aria secca contenuta nella stessa massa. Poiché la quantità di vapore acqueo che l'aria contiene è proporzionale alla tensione del vapore (definita come la pressione parziale del vapore acqueo contenuto nell'aria) ben si capisce, quando si parla di umidità relativa contenuta nell'aria pari a 70%, che l'aria in esame contiene il 70% della quantità del vapore acqueo che, a quella data pressione e temperatura, porterebbe alla saturazione. Normalmente si definisce l’ umidità relativa rispetto ad un riferimento.Come riferimento è consuetudine assumere la tensione di vapore saturo TVS dell’ acqua (ossia la pressione del vapore contenuto nel volume chiuso al di sopra della superficie di un liquido in evaporazione). Si assume pertanto: UR = Pressione Parziale del vapore acqueo * 100% / TVS NB Poiché la TVS dipende dalla temperatura, anche la Pressione parziale ne dipenderà. Si parla di aria secca se l'umidità relativa è al di sotto del 35/40%, umida se supera il 70%. Il nostro organismo è molto sensibile a queste variazioni, così come abbiamo già notato per la temperatura. La variazione in grammi del contenuto di vapore acqueo nelle masse d'aria circolanti è molto alta in rapporto alla temperatura. Ci basti affermare che, se ad una temperatura di -20° la quantità massima di vapore acqueo che una massa d'aria può contenere è di soli 0,8 grammi per metro cubo, ad una temperatura di 30° la stessa massa d'aria può contenerne ben 28. Analogamente si giustifica lo scambio a livello tissutale, essendo: liquido interstiziale: capillari p O2 p CO2 100 40 mmHg " 30 50 L'azoto non svolge alcun ruolo negli scambi, ma quando la sua pressone parziale è molto elevata e viene abbassata di colpo può dare luogo ad embolie gassose. SCAMBI GASSOSI NEGLI ALVEOLI Aria inspirata: Sangue venoso: p O2 = 100 mmHg p O2 = 40 mmHg p CO2 = 40 mmHg p CO2 = 46 mmHg A livello alveolare il sangue acquista O 2 e perde CO 2 ! NB: nell’aria inspirata PO2 = 100 mmHg dunque la proporzione di ossigeno vale 100 / 760 = 0,13 = 13% Cosa succede nell’ acqua? I gas sono solubili in un liquido in misura diversa al variare della temperatura e della pressione. La legge di Henry stabilisce che la quantità di gas che si scioglie in un liquido è proporzionale alla pressione parziale di quel gas nello spazio sovrastante la superficie libera del liquido. Tale legge viene comunemente espressa in due forme diverse: in termini di volume di gas i-esimo in condizioni NTP ( 0 °C, 1 atm ) che si scioglie in 100 cm cubi di liquido: Vi = si pi dove si è detto coefficiente di solubilità; oppure in termini di concentrazione molare del gas nel liquido: Ci = ci pi dove ci è la costante di solubilità. Nella legge di Henry V è il volume di gas ( in cm 3) che si scioglie in 100 cm 3 di liquido, p è espressa in atm e s in cm 3 / atm ( es: a 0 °C per l’ossigeno s vale 4.9, per l’azoto vale 2.4, per la CO2 vale ben 170), dunque ad una atmosfera l’ossigeno disciolto in acqua vale 4,9 cm3 / 100 cm3, pari al 4,9 %. In molti casi si trova già espresso il volume (in ml) /100 ml di acqua, e si parla di ‘solubilità’: attenzione a non confondere es per l’azoto, la solubilità vale 1.2 ml/100 ml di acqua La respirazione di pesci e anfibi Nell'ambiente acquatico gli organismi hanno più difficoltà a procurarsi ossigeno. In un litro di acqua vi è solo il 5% dell'ossigeno che si trova in un litro di aria; inoltre, l'acqua è un mezzo più denso dell'aria. A causa di tali condizioni gli animali acquatici devono spendere molta più energia degli animali terrestri. Nei pesci la respirazione avviene mediante le branchie, strutture dall'aspetto piumoso presenti ai lati del capo. Le branchie sono riccamente irrorate dai vasi sanguigni in cui scorre sangue: nei globuli rossi del sangue è contenuta l'emoglobina, la sostanza che fissa l'ossigeno e ne permette il trasporto alle cellule. L’ossigeno non è molto solubile in sangue o acqua: alla temperatura corporea 1 l di plasma con pO2= 100 mmHg contiene circa 2.5 cm3 di O2 disciolto, mentre a una pCO2 di 40 mmHg corrisponde una quantità di 25 cm3 di CO2 disciolta. Questo spiega perché necessitiamo di ‘trasportatori’ di Ossigeno (emoglobina): attraverso l’ Hb, 1 l di sangue trasporta circa 200 cm3 di O2 ossia 100 volte di più di quanto potrebbe essere disciolto! Modulo 2: Gli esseri viventi sono degli agglomerati di cellule: Vc = 5 mm3 Ogni cm3 di essere vivente contiene N= 1 / 5 (10-4)3 = 2 10 11 cellule Per permettere il ciclo vitale ogni cellula deve ricevere ossigeno (respirazione), nutrienti ( circolazione), regolare il suo volume di acqua (osmosi), la sua acidità, e per le cellule nervose e muscolari anche il suo potenziale elettrico. Tutti questi processi si basano sul principio della diffusione. Concentrazione Composizione dei due mezzi (compartimenti) tra cui sta la membrana: se miscele di gas pressioni parziali dei singoli gas se soluzioni liquide concentrazioni del soluto nel solvente/soluzione Concentrazione = massa soluto / volume solvente (soluzione) C = m/V g/cm3 dimensionalmente uguale a densità Unità pratiche: molalità n.moli soluto / kg solvente moli/kg molarità n.moli soluto / litri soluzione moli/l fraz.molare n.moli soluto / n.moli soluzione adim. Diffusione libera Se il soluto diffonde liberamente nella soluzione per agitazione termica: Relazione tra flusso e concentrazione Legge di Fick: JS = -D C/x Per le miscele di gas (perfetti): piV = niRT Ci= ni/V = pi/RT pi RT x a T costante: JSi = Di molecole equilibrio non equilibrio flusso netto 0 c1 c2 c c1 cf c2 t Le curve sono esponenziali e sono caratterizzate dalla costante di tempo t necessaria a raggiungere circa 1/3 del valore di equilibrio. Se vogliamo avere un flusso netto occorre che cambi qualcosa tra i due settori. Se , in particolare, cambia la concentrazione delle molecole: c = N / V ecco che cambierà N dalle due parti: necessariamente dovrà modificarsi il valore delle velocità delle molecole, e quindi la frazione di particelle che ha velocità opportune per attraversare il setto. Ne discende che ci sarà un flusso netto dalla parte in cui la concentrazione è maggiore a quella in cui è minore fino a che non verrà ristabilito l'equilibrio. Questa osservazione sperimentale va sotto il nome di Legge di Fick: il flusso J di particelle attraverso un sezione ( definito come numero di particelle per unità di superficie per unità di tempo ) è proporzionale alla differenza di concentrazione c a cavallo della sezione: J = -D grad c D è detto coefficiente di diffusione libera. Un altro modo per variare il flusso netto attraverso la sezione consiste nel modificare la pressione del gas dalle due parti, essendo infatti la pressione p legata alla concentrazione c dalla legge c = p / R T J= -D grad C grad C = C/ x , ossia rappresenta la variazione nello spazio x della concentrazione C. J qui è x è lo spessore del setto C1 C=C1-C2 C2 Diffusione Gas distanza tra molecole d 10-7 cm Liquidi distanza tra molecole d 10-8 cm Agitazione termica: moto browniano casuale con moltissimi urti ______ 1 2 3 kT 2 Energia cinetica media – Velocità media dipendono dalla temperatura (assoluta) T La velocità tra due urti successivi aumenta al crescere della temperatura diminuisce al crescere del peso molecolare vrms v 2 mv __ 2 Velocità di diffusione = velocità “effettiva” vAB molto più piccola! vossigeno in aria 1 m/s in acqua 1 mm/s 3kT m Coefficiente di diffusione Il coefficiente di diffusione libera D dipende da: - temperatura assoluta T - caratteristiche fisico-chimiche di soluto e solvente (tipo di urti che subisce la molecola di soluto dimensioni molecola: raggio r attrito viscosità liquido) D T/r (almeno 10000 volte più grande nei gas che nei liquidi) Il coefficiente di diffusione attraverso la membrana DM dipende anche dal “rimbalzo” delle molecole sui bordi e sulle pareti della membrana rapporto r/R (raggio molecola / raggio poro) DM < D (10% - 90%) Es: calcolare il numero di moli n e di molecole N contenute in 4.5 l di acqua. Acqua: H 2 O -- PM = 2 x 1 + 16 = 18 uma 1 mole --- 18 g Dunque: 4.5 l 4.5 kg 4.5 10 3 g / 18 g = 250 moli 1 mole contiene Na molecole , con Na = 6 10 23 Dunque 4.5 l 250 x 6 10 23 = 1.5 10 26 molecole Le membrane nei sistemi biologici Le funzioni biologiche di tutti gli organismi viventi si svolgono mediante assorbimento/eliminazione di sostanze attraverso membrane. Membrana = struttura che separa due mezzi diversi compartimento (gas o liquidi) influenzando in modo selettivo le sostanze compartimento che li attraversano e modificandone quindi la composizione. Il passaggio delle molecole è determinato dai meccanismi di trasporto passivo: - diffusione - filtrazione - osmosi (differenza di concentrazione + differenza di potenziale elettrico) 1 2 Caratteristiche geometriche Membrana = parete “forata” di spessore x in cui si aprono NA pori, ciascuno di raggio R, per ogni elemento di area A. Tra i due compartimenti possono fluire molecole di raggio r. Coefficiente di partizione = frazione di area aperta al passaggio di sostanze rispetto all’area totale della membrana: = NA (R2) /A =0 membrana impermeabile =1 membrana inesistente Flussi attraverso membrane Per descrivere il flusso di sostanze tra i 2 compartimenti: “quantità di materia” che attraversa la membrana per unità di superficie e per unità di tempo Flusso di soluto: JS = n.moli soluto /(cm2•s) Flusso globale: JV = volume soluzione /(cm2•s) Grandezze vettoriali Equilibrio dinamico: JS = JS12 + JS21 = 0 JV = JV12 + JV21 = 0 Tipi di membrane biologiche regolazione funzioni concentrazione di: esempi biologici gas alveoli membrane capillari assorbimento O2 emissione CO2 (spessori) (10-4 cm: cellule) sali e proteine metabolismo escrezione membrane renali pareti capillari (10-4 cm: cellule) ioni Na, K, Ca, Cl generazione potenziali bioelettrici membrane cellulari (10-7 cm: molecole) Diffusione attraverso membrane La presenza della membrana porosa riduce la superficie libera alla diffusione di un fattore geometrico pari al coefficiente di partizione = NA (R2) /A La legge di Fick diventa: JSM = - DM C/x = - P C con P = -DM/x = -DM NA (R2) /(Ax) = permeabilità della membrana Per la presenza della membrana, la concentrazione di soluto “crolla” bruscamente (di un fattore ) tra i due compartimenti. All’interno della membrana diminuisce linearmente. Diamo i numeri….. Calcolare il numero di moli di glicerina che attraversano in un s una membrana di acqua spessa 7.5 10-9 m e di area 102 cm2 quando la differenza di concentrazione è 10-1 micromoli/l. Il coefficiente di diffusione vale 7.2 10-6 cm2 s-1. J = n /t S = D dc/dx n = D dc t S / dx = (7.2 10-6 cm2 s-1 10-7moli/103 cm31 s 102 cm2) / 7.5 10-7cm = 0.96 10-7 moli MODULO 3 INSIEME AL CONCETTO DI DIFFUSIONE (PASSAGGIO DI SOLUTO DA UN COMPARTIMENTO ALL’ ALTRO IN PRESENZA DI MEMBRANA PERMEABILE) E’ IMPORTANTISSIMO ANCHE IL FENOMENO DELL’ OSMOSI (PASSAGGIO DEL SOLVENTE DA UN COMPARTIMENTO ALL’ ALTRO IN PRESENZA DI MEMBRANA SEMIPERMEABILE). Membrane semipermeabili Membrana semipermeabile: permeabile al solvente impermeabile al soluto dimensioni: solvente < pori < soluto si osserva che... Osmosi Inizio: stesso livello stessa pressione idrostatica Fine: innalzamento del livello della soluzione interna tanto maggiore quanto maggiore è la concentrazione del soluto interno Spiegazione: flusso di solvente dalle concentrazioni maggiori (C1 = 100%) a quelle minori (C2) continua fino a quando l’innalzamento di pressione provoca un flusso inverso da C2 a C1 equilibrio dinamico Pressione osmotica Pressione osmotica = pressione max. in una soluzione quando una membrana semipermeabile la separa dal solvente puro Misura di pressione osmotica: differenza di pressione idrostatica = d g h = d g (h2-h1) d= densità soluzione La pressione osmotica dipende dalla temperatura e dalla concentrazione della soluzione. come? Leggi dell’osmosi Per soluzioni diluite: • a T costante = kC • a C costante (t) = 0(1+t) =1/273oC • Avogadro a ugual temperatura, soluzioni con ugual no di particelle di soluto nello stesso volume di solvente hanno pressioni osmotiche uguali Equazione di stato: V = n RT Una soluzione diluita si comporta in modo perfettamente analogo a un gas perfetto Boyle Gay-Lussac Avogadro = coeff. di dissociazione elettrolitica !!! PRESSIONE OSMOTICA dh t c1 c2 Membrana semipermeabile c1 > c2 I PROCESSI OSMOTICI Quando si prendono in considerazione membrane permeabili, ossia che permettono al soluto, concentrato in misura diversa dalle due parti del setto, di passare da parte a parte, si considerano processi di diffusione. Esistono però in natura delle membrane dette semipermeabili, che consentono cioè il passaggio del solvente ma non del soluto. L'evoluzione verso una condizione di egual concentrazione avviene in questo caso con un movimento netto del soluto, che si muove verso le regioni di maggior concentrazione per 'diluire' la soluzione. Questo aumento di volume del compartimento più concentrato, che determina un innalzamento dh, fa sì che aumenti la pressione idrostatica della quantità = d g dh. Diamo i numeri…. Determinare la concentrazione del sale NaCl ( supposto dissociato in ioni ) nell’ oceano, se la pressione osmotica dell’ acqua di mare è di 22 atm a 300 K°. Poiché = cRT, Si ha c = / RT = 22 atm / 0.082 atm l /mol K 300 K = 0.89 moli/l Poiché questa è la concentrazione ionica, per conoscere la concentrazione molecolare occorre dividere per 2: C (NaCl) = 0.445 moli/l La pressione osmotica viene talvolta misurata anche in termini di osmolarità : una soluzione è osmolare quando esercita una pressione osmotica uguale a quella di una soluzione di una mole di non-elettrolita disciolta in un litro d'acqua a T = 0 °C. 1 osmole = 22.4 atm Così come una pressione responsabile di una espansione compie lavoro, anche concentrare una soluzione, ossia impedire la diluizione dovuta all'osmosi, richiede energia: definito il lavoro osmotico dL = dV Unità di misura della pressione osmotica Unità di misura della pressione osmotica: tutte quelle consuete + osmolarità pressione di 1 mole di soluto con =1 in 1 litro d’acqua a 0oC molarità NaCl pressione di 1 mole di sale NaCl con =2 in 1 litro d’acqua a 0oC 1 osmole = 22.4 atmosfere 1 mole NaCl = 2 osmoli La pressione osmotica e il sangue Ci sono 2 importanti applicazioni della pressione osmotica che riguardano il sangue: 1) IL CONCETTO DI ISOTONICITA’ CON IL PLASMA 2) LA PRESSIONE ONCOTICA Se ext > glob glob Se ext < glob Per evitare fenomeni di emolisi i liquidi introdotti nel torrente circolatorio devono essere isotonici rispetto al plasma, ossia possedere la medesima pressione osmotica. Prepara le dosi per un litro di soluzione fisiologica (ossia isotonica rispetto al plasma: =0.31 osmolare) utilizzando separatamente le seguenti sostanze: SOSTANZA PESO MOLECOLARE d NaCl 58.5 g 1.86 HCl 36.6 1.9 Na2SO4 142 2.22 Glucosio 180 1 Saccarosio 342 1 Esprimi le dosi in g/l. Risolviamo ad es il primo caso: c= / dRT = 0.31/1.86 mol/l; m/V=PMc=58.5 0.167 = 9.75 g/l Vediamo ad es il primo caso: = 0.31 osmolare = 0.31 22.4 atm = 6.94 atm C= / d R T = 6.94 atm / (1.86 0.082 atm l /moli °K 310 K°)=moli/ =0.147 moli/l Poiché 1 mole 58.5 g Avremo: c = 0.147 58.5 = 8.6 g/l Pressione osmotica dell’ acqua di mare: 22 atm (a 300 K°). C (NaCl) = 0.445 moli/l Pressione osmotica plasma: = 0.31 osmolare = 0.31 22.4 atm = 6.94 atm C= 0.147 moli/l Equilibrio osmotico nei pesci marini e d'acqua dolce La differenza delle condizioni osmotiche (della concentrazione di acqua e sali) tra l'ambiente d'acqua salata e quello d'acqua dolce impone ai pesci dell'uno e dell'altro ambiente la messa in atto di diversi adattamenti fisiologici: i pesci marini devono evitare la perdita di acqua dal proprio corpo all'ambiente esterno, che tende a verificarsi a causa dell'alta concentrazione di sali nel mare; al contrario, i pesci d'acqua dolce devono contrastare la tendenza dell'acqua a entrare nei loro tessuti, che risultano più concentrati dell'ambiente esterno. La pressione oncotica Le pareti dei capillari non sono permeabili alle proteine, dunque queste avranno una loro pressione osmotica. Ad es. supponiamo che in un litro di plasma sanguigno ci siano 60 g di proteine, che la loro pressione osmotica valga 30 mmHg e la temperatura sia 37 °C. Potremo calcolarci la massa molecolare media delle proteine nel modo seguente: C= / RT = 30 133 Pa / (8.31 Pa m3 /mol °K 310 °K) = = 1.55 moli/ m3 = 1.55 10 –3 moli/l Poiché PM = m/moli = 60 g / l / 1.55 10 –3 moli/l = 38710 Diamo i numeri…. La linfa contiene circa l’ 1% in peso di saccarosio (C12H22O11). Se la temperatura è di 25 °C, calcolare di quanto risale la linfa negli alberi a primavera. PM = 12x12 + 22x1 + 11 x 16 = 342 uma m/M=n PM/d V = 10-2 ---> n/V=10-2 d/PM PO= n/V R T = d g h dunque h = 10-2 d R T /(PM d g) = (10-2 8.31 298)/ (342 10-3 10)= 7.2 m
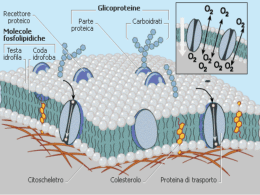
Scaricare