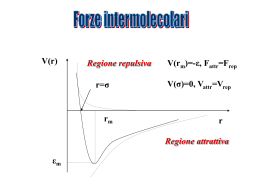
Concetti di base nella chimica degli esseri viventi ELEMENTI E COMPOSTI Elementi: sostanze formate da un solo tipo di atomi Composti: sostanze formate da 2 o più atomi Molecole: particelle che costituiscono i composti ELEMENTI PRESENTI IN MAGGIORE QUANTITA’ NELLA MATERIA VIVENTE BIOELEMENTI Ossigeno (O) - Carbonio (C) Idrogeno (H) - Azoto (N) Fosforo (P) - Zolfo (S) Tutti insieme costituiscono oltre il 95% della materia vivente ELEMENTI ESSENZIALI PRESENTI COME IONI Calcio (Ca2+) - Potassio (K+) Sodio (Na+) - Cloro (Cl-) Magnesio (Mg2+) ELEMENTI PRESENTI IN TRACCE Ferro (Fe) - Rame (Cu) Manganese (Mn) - Zinco (Zn) Iodio (I) - Fluoro (F) Silicio (Si) - LE BIOMOLECOLE LE BIOMOLECOLE sono composti organici, in genere ad alto peso molecolare, appartenenti a quattro classi principali. Proteine Carboidrati Lipidi Acidi nucleici LE INTERAZIONI DEBOLI Le interazioni molecolari reversibili (non covalenti) sono alla base della vita. Le interazioni deboli sono fondamentali nella replicazione del DNA, nel corretto ripiegamento tridimensionale degli RNA e delle proteine. Le interazioni deboli hanno 1/20 della forza dei legami covalenti I tipi fondamentali di legami non covalenti sono: legami elettrostatici forze di Van der Waals legami idrogeno LEGAMI ELETTROSTATICI Queste interazioni possono essere di reciproca attrazione o repulsione a seconda del segno (uguale o diverso) delle cariche elettriche coinvolte. Esempi di interazioni elettrostatiche: Es: interazione tra 2 aminoacidi carichi presenti nella stessa proteina Es: interazione tra 2 aminoacidi carichi, uno sull’enzima e l’altro sulla proteina substrato La forza di queste interazioni è data dalla Legge di Coulomb F= D (q1x q2) /r2 q1 e q2 sono le cariche coinvolte r è la distanza che le separa D è la costante dielettrica caratteristica del mezzo (es. l’acqua) Forze di van der Waals Forze di attrazione intermolecolare non specifiche. Coinvolgono atomi che si trovano a distanza di 3-4 Å. Dovute a distribuzione asimmetrica di carica attorno al nucleo. Dovute al fatto che: In ogni istante la distribuzione della carica elettronica (dovuta alla nube di elettroni) attorno al nucleo di un atomo non è perfettamente omogenea. Atomi vicini possono indurre una polarizzazione della configurazione elettronica. Ci sono zone con minore densità di carica negativa e quindi più “positive” (i protoni del nucleo sono carichi positivamente) E zone con maggiore densità di carica negativa e quindi più “negative” (dove la nube elettronica, carica negativamente, è più densa) Questa asimmetria temporanea di carica induce la comparsa di una asimmetria simile in atomi adiacenti e ne provoca l’attrazione Atomo A Atomo B LEGAMI IDROGENO Tipo di legame in cui un atomo di idrogeno è condiviso da due atomi (fortemente elettronegativi) entrambi con grossa affinità per l’idrogeno. + = addensamento di cariche + - = addensamento di cariche - Legami direzionali Singolarmente molto deboli possono essere numerosissimi in una macromolecola o fra macromolecole Emivita brevissima Mentre alcuni si rompono molti altri si possono formare ACQUA (H2O) Pur essendo un composto inorganico, l’acqua è un componente essenziale e spesso preponderante di tutte le cellule e degli organismi. Contenuto d’acqua del corpo umano adulto (60%) del neonato (75%). Ha notevole influenza su tutte le interazioni molecolari nei sistemi biologici 1) È una molecola polare 2) È elettricamente neutra 3) Presenta una distribuzione asimmetrica delle cariche (dipolo) La nube elettronica presente attorno ai due atomi H è attratta dall’atomo di O. I protoni presenti nei nuclei degli atomi di H non sono più “schermati” dai loro elettroni, e risultano polarizzati positivamente (+). Attorno all’atomo di O si sviluppa una densità di carica negativa (-). - H + + O - (addensamento cariche -) + H + (addensamento cariche +) 4) L’acqua è altamente coesiva Le molecole di acqua sono molto affini tra loro e si orientano in modo da formare più legami H possibili. O O O O O Legami H
Scaricare