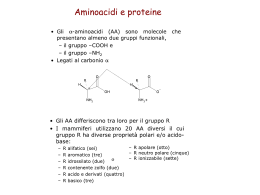
Aminoacidi e Proteine Funzioni Ruolo strutturale (cheratina, collagene,elastina, fibroina..) Proteine contrattili (Miosina,actina, dineina..) Riserva energetica ( <<zuccheri- lipidi) Enzimi Anticorpi Ormoni (insulina, glucagone, GH) Proteine di trasporto (emoglobina,mioglobina,transferrina,albumina..) Struttura degli Aminoacidi - Aminoacidi (20) 8-9 essenziali Met,Tre,Lys,Iso,Val, Leu,trip,Fen,Ist**,(Arg*) Gruppo amminico (NH2) Gruppo carbossilico (COOH) Idrogeno Non polari Non polari aromatici Polari, non carichi Carichi positivi Carichi negativi Il 21° aminoacido…….. Legame peptidico A - - Legame peptidico unisce due AA Il legame coinvolge il gruppo carbossilico di A ed il gruppo Amminico di B Oligopeptidi (2-7 aa) Polipeptidi (8-49 aa) Proteine (>>50 aa) AA B A C-N 1.49 A C=N 1.27 A Leg.peptidico 1.32 A B Estremità amino-terminale Estremità carbossi-terminale Livelli strutturali delle proteine Struttura primaria: Sequenza degli aa, scheletro della catena polipeptidica, sequenza degli aa essenziale per il ruolo fisiologico della proteina insulina AA non proteici -tiroxina (tirosina) -dopamina(tirosina) -Istammina(istidina) -GABA (glutammato) Derivati di AA Struttura secondaria delle proteine Ripetizione regolare e ricorrente di una struttura nello spazio lungo la catena polipeptidica: - elica - foglietto Random coil - elica Forma mantenuta da legami idrogeno tra i gruppi C=O e N-H I gruppi R sono rivolti verso l’esterno - foglietto Struttura mantenuta da legami idrogeno tra i gruppi C=O and N-H I gruppi R sono rivolti sopra e sotto il piano Random coil Struttura secondaria non ripetitiva, casuale. Proteine fibrose (solo struttura secondaria): cheratina, collagene, fibroina Fibroina della seta Struttura terziaria delle proteine Indica il modo nel quale le strutture secondarie si ripiegano nello spazio e formano proteine di tipo globulare. mioglobina Struttura terziaria – legame idrogeno Hydrogen bond Legame non fortissimo, rende possibile modifiche nella struttura della proteina (tipo funzionale) Struttura terziariaponte disolfuro 2 cysteine Struttura terziaria – ponti salini Gruppi carichi (+ e -) delle catene laterali R interagiscono tra di loro Strutture terziarie – interazion idrofobiche Attrazione di gruppi R non-polari. Interazione non forte ma molto frequente I gruppi non polari respingono molecole cariche e polari. Elementi ricorrenti di struttura terziaria Struttura quaternaria Alcune proteine “oligomeriche” sono costituite da piu’ catene polipeptidiche. La struttura 4°, indica la disposizione nello spazio di queste catene. Proteine“oligomeriche” sono regolate nella loro funzione (emoglobina) Struttura delle proteine – Tipologia di legami coinvolti Peptidico (1°) Idrogeno (2°,4°) Ponte disolfuro (3°) Ponte salino o interazione ionica (3°,4°) Forze idrofobiche (3°)
Scarica