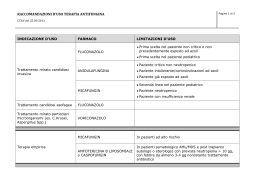
Il punto di vista dell’ematologo Prof Paolo Bernasconi, S.C. Ematologia Fondazione IRCCS Policlinico San Matteo, Università di Pavia [email protected] Should clinical hematologists put their microscopes on eBay? 1. Despite technological advances have shed light on the pathogenesis of onco-hematological disorders, the examination of a well-made blood film is an important part of the history and physical examination 2. Relying on sophisticated technology without looking at the tissue to be examined is fraught with danger 3. Once the skill of microscopy has been lost by hematologists it will never return McCann, Haematologica 2015 Quale «Expertise» è richiesta all’ematologo? 1. Conoscenza di aspetti tecnico-analitici 2. Conoscenza di possibili correlazioni tra suggerimenti strumentali, morfologia ematologica e realtà clinica, nonché di percorsi diagnostici interni per verificare tali correlazioni nel singolo paziente Parametri irrinunciabili che tuttavia richiedono una valutazione morfologica 1. Globuli rossi (RBC), Emoglobina (Hb), Ematocrito (HCT)*, Volume globulare medio (MCV)*, Concentrazione corpuscolare media di emoglobina (MCHC), Globuli bianchi (WBC), Piastrine (Plts) 2. Quantificazione assoluta delle cinque popolazioni leucocitarie 3. Reticolociti** in numero assoluto * Errori nella loro determinazione possono essere causati da microcoaguli, importante aumento di emazie microcitiche, crioglobuline ed agglutinine fredde, falcizzazione e aumento dell’osmolarità plasmatica (iperglicemia) ** Errori nella loro quantificazione possono essere causati da inclusioni leucocitarie e piastriniche, corpi di Howell-Jolly, parassiti (malaria) Reticolocitosi periferica post-trapianto: il primo segnale di ricostituzione ematopoietica Conta piastrinica 1. Microaggregati e/o presenza di importante componente monoclonale o di altri fattori determinano errori che rendono sempre obbligatoria la valutazione morfologica o l’impiego di anticorpi monoclonali CD41, CD42, CD61. 2. Bassi valori piastrinici rendono difficile ottenere determinazioni di soddisfacente accuratezza con importanti ripercussioni sul processo decisionale clinico 3. La presenza di micromegacariociti e soprattutto di «piastrine giganti» deve essere sempre confermata dall’esame morfologico Ampiezza di distribuzione dei volumi eritrocitari 1. E’ indicativa di anisocitosi, ma risente di problemi statistici; può essere utile per distinguere le anemie sideropeniche da quelle talassemiche e le anemie megaloblastiche da altre forme macrocitiche. 3. Richiede sempre una conferma morfologica specie se si sospetta una schistocitosi che può essere prodotta da sindrome uremico-emolitica, malattia di Moschowitz, CID, endotelite post-trapianto Contenuto emoglobinico reticolocitario 1. Misura indiretta del ferro disponibile per la produzione di nuove emazie nei 3-4 giorni precedenti 2. Ottimo parametro per la diagnosi differenziale delle anemie, per il monitoraggio delle terapie antianemiche, per valutare la ricostituzione post-trapianto, per monitorare il paziente dializzato, in terapia con eritropoietina e per l’anti-doping Frazione di reticolociti immaturi 1. Misura l’eritropoiesi effettiva 2. Ottimo parametro nella diagnosi differenziale delle anemie: ridotto nelle anemie aplastiche, aumentato nelle anemie emolitiche e post-emorragiche. Eritroblasti circolanti 1. La loro presenza deve essere confermata dall’esame morfologico; i vecchi strumenti li inserivano tra i leucociti 2. Un loro aumento nei neonati e prematuri è indice di sofferenza fetale 3. Un loro aumento nei pazienti ricoverati in Unità di Terapia Intensiva si correla con un significativo aumento della mortalità 4. Nei talassemici trasfusione-dipendenti possono essere impiegati per modulare la terapia trasfusionale: una loro percentuale costantemente <5% è indicativa di soppressione dell’eritropoiesi endogena Anomalie leucocitarie che devono essere sempre confermate dall’esame morfologico 1. Linfociti atipici: linfociti attivati (cellule di Turk, o di Downey) o neoplastici? 2. Elementi linfo-monocitoidi: morfologiche possiedono? quali caratteristiche 3. Molti strumenti non distinguono tra elementi immaturi (promielociti, mielociti, metamielociti e blasti) Infezione virale Leucemia linfoblastica acuta Mononucleosi Nuovi parametri leucocitari 1. I vari tipi di leucociti sono definiti da coordinate, generate da analisi di volume, conduttività, scatter (VCS) 2. Possono essere impiegati: per distinguere le linfocitosi da malattia linfoproliferativa e da quelle virali come screening test per la malaria per identificare plasmacellule per valutare la struttura interna dei neutrofili identificando quelli ipogranulati indicativi di sindrome mielodisplastica per eseguire indagini di citochimiche P. Falciparum P. P. Malariae P. Vivax LAM-M2 LAM-M2: positività al Nero Sudan Identificazione strumentale di blasti e problematiche relative 1. Vengono identificati con uguale capacità da tutti gli strumenti 2. La conferma microscopica è obbligatoria e dovrebbe fornire determinazioni di tipo semiquantitativo: <5% (rare), 5-10% (alcune), >10% (numerose) 3. Allarme blasti pleonastico nelle forme con leucocitosi, anemia, piastrinopenia 4. Allarme blasti irrilevante nelle leucopenie, situazioni in cui l’informazione clinica può essere addirittura più rilevante dell’osservazione morfologica LAM-M3 Volume medio piastrinico (MPV) 1. Varia con la tecnica impiegata e con il tempo e le condizioni di raccolta del prelievo, ma un suo aumento è identifica soggetti a rischio di infarto miocardico o con anamnesi di pregresso infarto miocardico o cerebrale 2. Un alto valore è indicativo di macrotrombocitopenia ereditaria Correlazioni tra suggerimenti strumentali, morfologia ematologica e realtà clinica L’esempio dell’eosinofilia UPN 1 Donna di 31 anni che si reca presso il nostro ambulatorio perché lamenta astenia ingravescente e senso di ripienezza post-prandiale Esame emocromocitometrico: Hb 11.5g/dl, GB 21.6x106/l con eosinofilia relativa (3.5x109/l), Pts 107x109/l Esame obiettivo: imponente splenomegalia (12cm al di sotto dell’arco costale) Mieloaspirato e biopsia ossea: aumento della cellularità midollare per iperplasia della serie granulocitopoietica prevalentemente costiuita da elementi appartenenti allo stipite eosinofilo; fibrosi di grado 1 Algoritmo diagnostico STEP-1: natura reattiva dell’ipereosinofilia STEP-2:Escludere Escludereladisordini onco-ematologici ed altre condizioni associate ad ipereosinofilia reattiva o clonale Linfoma di Hodgkin Reazioni allergiche: da farmaci, asma ecc (RAST Test) Neoplasie delle cellule B o T Infezioni parassitarie: Strongyloides stercoralis, Toxocara, Filaria, Leucemia mieloide acuta con t(8;21)(q24;q22) o con Schistosoma (Ricerca parassiti e sierologie) inv(16)(p13q22)/t(16;16)(p13;q22) positiva Insufficienza surrenalica: livelli di cortisolo, Leucemia mieloide cronica Immunodeficienze umorali: aumento di IgE, aumento di IgM, Leucemia mielomonocitica cronica Sindrome di Wiskott-Aldrich, deficit di IgA Malattie mieloprolifetive con riarrangiamento dei geni PDGFRA, Eosinofilie polmonari: granuloma eosinofilo, aspergillosi PDGFRB, FGFR1 polmonare, polmoniti eosinofile idiopatiche (livelli di ANCA) Leucemie eosinofiliche croniche non altrimenti specificate Dermatiti bollose autoimmuni: dermatiti erpetiformi, pemfigo Eosinofilie paraneoplastiche bolloso (Visita dermatologica) Eosinofilie idiopatiche Leucemia Eosinofilica Cronica (LEC) Malattia della cellula staminale ematopoietica che si estrinseca con un aumento del numero di eosinofili spesso dismorfici nel midollo osseo e nel sangue periferico ed infiltrati a livello di molti organi e tessuti. E’ distinta in forme con e senza anomalie genetiche ricorrenti. LEC: Patogenesi citogenetica e molecolare 1. Con 2. 3. Con riarragiamento riarrangiamento riarrangiamentodidi diPDGFR PDGFR FGFR1,beta, alpha, mappato mappato mappato in 8p11 in in 5q33 4q12 Del(4)(q12) FIP1L1/PDGFRA Analisi cromosomica e FISH nella nostra paziente FISHcon consonde sondaper perJAK2 PCM1 FISH Ricerca di sonde che mappano a livello dei punti di rottura dei due cromosomi; vengono scelte sonde che coprono i geni PCM1 (RP11-880I6 e RP11-428L21) e JAK2 (RP11-3H3 e RP11-428-L21), ritenuti più Conclusioni: t(8;9)(p22;p24) con fusionequelli PCM1-JAK2 probabilmente coinvolti nella traslocazione Cariotipo:46,XY,t(8;9)(p22;p24) E’ importante determinare la patogenesi molecolare della LEC? Si, perché abbiamo a disposizione inibitori pankinasici o kinasi-specifici Risposta citogenetica e molecolare Rumi et al, JCO 2013 Should clinical hematologists put their microscopes on eBay? Not at all!! Morphology is mandatory in Hematology; it still provides fundamental information in the diagnostic work-up of every day
Scarica